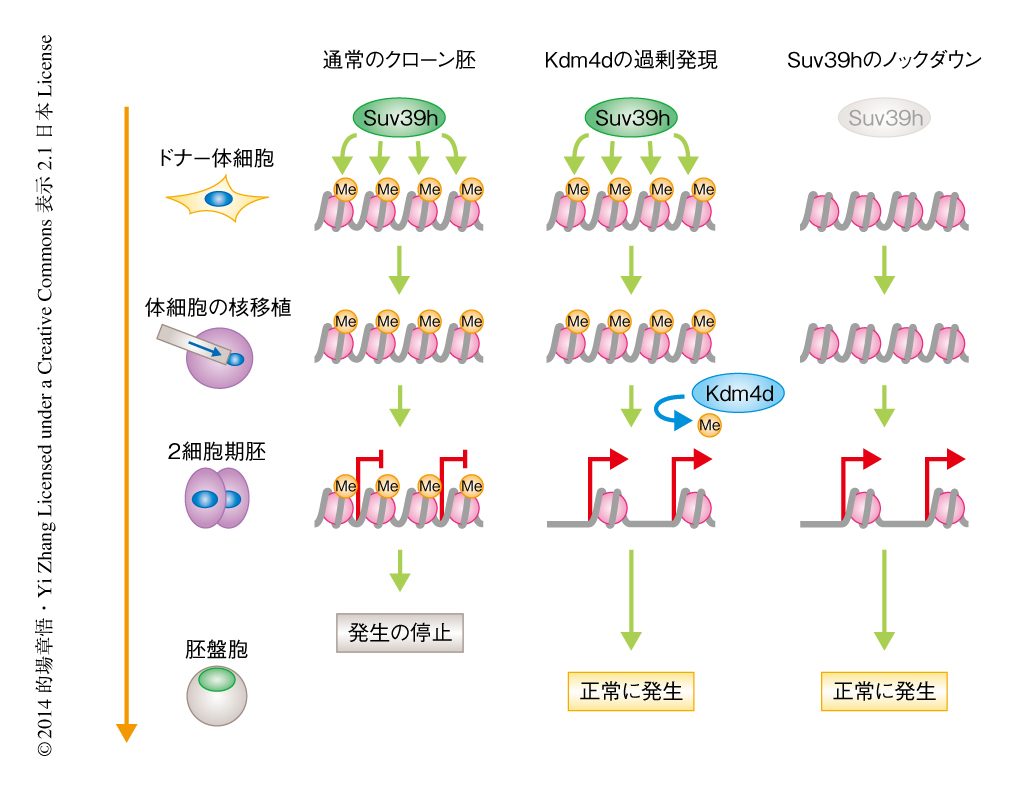
クローン胚の発生は体細胞に由来するヒストンのメチル化修飾により阻害される
的場章悟・Yi Zhang
(米国Harvard Medical School,Department of Genetics)
email:的場章悟
DOI: 10.7875/first.author.2014.138
Embryonic development following somatic cell nuclear transfer impeded by persisting histone methylation.
Shogo Matoba, Yuting Liu, Falong Lu, Kumiko A. Iwabuchi, Li Shen, Azusa Inoue, Yi Zhang
Cell, 159, 884-895 (2014)
哺乳類の卵子は体細胞核移植法により移植された体細胞核を,未分化な受精卵と同じ状態にまで初期化することにより体細胞クローンを作製する能力をもつ.これまで,多くの動物種において体細胞クローンが作製されてきたが,ほとんどのクローン胚は原因不明の異常により発生を停止してしまうことが知られていた.今回,筆者らは,体細胞核のゲノムのもつヒストンH3の9番目のLysのトリメチル化が体細胞核移植ののちの初期化を阻害しており,これがクローン胚の発生率の低いおもな理由であることを見い出した.2細胞期の受精胚とクローン胚において転写の活性化のパターンを比較することにより,クローン胚において初期化に抵抗性を示すゲノム領域を同定した.体細胞のエピジェネティクスを詳細に解析したところ,初期化に抵抗性を示すゲノム領域にはヒストンH3の9番目のLysのトリメチル化が特異的に集積していた.そこで,クローン胚においてヒストン脱メチル化酵素であるKdm4dを強制発現させてこのトリメチル化を消去した結果,初期化に抵抗性を示すゲノム領域からの転写の活性化が回復しただけでなく,クローン胚の発生の効率も劇的に改善した.さらに,ヒストンメチル基転移酵素をノックダウンした体細胞を用いると,同様にクローン胚の発生が改善した.以上の結果から,体細胞核のゲノムのもつヒストンH3の9番目のLysのトリメチル化が体細胞核移植による初期化を阻害することが示されただけでなく,体細胞クローンの作出の効率を改善する簡便な手法が示された.
哺乳類の卵子は体細胞核移植法により移植された体細胞核を,全能性をもつ受精卵の状態にまで初期化する能力がある.この能力を利用することにより,ドナーとなる体細胞と同じゲノムをもつ“クローン”個体を作製することができる.1996年,哺乳類において最初の体細胞クローンであるヒツジのドリーが誕生し,そののち,マウスをはじめ,イヌ,ネコなどのペットから,ウシ,ウマなどの家畜まで,20以上の動物種において体細胞クローンが作出されてきた1).さらに,体細胞核移植法により作製された胚盤胞からはES細胞が樹立できるため,ヒトの医療に対する貢献も期待されている.2013年,クローン胚に由来するES細胞の樹立がヒトにおいてはじめて報告され,この潮流は加速することが予想されている2).このように,体細胞核移植法が大きな可能性をもつにもかかわらずいまだ実用化されていない理由のひとつに,クローン胚の発生の効率がいちじるしく低いことがあげられる.たとえばマウスの場合,半数以上のクローン胚は着床のまえに発生を停止し,さらに着床ののちにもつぎつぎと発生の異常を示して胎生期に致死となるため,最終的に出生にいたるクローン胚は1~2%にすぎない.ほかの動物種でも体細胞クローンの作出の効率は1~5%と非常に低いが,その理由はよくわかっていない.X染色体の不活性化をつかさどるXist遺伝子の発現の異常がその原因のひとつであることが示されているが3,4),とくに着床のまえの発生の停止の原因についてはわかっていなかった.
クローン胚の発生の異常が現われはじめる時期は,受精胚においてゲノムの全体における転写の開始する胚性ゲノムの活性化の時期(マウスでは2細胞期,ブタ,ウシ,ヒトなどでは4~8細胞期5))と一致することから,クローン胚は胚性ゲノムの活性化に異常のあることが示唆されていた.実際に,胚性ゲノムの活性化の時期に発現の異常を示す遺伝子も数多く報告されているが,その原因については不明であった.筆者らは,ドナーとなる体細胞核に存在するなんらかのエピジェネティックな修飾がクローン胚における初期化を阻害している考え,クローン胚のゲノムの活性化のパターンとドナーとなる体細胞核のエピジェネティックな修飾とを比較することにより初期化を阻害する因子の同定を試みた.
マウスのクローン胚におけるゲノムの活性化のパターンを調べるため,卵丘細胞をドナーとしたクローン胚を作製し,その1細胞期胚および2細胞期胚についてRNAシークエンシング法によりトランスクリプトームを解析した.この時期のマウスの胚においては,タンパク質をコードするmRNAだけでなく,内在性のレトロウイルスなど反復配列を含む領域からも活発に転写が起こることが知られている6).そこで,ゲノムの全体における包括的な転写の状態をとらえるため,個々の“遺伝子”ではなく100 kbを1領域とする“ゲノム領域”ごとに比較した.まず,受精胚の1細胞期と2細胞期のトランスクリプトームの比較により,2細胞期において転写の活性化する811箇所の領域を同定した.これらの領域の転写の状態を受精胚とクローン胚とで比較したところ,342箇所の領域はクローン胚においても受精胚と同じ程度(差は2倍以下)に活性化されており,これを完全初期化領域とした.また,247箇所の領域は受精胚ほどではないもののクローン胚でもある程度(差は2~5倍)は活性化されており,これを部分的初期化領域とした.残りの222箇所の領域はクローン胚ではほとんど活性化されておらず(差は5倍以上),これを初期化抵抗性領域とした.興味深いことに,初期化抵抗性ゲノム領域からの転写産物はその多くが遺伝子をコードしていなかった.この初期化抵抗性ゲノム領域にクローン胚における発生の異常の原因があるのではないかと考えた.
クローン胚の初期化抵抗性ゲノム領域においては2細胞期における胚性ゲノムの活性化が顕著に阻害されていたことから,ドナーとなる体細胞の初期化抵抗性ゲノム領域にはなんらかの特徴的なエピジェネティックな修飾が存在し,これが体細胞核移植ののちの初期化を阻害しているとの仮説をたてた.マウスのクローン胚が2細胞期の前後に発生を停止するという表現型は,どの種類の体細胞をドナーとして用いてもみられる普遍的な現象であることから,ここで想定したエピジェネティックな修飾はすべての体細胞種において共通して存在すると考えた.そこで,エピジェネティックな修飾の情報がもっとも多く蓄積されている体細胞種のひとつであるマウスの胎仔繊維芽細胞に着目し,初期化抵抗性ゲノム領域にはどのようなヒストン修飾が存在するかをin silicoにおいて解析した.その結果,初期化抵抗性ゲノム領域にはヒストンH3の9番目のLysのトリメチル化が特異的に集積していた.一方,完全初期化領域や部分的初期化領域にはとくに明確なヒストン修飾の集積は認められなかった.このような初期化抵抗性ゲノム領域へのヒストンH3の9番目のLysのトリメチル化の特異的な集積は,マウスの胎仔繊維芽細胞だけでなく,ほかに解析した4種類の体細胞のすべてにおいて認められた.以上の結果から,体細胞の初期化抵抗性ゲノム領域にはヒストンH3の9番目のLysのトリメチル化が集積していることが明らかになった.
体細胞の初期化抵抗性ゲノム領域にヒストンH3の9番目のLysのトリメチル化が特異的に集積していたことから,このトリメチル化がクローン胚における胚性ゲノムの活性化を阻害していると考えた.そこで,クローン胚のゲノムからヒストンH3の9番目のLysのトリメチル化を消去するため,このトリメチル化に対し特異的なヒストン脱メチル化酵素であるKdm4dに着目した.in vitroにおいて合成したKdm4dをコードするmRNAを1細胞期のクローン胚に注入することによりKdm4dを過剰に発現させたところ,注入から5時間後の1細胞期後期の時点において,ヒストンH3の9番目のLysのトリメチル化は免疫染色により検出できないレベルにまで低下した.この低メチル化状態は胚性ゲノムの活性化の起こる2細胞期まで維持されていた.一方で,脱メチル化活性のない変異型Kdm4dをコードするmRNAを注入した場合にはトリメチル化の消去は認められなかった.
ヒストンH3の9番目のLysのトリメチル化の消去がクローン胚における胚性ゲノムの活性化を改善するかどうかを調べるため,RNAシークエンス法により2細胞期におけるトランスクリプトームを解析した.その結果,222箇所の初期化抵抗性ゲノム領域のうち83%が野生型Kdm4dの過剰発現により活性化されていた.このとき,タンパク質をコードするmRNAだけでなく,反復配列などの非コード転写産物に関してもKdm4dによりその多くが転写を回復していた.階層的クラスタリング解析によりゲノムの全体のトランスクリプトームを比較したところ,Kdm4dをコードするmRNAを注入したクローン胚は通常のクローン胚よりも受精胚に近いトランスクリプトームをもつことがわかった.以上の結果から,クローン胚の核からヒストンH3の9番目のLysのトリメチル化を消去することにより,初期化抵抗性ゲノム領域の活性化が回復するだけでなく,ゲノムの全体のトランスクリプトームまで改善することが明らかになった.
ヒストン脱メチル化酵素であるKdm4dをコードするmRNAの注入によるゲノムの全体におけるトランスクリプトームの改善が,クローン胚における発生の効率をどこまで回復させるか検証した.まず,卵丘細胞をドナーとした場合,通常のクローン胚は2細胞期ののちつぎつぎに発生を停止し,最終的に約26%しか胚盤胞まで発生しなかった.一方で,Kdm4dをコードするmRNAを注入したクローン胚は2細胞期ののちもほとんど発生を停止することなく,受精胚と同じ程度の88.6%という非常に高い効率で胚盤胞まで発生した.変異型Kdm4dをコードするmRNAの注入ではそのような改善効果は認められなかった.さらに,セルトリ細胞あるいは胎仔線維芽細胞をドナーとしたクローン胚でもKdm4dの過剰発現により胚盤胞までの発生の効率の大幅な改善がみられた.
Kdm4dをコードするmRNAの注入によりみられた発生の効率の改善が着床ののちにもひきつづきみられるかどうか調べるため,2細胞期の卵丘細胞に由来するクローン胚を偽妊娠メスの卵管に移植した.出生日に帝王切開することにより着床数を比較すると,通常のクローン胚では卵管へ移植した胚のうち21.2%しか着床していなかったのに対し,Kdm4dをコードするmRNAの注入により着床率は63%まで上昇した.さらに重要なことに,通常のクローン胚は104個の胚を移植したにもかかわらず出生日までに1匹も発生しなかった一方で,Kdm4dをコードするmRNAを注入したクローン胚では移植した胚のうち7.6%が出生日に正常な産仔として生まれた.同様に,セルトリ細胞をドナーとしたクローン胚でもKdm4dの過剰発現により着床率は21%から64%にまで改善し,出生率も1%から8.7%に大幅に上昇した.以上の結果は,ドナーとなる体細胞のもつヒストンH3の9番目のLysのトリメチル化がクローン胚における初期化を阻害していることを示すと同時に,ヒストン脱メチル化酵素であるKdm4dをコードするmRNAの注入という簡便な操作によりこのトリメチル化を消去することによりマウスにおける体細胞クローンの作出の効率を大幅に改善できることが示された.
体細胞核のゲノムの初期化を阻害するヒストンH3の9番目のLysのトリメチル化が体細胞においてどのヒストンメチル化酵素により形成されているか同定を試みた.哺乳類においてヒストンH3の9番目のLysをトリメチル化する酵素としてはSuv39h1,Suv39h2,Setdb1の3つが知られている7,8).これらの酵素を個別に,あるいは,同時にノックダウンしたマウスの胎仔繊維芽細胞をドナーとしてクローン胚を作製することにより,どの酵素が初期化の障壁の形成にはたらいているのか検証した.その結果,3つの酵素すべてをノックダウンした場合,および,Suv39h1とSuv39h2をともにノックダウンした場合に,クローン胚の胚盤胞への発生の効率の改善がみられた.一方で,Setdb1単独でのノックダウンは発生の効率を改善しなかった.以上の結果から,Suv39h1およびSuv39h2が初期化を阻害するヒストンH3の9番目のLysのトリメチル化を確立する主たるヒストンメチル化酵素であることが明らかになった.
カエルを使ったはじめての体細胞クローンの作出の報告は1962年までさかのぼる9).それから50年以上の研究の積み重ねにもかかわらず,体細胞クローンの作出の効率はどの動物種においても低いままである.そのおもな原因は,卵子による体細胞の初期化の機構がほとんどわかっていなかった点にあった.この論文においては,ヒストンメチル化酵素であるSuv39h1およびSuv39h2により確立されるヒストンH3の9番目のLysのトリメチル化が体細胞核移植ののちの初期化を阻害していることを示しただけでなく,この阻害はヒストン脱メチル化酵素であるKdm4dを過剰に発現させることにより簡単に除くことができることも示した(図1).iPS細胞の樹立の過程においてもヒストンH3の9番目のLysのトリメチル化は初期化を阻害することが報告されており10,11),このトリメチル化は分化した体細胞のもつ普遍的な初期化の障壁の機構であるようだ.ただし,体細胞核移植法による初期化を阻害するヒストンH3の9番目のLysのトリメチル化はSuv39h1およびSuv39h2により形成されるのに対し,iPS細胞の樹立の際にはおもにSetdb1に依存するなどの違いはある.さらに,iPS細胞の樹立の際に必須の転写因子Oct4が体細胞核移植法においては必要ないなど12),iPS細胞の樹立と体細胞核移植の初期化の機構は異なるものと想定される.iPS細胞の樹立と比較して,体細胞核移植法による初期化の機構にはいまだ不明な点が多く残されており,今後,さらなる解明が期待される.
また,ヒストンH3の9番目のLysのトリメチルはほかの動物種のクローン胚においても初期化を阻害しているかどうか,すなわち,ほかの動物種においてもヒストン脱メチル化酵素の過剰な発現により体細胞クローンの作出の効率を改善できるかどうかも重要な今後の課題である.とくに,畜産分野においてブタやウシなどの家畜の体細胞クローンの作出の効率の上昇は重要な課題とされており,今回の発見が畜産分野に応用が可能かどうかを検討する必要がある.また,ヒトのクローン胚に由来するES細胞はiPS細胞よりも高品質といわれており13),高い効率でクローン胚の胚盤胞を得られる方法の確立は重要である.そのため,Kdm4dをコードするmRNAの注入によりヒトのクローン胚に由来するES細胞の樹立の効率を大幅に上昇させることができるなら再生医療分野における貢献も期待される.
略歴:2009年 東京大学大学院農学生命科学研究科 修了,同年 理化学研究所バイオリソースセンター 研究員を経て,2012年より米国Harvard Medical School研究員.
研究テーマ:哺乳類の卵子による体細胞の初期化の機構.
抱負:基礎研究から獣医学に貢献したい.
Yi Zhang
米国Harvard Medical School教授.
研究室URL:http://zhanglab.tch.harvard.edu/
© 2014 的場章悟・Yi Zhang Licensed under CC 表示 2.1 日本
(米国Harvard Medical School,Department of Genetics)
email:的場章悟
DOI: 10.7875/first.author.2014.138
Embryonic development following somatic cell nuclear transfer impeded by persisting histone methylation.
Shogo Matoba, Yuting Liu, Falong Lu, Kumiko A. Iwabuchi, Li Shen, Azusa Inoue, Yi Zhang
Cell, 159, 884-895 (2014)
要 約
哺乳類の卵子は体細胞核移植法により移植された体細胞核を,未分化な受精卵と同じ状態にまで初期化することにより体細胞クローンを作製する能力をもつ.これまで,多くの動物種において体細胞クローンが作製されてきたが,ほとんどのクローン胚は原因不明の異常により発生を停止してしまうことが知られていた.今回,筆者らは,体細胞核のゲノムのもつヒストンH3の9番目のLysのトリメチル化が体細胞核移植ののちの初期化を阻害しており,これがクローン胚の発生率の低いおもな理由であることを見い出した.2細胞期の受精胚とクローン胚において転写の活性化のパターンを比較することにより,クローン胚において初期化に抵抗性を示すゲノム領域を同定した.体細胞のエピジェネティクスを詳細に解析したところ,初期化に抵抗性を示すゲノム領域にはヒストンH3の9番目のLysのトリメチル化が特異的に集積していた.そこで,クローン胚においてヒストン脱メチル化酵素であるKdm4dを強制発現させてこのトリメチル化を消去した結果,初期化に抵抗性を示すゲノム領域からの転写の活性化が回復しただけでなく,クローン胚の発生の効率も劇的に改善した.さらに,ヒストンメチル基転移酵素をノックダウンした体細胞を用いると,同様にクローン胚の発生が改善した.以上の結果から,体細胞核のゲノムのもつヒストンH3の9番目のLysのトリメチル化が体細胞核移植による初期化を阻害することが示されただけでなく,体細胞クローンの作出の効率を改善する簡便な手法が示された.
はじめに
哺乳類の卵子は体細胞核移植法により移植された体細胞核を,全能性をもつ受精卵の状態にまで初期化する能力がある.この能力を利用することにより,ドナーとなる体細胞と同じゲノムをもつ“クローン”個体を作製することができる.1996年,哺乳類において最初の体細胞クローンであるヒツジのドリーが誕生し,そののち,マウスをはじめ,イヌ,ネコなどのペットから,ウシ,ウマなどの家畜まで,20以上の動物種において体細胞クローンが作出されてきた1).さらに,体細胞核移植法により作製された胚盤胞からはES細胞が樹立できるため,ヒトの医療に対する貢献も期待されている.2013年,クローン胚に由来するES細胞の樹立がヒトにおいてはじめて報告され,この潮流は加速することが予想されている2).このように,体細胞核移植法が大きな可能性をもつにもかかわらずいまだ実用化されていない理由のひとつに,クローン胚の発生の効率がいちじるしく低いことがあげられる.たとえばマウスの場合,半数以上のクローン胚は着床のまえに発生を停止し,さらに着床ののちにもつぎつぎと発生の異常を示して胎生期に致死となるため,最終的に出生にいたるクローン胚は1~2%にすぎない.ほかの動物種でも体細胞クローンの作出の効率は1~5%と非常に低いが,その理由はよくわかっていない.X染色体の不活性化をつかさどるXist遺伝子の発現の異常がその原因のひとつであることが示されているが3,4),とくに着床のまえの発生の停止の原因についてはわかっていなかった.
クローン胚の発生の異常が現われはじめる時期は,受精胚においてゲノムの全体における転写の開始する胚性ゲノムの活性化の時期(マウスでは2細胞期,ブタ,ウシ,ヒトなどでは4~8細胞期5))と一致することから,クローン胚は胚性ゲノムの活性化に異常のあることが示唆されていた.実際に,胚性ゲノムの活性化の時期に発現の異常を示す遺伝子も数多く報告されているが,その原因については不明であった.筆者らは,ドナーとなる体細胞核に存在するなんらかのエピジェネティックな修飾がクローン胚における初期化を阻害している考え,クローン胚のゲノムの活性化のパターンとドナーとなる体細胞核のエピジェネティックな修飾とを比較することにより初期化を阻害する因子の同定を試みた.
1.初期化に抵抗性を示すゲノム領域の同定
マウスのクローン胚におけるゲノムの活性化のパターンを調べるため,卵丘細胞をドナーとしたクローン胚を作製し,その1細胞期胚および2細胞期胚についてRNAシークエンシング法によりトランスクリプトームを解析した.この時期のマウスの胚においては,タンパク質をコードするmRNAだけでなく,内在性のレトロウイルスなど反復配列を含む領域からも活発に転写が起こることが知られている6).そこで,ゲノムの全体における包括的な転写の状態をとらえるため,個々の“遺伝子”ではなく100 kbを1領域とする“ゲノム領域”ごとに比較した.まず,受精胚の1細胞期と2細胞期のトランスクリプトームの比較により,2細胞期において転写の活性化する811箇所の領域を同定した.これらの領域の転写の状態を受精胚とクローン胚とで比較したところ,342箇所の領域はクローン胚においても受精胚と同じ程度(差は2倍以下)に活性化されており,これを完全初期化領域とした.また,247箇所の領域は受精胚ほどではないもののクローン胚でもある程度(差は2~5倍)は活性化されており,これを部分的初期化領域とした.残りの222箇所の領域はクローン胚ではほとんど活性化されておらず(差は5倍以上),これを初期化抵抗性領域とした.興味深いことに,初期化抵抗性ゲノム領域からの転写産物はその多くが遺伝子をコードしていなかった.この初期化抵抗性ゲノム領域にクローン胚における発生の異常の原因があるのではないかと考えた.
2.体細胞の初期化抵抗性ゲノム領域にはヒストンH3の9番目のLysのトリメチル化が集積している
クローン胚の初期化抵抗性ゲノム領域においては2細胞期における胚性ゲノムの活性化が顕著に阻害されていたことから,ドナーとなる体細胞の初期化抵抗性ゲノム領域にはなんらかの特徴的なエピジェネティックな修飾が存在し,これが体細胞核移植ののちの初期化を阻害しているとの仮説をたてた.マウスのクローン胚が2細胞期の前後に発生を停止するという表現型は,どの種類の体細胞をドナーとして用いてもみられる普遍的な現象であることから,ここで想定したエピジェネティックな修飾はすべての体細胞種において共通して存在すると考えた.そこで,エピジェネティックな修飾の情報がもっとも多く蓄積されている体細胞種のひとつであるマウスの胎仔繊維芽細胞に着目し,初期化抵抗性ゲノム領域にはどのようなヒストン修飾が存在するかをin silicoにおいて解析した.その結果,初期化抵抗性ゲノム領域にはヒストンH3の9番目のLysのトリメチル化が特異的に集積していた.一方,完全初期化領域や部分的初期化領域にはとくに明確なヒストン修飾の集積は認められなかった.このような初期化抵抗性ゲノム領域へのヒストンH3の9番目のLysのトリメチル化の特異的な集積は,マウスの胎仔繊維芽細胞だけでなく,ほかに解析した4種類の体細胞のすべてにおいて認められた.以上の結果から,体細胞の初期化抵抗性ゲノム領域にはヒストンH3の9番目のLysのトリメチル化が集積していることが明らかになった.
3.ヒストン脱メチル化酵素Kdm4dの過剰発現によりクローン胚における胚性ゲノムの活性化は回復する
体細胞の初期化抵抗性ゲノム領域にヒストンH3の9番目のLysのトリメチル化が特異的に集積していたことから,このトリメチル化がクローン胚における胚性ゲノムの活性化を阻害していると考えた.そこで,クローン胚のゲノムからヒストンH3の9番目のLysのトリメチル化を消去するため,このトリメチル化に対し特異的なヒストン脱メチル化酵素であるKdm4dに着目した.in vitroにおいて合成したKdm4dをコードするmRNAを1細胞期のクローン胚に注入することによりKdm4dを過剰に発現させたところ,注入から5時間後の1細胞期後期の時点において,ヒストンH3の9番目のLysのトリメチル化は免疫染色により検出できないレベルにまで低下した.この低メチル化状態は胚性ゲノムの活性化の起こる2細胞期まで維持されていた.一方で,脱メチル化活性のない変異型Kdm4dをコードするmRNAを注入した場合にはトリメチル化の消去は認められなかった.
ヒストンH3の9番目のLysのトリメチル化の消去がクローン胚における胚性ゲノムの活性化を改善するかどうかを調べるため,RNAシークエンス法により2細胞期におけるトランスクリプトームを解析した.その結果,222箇所の初期化抵抗性ゲノム領域のうち83%が野生型Kdm4dの過剰発現により活性化されていた.このとき,タンパク質をコードするmRNAだけでなく,反復配列などの非コード転写産物に関してもKdm4dによりその多くが転写を回復していた.階層的クラスタリング解析によりゲノムの全体のトランスクリプトームを比較したところ,Kdm4dをコードするmRNAを注入したクローン胚は通常のクローン胚よりも受精胚に近いトランスクリプトームをもつことがわかった.以上の結果から,クローン胚の核からヒストンH3の9番目のLysのトリメチル化を消去することにより,初期化抵抗性ゲノム領域の活性化が回復するだけでなく,ゲノムの全体のトランスクリプトームまで改善することが明らかになった.
4.ヒストン脱メチル化酵素Kdm4dの過剰発現によりクローン胚における発生の効率は大幅に改善する
ヒストン脱メチル化酵素であるKdm4dをコードするmRNAの注入によるゲノムの全体におけるトランスクリプトームの改善が,クローン胚における発生の効率をどこまで回復させるか検証した.まず,卵丘細胞をドナーとした場合,通常のクローン胚は2細胞期ののちつぎつぎに発生を停止し,最終的に約26%しか胚盤胞まで発生しなかった.一方で,Kdm4dをコードするmRNAを注入したクローン胚は2細胞期ののちもほとんど発生を停止することなく,受精胚と同じ程度の88.6%という非常に高い効率で胚盤胞まで発生した.変異型Kdm4dをコードするmRNAの注入ではそのような改善効果は認められなかった.さらに,セルトリ細胞あるいは胎仔線維芽細胞をドナーとしたクローン胚でもKdm4dの過剰発現により胚盤胞までの発生の効率の大幅な改善がみられた.
Kdm4dをコードするmRNAの注入によりみられた発生の効率の改善が着床ののちにもひきつづきみられるかどうか調べるため,2細胞期の卵丘細胞に由来するクローン胚を偽妊娠メスの卵管に移植した.出生日に帝王切開することにより着床数を比較すると,通常のクローン胚では卵管へ移植した胚のうち21.2%しか着床していなかったのに対し,Kdm4dをコードするmRNAの注入により着床率は63%まで上昇した.さらに重要なことに,通常のクローン胚は104個の胚を移植したにもかかわらず出生日までに1匹も発生しなかった一方で,Kdm4dをコードするmRNAを注入したクローン胚では移植した胚のうち7.6%が出生日に正常な産仔として生まれた.同様に,セルトリ細胞をドナーとしたクローン胚でもKdm4dの過剰発現により着床率は21%から64%にまで改善し,出生率も1%から8.7%に大幅に上昇した.以上の結果は,ドナーとなる体細胞のもつヒストンH3の9番目のLysのトリメチル化がクローン胚における初期化を阻害していることを示すと同時に,ヒストン脱メチル化酵素であるKdm4dをコードするmRNAの注入という簡便な操作によりこのトリメチル化を消去することによりマウスにおける体細胞クローンの作出の効率を大幅に改善できることが示された.
5.初期化を阻害するヒストンH3の9番目のLysのトリメチル化はヒストンメチル化酵素Suv39h1およびSuv39h2により確立される
体細胞核のゲノムの初期化を阻害するヒストンH3の9番目のLysのトリメチル化が体細胞においてどのヒストンメチル化酵素により形成されているか同定を試みた.哺乳類においてヒストンH3の9番目のLysをトリメチル化する酵素としてはSuv39h1,Suv39h2,Setdb1の3つが知られている7,8).これらの酵素を個別に,あるいは,同時にノックダウンしたマウスの胎仔繊維芽細胞をドナーとしてクローン胚を作製することにより,どの酵素が初期化の障壁の形成にはたらいているのか検証した.その結果,3つの酵素すべてをノックダウンした場合,および,Suv39h1とSuv39h2をともにノックダウンした場合に,クローン胚の胚盤胞への発生の効率の改善がみられた.一方で,Setdb1単独でのノックダウンは発生の効率を改善しなかった.以上の結果から,Suv39h1およびSuv39h2が初期化を阻害するヒストンH3の9番目のLysのトリメチル化を確立する主たるヒストンメチル化酵素であることが明らかになった.
おわりに
カエルを使ったはじめての体細胞クローンの作出の報告は1962年までさかのぼる9).それから50年以上の研究の積み重ねにもかかわらず,体細胞クローンの作出の効率はどの動物種においても低いままである.そのおもな原因は,卵子による体細胞の初期化の機構がほとんどわかっていなかった点にあった.この論文においては,ヒストンメチル化酵素であるSuv39h1およびSuv39h2により確立されるヒストンH3の9番目のLysのトリメチル化が体細胞核移植ののちの初期化を阻害していることを示しただけでなく,この阻害はヒストン脱メチル化酵素であるKdm4dを過剰に発現させることにより簡単に除くことができることも示した(図1).iPS細胞の樹立の過程においてもヒストンH3の9番目のLysのトリメチル化は初期化を阻害することが報告されており10,11),このトリメチル化は分化した体細胞のもつ普遍的な初期化の障壁の機構であるようだ.ただし,体細胞核移植法による初期化を阻害するヒストンH3の9番目のLysのトリメチル化はSuv39h1およびSuv39h2により形成されるのに対し,iPS細胞の樹立の際にはおもにSetdb1に依存するなどの違いはある.さらに,iPS細胞の樹立の際に必須の転写因子Oct4が体細胞核移植法においては必要ないなど12),iPS細胞の樹立と体細胞核移植の初期化の機構は異なるものと想定される.iPS細胞の樹立と比較して,体細胞核移植法による初期化の機構にはいまだ不明な点が多く残されており,今後,さらなる解明が期待される.
また,ヒストンH3の9番目のLysのトリメチルはほかの動物種のクローン胚においても初期化を阻害しているかどうか,すなわち,ほかの動物種においてもヒストン脱メチル化酵素の過剰な発現により体細胞クローンの作出の効率を改善できるかどうかも重要な今後の課題である.とくに,畜産分野においてブタやウシなどの家畜の体細胞クローンの作出の効率の上昇は重要な課題とされており,今回の発見が畜産分野に応用が可能かどうかを検討する必要がある.また,ヒトのクローン胚に由来するES細胞はiPS細胞よりも高品質といわれており13),高い効率でクローン胚の胚盤胞を得られる方法の確立は重要である.そのため,Kdm4dをコードするmRNAの注入によりヒトのクローン胚に由来するES細胞の樹立の効率を大幅に上昇させることができるなら再生医療分野における貢献も期待される.
文 献
- Rodriguez-Osorio, N., Urrego, R., Cibelli, J. B. et al.: Reprogramming mammalian somatic cells. Theriogenology, 78, 1869-1886 (2012)[PubMed]
- Tachibana, M., Amato, P., Sparman, M. et al.: Human embryonic stem cells derived by somatic cell nuclear transfer. Cell, 153, 1228-1238 (2013)[PubMed]
- Inoue, K., Kohda, T., Sugimoto, M. et al.: Impeding Xist expression from the active X chromosome improves mouse somatic cell nuclear transfer. Science, 330, 496-499, (2010)[PubMed] [新着論文レビュー]
- Matoba, S., Inoue, K., Kohda, T. et al.: RNAi-mediated knockdown of Xist can rescue the impaired postimplantation development of cloned mouse embryos. Proc. Natl. Acad. Sci. USA, 108, 20621-20626 (2011)[PubMed]
- Schultz, R. M.: The molecular foundations of the maternal to zygotic transition in the preimplantation embryo. Hum. Reprod. Update, 8, 323-331 (2002)[PubMed]
- Evsikov, A. V., de Vries, W. N., Peaston, A. E. et al.: Systems biology of the 2-cell mouse embryo. Cytogenet. Genome Res., 105, 240-250 (2004)[PubMed]
- Matsui, T., Leung, D., Miyashita, H. et al.: Proviral silencing in embryonic stem cells requires the histone methyltransferase ESET. Nature, 464, 927-931 (2010)[PubMed]
- Peters, A. H., O'Carroll, D., Scherthan, H. et al.: Loss of the Suv39h histone methyltransferases impairs mammalian heterochromatin and genome stability. Cell, 107, 323-337 (2001)[PubMed]
- Gurdon, J. B.: The developmental capacity of nuclei taken from intestinal epithelium cells of feeding tadpoles. J. Embryol. Exp. Morphol., 10, 622-640 (1962)[PubMed]
- Sridharan, R., Gonzales-Cope, M., Chronis, C. et al.: Proteomic and genomic approaches reveal critical functions of H3K9 methylation and heterochromatin protein-1γ in reprogramming to pluripotency. Nat. Cell Biol., 15, 872-882 (2013)[PubMed]
- Chen, J., Liu, H., Liu, J. et al.: H3K9 methylation is a barrier during somatic cell reprogramming into iPSCs. Nat. Genet., 45, 34-42 (2013)[PubMed]
- Wu, G., Han, D., Gong, Y. et al.: Establishment of totipotency does not depend on Oct4A. Nat. Cell Biol., 15, 1089-1097 (2013)[PubMed]
- Ma, H., Morey, R., O'Neil, R. C. et al.: Abnormalities in human pluripotent cells due to reprogramming mechanisms. Nature, 511, 177-183 (2014)[PubMed]
著者プロフィール
略歴:2009年 東京大学大学院農学生命科学研究科 修了,同年 理化学研究所バイオリソースセンター 研究員を経て,2012年より米国Harvard Medical School研究員.
研究テーマ:哺乳類の卵子による体細胞の初期化の機構.
抱負:基礎研究から獣医学に貢献したい.
Yi Zhang
米国Harvard Medical School教授.
研究室URL:http://zhanglab.tch.harvard.edu/
© 2014 的場章悟・Yi Zhang Licensed under CC 表示 2.1 日本