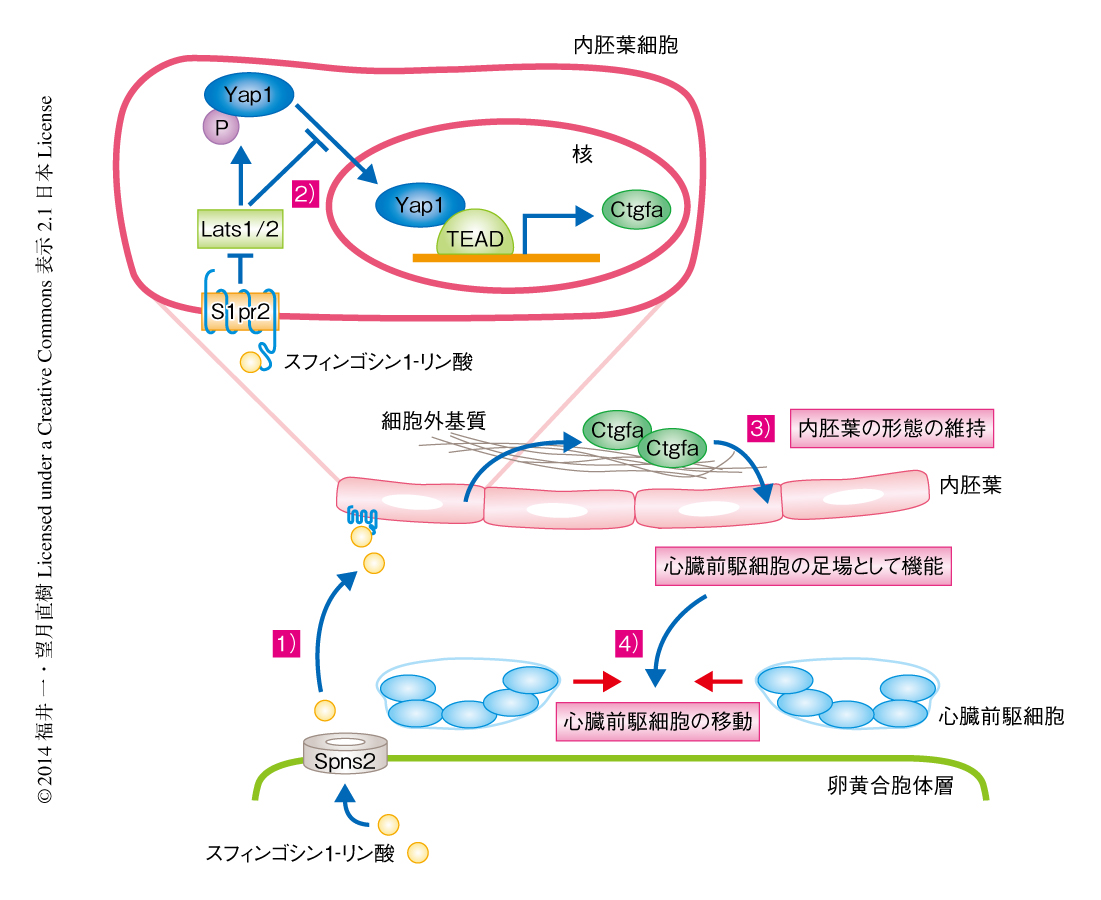
転写因子Yapに依存性のシグナルは内胚葉において心臓の正中への移動を制御する
福井 一・望月直樹
(国立循環器病研究センター研究所 細胞生物学部)
email:福井 一,望月直樹
DOI: 10.7875/first.author.2014.133
S1P-Yap1 signaling regulates endoderm formation required for cardiac precursor cell migration in zebrafish.
Hajime Fukui, Kenta Terai, Hiroyuki Nakajima, Ayano Chiba, Shigetomo Fukuhara, Naoki Mochizuki
Developmental Cell, 31, 128-136 (2014)
心臓の前駆細胞は両側の側版中胚葉に由来し,これが正中に移動することによりひとつの原始心筒を形成し,そののち,心房および心室ができあがる.ゼブラフィッシュを用いた研究において,内胚葉の変異体やスフィンゴシン1-リン酸シグナル伝達系を構成するタンパク質の変異体では,心臓前駆細胞の正中への移動が障害され,結果として二股心臓を呈することが報告されていた.この原因として,内胚葉が心臓前駆細胞の足場となり両側から正中への移動を制御していることが考えられていたが,その機構は不明であった.今回の研究において,卵黄合胞体層から分泌されたスフィンゴシン1-リン酸は内胚葉においてスフィンゴシン1-リン酸受容体を活性化し,セリン/スレオニンキナーゼであるLats1/2を阻害することにより,転写因子Yap1の核への移行を促進していることがわかった.Yap1は結合組織増殖因子Ctgfaの発現を促進し,Ctgfaが基質であるフィブロネクチンに結合することにより内胚葉は維持されていた.その結果,心臓前駆細胞の正中への移動が可能になることが明らかにされた.
中胚葉臓器である心臓が形成される過程は,まず,両側の側板中胚葉において心臓の前駆細胞が決定されることからはじまる.さらに,この心臓前駆細胞が正中へむかって移動し,両側の心臓前駆細胞が集団となり原始心筒が形成される.そののち,1次心臓領域と2次心臓領域の大別された心筋細胞が心室および心房を形成する細胞になる.ゼブラフィッシュは1心房1心室であり,哺乳類の2心房2心室とは異なるが,ゼブラフィッシュでも哺乳類でも両側の中胚葉に存在する心臓前駆細胞の正中への移動が障害されると,二股心臓とよばれる両側に心臓のみられる発生の異常が生じる.ゼブラフィッシュの心臓前駆細胞は内胚葉と卵黄合胞体層とにはさまれる空間を移動する1).そのため,内胚葉それ自体が移動の足場になること,および,内胚葉は移動の足場になる細胞外基質を分泌することが予想されていた.実際に,内胚葉を欠損した変異体や細胞外基質であるフィブロネクチンの変異体では,二股心臓を呈することが報告された2,3).さらに,スフィンゴシン1-リン酸の受容体であるS1pr2の変異体,および,スフィンゴシン1-リン酸の輸送体であるSpsn2の変異体において二股心臓になるゼブラフィッシュが報告されたことから4,5),スフィンゴシン1-リン酸シグナル伝達系の障害により心臓前駆細胞の移動に異常を来たすことが示唆された.筆者らは,Spns2は卵黄合胞体層に発現することから,スフィンゴシン1-リン酸は内胚葉あるいは心筋前駆細胞に作用することにより心筋前駆細胞の移動を制御していると予想した.
近年,哺乳類において,スフィンゴシン1-リン酸により活性化されたS1PR2がHippoシグナルにより制御される転写因子Yap1の核への移行を促進することが報告された6).このYap1の核への移行の促進は培養細胞において認められたもので,個体における生理的な機能の意義については未解明であった.Yap1はTEADファミリータンパク質と結合してCTGF遺伝子,Cyr61遺伝子,Birc5遺伝子などの転写を促進することが報告されていた7).以上の知見から,筆者らは,ゼブラフィッシュの個体においては,卵黄合胞体層から分泌されたスフィンゴシン1-リン酸の下流にて転写因子Yap1が機能することにより心臓前駆細胞の移動が制御されているという仮説を証明しようと考えた.
心臓前駆細胞の位置を確認できるよう,心筋ミオシン軽鎖の遺伝子プロモーターに依存して蛍光タンパク質を発現するトランスジェニックゼブラフィッシュを作製した.このトランスジェニックゼブラフィッシュにおいて,アンチセンスオリゴヌクレオチドモルフォリーノを用いて転写因子Yap1の発現を抑制した胚は二股心臓を呈した.さらに,TEADファミリータンパク質との結合ドメインだけを発現するYap1の優勢劣勢変異体を胚において発現させたところ二股心臓を呈したことから,Yap1に依存性の転写が心臓前駆細胞の移動に不可欠であることがわかった.
スフィンゴシン1-リン酸の受容体であるS1pr2およびスフィンゴシン1-リン酸の輸送体であるSpns2は,それぞれ,内胚葉および卵黄合胞体層において発現することが報告されていた.そのため,内胚葉あるいは卵黄合胞体層のいずれにおいて転写因子Yap1の機能することが重要かを調べることが必要と考えた.そこで,卵黄合胞体層においてS1pr2,Spns2,Yap1の発現をそれぞれ抑制した場合の心臓の位置を確認したところ,Spns2の発現を抑制した場合には二股心臓を呈したが,S1pr2あるいはYap1の発現を抑制した場合には異常は認められなかった.したがって,S1pr2によるYap1の制御は内胚葉において機能している可能性が考えられた.内胚葉の形態を観察するため,内胚葉において活性化するsox17遺伝子のプロモーターによりGFPを発現するトランスジェニックゼブラフィッシュを用い8),S1pr2あるいはYap1の発現を抑制した個体を観察したところ,内胚葉シートの欠損が認められた.S1pr2と三量体Gタンパク質であるGα13とによるシグナル伝達系が内胚葉の形成にかかわるという報告があったため9),Gα13の発現を抑制した個体を調べたところ,内胚葉の欠損が認められた.これらの内胚葉の欠損はセリン/スレオニンキナーゼであるLats1/2の発現を抑制すると回復したことから,S1pr2-Gα13シグナル伝達系によるLats1/2シグナル伝達系の抑制が内胚葉シートの維持において重要であることがわかった.心臓前駆細胞にYap1の優勢劣勢変異体を発現させてYap1に依存性の転写を抑制しても二股心臓を呈さなかったことから,少なくとも心臓前駆細胞の移動において,心筋細胞におけるYap1による転写の制御は重要でないことが示唆された.以上から,内胚葉におけるスフィンゴシン1-リン酸シグナル伝達系により転写因子Yap1が機能して,内胚葉シートの形態が維持されていることが明らかにされた.
発生の初期の段階において,内胚葉はまず正中線にむかって収束し,さらに頭尾の方向にむかい伸張する.転写因子Yap1の発現の抑制により内胚葉シートの欠損が生じる理由として,内胚葉細胞の運動および遊走,および,内胚葉細胞における生存シグナルの異常の2つの可能性が考えられた.内胚葉においてGFPを発現するトランスジェニックゼブラフィッシュの胚において,Yap1の発現を抑制してタイムラプス観察を行ったところ,内胚葉細胞の破裂および断片化が認められた.このことから,Yap1は内胚葉細胞の生存および維持に不可欠であり,Yap1に依存性の転写により内胚葉において生存に重要なタンパク質が発現していると考えた.そこで,内胚葉においてGFPを発現するトランスジェニックゼブラフィッシュにおいて,野生型の胚およびYap1の発現を抑制した胚から蛍光セルソーターを用いてGFP陽性を示す内胚葉細胞を分取した.この細胞に対しRNA-seq法を行うことにより,Yap1に依存性の転写により活性が制御されると報告されている遺伝子の発現について調べた.その結果,Ctgfa遺伝子およびCyr61遺伝子の発現が野生型の胚において著明に低下していたので,この2つの遺伝子の発現を抑制して心臓前駆細胞の移動について調べた.その結果,Ctgfa遺伝子の発現を抑制した個体のみで二股心臓を呈したことから,心臓前駆細胞の移動には結合組織増殖因子Ctgfaの発現が必要であることがわかった.
転写因子Yap1による結合組織増殖因子Ctgfaの発現が心筋前駆細胞の移動において重要なのは,内胚葉における細胞自律的な制御としてなのか,あるいは,心筋前駆細胞においても重要なのかを確認することが必要と考えた.そのため,内胚葉に分化する予定の細胞あるいは心筋細胞に分化する予定の細胞において,Yap1あるいはCtgfaの発現を特異的に抑制した10,11).その結果,内胚葉に分化する予定の細胞においてYap1あるいはCtgfaの発現を抑制したときのみ,内胚葉の欠損を示し二股心臓になった.内胚葉においてGFPを発現するトランスジェニックゼブラフィッシュの胚から内胚葉細胞を分取し,siRNAによりYap1あるいはCtgfaをノックダウンしてフィブロネクチンをコートした培養皿への接着および広がりを観察した.Yap1あるいはCtgfaがノックダウンされた細胞は接着が弱くなり細胞の広がりが低下していたことから,Ctgfaは内胚葉において細胞と細胞外基質とのあいだの接着を制御していることが示唆された.
以上の結果から,内胚葉細胞におけるスフィンゴシン1-リン酸により惹起されたS1pr2-Gα13シグナル伝達系によるLats1/2の抑制と,それにひきつづくYap1に依存性のCtgfaの発現の上昇により,内胚葉それ自体の生存および維持の機構がはたらくことが明らかにされた(図1).この結果は,内胚葉が心筋前駆細胞の移動の際の足場となることを示した.
心臓の初期の発生において,両側の側板中胚葉の移動の制御機構として内胚葉が移動の足場となるためには,スフィンゴシン1-リン酸により活性化される内胚葉におけるシグナル伝達系が重要である.ゼブラフィッシュでは卵黄合胞体層から分泌されるスフィンゴシン1-リン酸がこのシグナルの起源になっているが,哺乳類には卵黄合胞体層がないため,ほかの機構が内胚葉の維持にはたらいているのかもしれない.今回の研究において,心臓の位置の決定において内胚葉が必須であることを示したが,内胚葉それ自体の欠損により内臓の位置に異常をきたすことについても調べる必要がある.また,胚葉のあいだのシグナル伝達は内胚葉→中胚葉(心臓)であったが,膵臓,肝臓,脾臓など左右非対称の内臓の位置の決定には逆に中胚葉→内胚葉のシグナル伝達もかかわる可能性がある.今後は,左右非対称な臓器の位置の決定において,内胚葉と中胚葉とのあいだのシグナル伝達の解明にむけた研究も必要であることが示唆された.
略歴:2009年 京都大学大学院生命科学研究科博士課程 修了,同年 京都府立医科大学大学院医学研究科 助教を経て,2012年より国立循環器病研究センター研究所 研究員.
研究テーマ:心筋細胞の運命の決定機構および形態の制御機構.
関心事:動的な状態における蛍光イメージング.
望月 直樹(Naoki Mochizuki)
国立循環器病研究センター研究所 部長.
研究室URL:http://www.ncvc.go.jp/res/divisions/structural_analysis/index.html
© 2014 福井 一・望月直樹 Licensed under CC 表示 2.1 日本
(国立循環器病研究センター研究所 細胞生物学部)
email:福井 一,望月直樹
DOI: 10.7875/first.author.2014.133
S1P-Yap1 signaling regulates endoderm formation required for cardiac precursor cell migration in zebrafish.
Hajime Fukui, Kenta Terai, Hiroyuki Nakajima, Ayano Chiba, Shigetomo Fukuhara, Naoki Mochizuki
Developmental Cell, 31, 128-136 (2014)
要 約
心臓の前駆細胞は両側の側版中胚葉に由来し,これが正中に移動することによりひとつの原始心筒を形成し,そののち,心房および心室ができあがる.ゼブラフィッシュを用いた研究において,内胚葉の変異体やスフィンゴシン1-リン酸シグナル伝達系を構成するタンパク質の変異体では,心臓前駆細胞の正中への移動が障害され,結果として二股心臓を呈することが報告されていた.この原因として,内胚葉が心臓前駆細胞の足場となり両側から正中への移動を制御していることが考えられていたが,その機構は不明であった.今回の研究において,卵黄合胞体層から分泌されたスフィンゴシン1-リン酸は内胚葉においてスフィンゴシン1-リン酸受容体を活性化し,セリン/スレオニンキナーゼであるLats1/2を阻害することにより,転写因子Yap1の核への移行を促進していることがわかった.Yap1は結合組織増殖因子Ctgfaの発現を促進し,Ctgfaが基質であるフィブロネクチンに結合することにより内胚葉は維持されていた.その結果,心臓前駆細胞の正中への移動が可能になることが明らかにされた.
はじめに
中胚葉臓器である心臓が形成される過程は,まず,両側の側板中胚葉において心臓の前駆細胞が決定されることからはじまる.さらに,この心臓前駆細胞が正中へむかって移動し,両側の心臓前駆細胞が集団となり原始心筒が形成される.そののち,1次心臓領域と2次心臓領域の大別された心筋細胞が心室および心房を形成する細胞になる.ゼブラフィッシュは1心房1心室であり,哺乳類の2心房2心室とは異なるが,ゼブラフィッシュでも哺乳類でも両側の中胚葉に存在する心臓前駆細胞の正中への移動が障害されると,二股心臓とよばれる両側に心臓のみられる発生の異常が生じる.ゼブラフィッシュの心臓前駆細胞は内胚葉と卵黄合胞体層とにはさまれる空間を移動する1).そのため,内胚葉それ自体が移動の足場になること,および,内胚葉は移動の足場になる細胞外基質を分泌することが予想されていた.実際に,内胚葉を欠損した変異体や細胞外基質であるフィブロネクチンの変異体では,二股心臓を呈することが報告された2,3).さらに,スフィンゴシン1-リン酸の受容体であるS1pr2の変異体,および,スフィンゴシン1-リン酸の輸送体であるSpsn2の変異体において二股心臓になるゼブラフィッシュが報告されたことから4,5),スフィンゴシン1-リン酸シグナル伝達系の障害により心臓前駆細胞の移動に異常を来たすことが示唆された.筆者らは,Spns2は卵黄合胞体層に発現することから,スフィンゴシン1-リン酸は内胚葉あるいは心筋前駆細胞に作用することにより心筋前駆細胞の移動を制御していると予想した.
近年,哺乳類において,スフィンゴシン1-リン酸により活性化されたS1PR2がHippoシグナルにより制御される転写因子Yap1の核への移行を促進することが報告された6).このYap1の核への移行の促進は培養細胞において認められたもので,個体における生理的な機能の意義については未解明であった.Yap1はTEADファミリータンパク質と結合してCTGF遺伝子,Cyr61遺伝子,Birc5遺伝子などの転写を促進することが報告されていた7).以上の知見から,筆者らは,ゼブラフィッシュの個体においては,卵黄合胞体層から分泌されたスフィンゴシン1-リン酸の下流にて転写因子Yap1が機能することにより心臓前駆細胞の移動が制御されているという仮説を証明しようと考えた.
1.Yap1に依存性の転写は心臓前駆細胞の正中への移動に必須である
心臓前駆細胞の位置を確認できるよう,心筋ミオシン軽鎖の遺伝子プロモーターに依存して蛍光タンパク質を発現するトランスジェニックゼブラフィッシュを作製した.このトランスジェニックゼブラフィッシュにおいて,アンチセンスオリゴヌクレオチドモルフォリーノを用いて転写因子Yap1の発現を抑制した胚は二股心臓を呈した.さらに,TEADファミリータンパク質との結合ドメインだけを発現するYap1の優勢劣勢変異体を胚において発現させたところ二股心臓を呈したことから,Yap1に依存性の転写が心臓前駆細胞の移動に不可欠であることがわかった.
2.内胚葉にてスフィンゴシン1-リン酸シグナル伝達系の下流においてYap1の機能することが心臓前駆細胞の移動に重要である
スフィンゴシン1-リン酸の受容体であるS1pr2およびスフィンゴシン1-リン酸の輸送体であるSpns2は,それぞれ,内胚葉および卵黄合胞体層において発現することが報告されていた.そのため,内胚葉あるいは卵黄合胞体層のいずれにおいて転写因子Yap1の機能することが重要かを調べることが必要と考えた.そこで,卵黄合胞体層においてS1pr2,Spns2,Yap1の発現をそれぞれ抑制した場合の心臓の位置を確認したところ,Spns2の発現を抑制した場合には二股心臓を呈したが,S1pr2あるいはYap1の発現を抑制した場合には異常は認められなかった.したがって,S1pr2によるYap1の制御は内胚葉において機能している可能性が考えられた.内胚葉の形態を観察するため,内胚葉において活性化するsox17遺伝子のプロモーターによりGFPを発現するトランスジェニックゼブラフィッシュを用い8),S1pr2あるいはYap1の発現を抑制した個体を観察したところ,内胚葉シートの欠損が認められた.S1pr2と三量体Gタンパク質であるGα13とによるシグナル伝達系が内胚葉の形成にかかわるという報告があったため9),Gα13の発現を抑制した個体を調べたところ,内胚葉の欠損が認められた.これらの内胚葉の欠損はセリン/スレオニンキナーゼであるLats1/2の発現を抑制すると回復したことから,S1pr2-Gα13シグナル伝達系によるLats1/2シグナル伝達系の抑制が内胚葉シートの維持において重要であることがわかった.心臓前駆細胞にYap1の優勢劣勢変異体を発現させてYap1に依存性の転写を抑制しても二股心臓を呈さなかったことから,少なくとも心臓前駆細胞の移動において,心筋細胞におけるYap1による転写の制御は重要でないことが示唆された.以上から,内胚葉におけるスフィンゴシン1-リン酸シグナル伝達系により転写因子Yap1が機能して,内胚葉シートの形態が維持されていることが明らかにされた.
3.Yap1による内胚葉の形態の維持には内胚葉における生存シグナルが重要である
発生の初期の段階において,内胚葉はまず正中線にむかって収束し,さらに頭尾の方向にむかい伸張する.転写因子Yap1の発現の抑制により内胚葉シートの欠損が生じる理由として,内胚葉細胞の運動および遊走,および,内胚葉細胞における生存シグナルの異常の2つの可能性が考えられた.内胚葉においてGFPを発現するトランスジェニックゼブラフィッシュの胚において,Yap1の発現を抑制してタイムラプス観察を行ったところ,内胚葉細胞の破裂および断片化が認められた.このことから,Yap1は内胚葉細胞の生存および維持に不可欠であり,Yap1に依存性の転写により内胚葉において生存に重要なタンパク質が発現していると考えた.そこで,内胚葉においてGFPを発現するトランスジェニックゼブラフィッシュにおいて,野生型の胚およびYap1の発現を抑制した胚から蛍光セルソーターを用いてGFP陽性を示す内胚葉細胞を分取した.この細胞に対しRNA-seq法を行うことにより,Yap1に依存性の転写により活性が制御されると報告されている遺伝子の発現について調べた.その結果,Ctgfa遺伝子およびCyr61遺伝子の発現が野生型の胚において著明に低下していたので,この2つの遺伝子の発現を抑制して心臓前駆細胞の移動について調べた.その結果,Ctgfa遺伝子の発現を抑制した個体のみで二股心臓を呈したことから,心臓前駆細胞の移動には結合組織増殖因子Ctgfaの発現が必要であることがわかった.
4.内胚葉における細胞自律的なYap1に依存性のCtgfaの発現が細胞の生存に重要である
転写因子Yap1による結合組織増殖因子Ctgfaの発現が心筋前駆細胞の移動において重要なのは,内胚葉における細胞自律的な制御としてなのか,あるいは,心筋前駆細胞においても重要なのかを確認することが必要と考えた.そのため,内胚葉に分化する予定の細胞あるいは心筋細胞に分化する予定の細胞において,Yap1あるいはCtgfaの発現を特異的に抑制した10,11).その結果,内胚葉に分化する予定の細胞においてYap1あるいはCtgfaの発現を抑制したときのみ,内胚葉の欠損を示し二股心臓になった.内胚葉においてGFPを発現するトランスジェニックゼブラフィッシュの胚から内胚葉細胞を分取し,siRNAによりYap1あるいはCtgfaをノックダウンしてフィブロネクチンをコートした培養皿への接着および広がりを観察した.Yap1あるいはCtgfaがノックダウンされた細胞は接着が弱くなり細胞の広がりが低下していたことから,Ctgfaは内胚葉において細胞と細胞外基質とのあいだの接着を制御していることが示唆された.
以上の結果から,内胚葉細胞におけるスフィンゴシン1-リン酸により惹起されたS1pr2-Gα13シグナル伝達系によるLats1/2の抑制と,それにひきつづくYap1に依存性のCtgfaの発現の上昇により,内胚葉それ自体の生存および維持の機構がはたらくことが明らかにされた(図1).この結果は,内胚葉が心筋前駆細胞の移動の際の足場となることを示した.
おわりに
心臓の初期の発生において,両側の側板中胚葉の移動の制御機構として内胚葉が移動の足場となるためには,スフィンゴシン1-リン酸により活性化される内胚葉におけるシグナル伝達系が重要である.ゼブラフィッシュでは卵黄合胞体層から分泌されるスフィンゴシン1-リン酸がこのシグナルの起源になっているが,哺乳類には卵黄合胞体層がないため,ほかの機構が内胚葉の維持にはたらいているのかもしれない.今回の研究において,心臓の位置の決定において内胚葉が必須であることを示したが,内胚葉それ自体の欠損により内臓の位置に異常をきたすことについても調べる必要がある.また,胚葉のあいだのシグナル伝達は内胚葉→中胚葉(心臓)であったが,膵臓,肝臓,脾臓など左右非対称の内臓の位置の決定には逆に中胚葉→内胚葉のシグナル伝達もかかわる可能性がある.今後は,左右非対称な臓器の位置の決定において,内胚葉と中胚葉とのあいだのシグナル伝達の解明にむけた研究も必要であることが示唆された.
文 献
- Staudt, D. & Stainier, D.: Uncovering the molecular and cellular mechanisms of heart development using zebrafish. Annu. Rev. Genet., 46, 397-418 (2012)[PubMed]
- Sainier, D., Fouquet, B., Chen, J. N. et al.: Mutations affecting the formation and function of the cardiovascular system in the zebrafish embryo. Development, 123, 285-192 (1996)[PubMed]
- Sakaguchi, T., Kikuchi, Y., Kutoiwa, A. et al.: The yolk syncutial layer regulates myocardial migration by influencing extracellular matrix assembly in zebrafish. Development, 133, 4063-4071 (2006)[PubMed]
- Kupperman, E., An, S., Osborne N. et al.: A sphingosine-1-phosphate receptor regulates cell migration during vertebrate heart development. Nature, 406, 192-195 (2000)[PubMed]
- Kawahara, A., Nishi, T., Hisano, Y. et al.: The sphingolipid transporter spns2 functions in migration of zebrafish myocardial precursors. Science, 323, 524-527 (2009)[PubMed]
- Yu, F. X., Zhao, B., Panupinthu, N. et al.: Regulation of the Hippo-YAP pathway by G-protein-coupled receptor signaling. Cell, 150, 780-791 (2012)[PubMed]
- Hong, W. & Guan, K. L.: The YAP and TAZ transcription co-activators: key downstream effectors of the mammalian Hippo pathway. Semin. Cell Dev. Biol., 23, 785-793 (2012)[PubMed]
- Mizoguchi, T., Verkade, H., Heath, J. K. et al.: Sdf1/Cxcr4 signaling controls the dorsal migration of endodermal cells during zebrafish gastrulation. Development, 135, 2521-2529 (2008)[PubMed]
- Ye, D. & Lin, F.: S1pr2/Gα13 signaling controls myocardial migration by regulating endoderm convergence. Development 140, 789-799 (2013)[PubMed]
- Aoki, T.O., David N.B., Minchiotti, G. et al.: Molecular integration of casanova in the Nodal signaling pathway controlling endoderm formation. Development, 129, 275-286 (2002)[PubMed]
- Lou, S., Deshwar, A. R., Crump, J. G. et al.: Smarcd3b and Gata5 promote a cardiac progenitor fate in zebrafish embryo. Development, 138, 3113-3123 (2011)[PubMed]
著者プロフィール
略歴:2009年 京都大学大学院生命科学研究科博士課程 修了,同年 京都府立医科大学大学院医学研究科 助教を経て,2012年より国立循環器病研究センター研究所 研究員.
研究テーマ:心筋細胞の運命の決定機構および形態の制御機構.
関心事:動的な状態における蛍光イメージング.
望月 直樹(Naoki Mochizuki)
国立循環器病研究センター研究所 部長.
研究室URL:http://www.ncvc.go.jp/res/divisions/structural_analysis/index.html
© 2014 福井 一・望月直樹 Licensed under CC 表示 2.1 日本