ドーパミンがスパインの形態の可塑性に対して作用する狭い時間枠
柳下 祥・河西春郎
(東京大学大学院医学系研究科 疾患生命工学センター構造生理学部門)
email:河西春郎
DOI: 10.7875/first.author.2014.126
A critical time window for dopamine actions on the structural plasticity of dendritic spines.
Sho Yagishita, Akiko Hayashi-Takagi, Graham C.R. Ellis-Davies, Hidetoshi Urakubo, Shin Ishii, Haruo Kasai
Science, 345, 1616-1620 (2014)
動物の行動は報酬により強化することができるが,この際,報酬は強化する行動や条件刺激のすぐあとにあたえなければならない.この報酬のタイミングは条件反射や強化学習の要件である.報酬シグナルは側坐核や線条体に投射するドーパミン作動性ニューロンの一過性の発火により表現され,このドーパミンがシナプスの可塑性を修飾することが学習の基盤となると考えられてきた.しかし,ドーパミン作動性ニューロンが発火したタイミングがどのように検出されて可塑性を制御しているのかというドーパミンの報酬作用の根本となる部分の理解はなされていなかった.そこで,筆者らは,マウスの脳の側坐核のニューロンにおいて,2光子刺激により単一のスパインにおいてグルタミン酸のシグナルを,光遺伝学によりドーパミンのシグナルを独立に操作することにより,ドーパミンがスパインの頭部の増大をひき起こす時間枠を調べた.その結果,グルタミン酸の刺激によりスパインが活性化された直後から0.3~2秒後の短い時間枠でのみ,興奮性シナプスのスパインの頭部に増大が起こり,50分後までシナプス結合が強化されつづけることが確かめられた.この時間枠はドーパミンの下流のシグナルであるcAMPの産生および分解が樹状突起の細い形状をもつ部分において鋭く制御されることにより形成されていた.今回,見い出された単一のスパインがもつ強化的な可塑性の時間枠は,ドーパミンが報酬作用をもつための基本的な特性と考えられた.
条件づけ学習は100年以上もまえに記述されており,報酬は強化すべき行動や感覚刺激のすぐあとにあたえなければならないことが知られている.報酬による条件づけ学習には側坐核や線条体といった脳部位がかかわるとされ,これらの領域に新皮質,海馬,扁桃体から投射するグルタミン酸作動性ニューロンのシナプスが,報酬シグナルであるドーパミンにより可塑的に制御されることが学習の基盤になると考えられてきた.動物の行動において報酬のタイミングが強化すべき行動や感覚刺激を決めていることから,ドーパミンの作用にも時間枠があることが予想された.条件づけについても,シナプス結合している2つのニューロンが同期して興奮するときにシナプス結合は強くなるというHebbの学習則が関与すると考えられていた.しかし,実際に条件づけがどのようなニューロンや神経回路の機構によりなされているかは不明であった.そのひとつの理由として,これまでの電気刺激による実験では,グルタミン酸作動性ニューロンとドーパミン作動性ニューロンを独立して刺激することができなかったことがある.
そこで,筆者らは,マウスの脳の側坐核のニューロンにおいて,2光子刺激により単一のスパインにおいてグルタミン酸のシグナルを,光遺伝学によりドーパミンのシグナルを,それぞれ独立に操作することによりドーパミンの作用の時間枠を調べることにした.大脳の興奮性シナプスの後部にはスパインとよばれる構造がある.このスパインの体積と機能は相関しており1),さらに,可塑性の刺激をあたえると刺激したスパインに特異的に頭部が増大しグルタミン酸のシグナルにより流れる電流値が増大することから,長期にわたり安定するシナプスの可塑性には形態的な基盤があると考えられるようになった2,3).側坐核の主たるニューロンである中型有棘ニューロンもスパインに富み,このスパインの形態の可塑性がドーパミンにより制御されている可能性が予測された.
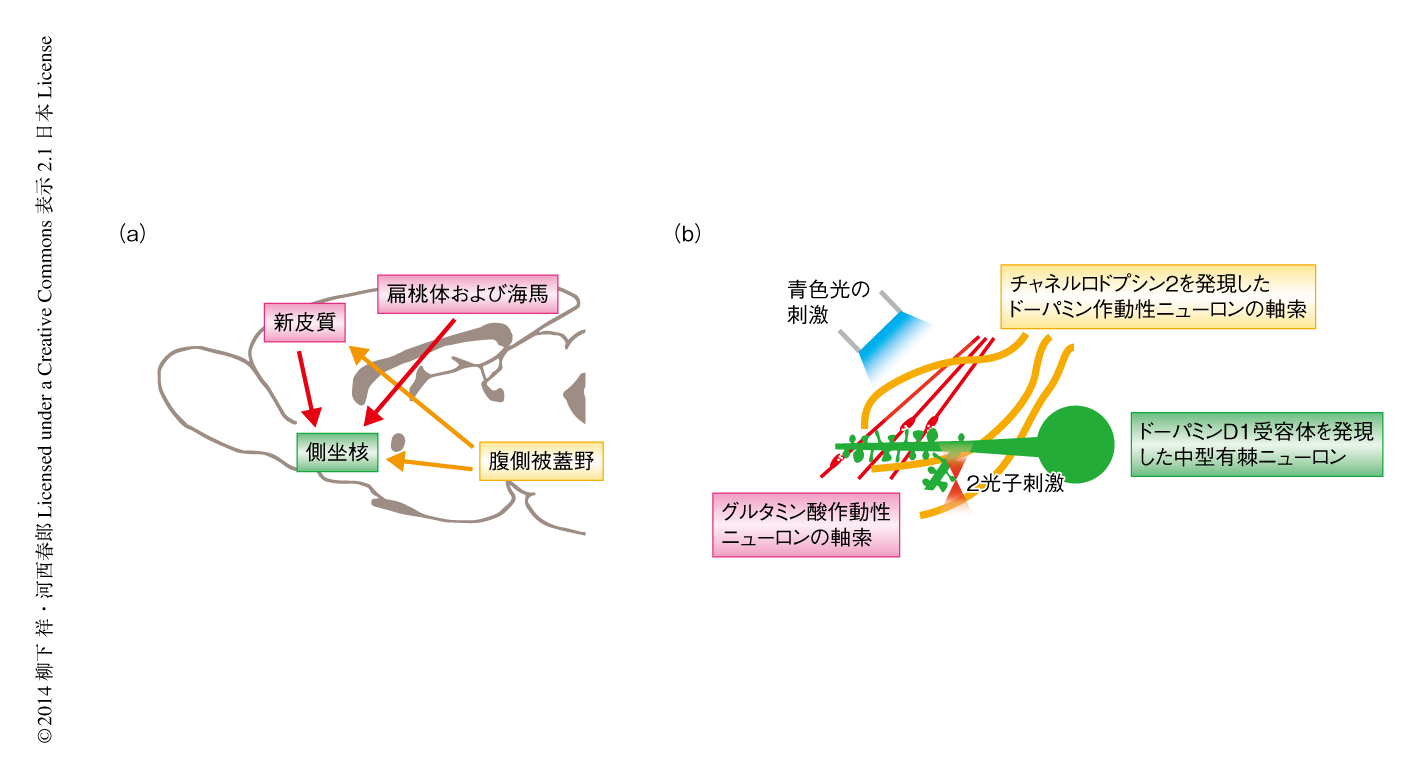
ドーパミン報酬作用の神経基盤を明らかにするため,光刺激によりグルタミン酸のシグナルとドーパミンのシグナルとを独立して制御する実験系を構築した.具体的には,DAT-CreマウスにCreレコンビナーゼに依存的に発現するチャネルロドプシン2をアデノ随伴ウイルスベクターを用いて導入し,切片標本において青色レーザーによりチャネルロドプシン2を視野の全体において刺激し,単一のスパインを2光子刺激によるケイジドグルタミン酸の分解1) により刺激できるようにした(図1).マウスの個体においては報酬に反応して過半数のドーパミン作動性ニューロンが一過性の発火応答を示すことから,ドーパミンのシグナルは時間的には厳密に制御されているが,おのおののドーパミン作動性ニューロンは空間的には広い箇所に投射し4),拡散性の伝達により広い範囲にドーパミンを放出する.このことから,ドーパミン作動性ニューロンはチャネルロドプシン2により時間的な発火パターンは制御しつつ,視野の全体において活性化させた.
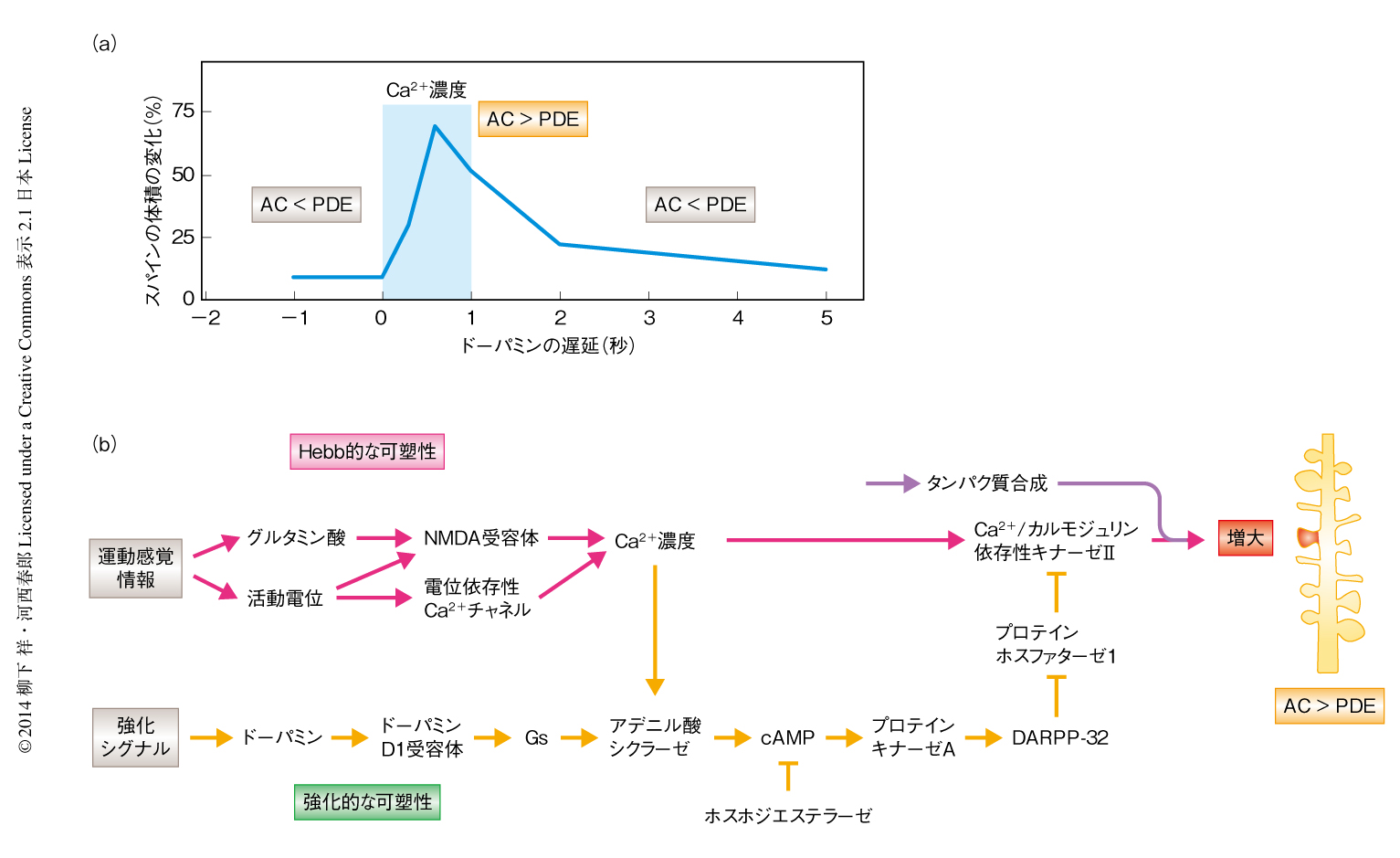
側坐核にはドーパミンD1受容体を発現し直接路を構成する中型有棘ニューロンと,ドーパミンD2受容体を発現し間接路を構成する中型有棘ニューロンとがあるが,報酬による学習の獲得はドーパミンD1受容体を発現する中型有棘ニューロンが中心となる5).ドーパミンD1受容体はドーパミンに応答する閾値が高いため,報酬によるドーパミン作動性ニューロンの一過性の発火により高濃度に上昇するドーパミンによりはじめて活性化するとされる.そこで,側坐核のドーパミンD1受容体を発現する中型有棘ニューロンをウイルスにより標識し,このスパインの形態の可塑性にあたえるドーパミンの影響を調べた.まず,グルタミン酸の2光子刺激によりスパイクのタイミングに依存的な可塑性の刺激を単一のスパインにあたえたが,形態の可塑性はわずかしかみられなかった.このときの刺激の回数は,先行研究において海馬のスパインに対し用いられた刺激3) よりも多かった.ところが,ここに高濃度のドーパミンを持続的に投与すると顕著な形態の可塑性を示した.つぎに,生体における反応を模したドーパミンの一過性の発火刺激をスパイクのタイミングに依存的な可塑性の刺激のすぐあとにあたえたところ,ドーパミンの持続的な投与と同等の可塑性を示した.しかし,スパイクのタイミングに依存的な可塑性の刺激の1秒前あるいは5秒後にドーパミンの刺激をあたえても可塑性は示されなかった.時間枠を詳細に調べると,スパイクのタイミングに依存的な可塑性の刺激の0.6秒後(ピークが重なる)においてもっとも強い反応がみられた(図2a).この形態の可塑性はグルタミン酸の2光子刺激による電流値の増加(長期増強)をともなっていた.
このドーパミンに依存性の形態の可塑性にかかわるシグナル伝達系を薬理学的に調べたところ,NMDA受容体,Ca2+/カルモジュリン依存性キナーゼII,タンパク質合成といった,海馬におけるスパインの形態の可塑性と同様のシグナル伝達系が必要であった.くわえて,ドーパミンD1受容体およびプロテインキナーゼAも関与していた.
さらに,ドーパミンやその下流のシグナルはどのようにCa2+やCa2+/カルモジュリン依存性キナーゼIIといった可塑性のシグナル伝達系に影響をあたえるのかを調べた.ドーパミンの可塑性の修飾のタイミングは秒単位と速かったため,この修飾にはCa2+シグナルの制御がかかわっている可能性を検討した.Ca2+蛍光指示薬を用いて,スパイクのタイミングに依存的な可塑性の刺激により誘発されたスパインにおけるCa2+濃度の上昇がドーパミンの刺激により変化するかどうか調べたが,Ca2+濃度の上昇はドーパミンによる明らかな修飾をうけなかった.
そこで,Ca2+の下流であるCa2+/カルモジュリン依存性キナーゼIIの活性をFRETプローブにより測定することにより,ドーパミンがCa2+/カルモジュリン依存性キナーゼIIの活性を制御している可能性について調べた.プロテインホスファターゼ1はCa2+/カルモジュリン依存性キナーゼIIを脱リン酸化することにより阻害し,さらに,DARPP-32はプロテインホスファターゼ1を阻害することから,ドーパミンD1受容体-プロテインキナーゼA-DARPP32-プロテインホスファターゼ1というシグナル伝達経路によるCa2+/カルモジュリン依存性キナーゼIIの脱抑制が関与しているという仮説について検証した.スパイクのタイミングに依存的な可塑性の刺激だけではスパインにおいて微弱なCa2+/カルモジュリン依存性キナーゼII活性しか認められなかった.このCa2+/カルモジュリン依存性キナーゼII活性をドーパミンは増強したが,その時間枠は可塑性を増強する時間枠と同様であった.このドーパミンによるCa2+/カルモジュリン依存性キナーゼII活性および形態の可塑性の増強作用はDARPP-32を阻害すると抑制された.また,ドーパミンの作用はプロテインホスファターゼ1を阻害することにより置換された.これらのことから,ドーパミンはプロテインキナーゼA-DARPP32-プロテインホスファターゼ1というシグナル伝達経路を介してCa2+/カルモジュリン依存性キナーゼIIの脱抑制をすることにより可塑性を制御しているものと考えられた(図2b).同時に,Ca2+/カルモジュリン依存性キナーゼIIの活性化の時点で,すでに時間枠が形成されていることが示唆された.
プロテインキナーゼAの活性をモニターするFRETプローブを用いて,時間枠を形成する分子基盤について調べた.まず,可塑性が誘発されるタイミングでスパイクのタイミングに依存的な可塑性の刺激とドーパミンの刺激をあたえ,スパインにおけるプロテインキナーゼAの活性を測定した.すると,グルタミン酸の刺激をあたえたスパインにくわえ,周囲のスパインや樹状突起においてもプロテインキナーゼAの活性がみられた.さらに,グルタミン酸の刺激がなくても,活動電位とドーパミンの刺激のみでプロテインキナーゼAの活性は上昇した.しかし,ドーパミンの刺激だけではプロテインキナーゼAの活性の上昇はみられなかったことから,樹状突起におけるプロテインキナーゼAの活性はドーパミンと活動電位に依存することがわかった.そこで,活動電位に対してさまざまな時間枠でドーパミンの刺激をあたえたところ,可塑性の時間枠と類似した時間枠でのみ,プロテインキナーゼAの活性がみられた.活動電位とドーパミンの相互作用には,Ca2+/カルモジュリンおよびGタンパク質Gsにより相乗的に活性化されるアデニル酸シクラーゼ1が関与している可能性が考えられたので,その阻害剤であるNB001を投与したところ,プロテインキナーゼAの活性もスパインの形態の可塑性も阻害された.
樹状突起においてドーパミンの刺激だけではプロテインキナーゼAの活性が上昇しなかったことは意外であり,これまでの報告とは一致しなかった.そこで,細胞の全体においてドーパミンの刺激をあたえたときのプロテインキナーゼAの活性を測定してみると,細胞体においては活動電位がなくてもプロテインキナーゼAの活性の上昇がみられた.活動電位をあたえると細胞体におけるプロテインキナーゼAの活性も上昇したが,その程度は小さかった.つまり,樹状突起はドーパミンの刺激だけではプロテインキナーゼAの活性は上昇しないことから,樹状突起は活動電位によるプロテインキナーゼAの活性の制御の幅が広く,ドーパミンの刺激と活動電位のタイミングを鋭敏に検出できると考えられた.このように,ドーパミンの刺激だけではプロテインキナーゼAの活性が上昇しない理由として,cAMPの分解が高い可能性が考えられた.そこで,線条体に多く存在するホスホジエステラーゼ10Aに対する阻害剤であるパパベリンを投与すると,ドーパミンの刺激だけで樹状突起のプロテインキナーゼAの活性の上昇がみられた.ホスホジエステラーゼ10Aは細胞において一様に分布していることが報告されており,その細胞内局在は樹状突起における強い作用を説明できない.ホスホジエステラーゼは生体膜に局在することから,細い形状をもつ樹状突起においては膜体積比が高いため細胞質に存在するcAMPを効率的に分解できる可能性が考えられた.実際に,樹状突起の太さとドーパミン単独でのプロテインキナーゼAの活性の上昇には相関関係があったことから,この仮説は支持された.興味深いことに,中型有棘ニューロンにおいては,スパインは細い樹状突起にしか存在せず,スパインはドーパミンによる制御が効果的な部位にだけ存在していることが示唆された.
この研究により,単一のスパインにはドーパミンが強化的に作用できる時間枠があり,その時間枠の形成にはcAMPの産生および分解が関与していることがわかった.この時間枠は動物の個体において報酬が作用できる時間枠によく似ており6),ドーパミンのもつ報酬作用はこのシナプス基盤によると考えられた.実際の動物の行動において実験課題によっては許容される報酬の遅延は長くなるが,この遅延条件づけは海馬など大脳の神経回路がこの狭い時間枠を利用しながら成立していると推測される.また,この時間枠は強化学習理論おいて長年にわたり実態が不明であった資格痕跡の時間成分に対応する.細胞レベルでの条件づけの先駆的な研究によれば,前シナプスの軸索の終末において侵害刺激に反応したセロトニンおよびニューロンの発火がアデニル酸シクラーゼにより検出されることでcAMPが産生され,プロテインキナーゼAの活性が上昇することにより条件づけされるという7).この実験系においては報酬ではなく侵害刺激であり,また,哺乳動物の可塑性の主座である後シナプスではなく前シナプスにおける現象であるという違いがあるが,分子レベルでみると,モノアミンとおよびニューロンの発火のアデニル酸シクラーゼによる同期の検出という類似性がみられた.スパインにおいては,適切なタイミングでドーパミンがあたえられるとプロテインキナーゼAの活性が上昇し,これがCa2+/カルモジュリン依存性キナーゼIIを活性化する.NMDA受容体-Ca2+/カルモジュリン依存性キナーゼIIというシグナル伝達経路はHebbの学習則である同期発火によるシナプスの可塑性(Hebbの可塑性)において中心的な役割を担う.一方,ドーパミンによる強化作用はHebbの学習則とは異なり,シナプス後細胞の発火をともなわずHebbの可塑性を制御している.この2つの学習機構の協調により樹状突起の全体に広がるプロテインキナーゼAの活性の上昇が特定のスパインだけを強化することができ,報酬シグナルであるドーパミンが直前に活動した単一のスパインだけを強化できる.このように,単一のスパインのレベルにおいて強化的な可塑性の分子基盤および細胞基盤が明らかにされた.この強化の可塑性が精神疾患の理解の鍵をにぎっているのかもしれない.
略歴:東京大学大学院医学系研究科 特任助教.
研究テーマ:シナプスと学習,精神疾患.
河西 春郎(Haruo Kasai)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.bm2.m.u-tokyo.ac.jp/
© 2014 柳下 祥・河西春郎 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 疾患生命工学センター構造生理学部門)
email:河西春郎
DOI: 10.7875/first.author.2014.126
A critical time window for dopamine actions on the structural plasticity of dendritic spines.
Sho Yagishita, Akiko Hayashi-Takagi, Graham C.R. Ellis-Davies, Hidetoshi Urakubo, Shin Ishii, Haruo Kasai
Science, 345, 1616-1620 (2014)
要 約
動物の行動は報酬により強化することができるが,この際,報酬は強化する行動や条件刺激のすぐあとにあたえなければならない.この報酬のタイミングは条件反射や強化学習の要件である.報酬シグナルは側坐核や線条体に投射するドーパミン作動性ニューロンの一過性の発火により表現され,このドーパミンがシナプスの可塑性を修飾することが学習の基盤となると考えられてきた.しかし,ドーパミン作動性ニューロンが発火したタイミングがどのように検出されて可塑性を制御しているのかというドーパミンの報酬作用の根本となる部分の理解はなされていなかった.そこで,筆者らは,マウスの脳の側坐核のニューロンにおいて,2光子刺激により単一のスパインにおいてグルタミン酸のシグナルを,光遺伝学によりドーパミンのシグナルを独立に操作することにより,ドーパミンがスパインの頭部の増大をひき起こす時間枠を調べた.その結果,グルタミン酸の刺激によりスパインが活性化された直後から0.3~2秒後の短い時間枠でのみ,興奮性シナプスのスパインの頭部に増大が起こり,50分後までシナプス結合が強化されつづけることが確かめられた.この時間枠はドーパミンの下流のシグナルであるcAMPの産生および分解が樹状突起の細い形状をもつ部分において鋭く制御されることにより形成されていた.今回,見い出された単一のスパインがもつ強化的な可塑性の時間枠は,ドーパミンが報酬作用をもつための基本的な特性と考えられた.
はじめに
条件づけ学習は100年以上もまえに記述されており,報酬は強化すべき行動や感覚刺激のすぐあとにあたえなければならないことが知られている.報酬による条件づけ学習には側坐核や線条体といった脳部位がかかわるとされ,これらの領域に新皮質,海馬,扁桃体から投射するグルタミン酸作動性ニューロンのシナプスが,報酬シグナルであるドーパミンにより可塑的に制御されることが学習の基盤になると考えられてきた.動物の行動において報酬のタイミングが強化すべき行動や感覚刺激を決めていることから,ドーパミンの作用にも時間枠があることが予想された.条件づけについても,シナプス結合している2つのニューロンが同期して興奮するときにシナプス結合は強くなるというHebbの学習則が関与すると考えられていた.しかし,実際に条件づけがどのようなニューロンや神経回路の機構によりなされているかは不明であった.そのひとつの理由として,これまでの電気刺激による実験では,グルタミン酸作動性ニューロンとドーパミン作動性ニューロンを独立して刺激することができなかったことがある.
そこで,筆者らは,マウスの脳の側坐核のニューロンにおいて,2光子刺激により単一のスパインにおいてグルタミン酸のシグナルを,光遺伝学によりドーパミンのシグナルを,それぞれ独立に操作することによりドーパミンの作用の時間枠を調べることにした.大脳の興奮性シナプスの後部にはスパインとよばれる構造がある.このスパインの体積と機能は相関しており1),さらに,可塑性の刺激をあたえると刺激したスパインに特異的に頭部が増大しグルタミン酸のシグナルにより流れる電流値が増大することから,長期にわたり安定するシナプスの可塑性には形態的な基盤があると考えられるようになった2,3).側坐核の主たるニューロンである中型有棘ニューロンもスパインに富み,このスパインの形態の可塑性がドーパミンにより制御されている可能性が予測された.
1.スパインの頭部の増大を増強するドーパミンの時間枠
ドーパミン報酬作用の神経基盤を明らかにするため,光刺激によりグルタミン酸のシグナルとドーパミンのシグナルとを独立して制御する実験系を構築した.具体的には,DAT-CreマウスにCreレコンビナーゼに依存的に発現するチャネルロドプシン2をアデノ随伴ウイルスベクターを用いて導入し,切片標本において青色レーザーによりチャネルロドプシン2を視野の全体において刺激し,単一のスパインを2光子刺激によるケイジドグルタミン酸の分解1) により刺激できるようにした(図1).マウスの個体においては報酬に反応して過半数のドーパミン作動性ニューロンが一過性の発火応答を示すことから,ドーパミンのシグナルは時間的には厳密に制御されているが,おのおののドーパミン作動性ニューロンは空間的には広い箇所に投射し4),拡散性の伝達により広い範囲にドーパミンを放出する.このことから,ドーパミン作動性ニューロンはチャネルロドプシン2により時間的な発火パターンは制御しつつ,視野の全体において活性化させた.
側坐核にはドーパミンD1受容体を発現し直接路を構成する中型有棘ニューロンと,ドーパミンD2受容体を発現し間接路を構成する中型有棘ニューロンとがあるが,報酬による学習の獲得はドーパミンD1受容体を発現する中型有棘ニューロンが中心となる5).ドーパミンD1受容体はドーパミンに応答する閾値が高いため,報酬によるドーパミン作動性ニューロンの一過性の発火により高濃度に上昇するドーパミンによりはじめて活性化するとされる.そこで,側坐核のドーパミンD1受容体を発現する中型有棘ニューロンをウイルスにより標識し,このスパインの形態の可塑性にあたえるドーパミンの影響を調べた.まず,グルタミン酸の2光子刺激によりスパイクのタイミングに依存的な可塑性の刺激を単一のスパインにあたえたが,形態の可塑性はわずかしかみられなかった.このときの刺激の回数は,先行研究において海馬のスパインに対し用いられた刺激3) よりも多かった.ところが,ここに高濃度のドーパミンを持続的に投与すると顕著な形態の可塑性を示した.つぎに,生体における反応を模したドーパミンの一過性の発火刺激をスパイクのタイミングに依存的な可塑性の刺激のすぐあとにあたえたところ,ドーパミンの持続的な投与と同等の可塑性を示した.しかし,スパイクのタイミングに依存的な可塑性の刺激の1秒前あるいは5秒後にドーパミンの刺激をあたえても可塑性は示されなかった.時間枠を詳細に調べると,スパイクのタイミングに依存的な可塑性の刺激の0.6秒後(ピークが重なる)においてもっとも強い反応がみられた(図2a).この形態の可塑性はグルタミン酸の2光子刺激による電流値の増加(長期増強)をともなっていた.
2.ドーパミンによるスパインの頭部の増大にはCa2+/カルモジュリン依存性キナーゼIIの脱抑制がかかわる
このドーパミンに依存性の形態の可塑性にかかわるシグナル伝達系を薬理学的に調べたところ,NMDA受容体,Ca2+/カルモジュリン依存性キナーゼII,タンパク質合成といった,海馬におけるスパインの形態の可塑性と同様のシグナル伝達系が必要であった.くわえて,ドーパミンD1受容体およびプロテインキナーゼAも関与していた.
さらに,ドーパミンやその下流のシグナルはどのようにCa2+やCa2+/カルモジュリン依存性キナーゼIIといった可塑性のシグナル伝達系に影響をあたえるのかを調べた.ドーパミンの可塑性の修飾のタイミングは秒単位と速かったため,この修飾にはCa2+シグナルの制御がかかわっている可能性を検討した.Ca2+蛍光指示薬を用いて,スパイクのタイミングに依存的な可塑性の刺激により誘発されたスパインにおけるCa2+濃度の上昇がドーパミンの刺激により変化するかどうか調べたが,Ca2+濃度の上昇はドーパミンによる明らかな修飾をうけなかった.
そこで,Ca2+の下流であるCa2+/カルモジュリン依存性キナーゼIIの活性をFRETプローブにより測定することにより,ドーパミンがCa2+/カルモジュリン依存性キナーゼIIの活性を制御している可能性について調べた.プロテインホスファターゼ1はCa2+/カルモジュリン依存性キナーゼIIを脱リン酸化することにより阻害し,さらに,DARPP-32はプロテインホスファターゼ1を阻害することから,ドーパミンD1受容体-プロテインキナーゼA-DARPP32-プロテインホスファターゼ1というシグナル伝達経路によるCa2+/カルモジュリン依存性キナーゼIIの脱抑制が関与しているという仮説について検証した.スパイクのタイミングに依存的な可塑性の刺激だけではスパインにおいて微弱なCa2+/カルモジュリン依存性キナーゼII活性しか認められなかった.このCa2+/カルモジュリン依存性キナーゼII活性をドーパミンは増強したが,その時間枠は可塑性を増強する時間枠と同様であった.このドーパミンによるCa2+/カルモジュリン依存性キナーゼII活性および形態の可塑性の増強作用はDARPP-32を阻害すると抑制された.また,ドーパミンの作用はプロテインホスファターゼ1を阻害することにより置換された.これらのことから,ドーパミンはプロテインキナーゼA-DARPP32-プロテインホスファターゼ1というシグナル伝達経路を介してCa2+/カルモジュリン依存性キナーゼIIの脱抑制をすることにより可塑性を制御しているものと考えられた(図2b).同時に,Ca2+/カルモジュリン依存性キナーゼIIの活性化の時点で,すでに時間枠が形成されていることが示唆された.
3.時間枠は細い形状の樹状突起におけるcAMPの産生と分解の制御により形成される
プロテインキナーゼAの活性をモニターするFRETプローブを用いて,時間枠を形成する分子基盤について調べた.まず,可塑性が誘発されるタイミングでスパイクのタイミングに依存的な可塑性の刺激とドーパミンの刺激をあたえ,スパインにおけるプロテインキナーゼAの活性を測定した.すると,グルタミン酸の刺激をあたえたスパインにくわえ,周囲のスパインや樹状突起においてもプロテインキナーゼAの活性がみられた.さらに,グルタミン酸の刺激がなくても,活動電位とドーパミンの刺激のみでプロテインキナーゼAの活性は上昇した.しかし,ドーパミンの刺激だけではプロテインキナーゼAの活性の上昇はみられなかったことから,樹状突起におけるプロテインキナーゼAの活性はドーパミンと活動電位に依存することがわかった.そこで,活動電位に対してさまざまな時間枠でドーパミンの刺激をあたえたところ,可塑性の時間枠と類似した時間枠でのみ,プロテインキナーゼAの活性がみられた.活動電位とドーパミンの相互作用には,Ca2+/カルモジュリンおよびGタンパク質Gsにより相乗的に活性化されるアデニル酸シクラーゼ1が関与している可能性が考えられたので,その阻害剤であるNB001を投与したところ,プロテインキナーゼAの活性もスパインの形態の可塑性も阻害された.
樹状突起においてドーパミンの刺激だけではプロテインキナーゼAの活性が上昇しなかったことは意外であり,これまでの報告とは一致しなかった.そこで,細胞の全体においてドーパミンの刺激をあたえたときのプロテインキナーゼAの活性を測定してみると,細胞体においては活動電位がなくてもプロテインキナーゼAの活性の上昇がみられた.活動電位をあたえると細胞体におけるプロテインキナーゼAの活性も上昇したが,その程度は小さかった.つまり,樹状突起はドーパミンの刺激だけではプロテインキナーゼAの活性は上昇しないことから,樹状突起は活動電位によるプロテインキナーゼAの活性の制御の幅が広く,ドーパミンの刺激と活動電位のタイミングを鋭敏に検出できると考えられた.このように,ドーパミンの刺激だけではプロテインキナーゼAの活性が上昇しない理由として,cAMPの分解が高い可能性が考えられた.そこで,線条体に多く存在するホスホジエステラーゼ10Aに対する阻害剤であるパパベリンを投与すると,ドーパミンの刺激だけで樹状突起のプロテインキナーゼAの活性の上昇がみられた.ホスホジエステラーゼ10Aは細胞において一様に分布していることが報告されており,その細胞内局在は樹状突起における強い作用を説明できない.ホスホジエステラーゼは生体膜に局在することから,細い形状をもつ樹状突起においては膜体積比が高いため細胞質に存在するcAMPを効率的に分解できる可能性が考えられた.実際に,樹状突起の太さとドーパミン単独でのプロテインキナーゼAの活性の上昇には相関関係があったことから,この仮説は支持された.興味深いことに,中型有棘ニューロンにおいては,スパインは細い樹状突起にしか存在せず,スパインはドーパミンによる制御が効果的な部位にだけ存在していることが示唆された.
おわりに
この研究により,単一のスパインにはドーパミンが強化的に作用できる時間枠があり,その時間枠の形成にはcAMPの産生および分解が関与していることがわかった.この時間枠は動物の個体において報酬が作用できる時間枠によく似ており6),ドーパミンのもつ報酬作用はこのシナプス基盤によると考えられた.実際の動物の行動において実験課題によっては許容される報酬の遅延は長くなるが,この遅延条件づけは海馬など大脳の神経回路がこの狭い時間枠を利用しながら成立していると推測される.また,この時間枠は強化学習理論おいて長年にわたり実態が不明であった資格痕跡の時間成分に対応する.細胞レベルでの条件づけの先駆的な研究によれば,前シナプスの軸索の終末において侵害刺激に反応したセロトニンおよびニューロンの発火がアデニル酸シクラーゼにより検出されることでcAMPが産生され,プロテインキナーゼAの活性が上昇することにより条件づけされるという7).この実験系においては報酬ではなく侵害刺激であり,また,哺乳動物の可塑性の主座である後シナプスではなく前シナプスにおける現象であるという違いがあるが,分子レベルでみると,モノアミンとおよびニューロンの発火のアデニル酸シクラーゼによる同期の検出という類似性がみられた.スパインにおいては,適切なタイミングでドーパミンがあたえられるとプロテインキナーゼAの活性が上昇し,これがCa2+/カルモジュリン依存性キナーゼIIを活性化する.NMDA受容体-Ca2+/カルモジュリン依存性キナーゼIIというシグナル伝達経路はHebbの学習則である同期発火によるシナプスの可塑性(Hebbの可塑性)において中心的な役割を担う.一方,ドーパミンによる強化作用はHebbの学習則とは異なり,シナプス後細胞の発火をともなわずHebbの可塑性を制御している.この2つの学習機構の協調により樹状突起の全体に広がるプロテインキナーゼAの活性の上昇が特定のスパインだけを強化することができ,報酬シグナルであるドーパミンが直前に活動した単一のスパインだけを強化できる.このように,単一のスパインのレベルにおいて強化的な可塑性の分子基盤および細胞基盤が明らかにされた.この強化の可塑性が精神疾患の理解の鍵をにぎっているのかもしれない.
文 献
- Matsuzaki, M., Ellis-Davies, G. C., Nemoto, T. et al.: Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nat. Neurosci., 4, 1086-92 (2001)[PubMed]
- Matsuzaki, M., Honkura, N., Ellis-Davies, G. C. et al.: Structural basis of long-term potentiation in single dendritic spines. Nature, 429, 761-766 (2004)[PubMed]
- Tanaka, J., Horiike, Y., Matsuzaki, M. et al.: Protein synthesis and neurotrophin-dependent structural plasticity of single dendritic spines. Science, 319, 1683-1687 (2008)[PubMed]
- Matsuda, W., Furuta, T., Nakamura, K. C. et al.: Single nigrostriatal dopaminergic neurons form widely spread and highly dense axonal arborizations in the neostriatum. J. Neurosci., 29, 444-453 (2009)[PubMed]
- Hikida, T., Kimura, K., Wada, N. et al.: Distinct roles of synaptic transmission in direct and indirect striatal pathways to reward and aversive behavior. Neuron, 66, 896-907 (2010)[PubMed]
- Black, J., Belluzzi, J. D. & Stein, L.: Reinforcement delay of one second severely impairs acquisition of brain self-stimulation. Brain Res., 359, 113-119 (1985)[PubMed]
- Abrams, T. W. & Kandel, E. R.: Is contiguity detection in classical conditioning a system or a cellular property? Learning in Aplysia suggests a possible molecular site. Trends Neurosci., 11, 128-135 (1988)[PubMed]
著者プロフィール
略歴:東京大学大学院医学系研究科 特任助教.
研究テーマ:シナプスと学習,精神疾患.
河西 春郎(Haruo Kasai)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.bm2.m.u-tokyo.ac.jp/
© 2014 柳下 祥・河西春郎 Licensed under CC 表示 2.1 日本