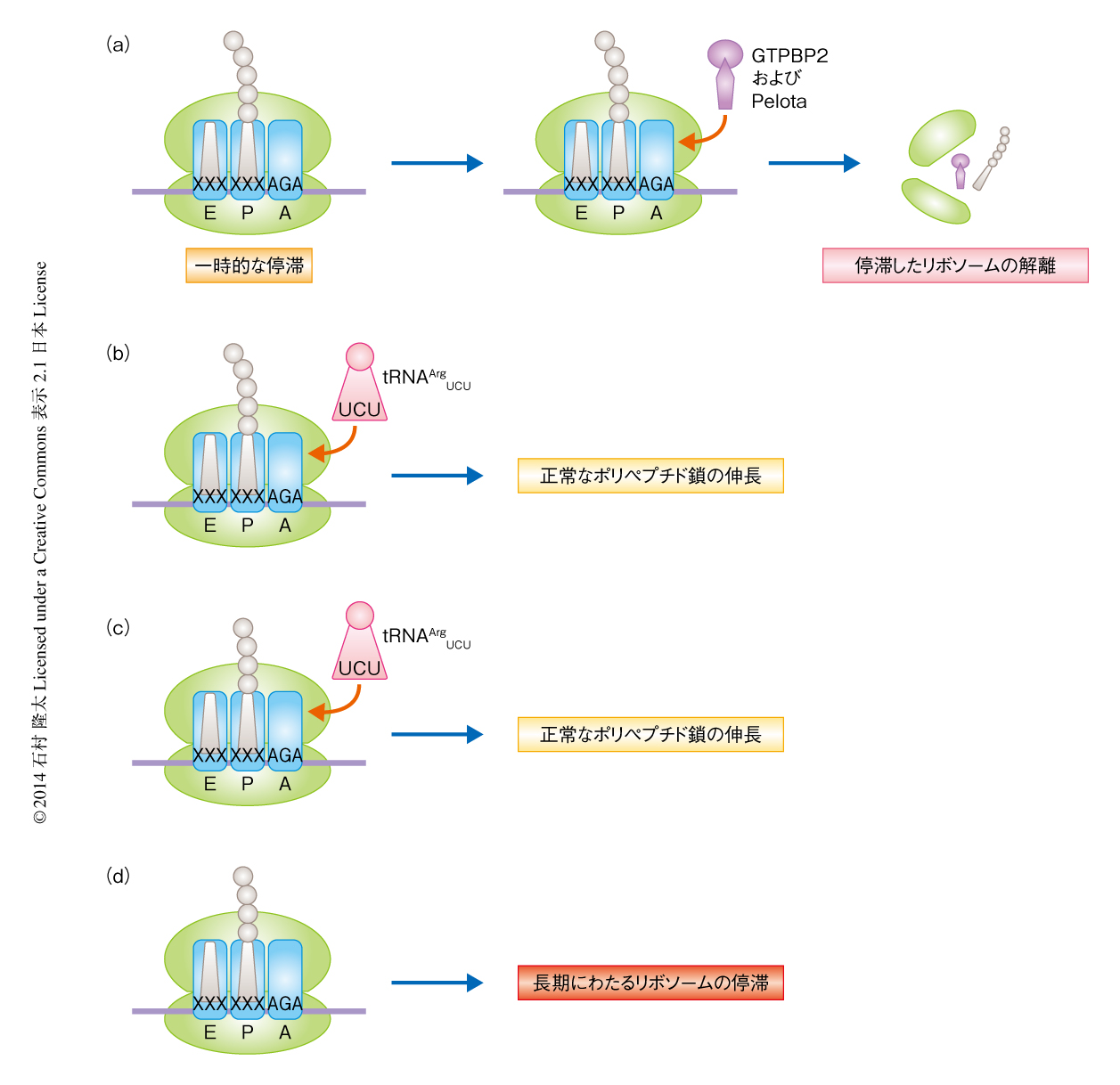
中枢神経系に特異的なtRNAの変異によりポリペプチド鎖の伸長過程においてリボソームが停滞し神経細胞死が起こる
石村 隆太
(米国Jackson Laboratory)
email:石村隆太
DOI: 10.7875/first.author.2014.112
Ribosome stalling induced by mutation of a CNS-specific tRNA causes neurodegeneration.
Ryuta Ishimura, Gabor Nagy, Ivan Dotu, Huihao Zhou, Xiang-Lei Yang, Paul Schimmel, Satoru Senju, Yasuharu Nishimura, Jeffrey H. Chuang, Susan L. Ackerman
Science, 345, 455-459 (2014)
高等真核生物の翻訳においては1つのコドンに対し複数のtRNAが存在するため,ある1種のtRNAに生じた変異はほかのtRNAにより代償されると考えられていた.しかし,実際には,1種のtRNAに生じた変異がポリペプチド鎖の伸長や細胞の恒常性に対しどのような影響を及ぼすかについての知見は乏しかった.同時に,高等真核生物はtRNAの変異およびそれに起因するポリペプチド鎖の伸長過程の異常に対しどのような修復機構をもつのかについてもほとんど知られていなかった.この研究では,神経細胞死を示す変異マウスを順遺伝学的に解析し,新規のタンパク質であるGTPBP2の欠損と中枢神経系に特異的なtRNAの変異が神経細胞死の原因であることをつきとめた.GTPBP2はポリペプチド鎖の伸長過程において停滞したリボソームの解離および再利用に機能するという分子機能的な側面を明らかにしただけでなく,核にコードされている1種のtRNAに生じた変異により疾患にいたることが示された.
高等真核生物においては何百ものtRNAの遺伝子が核にコードされている.ひとつのコドンに対応する複数のtRNAはそれぞれ異なる1次構造をもち,アイソデコーダーとよばれている.進化にともないアイソデコーダーの数はいちじるしく増加していることから,個々のアイソデコーダーはそれぞれ違った役割を担う可能性が考えられていた1).一方,細菌や酵母において低い頻度にしか使用されてないコドンを多く組み込んだレポーター遺伝子を過剰に発現させると,ポリペプチド鎖の伸長過程でリボソームがmRNA鎖において停滞することが知られていた.高等真核生物においては,核にコードされるあるひとつのアイソデコーダーに変異が生じた場合,ポリペプチド鎖の伸長過程に異変がもたらされるのか,あるいは,tRNAの変異などに起因するリボソームの停滞を修復する機構に変異が生じた場合,ポリペプチド鎖の伸長過程にどのような影響が及ぼされるのか,ひいては,細胞の恒常性にどのような結末がもたらされるのかについて,まったく知られていなかった.
C57BL/6J(B6J)系統のマウスに化学変異原であるN-エチル-N-ニトロソウレアにより点突然変異を誘発させることにより,さまざまな表現型を示す変異マウスが樹立されている2).そのなかから,神経細胞死により運動失調を示すマウスとしてnmf205変異マウスが得られた.このB6J系統を遺伝的な背景とするnmf205変異マウスは,生後3週目までは野生型のマウスと変わらなかったが,そののち神経細胞死とそれに起因する運動失調がはじまり,生後2カ月で死にいたった.小脳の顆粒細胞においていちじるしい細胞死がみられ,それ以外に,海馬CA2領域の錐体細胞や網膜の視細胞などにも細胞死が認められた.
連鎖解析によりnmf205変異マウスのもつ変異を探索したところ,Gtpbp2遺伝子の第6イントロンの開始部位に1塩基置換が認められた.この変異のため,Gtpbp2遺伝子にはスプライシングの異常およびそれにともなう終止コドンの出現が起こり,結果として,GTPBP2タンパク質の発現が欠損していた.Gtpbp2遺伝子をホモでノックアウトしたマウス,また,Gtpbp2遺伝子をノックアウトしたアリルとnmf205変異アリルとのヘテロ接合マウスにおいても,B6J系統を遺伝的な背景とするnmf205変異マウスと同様の表現型が確認されたため,nmf205変異マウスの神経細胞死はGTPBP2の欠損によると結論づけられた.
GTPBP2はGTP加水分解酵素ファミリーに属すると考えられ,終止コドンをもたないmRNAなどにおけるポリペプチド鎖の伸長過程で生じる停滞したリボソームを解離し再利用するタンパク質として知られるHbs1l,あるいは,真核生物における翻訳終結因子であり終止コドンにおいてリボソームを解離するタンパク質であるeRF3と,類似した1次構造をもっていた3-5).Hbs1lはPelotaと,eRF3はeRF1と,それぞれ結合することが知られている.免疫沈降法やGST融合タンパク質を用いた解析から,GTPBP2はPelotaと結合することが明らかになり,GTPBP2は停滞したリボソームの解離に関与している可能性が考えられた.
B6J系統のマウスとBALB/cJ系統のマウスとを掛け合わせる連鎖解析の過程において,nmf205変異マウスにおける神経細胞死の進行をホモあるいはヘテロで顕著に遅延させるモディファイアー遺伝子座がBALB/cJ系統のマウスの第1染色体に存在することが明らかになった.B6J系統を遺伝的な背景とするnmf205変異マウスでは生後3週目から神経細胞死が起こり生後2カ月で死にいたるのに対し,このモディファイアー遺伝子座をもつnmf205変異マウスは生後6カ月ごろから細胞死が起こりはじめ2年間も生存した.
このモディファイアー遺伝子をもつマウスの系統を探索するため,BALB/cJ系統以外の系統のマウスとも掛け合わせを行ったところ,C57BL/6NJ(B6N)系統を含むすべての系統のマウスにこのモディファイアー遺伝子が存在することが明らかになった.このことは逆に,B6J系統のマウスの第1染色体において新たな変異が生じたことを示唆した.
同じC57BL/6系統のマウスをもとに,米国Jackson Laboratoryにおいて系統の維持されたB6J系統のマウスと,米国NIHにおいて系統の維持されたB6N系統のマウスは,遺伝的な背景が酷似している.B6J系統のマウスとB6N系統のマウスのモディファイアー遺伝子の近傍の配列を比較したところ,唯一の変異としてn-Tr20遺伝子において1塩基置換が認められた.n-Tr20遺伝子は哺乳動物では全部で5種あるAGAアルギニンコドンに結合するtRNA(tRNAArgUCU)のうち1種をコードする.tRNAのTループにある50番目の塩基がB6N系統をふくむほかの系統のマウスではCであるのに対し,B6J系統のマウスではTに変異していた.n-Tr20遺伝子は脊椎動物のみならず無脊椎動物においても保存されており,tRNAとして必須の機能であるアミノ酸を結合させる活性をもつ.tRNAのTループにある変異はスプライシングによるtRNAの成熟に影響を及ぼすことが知られている6).ノーザンブロット解析により,B6N系統のマウスの脳には成熟したtRNAのバンドが確認されたのに対し,B6J系統のマウスの脳には5’側にリーダー配列および3’側にトレイラー配列をもつ105ヌクレオチド長の未成熟なtRNAのバンドが確認された.
野生型のn-Tr20遺伝子を発現するトランスジェニックマウスを作製し,掛け合わせによりこの遺伝子をB6J系統を遺伝的な背景とするnmf205変異マウスに発現させたところ,神経細胞死のいちじるしい遅延が認められ,n-Tr20遺伝子がモディファイアー遺伝子であることが再確認された.
Gtpbp2遺伝子は脳のほかの臓器にも広く発現しているのに対し,病理所見は脳のみにみられた.そこで,ノーザンブロット解析を行ったところ,ほかの4種のtRNAArgUCUはさまざまな臓器に普遍的に発現していたのに対し,n-Tr20遺伝子にコードされるtRNAArgUCUの発現は脳に特異的であった.B6N系統のマウスの脳におけるn-Tr20遺伝子の発現レベルは生後0日目から生後30日目にかけ変化はなかった.一方,B6J系統のマウスの脳ではn-Tr20遺伝子にコードされる成熟したtRNAの発現レベルは生後0日目から生後30日目にかけて減少し,相対的に,未成熟なtRNAの発現レベルは上昇していた.同様に,ノーザンブロット解析により脳におけるtRNAArgUCUのアイソデコーダーの発現レベルを比較したところ,n-Tr20遺伝子にコードされるtRNAArgUCUの発現レベルは,5種すべてのtRNAArgUCUの約60%をしめていた.n-Tr20遺伝子において成熟したtRNAレベルに対する未成熟なtRNAレベルの割合は,大脳皮質や海馬に比べ,もっとも神経細胞死を呈する小脳において高かった.これらのことから,Gtpbp2遺伝子の欠損による神経細胞死はn-Tr20遺伝子にコードされる成熟したtRNAの発現レベルと相関していることが示された.
これまでの結果から,まず,n-Tr20遺伝子の変異によりtRNAArgUCUの発現レベルが低下し,AGAコドンにおいてリボソームが一時的に停滞を起こすこと,つぎに,その停滞がGtpbp2遺伝子の欠損により増大するという可能性が考えられた.そこで,この仮説をリボソームプロファイリング法により検証した.近年になり開発されたこの手法は,対象とする組織あるいは細胞に多く存在する個々のリボソームがmRNAにおいてどの位置に存在するのかを,ライブラリーの作出,ディープシークエンシング,多量データ解析をとおして網羅的に明らかにするものである7-9).
n-Tr20遺伝子の変異およびGtpbp2遺伝子の欠損がリボソームの停滞に対しそれぞれどのような影響を及ぼすのかを調べるため,B6J系統のマウス(変異型のn-Tr20遺伝子をもつ),野生型のn-Tr20遺伝子をもつB6J系統のマウス,B6J系統を遺伝的な背景とするnmf205変異マウス(変異型のn-Tr20遺伝子をもち,Gtpbp2遺伝子を欠損する),野生型のn-Tr20遺伝子をもつB6J系統を遺伝的な背景とするnmf205変異マウス(Gtpbp2遺伝子を欠損する),を用意した(図1).B6J系統を遺伝的な背景とするnmf205変異マウスにおいても神経細胞死の発症は3週齢よりあとであることから,3週齢のマウスの小脳からライブラリーを構築した.ディープシークエンシングおよび多量データ解析をとおし,すべての遺伝子のタンパク質コード領域においてリボソームがどの位置にどれくらい存在するかを調べた.実際には,タンパク質コード領域のそれぞれのコドンにおいて,リボソームのA部位に存在するコドンがどれほど蓄積しているか,すなわち,おのおののコドンにおけるリボソームの停滞力価を得た.これまで,リボソームプロファイリング法はおもに細菌などの下等動物,あるいは,哺乳動物では培養細胞を用いた実験系に適用されており,哺乳動物の生体組織を対象とした例は稀少であった.しかし,以前の報告と同様に9),高い停滞力価を示すリボソームの停滞,とくに,Xbp1遺伝子にみられる既知のリボソームの停滞は10),どのマウスにおいてもみられそのレベルに大きな差異は認められなかった.
一方で,AGAコドンにおけるリボソームの停滞には大きな差異が認められた.野生型のn-Tr20遺伝子をもつマウスではGtpbp2遺伝子の欠損の有無にかかわらず,AGAコドンにおけるリボソームの停滞のレベルは低かった.しかし,変異型のn-Tr20遺伝子をもつB6J系統のマウスにおいてはそのレベルは有意に上昇し,変異型のn-Tr20遺伝子をもちGtpbp2遺伝子を欠損するB6J系統を遺伝的な背景とするnmf205変異マウスでおいてはさらなる上昇がみられた.B6J系統を遺伝的な背景とするnmf205変異マウスにおいて高い停滞力価を示したAGAコドンは800以上もあり,これは違った個体から得られた試料においても高い再現性が得られた.これらのリボソームの停滞を示したAGAコドンをもつ遺伝子を遺伝子オントロジーによりアノテーションしたところ,タンパク質翻訳機構に関与する遺伝子が多く含まれることが示された.
B6J系統のマウスおよびB6J系統を遺伝的な背景とするnmf205変異マウスでみられたリボソームの停滞がAGAコドンに特異的かどうかを調べるため,すべてのタンパク質コード領域において高い停滞力価を示すコドンの分布を調べた結果,AGAコドンに特異的であることが再確認された.
以上,n-Tr20遺伝子の変異によりtRNAArgUCUの発現レベルの低下が起こりAGAコドンにおいてリボソームが一時的に停滞を起こすこと,さらに,その停滞がGtpbp2遺伝子の欠損により増大することが明らかになった(図1).
この研究から,核にコードされているtRNAに変異が生じた場合,そのtRNAと同じコドンに結合するアイソデコーダーが存在するにもかかわらず,そのコドンに結合する総tRNA数の低下をまねき,結果として,ポリペプチド鎖の伸長過程ひいては細胞の恒常性に異変のもたらされることがはじめて示された.また,tRNAの変異により一時的にリボソームの停滞が起こるが,これは通常はGTPBP2により修復されていることが明らかになった.一方,停滞したリボソームを解離する既知のタンパク質Hbs1lはnmf205変異マウスにおいても正常に発現しており,Hbs1lはGTPBP2の欠損により生じたリボソームの停滞は修復できないことが示唆された.このことは,最近になり報告された,Hbs1(出芽酵母におけるHbs1l)とヘテロ二量体を形成するDom34(出芽酵母におけるPelota)の遺伝子を破壊した出芽酵母株におけるリボソームプロファイリング法の結果と矛盾しなかった11).n-Tr20遺伝子は臓器に特異的に発現しているという事実をふまえると,おのおののアイソデコーダーの発現により翻訳が制御されている可能性が考えられた.また,5種のアイソデコーダーのうちの1種の変異であっても疾患にいたるほどの影響が及ぼされたことから,アミノ酸の置換をともなわない1塩基変異も含めたさまざまな変異に対しても,tRNAの変異が相乗的に影響を及ぼす可能性が考えられた.この研究により,多コピー遺伝子のうちのひとつに変異があっても疾患にいたることが示された.
略歴:1998年 東京大学大学院農学生命科学研究科博士課程 修了,1999年 国立環境研究所 研究員をへて,2003年より米国Jackson Laboratory研究員.
研究テーマ:ニューロンの発達および機能の維持におけるタンパク質の品質管理機構の役割.
抱負:翻訳ののちのタンパク質の品質管理がニューロンの機能の維持に重要なことは周知である.今回の研究では,ポリペプチド鎖の伸長過程の異常がニューロンに悪影響を及ぼすことが明らかになった.その分子機構を詳細に調べていきたい.
© 2014 石村 隆太 Licensed under CC 表示 2.1 日本
(米国Jackson Laboratory)
email:石村隆太
DOI: 10.7875/first.author.2014.112
Ribosome stalling induced by mutation of a CNS-specific tRNA causes neurodegeneration.
Ryuta Ishimura, Gabor Nagy, Ivan Dotu, Huihao Zhou, Xiang-Lei Yang, Paul Schimmel, Satoru Senju, Yasuharu Nishimura, Jeffrey H. Chuang, Susan L. Ackerman
Science, 345, 455-459 (2014)
要 約
高等真核生物の翻訳においては1つのコドンに対し複数のtRNAが存在するため,ある1種のtRNAに生じた変異はほかのtRNAにより代償されると考えられていた.しかし,実際には,1種のtRNAに生じた変異がポリペプチド鎖の伸長や細胞の恒常性に対しどのような影響を及ぼすかについての知見は乏しかった.同時に,高等真核生物はtRNAの変異およびそれに起因するポリペプチド鎖の伸長過程の異常に対しどのような修復機構をもつのかについてもほとんど知られていなかった.この研究では,神経細胞死を示す変異マウスを順遺伝学的に解析し,新規のタンパク質であるGTPBP2の欠損と中枢神経系に特異的なtRNAの変異が神経細胞死の原因であることをつきとめた.GTPBP2はポリペプチド鎖の伸長過程において停滞したリボソームの解離および再利用に機能するという分子機能的な側面を明らかにしただけでなく,核にコードされている1種のtRNAに生じた変異により疾患にいたることが示された.
はじめに
高等真核生物においては何百ものtRNAの遺伝子が核にコードされている.ひとつのコドンに対応する複数のtRNAはそれぞれ異なる1次構造をもち,アイソデコーダーとよばれている.進化にともないアイソデコーダーの数はいちじるしく増加していることから,個々のアイソデコーダーはそれぞれ違った役割を担う可能性が考えられていた1).一方,細菌や酵母において低い頻度にしか使用されてないコドンを多く組み込んだレポーター遺伝子を過剰に発現させると,ポリペプチド鎖の伸長過程でリボソームがmRNA鎖において停滞することが知られていた.高等真核生物においては,核にコードされるあるひとつのアイソデコーダーに変異が生じた場合,ポリペプチド鎖の伸長過程に異変がもたらされるのか,あるいは,tRNAの変異などに起因するリボソームの停滞を修復する機構に変異が生じた場合,ポリペプチド鎖の伸長過程にどのような影響が及ぼされるのか,ひいては,細胞の恒常性にどのような結末がもたらされるのかについて,まったく知られていなかった.
1.nmf205変異マウスの神経細胞死はGtpbp2遺伝子の欠損による
C57BL/6J(B6J)系統のマウスに化学変異原であるN-エチル-N-ニトロソウレアにより点突然変異を誘発させることにより,さまざまな表現型を示す変異マウスが樹立されている2).そのなかから,神経細胞死により運動失調を示すマウスとしてnmf205変異マウスが得られた.このB6J系統を遺伝的な背景とするnmf205変異マウスは,生後3週目までは野生型のマウスと変わらなかったが,そののち神経細胞死とそれに起因する運動失調がはじまり,生後2カ月で死にいたった.小脳の顆粒細胞においていちじるしい細胞死がみられ,それ以外に,海馬CA2領域の錐体細胞や網膜の視細胞などにも細胞死が認められた.
連鎖解析によりnmf205変異マウスのもつ変異を探索したところ,Gtpbp2遺伝子の第6イントロンの開始部位に1塩基置換が認められた.この変異のため,Gtpbp2遺伝子にはスプライシングの異常およびそれにともなう終止コドンの出現が起こり,結果として,GTPBP2タンパク質の発現が欠損していた.Gtpbp2遺伝子をホモでノックアウトしたマウス,また,Gtpbp2遺伝子をノックアウトしたアリルとnmf205変異アリルとのヘテロ接合マウスにおいても,B6J系統を遺伝的な背景とするnmf205変異マウスと同様の表現型が確認されたため,nmf205変異マウスの神経細胞死はGTPBP2の欠損によると結論づけられた.
GTPBP2はGTP加水分解酵素ファミリーに属すると考えられ,終止コドンをもたないmRNAなどにおけるポリペプチド鎖の伸長過程で生じる停滞したリボソームを解離し再利用するタンパク質として知られるHbs1l,あるいは,真核生物における翻訳終結因子であり終止コドンにおいてリボソームを解離するタンパク質であるeRF3と,類似した1次構造をもっていた3-5).Hbs1lはPelotaと,eRF3はeRF1と,それぞれ結合することが知られている.免疫沈降法やGST融合タンパク質を用いた解析から,GTPBP2はPelotaと結合することが明らかになり,GTPBP2は停滞したリボソームの解離に関与している可能性が考えられた.
2.脳に特異的なAGAアルギニンコドンに結合するtRNAの変異により神経細胞死の発症の時期は異なる
B6J系統のマウスとBALB/cJ系統のマウスとを掛け合わせる連鎖解析の過程において,nmf205変異マウスにおける神経細胞死の進行をホモあるいはヘテロで顕著に遅延させるモディファイアー遺伝子座がBALB/cJ系統のマウスの第1染色体に存在することが明らかになった.B6J系統を遺伝的な背景とするnmf205変異マウスでは生後3週目から神経細胞死が起こり生後2カ月で死にいたるのに対し,このモディファイアー遺伝子座をもつnmf205変異マウスは生後6カ月ごろから細胞死が起こりはじめ2年間も生存した.
このモディファイアー遺伝子をもつマウスの系統を探索するため,BALB/cJ系統以外の系統のマウスとも掛け合わせを行ったところ,C57BL/6NJ(B6N)系統を含むすべての系統のマウスにこのモディファイアー遺伝子が存在することが明らかになった.このことは逆に,B6J系統のマウスの第1染色体において新たな変異が生じたことを示唆した.
同じC57BL/6系統のマウスをもとに,米国Jackson Laboratoryにおいて系統の維持されたB6J系統のマウスと,米国NIHにおいて系統の維持されたB6N系統のマウスは,遺伝的な背景が酷似している.B6J系統のマウスとB6N系統のマウスのモディファイアー遺伝子の近傍の配列を比較したところ,唯一の変異としてn-Tr20遺伝子において1塩基置換が認められた.n-Tr20遺伝子は哺乳動物では全部で5種あるAGAアルギニンコドンに結合するtRNA(tRNAArgUCU)のうち1種をコードする.tRNAのTループにある50番目の塩基がB6N系統をふくむほかの系統のマウスではCであるのに対し,B6J系統のマウスではTに変異していた.n-Tr20遺伝子は脊椎動物のみならず無脊椎動物においても保存されており,tRNAとして必須の機能であるアミノ酸を結合させる活性をもつ.tRNAのTループにある変異はスプライシングによるtRNAの成熟に影響を及ぼすことが知られている6).ノーザンブロット解析により,B6N系統のマウスの脳には成熟したtRNAのバンドが確認されたのに対し,B6J系統のマウスの脳には5’側にリーダー配列および3’側にトレイラー配列をもつ105ヌクレオチド長の未成熟なtRNAのバンドが確認された.
野生型のn-Tr20遺伝子を発現するトランスジェニックマウスを作製し,掛け合わせによりこの遺伝子をB6J系統を遺伝的な背景とするnmf205変異マウスに発現させたところ,神経細胞死のいちじるしい遅延が認められ,n-Tr20遺伝子がモディファイアー遺伝子であることが再確認された.
Gtpbp2遺伝子は脳のほかの臓器にも広く発現しているのに対し,病理所見は脳のみにみられた.そこで,ノーザンブロット解析を行ったところ,ほかの4種のtRNAArgUCUはさまざまな臓器に普遍的に発現していたのに対し,n-Tr20遺伝子にコードされるtRNAArgUCUの発現は脳に特異的であった.B6N系統のマウスの脳におけるn-Tr20遺伝子の発現レベルは生後0日目から生後30日目にかけ変化はなかった.一方,B6J系統のマウスの脳ではn-Tr20遺伝子にコードされる成熟したtRNAの発現レベルは生後0日目から生後30日目にかけて減少し,相対的に,未成熟なtRNAの発現レベルは上昇していた.同様に,ノーザンブロット解析により脳におけるtRNAArgUCUのアイソデコーダーの発現レベルを比較したところ,n-Tr20遺伝子にコードされるtRNAArgUCUの発現レベルは,5種すべてのtRNAArgUCUの約60%をしめていた.n-Tr20遺伝子において成熟したtRNAレベルに対する未成熟なtRNAレベルの割合は,大脳皮質や海馬に比べ,もっとも神経細胞死を呈する小脳において高かった.これらのことから,Gtpbp2遺伝子の欠損による神経細胞死はn-Tr20遺伝子にコードされる成熟したtRNAの発現レベルと相関していることが示された.
3.B6J系統を遺伝的な背景とするnmf205変異マウスにおいてはリボソームの停滞が起こる
これまでの結果から,まず,n-Tr20遺伝子の変異によりtRNAArgUCUの発現レベルが低下し,AGAコドンにおいてリボソームが一時的に停滞を起こすこと,つぎに,その停滞がGtpbp2遺伝子の欠損により増大するという可能性が考えられた.そこで,この仮説をリボソームプロファイリング法により検証した.近年になり開発されたこの手法は,対象とする組織あるいは細胞に多く存在する個々のリボソームがmRNAにおいてどの位置に存在するのかを,ライブラリーの作出,ディープシークエンシング,多量データ解析をとおして網羅的に明らかにするものである7-9).
n-Tr20遺伝子の変異およびGtpbp2遺伝子の欠損がリボソームの停滞に対しそれぞれどのような影響を及ぼすのかを調べるため,B6J系統のマウス(変異型のn-Tr20遺伝子をもつ),野生型のn-Tr20遺伝子をもつB6J系統のマウス,B6J系統を遺伝的な背景とするnmf205変異マウス(変異型のn-Tr20遺伝子をもち,Gtpbp2遺伝子を欠損する),野生型のn-Tr20遺伝子をもつB6J系統を遺伝的な背景とするnmf205変異マウス(Gtpbp2遺伝子を欠損する),を用意した(図1).B6J系統を遺伝的な背景とするnmf205変異マウスにおいても神経細胞死の発症は3週齢よりあとであることから,3週齢のマウスの小脳からライブラリーを構築した.ディープシークエンシングおよび多量データ解析をとおし,すべての遺伝子のタンパク質コード領域においてリボソームがどの位置にどれくらい存在するかを調べた.実際には,タンパク質コード領域のそれぞれのコドンにおいて,リボソームのA部位に存在するコドンがどれほど蓄積しているか,すなわち,おのおののコドンにおけるリボソームの停滞力価を得た.これまで,リボソームプロファイリング法はおもに細菌などの下等動物,あるいは,哺乳動物では培養細胞を用いた実験系に適用されており,哺乳動物の生体組織を対象とした例は稀少であった.しかし,以前の報告と同様に9),高い停滞力価を示すリボソームの停滞,とくに,Xbp1遺伝子にみられる既知のリボソームの停滞は10),どのマウスにおいてもみられそのレベルに大きな差異は認められなかった.
一方で,AGAコドンにおけるリボソームの停滞には大きな差異が認められた.野生型のn-Tr20遺伝子をもつマウスではGtpbp2遺伝子の欠損の有無にかかわらず,AGAコドンにおけるリボソームの停滞のレベルは低かった.しかし,変異型のn-Tr20遺伝子をもつB6J系統のマウスにおいてはそのレベルは有意に上昇し,変異型のn-Tr20遺伝子をもちGtpbp2遺伝子を欠損するB6J系統を遺伝的な背景とするnmf205変異マウスでおいてはさらなる上昇がみられた.B6J系統を遺伝的な背景とするnmf205変異マウスにおいて高い停滞力価を示したAGAコドンは800以上もあり,これは違った個体から得られた試料においても高い再現性が得られた.これらのリボソームの停滞を示したAGAコドンをもつ遺伝子を遺伝子オントロジーによりアノテーションしたところ,タンパク質翻訳機構に関与する遺伝子が多く含まれることが示された.
B6J系統のマウスおよびB6J系統を遺伝的な背景とするnmf205変異マウスでみられたリボソームの停滞がAGAコドンに特異的かどうかを調べるため,すべてのタンパク質コード領域において高い停滞力価を示すコドンの分布を調べた結果,AGAコドンに特異的であることが再確認された.
以上,n-Tr20遺伝子の変異によりtRNAArgUCUの発現レベルの低下が起こりAGAコドンにおいてリボソームが一時的に停滞を起こすこと,さらに,その停滞がGtpbp2遺伝子の欠損により増大することが明らかになった(図1).
おわりに
この研究から,核にコードされているtRNAに変異が生じた場合,そのtRNAと同じコドンに結合するアイソデコーダーが存在するにもかかわらず,そのコドンに結合する総tRNA数の低下をまねき,結果として,ポリペプチド鎖の伸長過程ひいては細胞の恒常性に異変のもたらされることがはじめて示された.また,tRNAの変異により一時的にリボソームの停滞が起こるが,これは通常はGTPBP2により修復されていることが明らかになった.一方,停滞したリボソームを解離する既知のタンパク質Hbs1lはnmf205変異マウスにおいても正常に発現しており,Hbs1lはGTPBP2の欠損により生じたリボソームの停滞は修復できないことが示唆された.このことは,最近になり報告された,Hbs1(出芽酵母におけるHbs1l)とヘテロ二量体を形成するDom34(出芽酵母におけるPelota)の遺伝子を破壊した出芽酵母株におけるリボソームプロファイリング法の結果と矛盾しなかった11).n-Tr20遺伝子は臓器に特異的に発現しているという事実をふまえると,おのおののアイソデコーダーの発現により翻訳が制御されている可能性が考えられた.また,5種のアイソデコーダーのうちの1種の変異であっても疾患にいたるほどの影響が及ぼされたことから,アミノ酸の置換をともなわない1塩基変異も含めたさまざまな変異に対しても,tRNAの変異が相乗的に影響を及ぼす可能性が考えられた.この研究により,多コピー遺伝子のうちのひとつに変異があっても疾患にいたることが示された.
文 献
- Goodenbour, J. M. & Pan, T.: Diversity of tRNA genes in eukaryotes. Nucleic Acids Res., 34, 6137-6146 (2006)[PubMed]
- Goldowitz, D., Frankel, W. N., Takahashi, J. S. et al.: Large-scale mutagenesis of the mouse to understand the genetic bases of nervous system structure and function. Mol. Brain Res., 132, 105-115 (2004)[PubMed]
- Dever, T. E. & Green, R.: The elongation, termination, and recycling phases of translation in eukaryotes. Cold Spring Harb. Perspect. Biol., 4, a013706 (2012)[PubMed]
- Pisareva, V. P., Skabkin, M. A., Hellen, C. U. et al.: Dissociation by Pelota, Hbs1 and ABCE1 of mammalian vacant 80S ribosomes and stalled elongation complexes. EMBO J., 30, 1804-1817 (2011)[PubMed]
- Shoemaker, C. J., Eyler, D. E. & Green, R.: Dom34:Hbs1 promotes subunit dissociation and peptidyl-tRNA drop-off to initiate no-go decay. Science, 330, 369-372 (2010)[PubMed]
- Levinger, L. & Serjanov, D.: Pathogenesis-related mutations in the T-loops of human mitochondrial tRNAs affect 3’ end processing and tRNA structure. RNA Biol., 9, 283-291 (2012)[PubMed]
- Ingolia, N. T., Brar, G. A., Rouskin, S. et al.: The ribosome profiling strategy for monitoring translation in vivo by deep sequencing of ribosome-protected mRNA fragments. Nat. Protoc., 7, 1534-1550 (2012)[PubMed]
- Ingolia, N. T., Ghaemmaghami, S., Newman, J. R. et al.: Genome-wide analysis in vivo of translation with nucleotide resolution using ribosome profiling. Science, 324, 218-223 (2009)[PubMed]
- Ingolia, N. T., Lareau, L. F. & Weissman, J. S.: Ribosome profiling of mouse embryonic stem cells reveals the complexity and dynamics of mammalian proteomes. Cell, 147, 789-802(2011)[PubMed]
- Yanagitani, K., Kimata, Y., Kadokura, H. et al.: Translational pausing ensures membrane targeting and cytoplasmic splicing of XBP1u mRNA. Science, 331, 586-589 (2011)[PubMed]
- Guydosh, N. R. & Green, R.: Dom34 rescues ribosomes in 3’ untranslated regions. Cell, 156, 950-962 (2014)[PubMed]
著者プロフィール
略歴:1998年 東京大学大学院農学生命科学研究科博士課程 修了,1999年 国立環境研究所 研究員をへて,2003年より米国Jackson Laboratory研究員.
研究テーマ:ニューロンの発達および機能の維持におけるタンパク質の品質管理機構の役割.
抱負:翻訳ののちのタンパク質の品質管理がニューロンの機能の維持に重要なことは周知である.今回の研究では,ポリペプチド鎖の伸長過程の異常がニューロンに悪影響を及ぼすことが明らかになった.その分子機構を詳細に調べていきたい.
© 2014 石村 隆太 Licensed under CC 表示 2.1 日本