線虫の学習行動におけるシナプスでのインスリン-PI3キナーゼ経路の役割
大野速雄・飯野雄一
(東京大学大学院理学系研究科 生物科学専攻分子行動遺伝学)
email:大野速雄
DOI: 10.7875/first.author.2014.106
Role of synaptic phosphatidylinositol 3-kinase in a behavioral learning response in C. elegans.
Hayao Ohno, Shinya Kato, Yasuki Naito, Hirofumi Kunitomo, Masahiro Tomioka, Yuichi Iino
Science, 345, 313-317 (2014)
最近,神経系において機能するインスリン-PI3キナーゼ経路はシナプスの可塑性や認知機能に関与すると考えられるようになってきた.しかし,この経路が神経系を含むさまざまな組織において多彩な機能を発揮する機構については未知の部分が多い.この研究では,線虫におけるインスリン受容体のホモログDAF-2の新規のアイソフォームであるDAF-2cについてその機能を解析した.DAF-2cはカルシンテニンのホモログCASY-1によりシナプス領域へと輸送され,この輸送によりシナプス領域においてインスリン-PI3キナーゼ経路が活性化することで,外界の塩濃度と飢餓の経験とを関連づける線虫の連合学習が成立した.さらに,えさのシグナルを伝達すると考えられるRas-MAPキナーゼ経路がCASY-1によるDAF-2cの輸送を負に制御していることがわかった.以上の結果は,インスリン受容体に機能の多様性が付与される分子機構を明らかにするとともに,学習能への関与がともに示唆されてきたカルシンテニンとインスリン-PI3キナーゼ経路との密接な関係性を示した.
線虫Caenorhabditis elegansは遺伝学的な解析の手法が高度に発達しているとともに,比較的シンプルな神経系をもち,動物の行動を分子レベルおよび細胞レベルにおいて解析するうえで非常にすぐれたモデル生物である.行動遺伝学のモデル生物としての線虫の利点としては,1)302個のニューロンからなる神経系が個体差のない発生の過程をたどり,すべてのニューロンの位置および接続が明らかになっている,2)導入した遺伝子を発現させるトランスジェニック株の作製がきわめて容易である,3)変異株など利用の可能なリソースが充実している,4)身体が透明なため生きた状態のまま単一の細胞レベルでの分子イメージングや光遺伝学的な解析を行うことができる,といった点があげられる.
線虫には外界の化学物質を受容すると考えられている32個の化学感覚ニューロンが存在する(雌雄同体の場合).このうち22個のニューロンは頭部の左右に1対存在するアンフィド(amphid)とよばれる感覚器を形成している.アンフィドの感覚ニューロンは,シナプス伝達を含むさまざまな細胞間コミュニケーションの行われる神経環(nerve ring)とよばれる部位に軸索を投射する1).アンフィドの感覚ニューロンおよびその下流に位置する介在ニューロンは,行動,寿命,発生,代謝,身体の大きさの調節など,さまざまな現象を制御する中枢である.
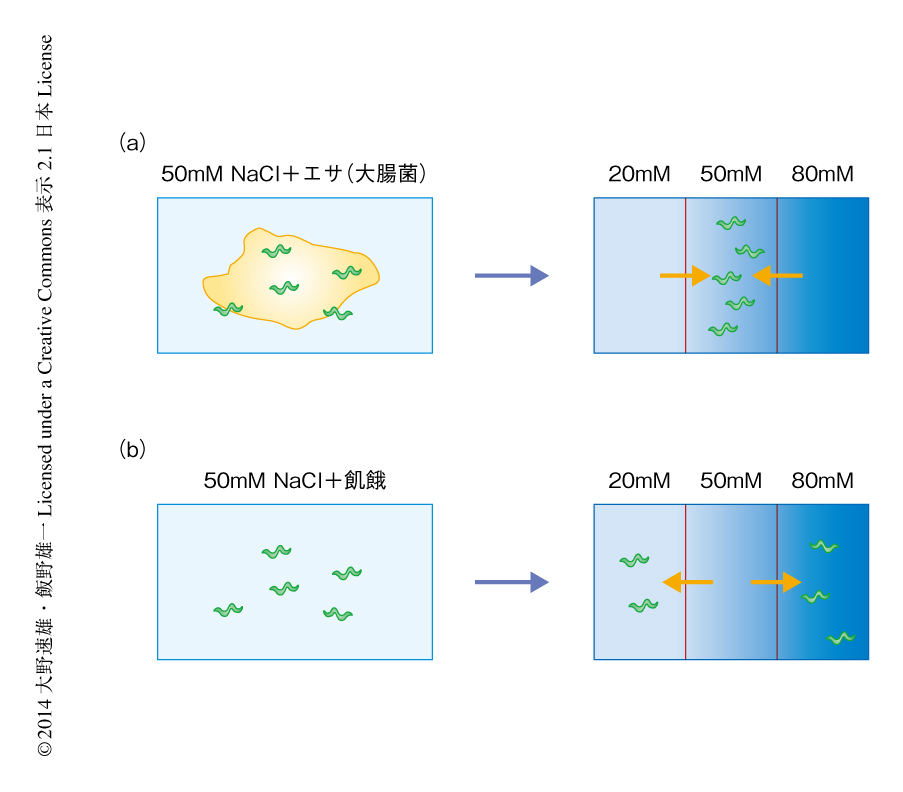
線虫はシンプルな神経系をもちながらも多様な行動可塑性を示し,過去の経験に応じて行動を適切に変化させる能力をもつ.たとえば,線虫は外界の塩濃度を記憶することができ,過去にえさとともに経験した塩濃度に誘引され,逆に,飢餓とともに経験した塩濃度を避けるような行動をとる2).この行動可塑性は,えさのある場所にとどまるため,あるいは,飢餓を経験した場所から離れて新たな環境を探索するために合理的な戦略であると考えられる.
近年,インスリン-PI3キナーゼ経路がシナプスの可塑性や認知機能に関与するとの報告が哺乳類を中心に多くなされている3,4).インスリン受容体は哺乳類の脳に広く発現しており5),ヒトにおいてはインスリンの鼻腔内への投与が健常者およびアルツハイマー型認知症患者の記憶能力を向上させるという知見がある4,6).また最近では,アルツハイマー型認知症の発症にインスリン-PI3キナーゼ経路の異常が関与する可能性が指摘され,アルツハイマー型認知症を“3型糖尿病”と称する研究者も現われている3,4,7).
線虫においても神経系ではたらくインスリン-PI3キナーゼ経路は重要な役割を担っている.変異体に対する組織特異的なレスキュー実験では,インスリン-PI3キナーゼ経路の活性を神経系でのみ回復させることが寿命,発生,連合学習の制御において十分であることが示唆されている8-10).しかしながら,神経系におけるインスリン-PI3キナーゼ経路が多様な生理現象を制御するうえでどのように機能の特異性を得ているのかについては大きな研究課題となっていた.
カルシンテニン(アルカデインともよばれる)はカドヘリンスーパーファミリーに属するI型膜タンパク質の一種である.線虫から哺乳類までその神経系に広く発現し,ヒトのカルシンテニン-2の遺伝子に存在する1塩基多型(SNP)は単語の記憶能力と相関することが報告されている11,12).カルシンテニンの細胞内ドメインはキネシン-1の軽鎖と相互作用し,カルシンテニンのノックダウンはアルツハイマー型認知症の原因タンパク質であるアミロイド前駆体タンパク質の輸送やプロセシングに影響を及ぼすことが知られている13).また,アルツハイマー型認知症やLewy小体型認知症の患者の脳脊髄液ではカルシンテニン-1の量が変化している可能性が示唆されている14,15).これらの生化学的な知見が集積する一方で,カルシンテニンの生理機能については未知の部分が多かった.
さきに述べたように,線虫は過去にえさとともに経験した塩濃度に誘引され,逆に,飢餓とともに経験した塩濃度を避けるような連合学習を行う(図1).筆者らは以前に,塩などの水溶性物質を受容する感覚ニューロンのひとつであるASERニューロンにおけるインスリン-PI3キナーゼ経路が,外界の塩濃度と飢餓とを関連づける学習に必要であることを見い出していた2,9).
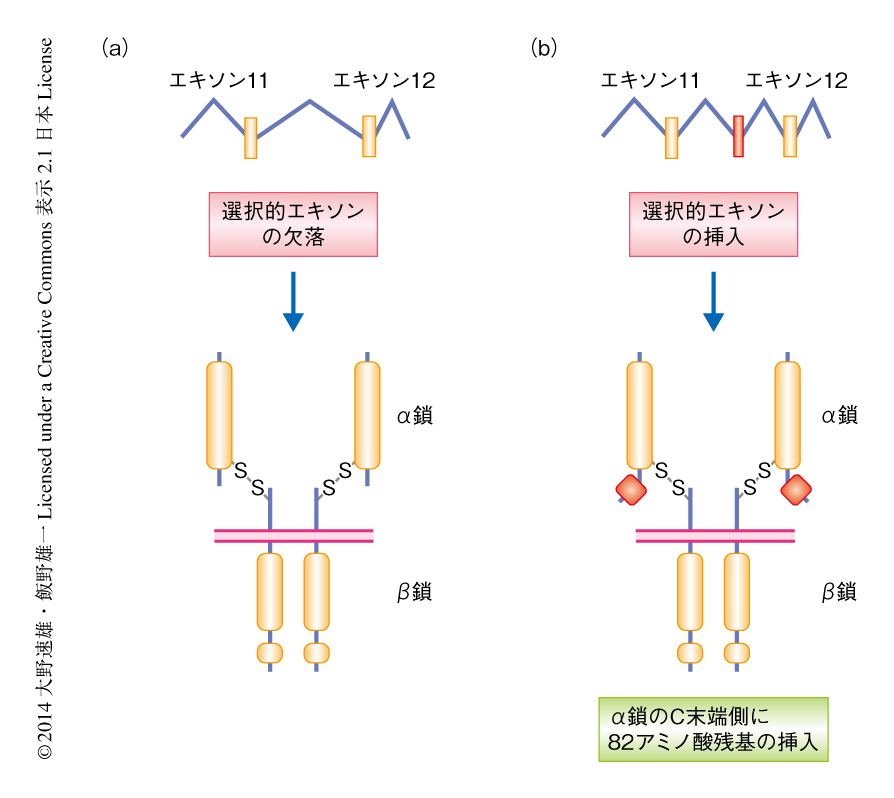
しかしながら,インスリン受容体であるDAF-2については,ASERニューロンにおいて既知のアイソフォームを発現させても変異体において学習の異常は回復せず,未知のDAF-2アイソフォームが塩濃度を忌避する学習を制御している可能性が示唆されていた.そこで,RT-PCR法によるDAF-2アイソフォームの探索を行い,新規のアイソフォームであるDAF-2cを同定した.DAF-2cは既知のアイソフォームであるDAF-2aをコードする11番目のエキソンと12番目のエキソンとのあいだに246 bpからなる1つの選択的エキソンが挿入されるようなスプライシングにより産生されていた(図2).DAF-2あるいはほかのインスリン受容体のホモログはα鎖とβ鎖がプロテアーゼによる切断により産生されてα-β-β-α四量体を構成すると考えられているが,DAF-2cでは選択的エキソンのコードする82アミノ酸残基からなる断片がα鎖のC末端の近くに挿入されていた(図2).なお,もうひとつの既知のアイソフォームであるDAF-2bはβ鎖のほぼすべてを欠失しており,受容体型チロシンキナーゼとしては機能しないことが予想される.
これらのDAF-2アイソフォームの機能を解析するため,変異体におのおののアイソフォームをコードするcDNAを導入するレスキュー実験を行った.その結果,寿命,発生,熱ストレスへの耐性の制御においてはおもにDAF-2aが,塩濃度と飢餓とを関連づける学習においてはDAF-2cが機能していることが明らかになり,2種類のDAF-2アイソフォームのあいだで機能の使い分けのなされていることが示唆された.
DAF-2aとDAF-2cに機能の差が生じる原因を明らかにするため,おのおののアイソフォームのC末端側に蛍光タンパク質Venusを付加しASERニューロンに発現させてその局在を調べた.ASERニューロンは神経環へと軸索を投射し,軸索の遠位側から中央付近においてほかのニューロンと多数のシナプス接続を形成する1).DAF-2aはおもにASERニューロンの細胞体および樹状突起に局在したが,DAF-2cはこれらの領域にくわえ軸索のシナプス領域に強く局在した.さらに,線虫が飢餓を経験するとシナプス領域へのDAF-2cの局在が強まることが明らかになった.さらに,PI3キナーゼを青色光で活性化する系16) を用いた実験により,経験した塩濃度の忌避をひき起こすのにシナプス領域におけるインスリン-PI3キナーゼ経路の活性化が十分であることが示唆された.
シナプス領域においてインスリン-PI3キナーゼ経路が活性化することの重要性は,線虫におけるカルシンテニンのホモログであるCASY-1の機能解析からも示唆された.CASY-1は塩走性の可塑性など複数の行動可塑性および感覚統合にかかわることが報告されており17),casy-1変異体はインスリン-PI3キナーゼ経路の変異体と同様に,飢餓を経験した塩濃度からの忌避に異常を示した.さらに,casy-1変異体に対するサプレッサースクリーニングの結果,インスリン-PI3キナーゼ経路に対して拮抗的に機能するPTENホスファターゼの変異体が同定され,CASY-1とインスリン-PI3キナーゼ経路とのあいだに遺伝学的な相互作用の存在することが明らかになった.これらの結果をきっかけとして,casy-1変異体のASERニューロンにおいてはDAF-2cのシナプス領域への局在が消失することが見い出された.のちの生化学的な解析から,CASY-1がDAF-2cおよびキネシン-1の軽鎖の両方と物理的に相互作用するリンカーとなり,DAF-2cのシナプス領域への輸送を制御していることが示唆された.
哺乳類ではERK/MAPキナーゼがキネシン-1の軽鎖をリン酸化し,このリン酸化によりカルシンテニンの細胞内ドメインとの結合が負に制御されている18).線虫において,ERKやその上流において機能するRasの変異体ではDAF-2cのシナプス領域への局在が増大し,さらに,インスリン-PI3キナーゼ経路の変異体とは逆に,えさとともに経験した塩濃度への誘引が弱まった.これらの表現型はcasy-1変異体との二重変異体にすることにより抑圧され,CASY-1がRas-MAPキナーゼ経路の下流において機能する可能性が示唆された.さらに,ERKの活性をモニターするFRET型のプローブであるERKy 19) を用いた実験から,ASERニューロンにおけるERKの活性は飢餓の経験により減少することが明らかになった.以上の結果から,Ras-MAPキナーゼ経路がえさのシグナルを伝達し,CASY-1に依存性のDAF-2cの輸送を負に制御していることが示唆された.
筆者らは,カルシンテニンによりインスリン受容体の特定のアイソフォームがシナプス領域へと輸送されることが線虫の学習の成立に重要であることを明らかにした.なお,哺乳類のインスリン受容体についても線虫と非常によく似た様式で2種類のアイソフォームが産生されており,インスリン受容体のBアイソフォームでは選択的エキソンの挿入によりα鎖のC末端側に固有のペプチド配列の付加されることがわかっている20).今回の研究で明らかになった,インスリン受容体が機能の多様性を得る機構,また,カルシンテニンが膜受容体の輸送により神経可塑性を制御する機構が,ほかの生物においても保存されている可能性を検討することは興味深い.今後の線虫の研究においては,線虫がどのように外界の塩濃度を記憶するのか,さらに,インスリン-PI3キナーゼ経路がシナプス領域においてどのように行動可塑性を実現するのか,といった点が重要な研究課題になると思われる.
略歴:2014年 東京大学大学院理学系研究科にて博士号取得,同年より同 特任助教.
研究テーマ:線虫の行動可塑性をつかさどる分子機構.
関心事:動物の行動は分子生物学でどこまで明らかになるか.
飯野 雄一(Yuichi Iino)
東京大学大学院理学系研究科 教授.
研究室URL:http://molecular-ethology.biochem.s.u-tokyo.ac.jp/IINO_lab_J.html
© 2014 大野速雄・飯野雄一 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物科学専攻分子行動遺伝学)
email:大野速雄
DOI: 10.7875/first.author.2014.106
Role of synaptic phosphatidylinositol 3-kinase in a behavioral learning response in C. elegans.
Hayao Ohno, Shinya Kato, Yasuki Naito, Hirofumi Kunitomo, Masahiro Tomioka, Yuichi Iino
Science, 345, 313-317 (2014)
要 約
最近,神経系において機能するインスリン-PI3キナーゼ経路はシナプスの可塑性や認知機能に関与すると考えられるようになってきた.しかし,この経路が神経系を含むさまざまな組織において多彩な機能を発揮する機構については未知の部分が多い.この研究では,線虫におけるインスリン受容体のホモログDAF-2の新規のアイソフォームであるDAF-2cについてその機能を解析した.DAF-2cはカルシンテニンのホモログCASY-1によりシナプス領域へと輸送され,この輸送によりシナプス領域においてインスリン-PI3キナーゼ経路が活性化することで,外界の塩濃度と飢餓の経験とを関連づける線虫の連合学習が成立した.さらに,えさのシグナルを伝達すると考えられるRas-MAPキナーゼ経路がCASY-1によるDAF-2cの輸送を負に制御していることがわかった.以上の結果は,インスリン受容体に機能の多様性が付与される分子機構を明らかにするとともに,学習能への関与がともに示唆されてきたカルシンテニンとインスリン-PI3キナーゼ経路との密接な関係性を示した.
はじめに
線虫Caenorhabditis elegansは遺伝学的な解析の手法が高度に発達しているとともに,比較的シンプルな神経系をもち,動物の行動を分子レベルおよび細胞レベルにおいて解析するうえで非常にすぐれたモデル生物である.行動遺伝学のモデル生物としての線虫の利点としては,1)302個のニューロンからなる神経系が個体差のない発生の過程をたどり,すべてのニューロンの位置および接続が明らかになっている,2)導入した遺伝子を発現させるトランスジェニック株の作製がきわめて容易である,3)変異株など利用の可能なリソースが充実している,4)身体が透明なため生きた状態のまま単一の細胞レベルでの分子イメージングや光遺伝学的な解析を行うことができる,といった点があげられる.
線虫には外界の化学物質を受容すると考えられている32個の化学感覚ニューロンが存在する(雌雄同体の場合).このうち22個のニューロンは頭部の左右に1対存在するアンフィド(amphid)とよばれる感覚器を形成している.アンフィドの感覚ニューロンは,シナプス伝達を含むさまざまな細胞間コミュニケーションの行われる神経環(nerve ring)とよばれる部位に軸索を投射する1).アンフィドの感覚ニューロンおよびその下流に位置する介在ニューロンは,行動,寿命,発生,代謝,身体の大きさの調節など,さまざまな現象を制御する中枢である.
線虫はシンプルな神経系をもちながらも多様な行動可塑性を示し,過去の経験に応じて行動を適切に変化させる能力をもつ.たとえば,線虫は外界の塩濃度を記憶することができ,過去にえさとともに経験した塩濃度に誘引され,逆に,飢餓とともに経験した塩濃度を避けるような行動をとる2).この行動可塑性は,えさのある場所にとどまるため,あるいは,飢餓を経験した場所から離れて新たな環境を探索するために合理的な戦略であると考えられる.
近年,インスリン-PI3キナーゼ経路がシナプスの可塑性や認知機能に関与するとの報告が哺乳類を中心に多くなされている3,4).インスリン受容体は哺乳類の脳に広く発現しており5),ヒトにおいてはインスリンの鼻腔内への投与が健常者およびアルツハイマー型認知症患者の記憶能力を向上させるという知見がある4,6).また最近では,アルツハイマー型認知症の発症にインスリン-PI3キナーゼ経路の異常が関与する可能性が指摘され,アルツハイマー型認知症を“3型糖尿病”と称する研究者も現われている3,4,7).
線虫においても神経系ではたらくインスリン-PI3キナーゼ経路は重要な役割を担っている.変異体に対する組織特異的なレスキュー実験では,インスリン-PI3キナーゼ経路の活性を神経系でのみ回復させることが寿命,発生,連合学習の制御において十分であることが示唆されている8-10).しかしながら,神経系におけるインスリン-PI3キナーゼ経路が多様な生理現象を制御するうえでどのように機能の特異性を得ているのかについては大きな研究課題となっていた.
カルシンテニン(アルカデインともよばれる)はカドヘリンスーパーファミリーに属するI型膜タンパク質の一種である.線虫から哺乳類までその神経系に広く発現し,ヒトのカルシンテニン-2の遺伝子に存在する1塩基多型(SNP)は単語の記憶能力と相関することが報告されている11,12).カルシンテニンの細胞内ドメインはキネシン-1の軽鎖と相互作用し,カルシンテニンのノックダウンはアルツハイマー型認知症の原因タンパク質であるアミロイド前駆体タンパク質の輸送やプロセシングに影響を及ぼすことが知られている13).また,アルツハイマー型認知症やLewy小体型認知症の患者の脳脊髄液ではカルシンテニン-1の量が変化している可能性が示唆されている14,15).これらの生化学的な知見が集積する一方で,カルシンテニンの生理機能については未知の部分が多かった.
1.インスリン受容体DAF-2には異なる機能をもつ複数のスプライシングアイソフォームが存在する
さきに述べたように,線虫は過去にえさとともに経験した塩濃度に誘引され,逆に,飢餓とともに経験した塩濃度を避けるような連合学習を行う(図1).筆者らは以前に,塩などの水溶性物質を受容する感覚ニューロンのひとつであるASERニューロンにおけるインスリン-PI3キナーゼ経路が,外界の塩濃度と飢餓とを関連づける学習に必要であることを見い出していた2,9).
しかしながら,インスリン受容体であるDAF-2については,ASERニューロンにおいて既知のアイソフォームを発現させても変異体において学習の異常は回復せず,未知のDAF-2アイソフォームが塩濃度を忌避する学習を制御している可能性が示唆されていた.そこで,RT-PCR法によるDAF-2アイソフォームの探索を行い,新規のアイソフォームであるDAF-2cを同定した.DAF-2cは既知のアイソフォームであるDAF-2aをコードする11番目のエキソンと12番目のエキソンとのあいだに246 bpからなる1つの選択的エキソンが挿入されるようなスプライシングにより産生されていた(図2).DAF-2あるいはほかのインスリン受容体のホモログはα鎖とβ鎖がプロテアーゼによる切断により産生されてα-β-β-α四量体を構成すると考えられているが,DAF-2cでは選択的エキソンのコードする82アミノ酸残基からなる断片がα鎖のC末端の近くに挿入されていた(図2).なお,もうひとつの既知のアイソフォームであるDAF-2bはβ鎖のほぼすべてを欠失しており,受容体型チロシンキナーゼとしては機能しないことが予想される.
これらのDAF-2アイソフォームの機能を解析するため,変異体におのおののアイソフォームをコードするcDNAを導入するレスキュー実験を行った.その結果,寿命,発生,熱ストレスへの耐性の制御においてはおもにDAF-2aが,塩濃度と飢餓とを関連づける学習においてはDAF-2cが機能していることが明らかになり,2種類のDAF-2アイソフォームのあいだで機能の使い分けのなされていることが示唆された.
2.シナプス領域におけるインスリン-PI3キナーゼ経路の活性化が塩濃度を忌避する学習を成立させる
DAF-2aとDAF-2cに機能の差が生じる原因を明らかにするため,おのおののアイソフォームのC末端側に蛍光タンパク質Venusを付加しASERニューロンに発現させてその局在を調べた.ASERニューロンは神経環へと軸索を投射し,軸索の遠位側から中央付近においてほかのニューロンと多数のシナプス接続を形成する1).DAF-2aはおもにASERニューロンの細胞体および樹状突起に局在したが,DAF-2cはこれらの領域にくわえ軸索のシナプス領域に強く局在した.さらに,線虫が飢餓を経験するとシナプス領域へのDAF-2cの局在が強まることが明らかになった.さらに,PI3キナーゼを青色光で活性化する系16) を用いた実験により,経験した塩濃度の忌避をひき起こすのにシナプス領域におけるインスリン-PI3キナーゼ経路の活性化が十分であることが示唆された.
3.カルシンテニンがDAF-2cをシナプス領域へと輸送する
シナプス領域においてインスリン-PI3キナーゼ経路が活性化することの重要性は,線虫におけるカルシンテニンのホモログであるCASY-1の機能解析からも示唆された.CASY-1は塩走性の可塑性など複数の行動可塑性および感覚統合にかかわることが報告されており17),casy-1変異体はインスリン-PI3キナーゼ経路の変異体と同様に,飢餓を経験した塩濃度からの忌避に異常を示した.さらに,casy-1変異体に対するサプレッサースクリーニングの結果,インスリン-PI3キナーゼ経路に対して拮抗的に機能するPTENホスファターゼの変異体が同定され,CASY-1とインスリン-PI3キナーゼ経路とのあいだに遺伝学的な相互作用の存在することが明らかになった.これらの結果をきっかけとして,casy-1変異体のASERニューロンにおいてはDAF-2cのシナプス領域への局在が消失することが見い出された.のちの生化学的な解析から,CASY-1がDAF-2cおよびキネシン-1の軽鎖の両方と物理的に相互作用するリンカーとなり,DAF-2cのシナプス領域への輸送を制御していることが示唆された.
4.Ras-MAPキナーゼ経路はDAF-2cのシナプス領域への輸送を負に制御する
哺乳類ではERK/MAPキナーゼがキネシン-1の軽鎖をリン酸化し,このリン酸化によりカルシンテニンの細胞内ドメインとの結合が負に制御されている18).線虫において,ERKやその上流において機能するRasの変異体ではDAF-2cのシナプス領域への局在が増大し,さらに,インスリン-PI3キナーゼ経路の変異体とは逆に,えさとともに経験した塩濃度への誘引が弱まった.これらの表現型はcasy-1変異体との二重変異体にすることにより抑圧され,CASY-1がRas-MAPキナーゼ経路の下流において機能する可能性が示唆された.さらに,ERKの活性をモニターするFRET型のプローブであるERKy 19) を用いた実験から,ASERニューロンにおけるERKの活性は飢餓の経験により減少することが明らかになった.以上の結果から,Ras-MAPキナーゼ経路がえさのシグナルを伝達し,CASY-1に依存性のDAF-2cの輸送を負に制御していることが示唆された.
おわりに
筆者らは,カルシンテニンによりインスリン受容体の特定のアイソフォームがシナプス領域へと輸送されることが線虫の学習の成立に重要であることを明らかにした.なお,哺乳類のインスリン受容体についても線虫と非常によく似た様式で2種類のアイソフォームが産生されており,インスリン受容体のBアイソフォームでは選択的エキソンの挿入によりα鎖のC末端側に固有のペプチド配列の付加されることがわかっている20).今回の研究で明らかになった,インスリン受容体が機能の多様性を得る機構,また,カルシンテニンが膜受容体の輸送により神経可塑性を制御する機構が,ほかの生物においても保存されている可能性を検討することは興味深い.今後の線虫の研究においては,線虫がどのように外界の塩濃度を記憶するのか,さらに,インスリン-PI3キナーゼ経路がシナプス領域においてどのように行動可塑性を実現するのか,といった点が重要な研究課題になると思われる.
文 献
- White, J. G., Southgate, E., Thomson, J. N. et al.: The structure of the nervous system of the nematode Caenorhabditis elegans. Phil. Tran. R. Soc. Lond. B, 314, 1-340 (1986)[PubMed]
- Kunitomo, H., Sato, H., Iwata, R. et al.: Concentration memory-dependent synaptic plasticity of a taste circuit regulates salt concentration chemotaxis in Caenorhabditis elegans. Nat. Commun., 4, 2210 (2013)[PubMed]
- McNay, E. C. & Recknagel, A. K.: Brain insulin signaling: a key component of cognitive processes and a potential basis for cognitive impairment in type 2 diabetes. Neurobiol. Learn. Mem., 96, 432-442 (2011)[PubMed]
- Schioth, H. B., Craft, S., Brooks, S. J. et al.: Brain insulin signaling and Alzheimer’s disease: current evidence and future directions. Mol. Neurobiol., 46, 4-10 (2012)[PubMed]
- Havrankova, J., Roth, J. & Brownstein, M.: Insulin receptors are widely distributed in the central nervous system of the rat. Nature, 272, 827-829 (1978)[PubMed]
- Ott, V., Benedict, C., Schultes, B. et al.: Intranasal administration of insulin to the brain impacts cognitive function and peripheral metabolism. Diabetes Obes. Metab., 14, 214-221 (2012)[PubMed]
- Steen, E., Terry, B. M., Rivera, E. J. et al.: Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer’s disease: is this type 3 diabetes? J. Alzheimers Dis., 7, 63-80 (2005)[PubMed]
- Wolkow, C. A., Kimura, K. D., Lee, M. -S. et al.: Regulation of C. elegans life-span by insulinlike signaling in the nervous system. Science, 290, 147-150 (2000)[PubMed]
- Tomioka, M., Adachi, T., Suzuki, H. et al.: The insulin/PI 3-kinase pathway regulates salt chemotaxis learning in Caenorhabditis elegans. Neuron, 51, 613-625 (2006)[PubMed]
- Kodama, E., Kuhara, A., Mohri-Shiomi, A. et al.: Insulin-like signaling and the neural circuit for integrative behavior in C. elegans. Genes Dev., 20, 2955-2960 (2006)[PubMed]
- Papassotiropoulos, A., Stephan, D. A., Huentelman, M. J. et al.: Common kibra alleles are associated with human memory performance. Science, 314, 475-478 (2006)[PubMed]
- Preuschhof, C., Heekeren, H. R., Li, S. -C. et al.: KIBRA and CLSTN2 polymorphisms exert interactive effects on human episodic memory. Neuropsychologia, 48, 402-408 (2010)[PubMed]
- Vagnoni, A., Perkinton, M. S., Gray, E. M. et al.: Calsyntenin-1 mediates axonal transport of the amyloid precursor protein and regulates Aβ production. Hum. Mol. Genet., 21, 2845-2854 (2012)[PubMed]
- Dieks, J. K., Gawinecka, J., Asif, A. R. et al.: Low-abundant cerebrospinal fluid proteome alterations in dementia with Lewy bodies. J. Alzheimers Dis., 34, 387-397 (2013)[PubMed]
- Perrin, R. J., Craig-Schapiro, R., Malone, J. P. et al.: Identification and validation of novel cerebrospinal fluid biomarkers for staging early Alzheimer's disease. PLoS One, 6, e16032 (2011)[PubMed]
- Idevall-Hagren, O., Dickson, E. J., Hille, B. et al.: Optogenetic control of phosphoinositide metabolism. Proc. Natl. Acad. Sci. USA, 109, E2316-E2323 (2012)[PubMed]
- Ikeda, D. D., Duan, Y., Matsuki, M. et al.: CASY-1, an ortholog of calsyntenins/alcadeins, is essential for learning in Caenorhabditis elegans. Proc. Natl. Acad. Sci. USA, 105, 5260-5265 (2008)[PubMed]
- Vagnoni, A., Rodriguez, L., Manser, C. et al.: Phosphorylation of kinesin light chain 1 at serine 460 modulates binding and trafficking of calsyntenin-1. J. Cell Sci., 124, 1032-1042 (2011)[PubMed]
- Tomida, T., Oda, S., Takekawa, M. et al.: The temporal pattern of stimulation determines the extent and duration of MAPK activation in a Caenorhabditis elegans sensory neuron. Sci. Signal., 5, ra76 (2012)[PubMed]
- Belfiore, A., Frasca, F., Pandini, G. et al.: Insulin receptor isoforms and insulin receptor/insulin-like growth factor receptor hybrids in physiology and disease. Endocr. Rev., 30, 586-623 (2009)[PubMed]
著者プロフィール
略歴:2014年 東京大学大学院理学系研究科にて博士号取得,同年より同 特任助教.
研究テーマ:線虫の行動可塑性をつかさどる分子機構.
関心事:動物の行動は分子生物学でどこまで明らかになるか.
飯野 雄一(Yuichi Iino)
東京大学大学院理学系研究科 教授.
研究室URL:http://molecular-ethology.biochem.s.u-tokyo.ac.jp/IINO_lab_J.html
© 2014 大野速雄・飯野雄一 Licensed under CC 表示 2.1 日本