海綿動物の化学防御を担う共生細菌
脇本敏幸・阿部郁朗
(東京大学大学院薬学系研究科 天然物化学教室)
email:脇本敏幸,阿部郁朗
DOI: 10.7875/first.author.2014.102
Calyculin biogenesis from a pyrophosphate protoxin produced by a sponge symbiont.
Toshiyuki Wakimoto, Yoko Egami, Yu Nakashima, Yukihiko Wakimoto, Takahiro Mori, Takayoshi Awakawa, Takuya Ito, Hiromichi Kenmoku, Yoshinori Asakawa, Jörn Piel, Ikuro Abe
Nature Chemical Biology, 10, 648-655 (2014)
もっとも原始的な多細胞動物である海綿動物からは,医薬品の資源として多数の重要な生物活性物質が見い出されてきた.それらの構造の一部には細菌の2次代謝産物に類似した構造がみられることから,海綿動物を起源とする生物活性物質の多くは海綿動物に共生する微生物により生産されていることが示唆されてきた.一方で,海綿動物に由来する医薬品のリード化合物は天然資源からの量的な確保にかぎりのあることから,臨床応用にまで進んだ例は少ない.したがって,それらの生産を担う微生物の同定および生合成機構の解明は,その有効利用および安定供給をめざすうえで鍵となる.この研究では,伊豆半島や伊豆諸島の沿岸に生息するチョコガタイシカイメンDiscodermia calyxから見い出されたタンパク質脱リン酸化酵素の阻害剤calyculin Aの生合成遺伝子ならびに生産細菌の同定をめざした.そして,詳細な生合成経路の解析により,海綿動物における共生細菌およびcalyculin Aの新規の類縁体であるphosphocalyculin Aの存在意義について,その一端が明らかにされた.
系統学的にもっとも原始的な多細胞生物として位置づけられる海綿動物は,多様な生物活性物質の宝庫であり,抗がん剤のリード化合物として有望な2次代謝産物の単離が多く報告されてきた1).しかしながら,天然資源からの量的な確保にはかぎりのあることから,臨床応用まで進んだ例は少ない.一方で,長年にわたり,海綿動物を起源とする有用な生物活性物質の真の生産者は海綿動物に共生する難培養性の微生物であることが示唆されてきた2).したがって,海綿動物に由来する生物活性物質の生産を担う微生物の同定および生合成機構の解明は,その有効利用および安定供給をめざすうえで鍵となる.この研究では,伊豆半島や伊豆諸島の沿岸に生息するチョコガタイシカイメンDiscodermia calyxに由来するタンパク質脱リン酸化酵素の阻害剤calyculin A 3) の生合成遺伝子をクローニングし,その遺伝子をもつ共生細菌を探索することによりその生産細菌の同定をめざした.さらに,calyculin Aの生合成酵素の機能解析により,海綿動物と細菌との共生の意義について考察を試みた.
2000年以降,次世代シークエンサーの進展によりさまざまな微生物のゲノム解析が急速に進み,それと同時に,2次代謝産物の生合成遺伝子もつぎつぎとクローニングされてきた.その一方で,海綿動物に由来する生物活性物質の生合成遺伝子のクローニングを報告した例はいまだ少ない.その原因として,2次代謝産物の生産を担うと示唆されている海綿動物に共生する微生物のほとんどは現在の技術では培養が困難であり,生産微生物の単離および同定のむずかしいことがあげられる.このため,2次代謝産物の生合成遺伝子のクローニングは共生微生物を含むカイメン全体のメタゲノムからの探索に限られる.しかし,多種多様で複雑な微生物を含むカイメンのメタゲノムから候補となる遺伝子を選別することは容易ではない.この研究では,タンパク質脱リン酸化酵素の阻害剤calyculin Aの構造と遺伝子配列の相関性から候補遺伝子を選別し,その生合成遺伝子の同定をめざした.
calyculin Aは,その構造からI型ポリケチド合成酵素と非リボソーム型ぺプチド合成酵素とのハイブリッド経路により生合成されると予想された.I型ポリケチド合成酵素はモジュールの構成によりcis-AT型とtrans-AT型とに分類される.2009年,伸長反応を担うKSドメインの詳細な解析により,trans-AT型のKSドメインは受け入れる基質の構造に依存した配列相同性を示し,複数のクレードに分類されることが報告された4).また,β分岐構造をもつ化合物の多くはtrans-AT型のポリケチド合成酵素に由来し,この構造はcalyculin Aのテトラエン部分にも認められた.そこで,目的の遺伝子はtrans-AT型のポリケチド合成酵素であるという仮説をたて,KSドメインの遺伝子配列を足がかりにカイメンのメタゲノムから遺伝子クラスターの探索を進めた.
まず,伊豆諸島の式根島において採集したD. calyxよりメタゲノムDNAを抽出した.得られたDNAを鋳型として,I型ポリケチド合成酵素のKSドメインに保存された遺伝子配列に特異的な縮重プライマーを用いてPCRを行った.増幅された遺伝子断片の配列を解析したところ,D. calyxのメタゲノムにはcis-AT型,trans-AT型,および,カイメンユビキタス型に分類されるI型ポリケチド合成酵素の存在することが明らかになった.さらに,trans-AT型のKSドメインについて詳細に解析した結果,calyculin Aの部分構造と一致するクレードの含まれることが明らかになった.そこで,抽出されたメタゲノムDNAを用いてホスミドライブラリーを構築し,calyculin Aの生合成への関与の示唆されたKSドメインの遺伝子配列をもとにPCRスクリーニングを行った.さらに,陽性クローンの末端の配列をもとにスクリーニングをくり返し,最終的に12個のホスミドクローンが得られた.
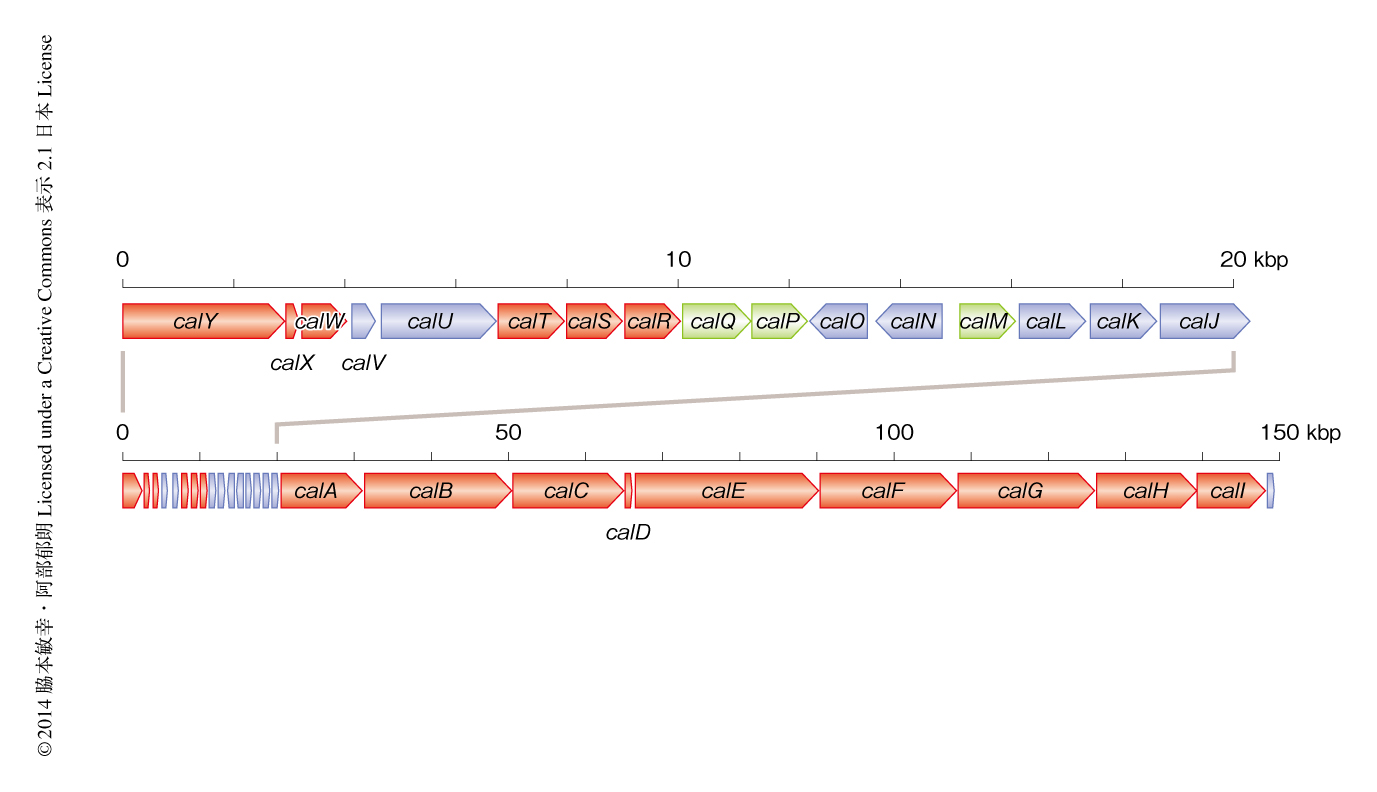
得られたホスミドクローンにおける挿入配列を次世代シークエンサーにより解析することにより,150 kb以上におよぶポリケチド合成酵素-非リボソーム型ぺプチド合成酵素遺伝子クラスターの配列情報が得られた(図1).この遺伝子クラスターの上流には3つの非リボソーム型ぺプチド合成酵素のモジュールがコードされており,Aドメインの配列から予測された伸長基質は順にSer,Gly,Serであった.最初のモジュールには2つのMTドメインが存在したことからトリメチルセリンの生成が推測された.また,3つ目のAドメインの上流および下流にはそれぞれHCドメインおよびOxドメインがコードされており,オキサゾールの形成が予想された.非リボソーム型ぺプチド合成酵素の下流には巨大なポリケチド合成酵素がコードされており,α位のメチル化に関与するMTドメインの配置はcalyculin Aのメチル基の位置と完全に一致した.さらに,KRドメインのアミノ酸配列から予想された水酸基の立体化学は,リン酸基が結合する17位を除きcalyculin Aの構造と一致した.さらに,KSドメインのクレードについてもcalyculin Aの部分構造とよい一致を示したことから,クローニングされたポリケチド合成酵素-非リボソーム型ぺプチド合成酵素遺伝子クラスターはcalyculin Aの生合成遺伝子であることが強く示唆された.しかしながら,末端テトラエンの生合成を担うモジュールの下流には予想外のモジュールが存在していた.その遺伝子情報より,Alaと1分子のマロニル-CoAが伸長したのちDHドメインによる二重結合のβ,γ-シフトが推測されたことから,このモジュールによってエナミドが生じ,さらにこれが加水分解されることにより末端アミドの前駆体が生成すると予想された.
クローニングされた遺伝子にはイントロンが認められなかったことから,このポリケチド合成酵素-非リボソーム型ぺプチド合成酵素遺伝子クラスターはD. calyxに共生する細菌に由来することが示唆された.そこで,calyculin Aの生産細菌の同定をめざした.まず,D. calyxに共生する細菌を遺伝子から探るため,D. calyxのメタゲノムについて16S rRNAを解析した.その結果,過去に報告されていたさまざまなカイメンと同様に,D. calyxにはα-Proteobacteria,δ-Proteobacteria,γ-Proteobacteria,Chloroflexi,Acidobacteriaなどに含まれる多様な細菌が共生していることが示唆された5).一方,D. calyxをミンチ状に破砕したのち,Ca2+およびMg2+を含まない人工海水に懸濁させその上清を光学顕微鏡にて観察したところ,複数の単細胞が数珠状に連なった特徴的な形状をもつ2種類のフィラメント状の細菌の存在が確認された.そこで,これらの細菌を含むD. calyxの懸濁液をスライドガラスに固定し,calyculin Aの生合成遺伝子を断片化した配列をプローブとしてCARD-FISH(catalyzed reporter deposition-fluorescence in situ hybridization)法6) を行った.その結果,一方の細菌が特異的に蛍光検出され,これがcalyculin Aの生産細菌であることが示唆された.さらなる確証を得るため,レーザーマイクロダイセクション法を用いてそれぞれの細菌をPCRチューブに分離し,calyculin Aの生合成遺伝子に特異的なプライマーを用いたPCRを行った.その結果,CARD-FISH法の結果と同様に,フィラメント状の細菌に特異的に目的の遺伝子断片が増幅されたことから,この細菌をcalyculin Aの生産細菌として特定した.さらに,16S rRNA解析によりこのcalyculin Aの生産細菌は新門Tectomicrobiaに属するEntotheonella sp.であることが明らかにされた7).
クローニングされたポリケチド合成酵素-非リボソーム型ぺプチド合成酵素遺伝子クラスターがcalyculin Aの生合成遺伝子であることを示すには,この遺伝子クラスターによりcalyculin Aが生産されることを実証しなければならない.しかしながら,現段階では実験室においてこの遺伝子クラスターをもつ共生細菌Entotheonella sp.の培養には成功していないことから,クローニングされた遺伝子の表現型を生産細菌を用いて証明することは困難であった.また,別の細菌を宿主とした遺伝子クラスター全体の異種発現についても,150 kbにおよぶ巨大な2次代謝産物遺伝子クラスターの発現例はなく,きわめてむずかしいことが予想された.そこで,クローニングされた遺伝子の一部を機能解析することにより,calyculin Aの生合成へのこの遺伝子クラスターの関与について検討した.遺伝子情報から推測されたポリケチド合成酵素-非リボソーム型ぺプチド合成酵素遺伝子クラスターによる反応産物が最終的にcalyculin Aへと変換されるには,スピロ環の形成,17位の水酸基の立体反転およびリン酸化,ニトリルの形成などの修飾反応が必要である.D. calyxからは末端アミドの類縁体であるcalyculinamide A 8) および脱リン酸化体であるdephosphonocalyculin A 9) が単離されていたことから,これらがcalyculin Aの生合成中間体であると予想した.一方で,ポリケチド合成酵素-非リボソーム型ぺプチド合成酵素遺伝子クラスターの上流にリン酸基転移酵素と配列相同性を示す3つのORF,CalM,CalP,CalQが見い出されたことから,calyculin Aにおけるニトリルの形成および17位のリン酸化においてリン酸基転移反応が重要な役割を担っていると推測し,これらのORFの機能解析に着手した.
大腸菌を宿主としてCalM,CalP,CalQの異種発現を試みた.それぞれの遺伝子断片の異種発現を種々の大腸菌発現用ベクターおよび大腸菌株を用いて試みたが,得られたタンパク質はすべて封入体であった.しかし,さらに発現条件を検討した結果,分子シャペロンGroELおよびGroESとの共発現により目的のタンパク質を可溶性画分に得ることができた.そこで,GroELおよびGroESの共存下においてCalM,CalP,CalQをN末端Hisタグ融合タンパク質として発現したのち,Ni-アフィニティカラムを用いて精製した.得られた精製タンパク質を用い,calyculinamide Aおよびdephoshonocalyculin Aを基質としてin vitroにおける酵素反応を試みた.その結果,ATPおよびMg2+の存在下においてCalQとcalyculinamide Aとの酵素反応液に新たな生成物が認められた.さらに,CalQは最終産物として考えられていたcalyculin Aをも基質とし,同様に分子量が80大きい生成物をあたえることが判明した.つまり,calyculin Aあるいはcalyculinamide Aに1分子のリン酸基が付加した構造の生成が予想されたのである.
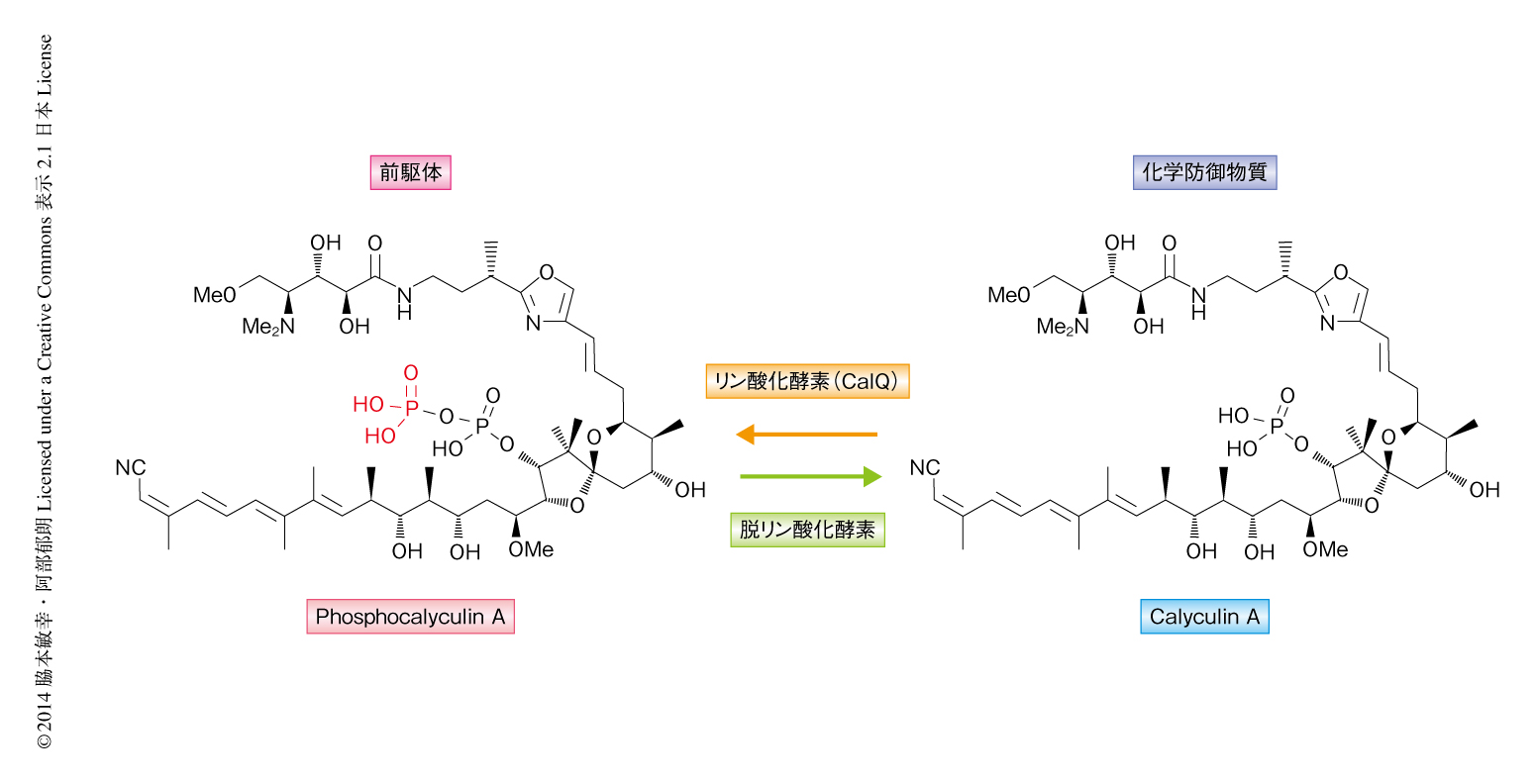
長年にわたり筆者らを含む複数の研究グループによりD. calyxの2次代謝産物が研究されてきたにもかかわらず,このような化合物の単離を報告した例はなかった.そこで,D. calyxにおけるこの化合物の存在意義を明らかにするため,再度,D. calyxの抽出物を精査した.過去の報告では,生のD. calyxあるいは凍結保存したD. calyxから各種の有機溶媒により抽出していた.しかしながら,この方法ではさまざまな溶媒や緩衝液を用いてもcalyculin Aが主要な代謝産物として検出されるのみであった.一方,興味深いことに,生のD. calyxを液体窒素により瞬間的に凍結しそのまま凍結乾燥した試料をメタノールにより抽出したところ,主要な代謝産物はcalyculin Aではなく,CalQによる酵素反応の生成物と一致する化合物であることが判明した.そこで,この化合物を精製しNMR法により解析した結果,calyculin Aのリン酸基がさらにリン酸化されたピロリン酸体phosphocalyculin Aであることが明らかになった.以上の結果は,クローニングされた遺伝子クラスターがcalyculin Aの生合成に関与することを強く支持したとともに,最終産物がphosphocalyculin Aであることを示した.
D. calyxにおけるphosphocalyculin Aの存在意義を明らかにするため,ヒトの子宮頸がん細胞に由来するHeLa細胞およびマウスの白血病細胞に由来するP388細胞に対する細胞毒性試験を行った.その結果,phosphocalyculin Aの細胞毒性はcalyculin Aより約1000倍も減弱していた.また,タンパク質脱リン酸化酵素PP2Aに対する阻害活性を試験したところ,phosphocalyculin Aの50%阻害濃度はcalyculin Aより約40倍も高い値を示し,phosphocalyculin Aはcalyculin Aより生物活性が減弱していることが判明した.一方で,生のD. calyxからの抽出においてはいずれの方法を用いた場合でもcalyculin Aが主要な代謝産物として得られたことから,抽出の過程におけるphosphocalyculin Aからcalyculin Aへの変換が予想された.実際に,D. calyxから粗酵素液を調製しphosphocalyculin Aと反応させたところ,数分でcalyculin Aへと変換されることが確認された.これに対し,熱変性した粗酵素液,また,同じTheonellidae科に属するカイメンであるDiscodermia kiiensisあるいはTheonella swinhoeiの粗酵素液ではこの反応は認められず,phosphocalyculin Aからcalyculin Aへの変換はD. calyxに特異的に存在する脱リン酸化酵素により生じることが明らかになった.さらに,D. calyxを2分間にわたりナイフでミンチ状に砕き,そののち,一定時間ごとに液体窒素により瞬間凍結して凍結乾燥した試料の代謝産物を分析したところ,傷害をうけたD. calyxの組織においてphosphocalyculin Aからcalyculin Aへの変換が瞬時に起こっていることが判明した.以上の結果より,D. calyxは化学防御物質の前駆体としてphosphocalyculin Aを蓄積し,外部からなんらかの刺激あるいは攻撃がくわわった際にただちにこれを脱リン酸化して強力な細胞毒性物質であるcalyculin Aを生成する“activated chemical defense”の機構が示唆された10)(図2).
海綿動物からはhalichondrin Bなど多くの抗がん剤のリード化合物が見い出されてきたが,それらは共生する細菌やシアノバクテリア,渦鞭毛藻などにより生産されていると考えられてきた.しかし,海綿動物に由来する生物活性物質の生産微生物を同定した研究例はこれまでほとんどなかった.その最大の理由は,生産微生物の多くが難培養性であるためであった.一方で,この研究では,化合物の構造とtrans-AT型ポリケチド合成酵素に特有の遺伝子情報をもとにしたメタゲノムマイニングにより,D. calyxに由来する細胞毒性物質calyculin Aの生合成遺伝子のクローニングに成功した.さらに,レーザーマイクロダイセクションを用いた単細胞レベルでの解析によりcalyculin Aの生合成遺伝子が共生細菌Entotheonella sp.にコードされていることが明らかにされた.このように,カイメンのメタゲノムから直接にクローニングした生合成遺伝子の配列をもとに生産微生物を同定した研究は,この研究がはじめてである.この研究により,海綿動物に由来する医薬品のリード化合物の生産微生物を特定するうえで重要な方法論が提示された.共生細菌Entotheonella sp.はいまだ難培養性であるが,可培養化あるいは適切な異種発現系の開発により,稀少な生物資源である海綿動物に由来する有用天然物の供給法の確立につながることが期待される.
略歴:2001年 東京大学大学院農学生命科学研究科博士課程 修了,同年 米国Pittsburgh大学 研究員,2003年 静岡県立大学薬学部 助手,2007年 同 講師,2010年 東京大学大学院薬学系研究科 講師を経て,2013年より同 准教授.
研究テーマ:海洋生物に由来する天然物の探索.
関心事:天然物のかかわる動的な生物現象.
阿部 郁朗(Ikuro Abe)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~tennen/head.htm
© 2014 脇本敏幸・阿部郁朗 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 天然物化学教室)
email:脇本敏幸,阿部郁朗
DOI: 10.7875/first.author.2014.102
Calyculin biogenesis from a pyrophosphate protoxin produced by a sponge symbiont.
Toshiyuki Wakimoto, Yoko Egami, Yu Nakashima, Yukihiko Wakimoto, Takahiro Mori, Takayoshi Awakawa, Takuya Ito, Hiromichi Kenmoku, Yoshinori Asakawa, Jörn Piel, Ikuro Abe
Nature Chemical Biology, 10, 648-655 (2014)
要 約
もっとも原始的な多細胞動物である海綿動物からは,医薬品の資源として多数の重要な生物活性物質が見い出されてきた.それらの構造の一部には細菌の2次代謝産物に類似した構造がみられることから,海綿動物を起源とする生物活性物質の多くは海綿動物に共生する微生物により生産されていることが示唆されてきた.一方で,海綿動物に由来する医薬品のリード化合物は天然資源からの量的な確保にかぎりのあることから,臨床応用にまで進んだ例は少ない.したがって,それらの生産を担う微生物の同定および生合成機構の解明は,その有効利用および安定供給をめざすうえで鍵となる.この研究では,伊豆半島や伊豆諸島の沿岸に生息するチョコガタイシカイメンDiscodermia calyxから見い出されたタンパク質脱リン酸化酵素の阻害剤calyculin Aの生合成遺伝子ならびに生産細菌の同定をめざした.そして,詳細な生合成経路の解析により,海綿動物における共生細菌およびcalyculin Aの新規の類縁体であるphosphocalyculin Aの存在意義について,その一端が明らかにされた.
はじめに
系統学的にもっとも原始的な多細胞生物として位置づけられる海綿動物は,多様な生物活性物質の宝庫であり,抗がん剤のリード化合物として有望な2次代謝産物の単離が多く報告されてきた1).しかしながら,天然資源からの量的な確保にはかぎりのあることから,臨床応用まで進んだ例は少ない.一方で,長年にわたり,海綿動物を起源とする有用な生物活性物質の真の生産者は海綿動物に共生する難培養性の微生物であることが示唆されてきた2).したがって,海綿動物に由来する生物活性物質の生産を担う微生物の同定および生合成機構の解明は,その有効利用および安定供給をめざすうえで鍵となる.この研究では,伊豆半島や伊豆諸島の沿岸に生息するチョコガタイシカイメンDiscodermia calyxに由来するタンパク質脱リン酸化酵素の阻害剤calyculin A 3) の生合成遺伝子をクローニングし,その遺伝子をもつ共生細菌を探索することによりその生産細菌の同定をめざした.さらに,calyculin Aの生合成酵素の機能解析により,海綿動物と細菌との共生の意義について考察を試みた.
1.calyculin Aの生合成遺伝子の探索
2000年以降,次世代シークエンサーの進展によりさまざまな微生物のゲノム解析が急速に進み,それと同時に,2次代謝産物の生合成遺伝子もつぎつぎとクローニングされてきた.その一方で,海綿動物に由来する生物活性物質の生合成遺伝子のクローニングを報告した例はいまだ少ない.その原因として,2次代謝産物の生産を担うと示唆されている海綿動物に共生する微生物のほとんどは現在の技術では培養が困難であり,生産微生物の単離および同定のむずかしいことがあげられる.このため,2次代謝産物の生合成遺伝子のクローニングは共生微生物を含むカイメン全体のメタゲノムからの探索に限られる.しかし,多種多様で複雑な微生物を含むカイメンのメタゲノムから候補となる遺伝子を選別することは容易ではない.この研究では,タンパク質脱リン酸化酵素の阻害剤calyculin Aの構造と遺伝子配列の相関性から候補遺伝子を選別し,その生合成遺伝子の同定をめざした.
calyculin Aは,その構造からI型ポリケチド合成酵素と非リボソーム型ぺプチド合成酵素とのハイブリッド経路により生合成されると予想された.I型ポリケチド合成酵素はモジュールの構成によりcis-AT型とtrans-AT型とに分類される.2009年,伸長反応を担うKSドメインの詳細な解析により,trans-AT型のKSドメインは受け入れる基質の構造に依存した配列相同性を示し,複数のクレードに分類されることが報告された4).また,β分岐構造をもつ化合物の多くはtrans-AT型のポリケチド合成酵素に由来し,この構造はcalyculin Aのテトラエン部分にも認められた.そこで,目的の遺伝子はtrans-AT型のポリケチド合成酵素であるという仮説をたて,KSドメインの遺伝子配列を足がかりにカイメンのメタゲノムから遺伝子クラスターの探索を進めた.
まず,伊豆諸島の式根島において採集したD. calyxよりメタゲノムDNAを抽出した.得られたDNAを鋳型として,I型ポリケチド合成酵素のKSドメインに保存された遺伝子配列に特異的な縮重プライマーを用いてPCRを行った.増幅された遺伝子断片の配列を解析したところ,D. calyxのメタゲノムにはcis-AT型,trans-AT型,および,カイメンユビキタス型に分類されるI型ポリケチド合成酵素の存在することが明らかになった.さらに,trans-AT型のKSドメインについて詳細に解析した結果,calyculin Aの部分構造と一致するクレードの含まれることが明らかになった.そこで,抽出されたメタゲノムDNAを用いてホスミドライブラリーを構築し,calyculin Aの生合成への関与の示唆されたKSドメインの遺伝子配列をもとにPCRスクリーニングを行った.さらに,陽性クローンの末端の配列をもとにスクリーニングをくり返し,最終的に12個のホスミドクローンが得られた.
得られたホスミドクローンにおける挿入配列を次世代シークエンサーにより解析することにより,150 kb以上におよぶポリケチド合成酵素-非リボソーム型ぺプチド合成酵素遺伝子クラスターの配列情報が得られた(図1).この遺伝子クラスターの上流には3つの非リボソーム型ぺプチド合成酵素のモジュールがコードされており,Aドメインの配列から予測された伸長基質は順にSer,Gly,Serであった.最初のモジュールには2つのMTドメインが存在したことからトリメチルセリンの生成が推測された.また,3つ目のAドメインの上流および下流にはそれぞれHCドメインおよびOxドメインがコードされており,オキサゾールの形成が予想された.非リボソーム型ぺプチド合成酵素の下流には巨大なポリケチド合成酵素がコードされており,α位のメチル化に関与するMTドメインの配置はcalyculin Aのメチル基の位置と完全に一致した.さらに,KRドメインのアミノ酸配列から予想された水酸基の立体化学は,リン酸基が結合する17位を除きcalyculin Aの構造と一致した.さらに,KSドメインのクレードについてもcalyculin Aの部分構造とよい一致を示したことから,クローニングされたポリケチド合成酵素-非リボソーム型ぺプチド合成酵素遺伝子クラスターはcalyculin Aの生合成遺伝子であることが強く示唆された.しかしながら,末端テトラエンの生合成を担うモジュールの下流には予想外のモジュールが存在していた.その遺伝子情報より,Alaと1分子のマロニル-CoAが伸長したのちDHドメインによる二重結合のβ,γ-シフトが推測されたことから,このモジュールによってエナミドが生じ,さらにこれが加水分解されることにより末端アミドの前駆体が生成すると予想された.
2.calyculin Aの生産細菌の同定
クローニングされた遺伝子にはイントロンが認められなかったことから,このポリケチド合成酵素-非リボソーム型ぺプチド合成酵素遺伝子クラスターはD. calyxに共生する細菌に由来することが示唆された.そこで,calyculin Aの生産細菌の同定をめざした.まず,D. calyxに共生する細菌を遺伝子から探るため,D. calyxのメタゲノムについて16S rRNAを解析した.その結果,過去に報告されていたさまざまなカイメンと同様に,D. calyxにはα-Proteobacteria,δ-Proteobacteria,γ-Proteobacteria,Chloroflexi,Acidobacteriaなどに含まれる多様な細菌が共生していることが示唆された5).一方,D. calyxをミンチ状に破砕したのち,Ca2+およびMg2+を含まない人工海水に懸濁させその上清を光学顕微鏡にて観察したところ,複数の単細胞が数珠状に連なった特徴的な形状をもつ2種類のフィラメント状の細菌の存在が確認された.そこで,これらの細菌を含むD. calyxの懸濁液をスライドガラスに固定し,calyculin Aの生合成遺伝子を断片化した配列をプローブとしてCARD-FISH(catalyzed reporter deposition-fluorescence in situ hybridization)法6) を行った.その結果,一方の細菌が特異的に蛍光検出され,これがcalyculin Aの生産細菌であることが示唆された.さらなる確証を得るため,レーザーマイクロダイセクション法を用いてそれぞれの細菌をPCRチューブに分離し,calyculin Aの生合成遺伝子に特異的なプライマーを用いたPCRを行った.その結果,CARD-FISH法の結果と同様に,フィラメント状の細菌に特異的に目的の遺伝子断片が増幅されたことから,この細菌をcalyculin Aの生産細菌として特定した.さらに,16S rRNA解析によりこのcalyculin Aの生産細菌は新門Tectomicrobiaに属するEntotheonella sp.であることが明らかにされた7).
3.修飾酵素の機能解析
クローニングされたポリケチド合成酵素-非リボソーム型ぺプチド合成酵素遺伝子クラスターがcalyculin Aの生合成遺伝子であることを示すには,この遺伝子クラスターによりcalyculin Aが生産されることを実証しなければならない.しかしながら,現段階では実験室においてこの遺伝子クラスターをもつ共生細菌Entotheonella sp.の培養には成功していないことから,クローニングされた遺伝子の表現型を生産細菌を用いて証明することは困難であった.また,別の細菌を宿主とした遺伝子クラスター全体の異種発現についても,150 kbにおよぶ巨大な2次代謝産物遺伝子クラスターの発現例はなく,きわめてむずかしいことが予想された.そこで,クローニングされた遺伝子の一部を機能解析することにより,calyculin Aの生合成へのこの遺伝子クラスターの関与について検討した.遺伝子情報から推測されたポリケチド合成酵素-非リボソーム型ぺプチド合成酵素遺伝子クラスターによる反応産物が最終的にcalyculin Aへと変換されるには,スピロ環の形成,17位の水酸基の立体反転およびリン酸化,ニトリルの形成などの修飾反応が必要である.D. calyxからは末端アミドの類縁体であるcalyculinamide A 8) および脱リン酸化体であるdephosphonocalyculin A 9) が単離されていたことから,これらがcalyculin Aの生合成中間体であると予想した.一方で,ポリケチド合成酵素-非リボソーム型ぺプチド合成酵素遺伝子クラスターの上流にリン酸基転移酵素と配列相同性を示す3つのORF,CalM,CalP,CalQが見い出されたことから,calyculin Aにおけるニトリルの形成および17位のリン酸化においてリン酸基転移反応が重要な役割を担っていると推測し,これらのORFの機能解析に着手した.
大腸菌を宿主としてCalM,CalP,CalQの異種発現を試みた.それぞれの遺伝子断片の異種発現を種々の大腸菌発現用ベクターおよび大腸菌株を用いて試みたが,得られたタンパク質はすべて封入体であった.しかし,さらに発現条件を検討した結果,分子シャペロンGroELおよびGroESとの共発現により目的のタンパク質を可溶性画分に得ることができた.そこで,GroELおよびGroESの共存下においてCalM,CalP,CalQをN末端Hisタグ融合タンパク質として発現したのち,Ni-アフィニティカラムを用いて精製した.得られた精製タンパク質を用い,calyculinamide Aおよびdephoshonocalyculin Aを基質としてin vitroにおける酵素反応を試みた.その結果,ATPおよびMg2+の存在下においてCalQとcalyculinamide Aとの酵素反応液に新たな生成物が認められた.さらに,CalQは最終産物として考えられていたcalyculin Aをも基質とし,同様に分子量が80大きい生成物をあたえることが判明した.つまり,calyculin Aあるいはcalyculinamide Aに1分子のリン酸基が付加した構造の生成が予想されたのである.
長年にわたり筆者らを含む複数の研究グループによりD. calyxの2次代謝産物が研究されてきたにもかかわらず,このような化合物の単離を報告した例はなかった.そこで,D. calyxにおけるこの化合物の存在意義を明らかにするため,再度,D. calyxの抽出物を精査した.過去の報告では,生のD. calyxあるいは凍結保存したD. calyxから各種の有機溶媒により抽出していた.しかしながら,この方法ではさまざまな溶媒や緩衝液を用いてもcalyculin Aが主要な代謝産物として検出されるのみであった.一方,興味深いことに,生のD. calyxを液体窒素により瞬間的に凍結しそのまま凍結乾燥した試料をメタノールにより抽出したところ,主要な代謝産物はcalyculin Aではなく,CalQによる酵素反応の生成物と一致する化合物であることが判明した.そこで,この化合物を精製しNMR法により解析した結果,calyculin Aのリン酸基がさらにリン酸化されたピロリン酸体phosphocalyculin Aであることが明らかになった.以上の結果は,クローニングされた遺伝子クラスターがcalyculin Aの生合成に関与することを強く支持したとともに,最終産物がphosphocalyculin Aであることを示した.
4.新規の類縁体phosphocalyculin Aの存在意義
D. calyxにおけるphosphocalyculin Aの存在意義を明らかにするため,ヒトの子宮頸がん細胞に由来するHeLa細胞およびマウスの白血病細胞に由来するP388細胞に対する細胞毒性試験を行った.その結果,phosphocalyculin Aの細胞毒性はcalyculin Aより約1000倍も減弱していた.また,タンパク質脱リン酸化酵素PP2Aに対する阻害活性を試験したところ,phosphocalyculin Aの50%阻害濃度はcalyculin Aより約40倍も高い値を示し,phosphocalyculin Aはcalyculin Aより生物活性が減弱していることが判明した.一方で,生のD. calyxからの抽出においてはいずれの方法を用いた場合でもcalyculin Aが主要な代謝産物として得られたことから,抽出の過程におけるphosphocalyculin Aからcalyculin Aへの変換が予想された.実際に,D. calyxから粗酵素液を調製しphosphocalyculin Aと反応させたところ,数分でcalyculin Aへと変換されることが確認された.これに対し,熱変性した粗酵素液,また,同じTheonellidae科に属するカイメンであるDiscodermia kiiensisあるいはTheonella swinhoeiの粗酵素液ではこの反応は認められず,phosphocalyculin Aからcalyculin Aへの変換はD. calyxに特異的に存在する脱リン酸化酵素により生じることが明らかになった.さらに,D. calyxを2分間にわたりナイフでミンチ状に砕き,そののち,一定時間ごとに液体窒素により瞬間凍結して凍結乾燥した試料の代謝産物を分析したところ,傷害をうけたD. calyxの組織においてphosphocalyculin Aからcalyculin Aへの変換が瞬時に起こっていることが判明した.以上の結果より,D. calyxは化学防御物質の前駆体としてphosphocalyculin Aを蓄積し,外部からなんらかの刺激あるいは攻撃がくわわった際にただちにこれを脱リン酸化して強力な細胞毒性物質であるcalyculin Aを生成する“activated chemical defense”の機構が示唆された10)(図2).
おわりに
海綿動物からはhalichondrin Bなど多くの抗がん剤のリード化合物が見い出されてきたが,それらは共生する細菌やシアノバクテリア,渦鞭毛藻などにより生産されていると考えられてきた.しかし,海綿動物に由来する生物活性物質の生産微生物を同定した研究例はこれまでほとんどなかった.その最大の理由は,生産微生物の多くが難培養性であるためであった.一方で,この研究では,化合物の構造とtrans-AT型ポリケチド合成酵素に特有の遺伝子情報をもとにしたメタゲノムマイニングにより,D. calyxに由来する細胞毒性物質calyculin Aの生合成遺伝子のクローニングに成功した.さらに,レーザーマイクロダイセクションを用いた単細胞レベルでの解析によりcalyculin Aの生合成遺伝子が共生細菌Entotheonella sp.にコードされていることが明らかにされた.このように,カイメンのメタゲノムから直接にクローニングした生合成遺伝子の配列をもとに生産微生物を同定した研究は,この研究がはじめてである.この研究により,海綿動物に由来する医薬品のリード化合物の生産微生物を特定するうえで重要な方法論が提示された.共生細菌Entotheonella sp.はいまだ難培養性であるが,可培養化あるいは適切な異種発現系の開発により,稀少な生物資源である海綿動物に由来する有用天然物の供給法の確立につながることが期待される.
文 献
- Gerwick, W. H. & Moore, B. S.: Lessons from the past and charting the future of marine natural products drug discovery and chemical biology. Chem. Biol., 19, 85-98 (2012)[PubMed]
- Bewley, C. A. & Faulkner, D. J.: Lithistid sponges: Star performers or hosts to the stars. Angew. Chem. Int. Ed., 37, 2162-2178 (1998)
- Kato, Y., Fusetani, N., Matsunaga, S. et al.: Calyculin A, a novel antitumor metabolite from the marine sponge Discodermia calyx. J. Am. Chem. Soc., 108, 2780-2781 (1986)
- Nguyen, T., Ishida, K., Jenke-Kodama, H. et al.: Exploiting the mosaic structure of trans-acyltransferase polyketide synthases for natural product discovery and pathway dissection. Nat. Biotechnol., 26, 225-233 (2008)[PubMed]
- Hentschel, U., Usher, K. M. & Taylor, M. W.: Marine sponges as microbial fermenters. FEMS Microbiol. Ecol., 55, 167-177 (2006)[PubMed]
- Pernthaler, A., Pernthaler, J. & Amann, R.: Fluorescence in situ hybridization and catalyzed reporter deposition for the identification of marine bacteria. Appl. Environ. Microbiol., 68, 3094-3101 (2002)[PubMed]
- Wilson, M. C., Mori, T., Ruckert, C. et al.: Discovery of an environmental bacterial taxon with a large and distinct metabolic repertoire. Nature, 506, 58-62 (2014)[PubMed]
- Matsunaga, S., Wakimoto, T. & Fusetani, N.: Isolation of four new calyculins from the marine sponge Discodermia calyx. J. Org. Chem., 62, 2640-2642 (1997)[PubMed]
- Matsunaga, S., Wakimoto, T., Fusetani, N. et al.: Isolation of dephosphonocalyculin A from the marine sponge, Discodermia calyx. Tetrahedron Lett. 38, 3763-3764 (1997)
- Paul, V. J. & Van Alstyne, K. L.: Activation of chemical defenses in the tropical green algae Halimeda spp. J. Exp. Mar. Biol. Ecol., 160, 191-203 (1992)
著者プロフィール
略歴:2001年 東京大学大学院農学生命科学研究科博士課程 修了,同年 米国Pittsburgh大学 研究員,2003年 静岡県立大学薬学部 助手,2007年 同 講師,2010年 東京大学大学院薬学系研究科 講師を経て,2013年より同 准教授.
研究テーマ:海洋生物に由来する天然物の探索.
関心事:天然物のかかわる動的な生物現象.
阿部 郁朗(Ikuro Abe)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~tennen/head.htm
© 2014 脇本敏幸・阿部郁朗 Licensed under CC 表示 2.1 日本