細胞におけるネットワークの再構築により明らかにされたマウスのES細胞において原始内胚葉への分化に重要なタンパク質間相互作用
安井典久・小出昌平
(米国Chicago大学Department of Biochemistry and Molecular Biology)
email:安井典久,小出昌平
DOI: 10.7875/first.author.2014.090
Directed network wiring identifies a key protein interaction in embryonic stem cell differentiation.
Norihisa Yasui, Greg M. Findlay, Gerald D. Gish, Marilyn S. Hsiung, Jin Huang, Monika Tucholska, Lorne Taylor, Louis Smith, W. Clifford Boldridge, Akiko Koide, Tony Pawson, Shohei Koide
Molecular Cell, 54, 1034-1041 (2014)
細胞においては多数のタンパク質間相互作用が複雑なネットワークを形成し,さまざまな細胞機能の発現とその制御に関与している.その複雑さゆえ,ある細胞機能の制御にタンパク質間相互作用ネットワークの総体が必要であるのか,それとも,少数かつ特定のタンパク質間相互作用のみが関与しているのかを実証することは挑戦的な課題である.今回,筆者らは,多数のリン酸化Tyrモチーフと相互作用する細胞内アダプタータンパク質Grb2のSH2ドメインを研究対象としてとりあげ,特定のリン酸化Tyrモチーフとのみ相互作用するように改変したGrb2変異体を作製し,それらを利用することによりこの課題を解決した.数あるリン酸化Tyrモチーフのうち,チロシンホスファターゼであるPtpn11のもつ特定のリン酸化Tyrとの相互作用のみを再構築すれば,野生型のGrb2と同様にマウスのES細胞において原始内胚葉への分化を誘導できることが明らかになった.すなわち,特定の細胞機能の制御には,複雑なタンパク質間相互作用ネットワークのうちの,ごくかぎられたタンパク質間相互作用で十分であることが示唆された.
細胞内シグナル伝達は多数のタンパク質間相互作用が動的に制御されることにより達成されている.なかでも,短いペプチドモチーフとそれを認識するタンパク質相互作用ドメインの関与する例は多く知られている1).タンパク質相互作用ドメインは標的とするペプチドモチーフに対し比較的低い親和性および広範な特異性を示すのが特徴であり,その結果,多数のタンパク質と相互作用する.そのため,あるタンパク質相互作用ドメインを中心としたタンパク質間相互作用ネットワークはきわめて複雑なものになる.リン酸化Tyrモチーフとそれを認識するSH2ドメインとの相互作用はその好例であり,それらのあいだの相互作用の特異性および親和性はともに比較的低いことが定量的な相互作用の解析により明らかにされている2).
SH2ドメインをもちタンパク質間相互作用ネットワークの中心として機能するタンパク質の代表として,細胞内アダプタータンパク質であるGrb2があげられる.Grb2は,リン酸化Tyrモチーフと相互作用するSH2ドメインにくわえ,それをはさみ2つのSH3ドメインをもつ.これまで,Grb2のSH2ドメインおよびSH3ドメインと相互作用するパートナータンパク質が多く同定されてきた3).一方で,マウスのES細胞が原始内胚葉に分化する段階においてGrb2は必須のタンパク質であり,SH2ドメインおよびSH3ドメインを介したタンパク質間相互作用が必要である.この分化の段階において,Grb2のSH2ドメインはリン酸化Tyrモチーフをもつ多数のタンパク質と相互作用することがわかっていた4).しかし,マウスES細胞の原始内胚葉への分化におけるGrb2のSH2ドメインと個々のリン酸化Tyrモチーフとのあいだの相互作用の役割についてはこれまで明らかではなかった.
ノックアウトやノックダウンといった従来の遺伝学的な手法は機能の消失にもとづいた方法であり,タンパク質の欠損や発現の減弱をともなうため,SH2ドメインだけではなく,SH3ドメインを介したものも含め多数のタンパク質間相互作用もなくなってしまう.リン酸化Tyrモチーフに変異を導入すると複数のSH2ドメインとの相互作用に影響をあたえる.結果として,既存の手法では特定のSH2ドメインと特定のリン酸化Tyrモチーフとの相互作用が機能的に重要であるのかどうかを解明することが不可能であった.この問題は,マウスES細胞の分化だけでなく,シグナル伝達ネットワークを理解するうえで本質的なものであるが,技術的な困難さからこれまでまったく明らかにされていなかった.
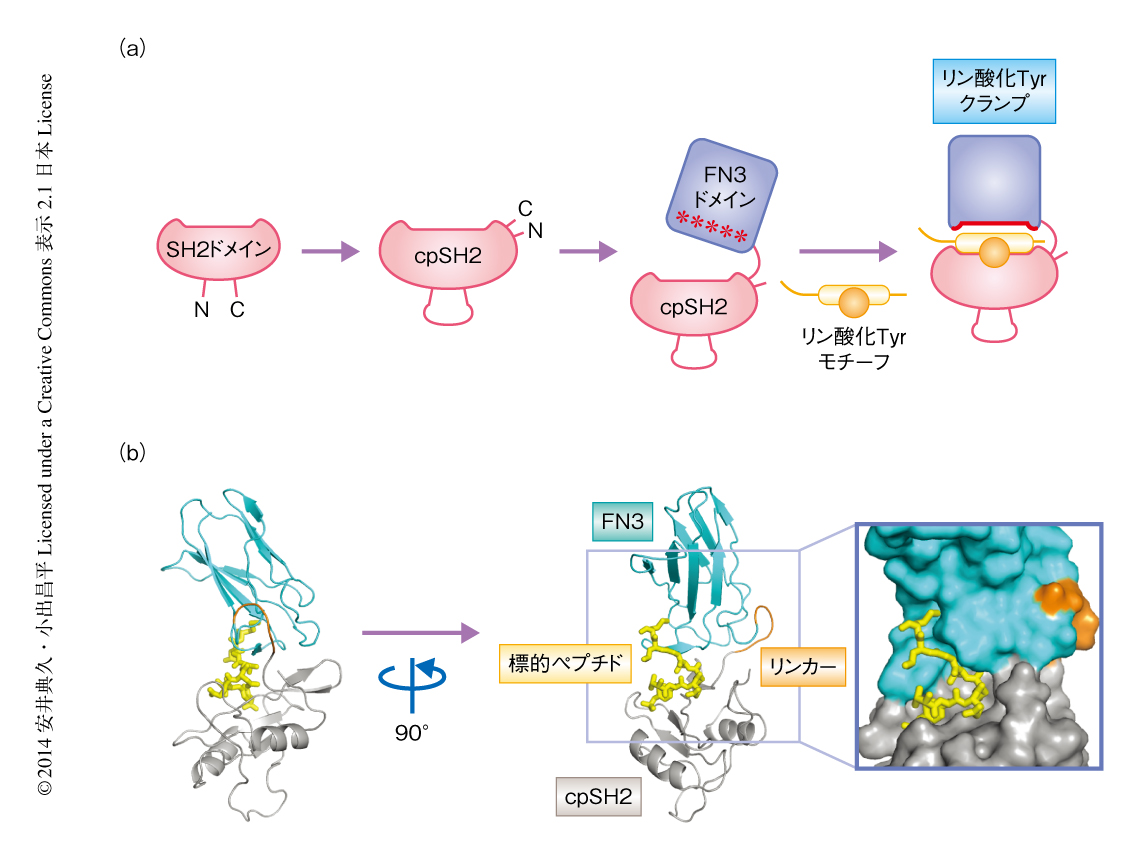
この問題を解決するためにはどのようなアプローチが有効なのだろうか? 特定のリン酸化Tyrモチーフと特異的に相互作用するように機能変換した人工タンパク質の作製とその利用により解決を試みた.まず,Grb2のもつSH2ドメインを単一のリン酸化Tyrモチーフと特異的に相互作用するよう機能改変することに取り組んだ.このとき,進化分子工学的な手法のひとつであるアフィニティクランプ技術を用いた5,6).この方法は,あるペプチドモチーフを認識するタンパク質相互作用ドメインをもとに,より大きな相互作用部位を構築することにより,ペプチドモチーフに対する親和性および特異性をタンパク質相互作用ドメインが単独の場合と比べ飛躍的に向上させるものである(図1a).
まず,リン酸化Tyrモチーフとの相互作用部位の近傍にFN3ドメインが配置されるよう,SH2ドメインの円順列変異体を設計した.ついで,SH2ドメイン円順列変異体のC末端にリンカー配列を介してFN3ドメインを連結した.FN3ドメインは人工結合タンパク質を構築するための分子骨格として多くの成果をあげている7).そして,FN3ドメインのアミノ酸配列を多様化したコンビナトリアルライブラリーの構築,および,酵母ディスプレイ法によるライブラリーの選別をへて,特定のリン酸化Tyrモチーフに対し高い親和性および特異性をもち認識するリン酸化Tyrクランプを作製した(図1a).
3つのタンパク質のもつリン酸化Tyr,BCRのリン酸化Tyr177,Shc1のリン酸化Tyr239/Tyr240,Ptpn11のリン酸化Tyr580に対し,それぞれ特異的なリン酸化Tyrクランプを作製することに成功した.これら3つのリン酸化Tyrクランプは,標的となるリン酸化Tyrに対し野生型のGrb2のもつSH2ドメインと比べきわめて高い親和性および特異性を示した.
得られたリン酸化Tyrクランプについて,これらが標的となるリン酸化Tyrに対し高い特異性を示す分子機構について明らかにするため,標的となるペプチドに対しアラニンスキャニング法を行いリン酸化Tyrクランプとの相互作用に重要なアミノ酸残基を同定した.その結果,3つのリン酸化Tyrクランプに共通して標的となるペプチドのリン酸化Tyrモチーフコア領域のアミノ酸残基が重要であった一方で,まったく異なる位置のアミノ酸残基も相互作用に重要であることがわかった.たとえば,BCRのリン酸Tyr177に対するリン酸化Tyrクランプは,リン酸化Tyrモチーフコア領域を含む6残基にわたり標的となるペプチドを認識しており,そのためこのリン酸化Tyrクランプがきわめて高い特異性を示すものと考えられた.
作製したリン酸化Tyrクランプのうち2つについては,標的となるペプチドとの共結晶構造を決定することに成功した(PDB ID:4JMG,4JMH).結晶構造から,リン酸化Tyrクランプは設計したとおり,リンカーをちょうつがいにSH2ドメインとFN3ドメインとがペプチドを二枚貝のようにはさみこむという特徴的な様式で標的となるペプチドを認識していることが確認された(図1b).さらに,Ptpn11のリン酸化Tyr580に対するリン酸化TyrクランプとShc1のリン酸化Tyr239/Tyr240に対するリン酸化Tyrクランプとで,リン酸化Tyrモチーフコア領域の認識の機構は共通していたものの,FN3ドメインと標的となるペプチドとのあいだの相互作用の様式は大きく異なっていた.これは,リン酸化Tyrクランプの高い特異性の獲得にFN3ドメインが寄与していることを示していた.
特定のリン酸化Tyrと特異的に相互作用する複数のリン酸化Tyrクランプを作製することに成功したので,Grb2のSH3ドメインはそのままに,SH2ドメインを3つのリン酸化Tyrクランプそれぞれにより置換することで,特定のリン酸化Tyrとのみ相互作用する3種類のGrb2変異体を作製した.これらのGrb2変異体をGrb2を欠失したマウスES細胞に導入し,リン酸化Tyrを介して内在性のパートナータンパク質と相互作用するかどうかを確認した.免疫沈降法によりGrb2変異体と共沈降してくるタンパク質を標的となるタンパク質に対する抗体を用いたウェスタンブロッティング法により検出した.その結果,作製したGrb2変異体はすべて野生型のGrb2と同等に内在性のパートナータンパク質と相互作用することがわかった.また,標的となるタンパク質のほか2種類のタンパク質に対する相互作用は,in vitroにおける特異性試験の結果と一致してほとんど検出されなかった.一方で,FN3ドメインとSH2ドメインの円順列変異体とを連結しただけでリン酸化Tyrとの相互作用部位を最適化していないものは,調べた3種類のタンパク質のいずれともほとんど相互作用しなかった.また,3種類のGrb2変異体は,Grb2のSH3ドメインと相互作用するSos1に対し野生型のGrb2と同じように相互作用することも確認された.すなわち,これらのGrb2変異体は,期待どおり,SH3ドメインの相互作用活性は保持したまま,内在性のタンパク質のもつ標的となるリン酸化Tyrと相互作用することが示された.
マウスのES細胞においては,分化が進行するまえのステージでのナイーブ状態からプライム状態への移行にGrb2シグナルが必要であることが知られている8).ナイーブ状態においてはそのマーカー遺伝子であるNanog遺伝子の発現が認められるが,プライム状態への移行にともないNanog遺伝子の発現の抑制およびDNAメチルトランスフェラーゼをコードするDnmt3b遺伝子の発現の上昇が認められるようになる.Grb2を欠失したマウスES細胞ではプライム状態の誘導は起こらず,マーカー遺伝子であるDnmt3b遺伝子の発現も認められない.Grb2を欠失したマウスES細胞にGrb2を再導入するとプライム状態の誘導が起こりDnmt3b遺伝子の発現も認められるようになる4).そこで,作製したGrb2変異体をGrb2を欠失したマウスES細胞に発現させ,野生型Grb2の機能を補完できるかどうかを調べることによりその機能について評価した.
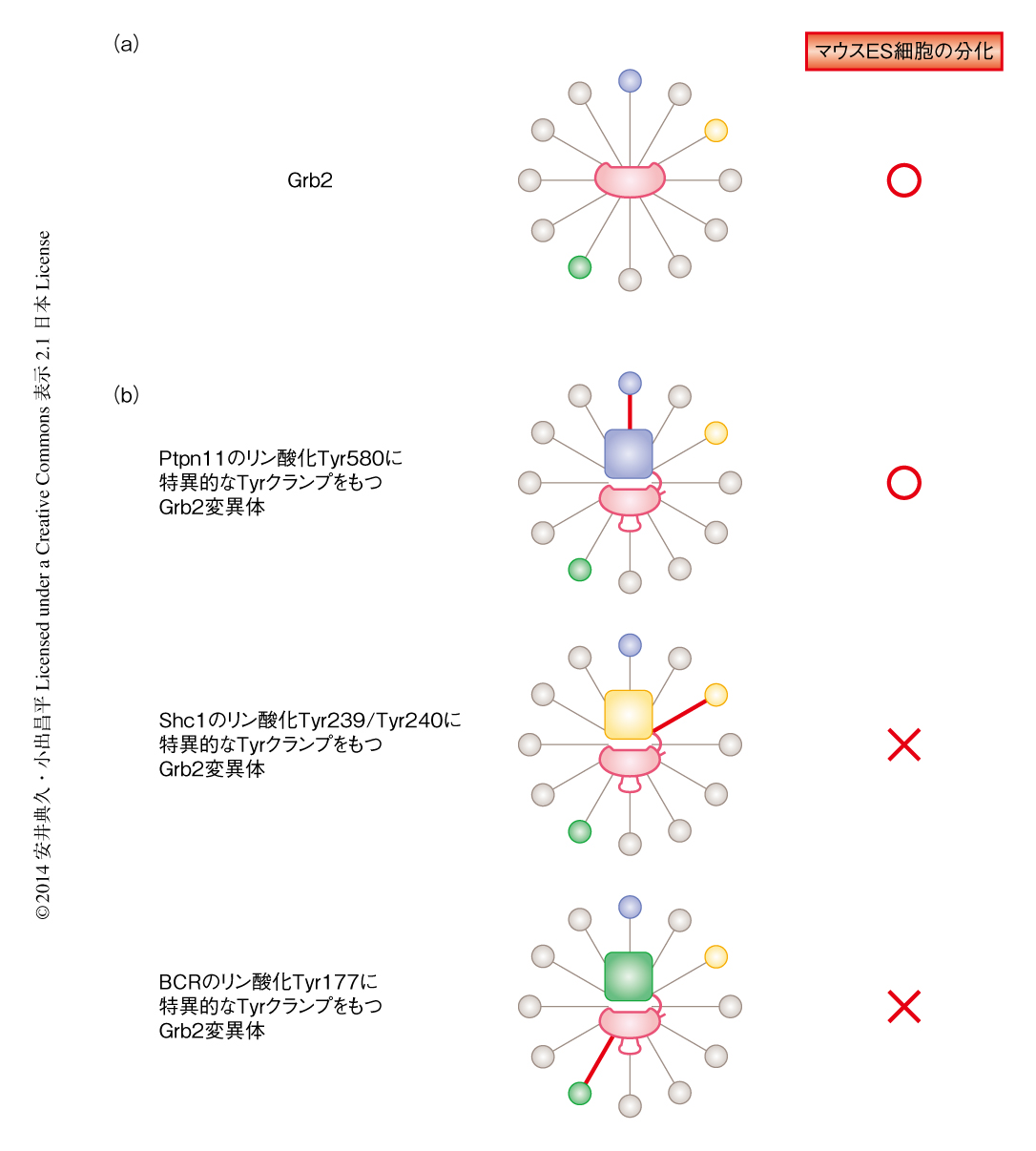
その結果,驚いたことに,チロシンホスファターゼであるPtpn11のリン酸化Tyr580に対し特異的なリン酸化TyrクランプをもつGrb2変異体を導入したところ,野生型Grb2と同様にマウスES細胞におけるNanog遺伝子の発現抑制とDnmt3b遺伝子の発現上昇が確認され,マウスES細胞のプライム状態への誘導を引き起こすことがわかった(図2).ほかの2つのGrb2変異体ではマウスES細胞の分化は誘導できなかった(図2).親和性を野生型Grb2と同じ程度に弱くしつつも特異性は維持したPtpn11のリン酸化Tyr580に特異的なリン酸化TyrクランプをもつGrb2変異体でも分化の誘導が起こった.これらのことより,Grb2によるマウスES細胞における分化の誘導は,多数のリン酸化Tyrとの相互作用を必要とするのではなく,チロシンホスファターゼPtpn11のリン酸化Tyr580との相互作用のみで十分であることが示唆された.
Ptpn11のリン酸化Tyr580に対し特異的なリン酸化TyrクランプをもつGrb2変異体について,マウスES細胞において相互作用するタンパク質を定量的な質量分析法により同定した.野生型のGrb2と比較して,SH3ドメインを介して相互作用するタンパク質は同じものがほとんど同じ量だけ検出された.一方,SH2ドメインを介して相互作用するタンパク質のプロファイルについては,野生型Grb2とPtpn11のリン酸化Tyr580に特異的なリン酸化TyrクランプをもつGrb2変異体とでは大きく異なっていた.野生型Grb2では,Ptpn11,Frs2,Shc1,Snx18とのタンパク質相互作用が検出されたのに対し,Ptpn11のリン酸化Tyr580に特異的なリン酸化TyrクランプをもつGrb2変異体においては,Ptpn11のみが相互作用するタンパク質として検出された.このことから,Ptpn11のリン酸化Tyr580に対し特異的なリン酸化TyrクランプをもつGrb2変異体によるマウスのES細胞における分化の誘導は,Ptpn11のリン酸化Tyr580との特異的な相互作用によりひき起こされることが示された.
この研究では,タンパク質相互作用の消失ではなく,特定のタンパク質相互作用のみを形成させ細胞におけるタンパク質間相互作用ネットワークを再構築することにより,生物機能の発現に重要なタンパク質間相互作用を同定する方法論を示し,この方法を“directed network wiring”として提唱した(図2).
タンパク質間相互作用により発揮される細胞における生命現象の解明をめざした研究はあまた存在するが,どういった手法を用いてどこまでを理解しようと考えるかは研究者個人のバックグラウンドや研究哲学に大きく左右されることと思う.今回,筆者らが報告したdirected network wiringは,要素を差し引くことにもとづく解析方法ではなく,特定の相互作用を“形成する”ことに立脚した解析方法である点ですぐれており,タンパク質工学者だからこそ達成できたアプローチであると自負している.この方法は,SH2ドメインとリン酸化Tyrモチーフとの相互作用にかぎらず,ほかのタンパク質間相互作用の機能の解明においても,従来の遺伝学的な方法を補完するものとして有用であると期待している.
略歴:2007年 大阪大学大学院理学研究科博士課程 修了,同年 大阪大学蛋白質研究所 特任研究員,同 助教,2010年 米国Chicago大学Research Associateを経て,2013年より岡山大学大学院医歯薬学総合研究科 助教.
研究テーマ:タンパク質の構造と分子機能.
抱負:機能の消失や要素を差し引くことにもとづいた研究手法からの脱却をめざしたい.
小出 昌平(Shohei Koide)
米国Chicago大学Professor.
研究室URL:http://koidelab.uchicago.edu/
© 2014 安井典久・小出昌平 Licensed under CC 表示 2.1 日本
(米国Chicago大学Department of Biochemistry and Molecular Biology)
email:安井典久,小出昌平
DOI: 10.7875/first.author.2014.090
Directed network wiring identifies a key protein interaction in embryonic stem cell differentiation.
Norihisa Yasui, Greg M. Findlay, Gerald D. Gish, Marilyn S. Hsiung, Jin Huang, Monika Tucholska, Lorne Taylor, Louis Smith, W. Clifford Boldridge, Akiko Koide, Tony Pawson, Shohei Koide
Molecular Cell, 54, 1034-1041 (2014)
要 約
細胞においては多数のタンパク質間相互作用が複雑なネットワークを形成し,さまざまな細胞機能の発現とその制御に関与している.その複雑さゆえ,ある細胞機能の制御にタンパク質間相互作用ネットワークの総体が必要であるのか,それとも,少数かつ特定のタンパク質間相互作用のみが関与しているのかを実証することは挑戦的な課題である.今回,筆者らは,多数のリン酸化Tyrモチーフと相互作用する細胞内アダプタータンパク質Grb2のSH2ドメインを研究対象としてとりあげ,特定のリン酸化Tyrモチーフとのみ相互作用するように改変したGrb2変異体を作製し,それらを利用することによりこの課題を解決した.数あるリン酸化Tyrモチーフのうち,チロシンホスファターゼであるPtpn11のもつ特定のリン酸化Tyrとの相互作用のみを再構築すれば,野生型のGrb2と同様にマウスのES細胞において原始内胚葉への分化を誘導できることが明らかになった.すなわち,特定の細胞機能の制御には,複雑なタンパク質間相互作用ネットワークのうちの,ごくかぎられたタンパク質間相互作用で十分であることが示唆された.
はじめに
細胞内シグナル伝達は多数のタンパク質間相互作用が動的に制御されることにより達成されている.なかでも,短いペプチドモチーフとそれを認識するタンパク質相互作用ドメインの関与する例は多く知られている1).タンパク質相互作用ドメインは標的とするペプチドモチーフに対し比較的低い親和性および広範な特異性を示すのが特徴であり,その結果,多数のタンパク質と相互作用する.そのため,あるタンパク質相互作用ドメインを中心としたタンパク質間相互作用ネットワークはきわめて複雑なものになる.リン酸化Tyrモチーフとそれを認識するSH2ドメインとの相互作用はその好例であり,それらのあいだの相互作用の特異性および親和性はともに比較的低いことが定量的な相互作用の解析により明らかにされている2).
SH2ドメインをもちタンパク質間相互作用ネットワークの中心として機能するタンパク質の代表として,細胞内アダプタータンパク質であるGrb2があげられる.Grb2は,リン酸化Tyrモチーフと相互作用するSH2ドメインにくわえ,それをはさみ2つのSH3ドメインをもつ.これまで,Grb2のSH2ドメインおよびSH3ドメインと相互作用するパートナータンパク質が多く同定されてきた3).一方で,マウスのES細胞が原始内胚葉に分化する段階においてGrb2は必須のタンパク質であり,SH2ドメインおよびSH3ドメインを介したタンパク質間相互作用が必要である.この分化の段階において,Grb2のSH2ドメインはリン酸化Tyrモチーフをもつ多数のタンパク質と相互作用することがわかっていた4).しかし,マウスES細胞の原始内胚葉への分化におけるGrb2のSH2ドメインと個々のリン酸化Tyrモチーフとのあいだの相互作用の役割についてはこれまで明らかではなかった.
ノックアウトやノックダウンといった従来の遺伝学的な手法は機能の消失にもとづいた方法であり,タンパク質の欠損や発現の減弱をともなうため,SH2ドメインだけではなく,SH3ドメインを介したものも含め多数のタンパク質間相互作用もなくなってしまう.リン酸化Tyrモチーフに変異を導入すると複数のSH2ドメインとの相互作用に影響をあたえる.結果として,既存の手法では特定のSH2ドメインと特定のリン酸化Tyrモチーフとの相互作用が機能的に重要であるのかどうかを解明することが不可能であった.この問題は,マウスES細胞の分化だけでなく,シグナル伝達ネットワークを理解するうえで本質的なものであるが,技術的な困難さからこれまでまったく明らかにされていなかった.
1.特定のリン酸化Tyrモチーフと特異的に相互作用するリン酸化Tyrクランプの作製
この問題を解決するためにはどのようなアプローチが有効なのだろうか? 特定のリン酸化Tyrモチーフと特異的に相互作用するように機能変換した人工タンパク質の作製とその利用により解決を試みた.まず,Grb2のもつSH2ドメインを単一のリン酸化Tyrモチーフと特異的に相互作用するよう機能改変することに取り組んだ.このとき,進化分子工学的な手法のひとつであるアフィニティクランプ技術を用いた5,6).この方法は,あるペプチドモチーフを認識するタンパク質相互作用ドメインをもとに,より大きな相互作用部位を構築することにより,ペプチドモチーフに対する親和性および特異性をタンパク質相互作用ドメインが単独の場合と比べ飛躍的に向上させるものである(図1a).
まず,リン酸化Tyrモチーフとの相互作用部位の近傍にFN3ドメインが配置されるよう,SH2ドメインの円順列変異体を設計した.ついで,SH2ドメイン円順列変異体のC末端にリンカー配列を介してFN3ドメインを連結した.FN3ドメインは人工結合タンパク質を構築するための分子骨格として多くの成果をあげている7).そして,FN3ドメインのアミノ酸配列を多様化したコンビナトリアルライブラリーの構築,および,酵母ディスプレイ法によるライブラリーの選別をへて,特定のリン酸化Tyrモチーフに対し高い親和性および特異性をもち認識するリン酸化Tyrクランプを作製した(図1a).
2.リン酸化Tyrクランプの特異性の発現における分子機構
3つのタンパク質のもつリン酸化Tyr,BCRのリン酸化Tyr177,Shc1のリン酸化Tyr239/Tyr240,Ptpn11のリン酸化Tyr580に対し,それぞれ特異的なリン酸化Tyrクランプを作製することに成功した.これら3つのリン酸化Tyrクランプは,標的となるリン酸化Tyrに対し野生型のGrb2のもつSH2ドメインと比べきわめて高い親和性および特異性を示した.
得られたリン酸化Tyrクランプについて,これらが標的となるリン酸化Tyrに対し高い特異性を示す分子機構について明らかにするため,標的となるペプチドに対しアラニンスキャニング法を行いリン酸化Tyrクランプとの相互作用に重要なアミノ酸残基を同定した.その結果,3つのリン酸化Tyrクランプに共通して標的となるペプチドのリン酸化Tyrモチーフコア領域のアミノ酸残基が重要であった一方で,まったく異なる位置のアミノ酸残基も相互作用に重要であることがわかった.たとえば,BCRのリン酸Tyr177に対するリン酸化Tyrクランプは,リン酸化Tyrモチーフコア領域を含む6残基にわたり標的となるペプチドを認識しており,そのためこのリン酸化Tyrクランプがきわめて高い特異性を示すものと考えられた.
作製したリン酸化Tyrクランプのうち2つについては,標的となるペプチドとの共結晶構造を決定することに成功した(PDB ID:4JMG,4JMH).結晶構造から,リン酸化Tyrクランプは設計したとおり,リンカーをちょうつがいにSH2ドメインとFN3ドメインとがペプチドを二枚貝のようにはさみこむという特徴的な様式で標的となるペプチドを認識していることが確認された(図1b).さらに,Ptpn11のリン酸化Tyr580に対するリン酸化TyrクランプとShc1のリン酸化Tyr239/Tyr240に対するリン酸化Tyrクランプとで,リン酸化Tyrモチーフコア領域の認識の機構は共通していたものの,FN3ドメインと標的となるペプチドとのあいだの相互作用の様式は大きく異なっていた.これは,リン酸化Tyrクランプの高い特異性の獲得にFN3ドメインが寄与していることを示していた.
3.リン酸化TyrクランプをもつGrb2変異体は細胞において特定のリン酸化Tyrと特異的に相互作用する
特定のリン酸化Tyrと特異的に相互作用する複数のリン酸化Tyrクランプを作製することに成功したので,Grb2のSH3ドメインはそのままに,SH2ドメインを3つのリン酸化Tyrクランプそれぞれにより置換することで,特定のリン酸化Tyrとのみ相互作用する3種類のGrb2変異体を作製した.これらのGrb2変異体をGrb2を欠失したマウスES細胞に導入し,リン酸化Tyrを介して内在性のパートナータンパク質と相互作用するかどうかを確認した.免疫沈降法によりGrb2変異体と共沈降してくるタンパク質を標的となるタンパク質に対する抗体を用いたウェスタンブロッティング法により検出した.その結果,作製したGrb2変異体はすべて野生型のGrb2と同等に内在性のパートナータンパク質と相互作用することがわかった.また,標的となるタンパク質のほか2種類のタンパク質に対する相互作用は,in vitroにおける特異性試験の結果と一致してほとんど検出されなかった.一方で,FN3ドメインとSH2ドメインの円順列変異体とを連結しただけでリン酸化Tyrとの相互作用部位を最適化していないものは,調べた3種類のタンパク質のいずれともほとんど相互作用しなかった.また,3種類のGrb2変異体は,Grb2のSH3ドメインと相互作用するSos1に対し野生型のGrb2と同じように相互作用することも確認された.すなわち,これらのGrb2変異体は,期待どおり,SH3ドメインの相互作用活性は保持したまま,内在性のタンパク質のもつ標的となるリン酸化Tyrと相互作用することが示された.
4.マウスのES細胞における原始内胚葉への分化はGrb2とPtpn11のリン酸化Tyr580との相互作用により誘導される
マウスのES細胞においては,分化が進行するまえのステージでのナイーブ状態からプライム状態への移行にGrb2シグナルが必要であることが知られている8).ナイーブ状態においてはそのマーカー遺伝子であるNanog遺伝子の発現が認められるが,プライム状態への移行にともないNanog遺伝子の発現の抑制およびDNAメチルトランスフェラーゼをコードするDnmt3b遺伝子の発現の上昇が認められるようになる.Grb2を欠失したマウスES細胞ではプライム状態の誘導は起こらず,マーカー遺伝子であるDnmt3b遺伝子の発現も認められない.Grb2を欠失したマウスES細胞にGrb2を再導入するとプライム状態の誘導が起こりDnmt3b遺伝子の発現も認められるようになる4).そこで,作製したGrb2変異体をGrb2を欠失したマウスES細胞に発現させ,野生型Grb2の機能を補完できるかどうかを調べることによりその機能について評価した.
その結果,驚いたことに,チロシンホスファターゼであるPtpn11のリン酸化Tyr580に対し特異的なリン酸化TyrクランプをもつGrb2変異体を導入したところ,野生型Grb2と同様にマウスES細胞におけるNanog遺伝子の発現抑制とDnmt3b遺伝子の発現上昇が確認され,マウスES細胞のプライム状態への誘導を引き起こすことがわかった(図2).ほかの2つのGrb2変異体ではマウスES細胞の分化は誘導できなかった(図2).親和性を野生型Grb2と同じ程度に弱くしつつも特異性は維持したPtpn11のリン酸化Tyr580に特異的なリン酸化TyrクランプをもつGrb2変異体でも分化の誘導が起こった.これらのことより,Grb2によるマウスES細胞における分化の誘導は,多数のリン酸化Tyrとの相互作用を必要とするのではなく,チロシンホスファターゼPtpn11のリン酸化Tyr580との相互作用のみで十分であることが示唆された.
5.Ptpn11のリン酸化Tyr580に特異的なリン酸化TyrクランプをもつGrb2変異体と相互作用するタンパク質の同定
Ptpn11のリン酸化Tyr580に対し特異的なリン酸化TyrクランプをもつGrb2変異体について,マウスES細胞において相互作用するタンパク質を定量的な質量分析法により同定した.野生型のGrb2と比較して,SH3ドメインを介して相互作用するタンパク質は同じものがほとんど同じ量だけ検出された.一方,SH2ドメインを介して相互作用するタンパク質のプロファイルについては,野生型Grb2とPtpn11のリン酸化Tyr580に特異的なリン酸化TyrクランプをもつGrb2変異体とでは大きく異なっていた.野生型Grb2では,Ptpn11,Frs2,Shc1,Snx18とのタンパク質相互作用が検出されたのに対し,Ptpn11のリン酸化Tyr580に特異的なリン酸化TyrクランプをもつGrb2変異体においては,Ptpn11のみが相互作用するタンパク質として検出された.このことから,Ptpn11のリン酸化Tyr580に対し特異的なリン酸化TyrクランプをもつGrb2変異体によるマウスのES細胞における分化の誘導は,Ptpn11のリン酸化Tyr580との特異的な相互作用によりひき起こされることが示された.
おわりに
この研究では,タンパク質相互作用の消失ではなく,特定のタンパク質相互作用のみを形成させ細胞におけるタンパク質間相互作用ネットワークを再構築することにより,生物機能の発現に重要なタンパク質間相互作用を同定する方法論を示し,この方法を“directed network wiring”として提唱した(図2).
タンパク質間相互作用により発揮される細胞における生命現象の解明をめざした研究はあまた存在するが,どういった手法を用いてどこまでを理解しようと考えるかは研究者個人のバックグラウンドや研究哲学に大きく左右されることと思う.今回,筆者らが報告したdirected network wiringは,要素を差し引くことにもとづく解析方法ではなく,特定の相互作用を“形成する”ことに立脚した解析方法である点ですぐれており,タンパク質工学者だからこそ達成できたアプローチであると自負している.この方法は,SH2ドメインとリン酸化Tyrモチーフとの相互作用にかぎらず,ほかのタンパク質間相互作用の機能の解明においても,従来の遺伝学的な方法を補完するものとして有用であると期待している.
文 献
- Pawson, T. & Nash, P.: Assembly of cell regulatory systems through protein interaction domains. Science, 300, 445-452 (2003)[PubMed]
- Machida, K., Thompson, C. M., Dierck, K. et al.: High-throughput phosphotyrosine profiling using SH2 domains. Mol. Cell, 26, 899-915 (2007)[PubMed]
- Bisson, N., James, D. A., Ivosev, G. et al.: Selected reaction monitoring mass spectrometry reveals the dynamics of signaling through the GRB2 adaptor. Nat. Biotechnol., 29, 653-658 (2011)[PubMed]
- Findlay, G. M., Smith, M. J., Lanner, F. et al.: Interaction domains of Sos1/Grb2 are finely tuned for cooperative control of embryonic stem cell fate. Cell, 152, 1008-1020 (2013)[PubMed]
- Huang, J., Koide, A., Makabe, K. et al.: Design of protein function leaps by directed domain interface evolution. Proc. Natl. Acad. Sci. USA, 105, 6578-6583 (2008)[PubMed]
- Koide, S. & Huang, J.: Generation of high-performance binding proteins for peptide motifs by affinity clamping. Methods Enzymol., 523, 285-302 (2013)[PubMed]
- Sha, F., Gencer, E. B., Georgeon, S. et al.: Dissection of the BCR-ABL signaling network using highly specific monobody inhibitors to the SHP2 SH2 domains. Proc. Natl. Acad. Sci. USA, 110, 14924-14929 (2013)[PubMed]
- Chazaud, C., Yamanaka, Y., Pawson, T. et al.: Early lineage segregation between epiblast and primitive endoderm in mouse blastocysts through the Grb2-MAPK pathway. Dev. Cell, 10, 615-624 (2006)[PubMed]
著者プロフィール
略歴:2007年 大阪大学大学院理学研究科博士課程 修了,同年 大阪大学蛋白質研究所 特任研究員,同 助教,2010年 米国Chicago大学Research Associateを経て,2013年より岡山大学大学院医歯薬学総合研究科 助教.
研究テーマ:タンパク質の構造と分子機能.
抱負:機能の消失や要素を差し引くことにもとづいた研究手法からの脱却をめざしたい.
小出 昌平(Shohei Koide)
米国Chicago大学Professor.
研究室URL:http://koidelab.uchicago.edu/
© 2014 安井典久・小出昌平 Licensed under CC 表示 2.1 日本