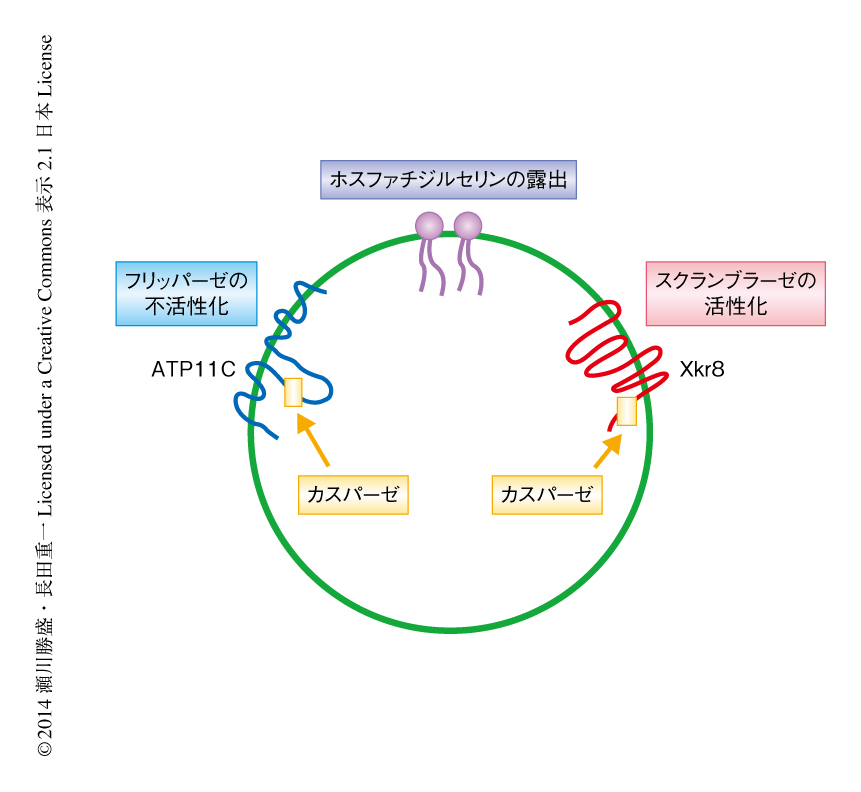
カスパーゼによるフリッパーゼの不活性化を介したホスファチジルセリンの露出
瀬川勝盛・長田重一
(京都大学大学院医学研究科 医化学分野)
email:瀬川勝盛,長田重一
DOI: 10.7875/first.author.2014.087
Caspase-mediated cleavage of phospholipid flippase for apoptotic phosphatidylserine exposure.
Katsumori Segawa, Sachiko Kurata, Yuichi Yanagihashi, Thijn R. Brummelkamp, Fumihiko Matsuda, Shigekazu Nagata
Science, 344, 1164-1168 (2014)
真核生物の細胞膜においてリン脂質は非対称に維持されている.このリン脂質の非対称的な分布は,ホスファチジルセリンなどのアミノリン脂質を細胞質側に輸送する酵素であるフリッパーゼにより維持されていると考えられている.一方,細胞がアポトーシスにおちいるとリン脂質の非対称的な分布が崩壊し,ホスファチジルセリンが細胞の表面に露出することにより食細胞に貪食される.筆者らは,ヒト1倍体細胞を用いたスクリーニング法により,細胞膜におけるフリッパーゼ活性の責任タンパク質としてATP11CおよびCDC50Aを同定した.ATP11Cは細胞膜において強いフリッパーゼ活性を示し,アポトーシスの際にカスパーゼにより切断され不活性化した.カスパーゼにより切断されないATP11C変異体を発現した細胞は,アポトーシスの際にホスファチジルセリンを露出せずマクロファージに貪食されなかった.一方,CDC50Aを欠損した細胞は細胞膜におけるフリッパーゼ活性がみられず,アポトーシスを起こすことなく細胞の表面にホスファチジルセリンを露出しマクロファージに貪食された.以上より,細胞膜におけるフリッパーゼの活性制御がホスファチジルセリンの細胞の表面への露出および貪食に重要であることが明らかになった.
真核生物のもつ細胞膜はリン脂質二重膜から構成され,リン脂質が非対称に分布している1).つまり,アミノ基を含んだホスファチジルセリンは細胞質側に配置され,細胞外側には分布しない.このホスファチジルセリンの非対称的な分布にはフリッパーゼとよばれるアミノリン脂質を細胞質側に輸送する酵素が関与していると想定されている2).一方,アポトーシスを起こした細胞ではホスファチジルセリンの非対称的な分布が崩壊し,本来は細胞質側に存在するホスファチジルセリンが細胞の表面に露出する.このホスファチジルセリンを認識することにより,食細胞は生きた細胞を貪食せず特異的にアポトーシスを起こした細胞を貪食すると考えられている3).しかしながら,ホスファチジルセリンが生きた細胞の細胞膜においてどのように非対称的に維持され,アポトーシスを起こした細胞ではどのように露出するのか,その分子機構は不明である.さらに,ホスファチジルセリンの露出がそれ単独で食細胞による貪食を誘導できるのかという問題については,いまだ明確な証拠が得られていない.そこで,筆者らは,生きた細胞あるいはアポトーシスを起こした細胞の細胞膜におけるホスファチジルセリンの分布を制御する機構,および,その制御機構が貪食に及ぼす影響について解析した.
これまで,フリッパーゼとしてP4型ATPaseファミリーとよばれる大きなファミリーを形成する10回膜貫通タンパク質が提唱されている2).しかしながら,その局在や機能については不明な部分も多く,とくに,哺乳類細胞の細胞膜において機能するフリッパーゼについては明快な答えが得られていなかった.そこで,細胞膜においてはたらくフリッパーゼを網羅的に探索することにした.スクリーニングには,ヒトの1倍体細胞を用いた遺伝子トラップスクリーニング法を用いた4).KBM7細胞は慢性骨髄性白血病の患者に由来する細胞株で,第8染色体を除くすべての染色体が1倍体である5).このKBM7細胞に遺伝子トラップベクターを組み込んだレトロウイルスを感染させることにより,ヒトの遺伝子を無作為に欠損させた細胞集団から機能スクリーニングを行うことが可能になる.
KBM7細胞は蛍光標識したホスファチジルセリンをすみやかに細胞質側に取り込んだことから,細胞膜において機能するフリッパーゼを発現していることが確かめられた.ついで,KBM7細胞に遺伝子トラップベクターを組み込んだレトロウイルスを濃縮感染させ,変異細胞集団を作製した.この変異細胞集団に蛍光標識したホスファチジルセリンを添加し,下位1%程度のホスファチジルセリンの取り込みが減少した細胞をフローサイトメトリーにより回収した.回収した細胞を培養し,再度,蛍光標識したホスファチジルセリンを添加し,その取り込みが減少した細胞をフローサイトメトリーにより回収した.このようにして,ホスファチジルセリンの取り込みが減少した細胞集団を濃縮することに成功し,LF(low-flipping)細胞と名づけた.次世代シークエンサーを用いてLF細胞におけるウイルスの挿入位置を網羅的に解析した結果,P4型ATPaseファミリーのメンバーのひとつであるATP11C,および,P4型ATPaseファミリーのメンバーのサブユニットとして知られているCDC50Aの遺伝子座において多数の挿入が確認された.
ATP11Cを欠損したKBM7細胞はフリッパーゼ活性が親株の20%程度にまで減弱していた.しかし,このATP11C欠損細胞は細胞質側の細胞膜にホスファチジルセリンを維持しており,リン脂質の非対称的な分布が維持されていた.KBM7細胞はATP11CのほかにもいくつかのP4型ATPaseファミリーのメンバーを発現しており,そのなかのフリッパーゼ活性をもつメンバーによりホスファチジルセリンの非対称的な分布が維持されていたものと考えられた.一方,CDC50Aを欠損したKBM7細胞はフリッパーゼ活性が親株の5%程度にまで減弱していた.興味深いことに,このCDC50A欠損細胞は細胞の表面にホスファチジルセリンを露出し,その露出はアポトーシスを起こした細胞と同じ程度の強いものであった.つまり,CDC50Aを欠損したKBM7細胞ではホスファチジルセリンの非対称的な分布が崩壊していた.
これらの現象がほかの細胞でもみられるかどうかを,マウスのT細胞株であるW3細胞において確認した.CRISPR/Cas系を用いて6),野生型のATP11Cを欠損したW3細胞を樹立した.このATP11C欠損W3細胞はフリッパーゼ活性が親株の15%程度にまで減少していたが,細胞の表面にホスファチジルセリンを露出していなかった.一方,野生型のCDC50Aを欠損したW3細胞はフリッパーゼ活性が親株の5%程度にまで減少し,細胞の表面にホスファチジルセリンを露出していた.以上より,KBM7細胞と同様の表現型がW3細胞においても確認された.
これまで,P4型ATPaseファミリーのメンバーはさまざまな細胞内局在を示し,その局在場所においてリン脂質を輸送することが提唱されてきた2).また,いくつかのP4型ATPaseはCDC50Aと結合することにより小胞体から輸送されることが報告されていた7-9).実際,CDC50A欠損細胞ではATP11Cが細胞膜に局在できないことが確認された.以上より,ATP11Cは細胞膜においてはたらくホスファチジルセリンに対する主要なフリッパーゼであり,CDC50AはATP11Cを含むいくつかのフリッパーゼをそれぞれ適切な局在場所に輸送することにより細胞膜におけるホスファチジルセリンの非対称的な分布を維持していると考えられた.
アポトーシスを起こした細胞の細胞膜においては,非特異的なリン脂質を双方向に輸送する活性であるスクランブラーゼ活性の上昇およびフリッパーゼ活性の低下が起こることが知られていたが10),その分子機構は不明であった.2013年,筆者らの研究室において,アポトーシスを起こした細胞におけるスクランブラーゼ活性の責任タンパク質としてXkr8を同定した11)(新着論文レビュー でも掲載).Xkr8を欠損した細胞はアポトーシスの際にスクランブラーゼ活性が上昇せずホスファチジルセリンを露出できない11).この発見により,ながらく不明であったスクランブラーゼ活性の分子実体が明らかになった.しかしながら,アポトーシスの際のフリッパーゼ活性の低下の機構,および,その意義は依然として不明であった.そこで,細胞膜におけるフリッパーゼであるATP11Cがアポトーシスの際にどのような制御をうけるか調べた.
W3細胞にFasリガンドを添加すると,すみやかにアポトーシスがひき起される.この過程で,ATP11Cがすみやかに切断されることが見い出された.この切断はカスパーゼ阻害剤により完全に消失したことから,ATP11Cはカスパーゼにより切断されることが示唆された.ヒトのATP11Cにカスパーゼ認識配列が存在するかどうかを予測アルゴリズムCascleave(http://sunflower.kuicr.kyoto-u.ac.jp/~sjn/Cascleave/)を用いて解析したところ,細胞質内ループに3つの認識部位の存在が予測された.これら3つのカスパーゼ認識部位は進化の過程でよく保存されており,実際,これらの認識部位に変異を導入したATP11Cはアポトーシスの過程で切断されなかった.したがって,ATP11Cは細胞質内ループにある3つのカスパーゼ認識部位を介してアポトーシスの際に切断されることが明らかになった.
これらのカスパーゼ認識部位に変異を導入したATP11Cのフリッパーゼ活性は野生型のATP11Cと同じ程度であったことから,このATP11C変異体を用いてカスパーゼによるATP11Cの切断がアポトーシスの際のホスファチジルセリンの露出にどのような影響をあたえるか解析した.野生型のATP11Cを発現させたW3細胞はアポトーシスの際にすみやかにホスファチジルセリンを細胞の表面に露出しマクロファージに貪食された.しかし,カスパーゼに抵抗性のATP11Cを発現したW3細胞はアポトーシスの際にもホスファチジルセリンを細胞の表面に露出せずマクロファージに貪食されなかった.カスパーゼ抵抗性ATP11C変異体の発現はアポトーシスの際のカスパーゼの活性化およびスクランブラーゼの活性化に影響をあたえなかったことから,ATP11Cの切断がホスファチジルセリンの露出に直接的に影響していることが示唆された.以上より,カスパーゼによるATP11Cの切断による不活性化は,アポトーシスの際のホスファチジルセリンの細胞の表面への露出および貪食に必須であると結論した.
ホスファチジルセリンを露出する生きた細胞がマクロファージにより貪食されるかどうかを検討した.CDC50Aを欠損したW3細胞とマウスの腹腔から得たマクロファージとを共培養し,蛍光顕微鏡を用いタイムラプスイメージング法により観察したところ,培養液のなかを動き回る生きた細胞がマクロファージにより,細胞の表面に露出したホスファチジルセリンに依存して貪食されるようすが確認された.貪食された細胞を電子顕微鏡を用いて観察したところ,アポトーシスを起こして凝縮した核をもつ細胞とは異なる形態の細胞が貪食されていた.また,一部の貪食された細胞がマクロファージの内部から脱出するという現象を見い出した.この現象はアポトーシスを起こした細胞の貪食ではみられない興味深い現象であり,生きた細胞の貪食を特徴づけるものであった.以上より,ホスファチジルセリンの細胞の表面への露出はそれ単独で貪食を誘導できる,貪食の十分条件であると結論づけた.
この研究,および,筆者らの研究室における以前の報告により11),アポトーシスを起こした細胞におけるホスファチジルセリンの露出の概要が明らかになった.アポトーシスを起こした細胞はすみやかにカスパーゼを活性化し,活性化したカスパーゼがXkr8を切断することによりリン脂質のスクランブラーゼ活性を“オン”に,同時に,ATP11Cを切断することによりフリッパーゼ活性を“オフ”にする.この両者がホスファチジルセリンのすみやかな露出に必須であることがわかった(図1).今後は,これらのタンパク質が単独でフリッパーゼ活性あるいはスクランブラーゼ活性を担っているのか,あるいは,ほかのタンパク質と大きな複合体を形成しているかを明らかにする必要があろう.
略歴:2009年 大阪大学大学院生命機能研究科 修了,同年 京都大学大学院医学研究科 研究員を経て,2011年より同 助教
研究テーマ:細胞膜におけるリン脂質の非対称性の分布の分子機構と,その生理的および病態的な意義.
関心事:次世代シークエンサーを用いた機能スクリーニング系の開発とその応用.
長田 重一(Shigekazu Nagata)
京都大学大学院医学研究科 教授.
研究室URL:http://www2.mfour.med.kyoto-u.ac.jp/~nagata/index.html
© 2014 瀬川勝盛・長田重一 Licensed under CC 表示 2.1 日本
(京都大学大学院医学研究科 医化学分野)
email:瀬川勝盛,長田重一
DOI: 10.7875/first.author.2014.087
Caspase-mediated cleavage of phospholipid flippase for apoptotic phosphatidylserine exposure.
Katsumori Segawa, Sachiko Kurata, Yuichi Yanagihashi, Thijn R. Brummelkamp, Fumihiko Matsuda, Shigekazu Nagata
Science, 344, 1164-1168 (2014)
要 約
真核生物の細胞膜においてリン脂質は非対称に維持されている.このリン脂質の非対称的な分布は,ホスファチジルセリンなどのアミノリン脂質を細胞質側に輸送する酵素であるフリッパーゼにより維持されていると考えられている.一方,細胞がアポトーシスにおちいるとリン脂質の非対称的な分布が崩壊し,ホスファチジルセリンが細胞の表面に露出することにより食細胞に貪食される.筆者らは,ヒト1倍体細胞を用いたスクリーニング法により,細胞膜におけるフリッパーゼ活性の責任タンパク質としてATP11CおよびCDC50Aを同定した.ATP11Cは細胞膜において強いフリッパーゼ活性を示し,アポトーシスの際にカスパーゼにより切断され不活性化した.カスパーゼにより切断されないATP11C変異体を発現した細胞は,アポトーシスの際にホスファチジルセリンを露出せずマクロファージに貪食されなかった.一方,CDC50Aを欠損した細胞は細胞膜におけるフリッパーゼ活性がみられず,アポトーシスを起こすことなく細胞の表面にホスファチジルセリンを露出しマクロファージに貪食された.以上より,細胞膜におけるフリッパーゼの活性制御がホスファチジルセリンの細胞の表面への露出および貪食に重要であることが明らかになった.
はじめに
真核生物のもつ細胞膜はリン脂質二重膜から構成され,リン脂質が非対称に分布している1).つまり,アミノ基を含んだホスファチジルセリンは細胞質側に配置され,細胞外側には分布しない.このホスファチジルセリンの非対称的な分布にはフリッパーゼとよばれるアミノリン脂質を細胞質側に輸送する酵素が関与していると想定されている2).一方,アポトーシスを起こした細胞ではホスファチジルセリンの非対称的な分布が崩壊し,本来は細胞質側に存在するホスファチジルセリンが細胞の表面に露出する.このホスファチジルセリンを認識することにより,食細胞は生きた細胞を貪食せず特異的にアポトーシスを起こした細胞を貪食すると考えられている3).しかしながら,ホスファチジルセリンが生きた細胞の細胞膜においてどのように非対称的に維持され,アポトーシスを起こした細胞ではどのように露出するのか,その分子機構は不明である.さらに,ホスファチジルセリンの露出がそれ単独で食細胞による貪食を誘導できるのかという問題については,いまだ明確な証拠が得られていない.そこで,筆者らは,生きた細胞あるいはアポトーシスを起こした細胞の細胞膜におけるホスファチジルセリンの分布を制御する機構,および,その制御機構が貪食に及ぼす影響について解析した.
1.細胞膜において機能するフリッパーゼのスクリーニング
これまで,フリッパーゼとしてP4型ATPaseファミリーとよばれる大きなファミリーを形成する10回膜貫通タンパク質が提唱されている2).しかしながら,その局在や機能については不明な部分も多く,とくに,哺乳類細胞の細胞膜において機能するフリッパーゼについては明快な答えが得られていなかった.そこで,細胞膜においてはたらくフリッパーゼを網羅的に探索することにした.スクリーニングには,ヒトの1倍体細胞を用いた遺伝子トラップスクリーニング法を用いた4).KBM7細胞は慢性骨髄性白血病の患者に由来する細胞株で,第8染色体を除くすべての染色体が1倍体である5).このKBM7細胞に遺伝子トラップベクターを組み込んだレトロウイルスを感染させることにより,ヒトの遺伝子を無作為に欠損させた細胞集団から機能スクリーニングを行うことが可能になる.
KBM7細胞は蛍光標識したホスファチジルセリンをすみやかに細胞質側に取り込んだことから,細胞膜において機能するフリッパーゼを発現していることが確かめられた.ついで,KBM7細胞に遺伝子トラップベクターを組み込んだレトロウイルスを濃縮感染させ,変異細胞集団を作製した.この変異細胞集団に蛍光標識したホスファチジルセリンを添加し,下位1%程度のホスファチジルセリンの取り込みが減少した細胞をフローサイトメトリーにより回収した.回収した細胞を培養し,再度,蛍光標識したホスファチジルセリンを添加し,その取り込みが減少した細胞をフローサイトメトリーにより回収した.このようにして,ホスファチジルセリンの取り込みが減少した細胞集団を濃縮することに成功し,LF(low-flipping)細胞と名づけた.次世代シークエンサーを用いてLF細胞におけるウイルスの挿入位置を網羅的に解析した結果,P4型ATPaseファミリーのメンバーのひとつであるATP11C,および,P4型ATPaseファミリーのメンバーのサブユニットとして知られているCDC50Aの遺伝子座において多数の挿入が確認された.
2.ATP11CおよびCDC50Aによる細胞膜におけるフリッパーゼ活性
ATP11Cを欠損したKBM7細胞はフリッパーゼ活性が親株の20%程度にまで減弱していた.しかし,このATP11C欠損細胞は細胞質側の細胞膜にホスファチジルセリンを維持しており,リン脂質の非対称的な分布が維持されていた.KBM7細胞はATP11CのほかにもいくつかのP4型ATPaseファミリーのメンバーを発現しており,そのなかのフリッパーゼ活性をもつメンバーによりホスファチジルセリンの非対称的な分布が維持されていたものと考えられた.一方,CDC50Aを欠損したKBM7細胞はフリッパーゼ活性が親株の5%程度にまで減弱していた.興味深いことに,このCDC50A欠損細胞は細胞の表面にホスファチジルセリンを露出し,その露出はアポトーシスを起こした細胞と同じ程度の強いものであった.つまり,CDC50Aを欠損したKBM7細胞ではホスファチジルセリンの非対称的な分布が崩壊していた.
これらの現象がほかの細胞でもみられるかどうかを,マウスのT細胞株であるW3細胞において確認した.CRISPR/Cas系を用いて6),野生型のATP11Cを欠損したW3細胞を樹立した.このATP11C欠損W3細胞はフリッパーゼ活性が親株の15%程度にまで減少していたが,細胞の表面にホスファチジルセリンを露出していなかった.一方,野生型のCDC50Aを欠損したW3細胞はフリッパーゼ活性が親株の5%程度にまで減少し,細胞の表面にホスファチジルセリンを露出していた.以上より,KBM7細胞と同様の表現型がW3細胞においても確認された.
これまで,P4型ATPaseファミリーのメンバーはさまざまな細胞内局在を示し,その局在場所においてリン脂質を輸送することが提唱されてきた2).また,いくつかのP4型ATPaseはCDC50Aと結合することにより小胞体から輸送されることが報告されていた7-9).実際,CDC50A欠損細胞ではATP11Cが細胞膜に局在できないことが確認された.以上より,ATP11Cは細胞膜においてはたらくホスファチジルセリンに対する主要なフリッパーゼであり,CDC50AはATP11Cを含むいくつかのフリッパーゼをそれぞれ適切な局在場所に輸送することにより細胞膜におけるホスファチジルセリンの非対称的な分布を維持していると考えられた.
3.アポトーシスの際のATP11Cの切断による不活性化
アポトーシスを起こした細胞の細胞膜においては,非特異的なリン脂質を双方向に輸送する活性であるスクランブラーゼ活性の上昇およびフリッパーゼ活性の低下が起こることが知られていたが10),その分子機構は不明であった.2013年,筆者らの研究室において,アポトーシスを起こした細胞におけるスクランブラーゼ活性の責任タンパク質としてXkr8を同定した11)(新着論文レビュー でも掲載).Xkr8を欠損した細胞はアポトーシスの際にスクランブラーゼ活性が上昇せずホスファチジルセリンを露出できない11).この発見により,ながらく不明であったスクランブラーゼ活性の分子実体が明らかになった.しかしながら,アポトーシスの際のフリッパーゼ活性の低下の機構,および,その意義は依然として不明であった.そこで,細胞膜におけるフリッパーゼであるATP11Cがアポトーシスの際にどのような制御をうけるか調べた.
W3細胞にFasリガンドを添加すると,すみやかにアポトーシスがひき起される.この過程で,ATP11Cがすみやかに切断されることが見い出された.この切断はカスパーゼ阻害剤により完全に消失したことから,ATP11Cはカスパーゼにより切断されることが示唆された.ヒトのATP11Cにカスパーゼ認識配列が存在するかどうかを予測アルゴリズムCascleave(http://sunflower.kuicr.kyoto-u.ac.jp/~sjn/Cascleave/)を用いて解析したところ,細胞質内ループに3つの認識部位の存在が予測された.これら3つのカスパーゼ認識部位は進化の過程でよく保存されており,実際,これらの認識部位に変異を導入したATP11Cはアポトーシスの過程で切断されなかった.したがって,ATP11Cは細胞質内ループにある3つのカスパーゼ認識部位を介してアポトーシスの際に切断されることが明らかになった.
これらのカスパーゼ認識部位に変異を導入したATP11Cのフリッパーゼ活性は野生型のATP11Cと同じ程度であったことから,このATP11C変異体を用いてカスパーゼによるATP11Cの切断がアポトーシスの際のホスファチジルセリンの露出にどのような影響をあたえるか解析した.野生型のATP11Cを発現させたW3細胞はアポトーシスの際にすみやかにホスファチジルセリンを細胞の表面に露出しマクロファージに貪食された.しかし,カスパーゼに抵抗性のATP11Cを発現したW3細胞はアポトーシスの際にもホスファチジルセリンを細胞の表面に露出せずマクロファージに貪食されなかった.カスパーゼ抵抗性ATP11C変異体の発現はアポトーシスの際のカスパーゼの活性化およびスクランブラーゼの活性化に影響をあたえなかったことから,ATP11Cの切断がホスファチジルセリンの露出に直接的に影響していることが示唆された.以上より,カスパーゼによるATP11Cの切断による不活性化は,アポトーシスの際のホスファチジルセリンの細胞の表面への露出および貪食に必須であると結論した.
4.ホスファチジルセリンを露出する生きた細胞の貪食
ホスファチジルセリンを露出する生きた細胞がマクロファージにより貪食されるかどうかを検討した.CDC50Aを欠損したW3細胞とマウスの腹腔から得たマクロファージとを共培養し,蛍光顕微鏡を用いタイムラプスイメージング法により観察したところ,培養液のなかを動き回る生きた細胞がマクロファージにより,細胞の表面に露出したホスファチジルセリンに依存して貪食されるようすが確認された.貪食された細胞を電子顕微鏡を用いて観察したところ,アポトーシスを起こして凝縮した核をもつ細胞とは異なる形態の細胞が貪食されていた.また,一部の貪食された細胞がマクロファージの内部から脱出するという現象を見い出した.この現象はアポトーシスを起こした細胞の貪食ではみられない興味深い現象であり,生きた細胞の貪食を特徴づけるものであった.以上より,ホスファチジルセリンの細胞の表面への露出はそれ単独で貪食を誘導できる,貪食の十分条件であると結論づけた.
おわりに
この研究,および,筆者らの研究室における以前の報告により11),アポトーシスを起こした細胞におけるホスファチジルセリンの露出の概要が明らかになった.アポトーシスを起こした細胞はすみやかにカスパーゼを活性化し,活性化したカスパーゼがXkr8を切断することによりリン脂質のスクランブラーゼ活性を“オン”に,同時に,ATP11Cを切断することによりフリッパーゼ活性を“オフ”にする.この両者がホスファチジルセリンのすみやかな露出に必須であることがわかった(図1).今後は,これらのタンパク質が単独でフリッパーゼ活性あるいはスクランブラーゼ活性を担っているのか,あるいは,ほかのタンパク質と大きな複合体を形成しているかを明らかにする必要があろう.
文 献
- Leventis, P. A. & Grinstein S.: The distribution and function of phosphatidylserine in cellular membranes. Annu. Rev. Biophys., 39, 407-427 (2010)[PubMed]
- Tanaka, K., Fujimura-Kamada, K. & Yamamoto, T.: Functions of phospholipid flippases. J. Biochem., 149, 131-143 (2011)[PubMed]
- Nagata, S., Hanayama, R. & Kawane, K.: Autoimmunity and the clearance of dead cells. Cell, 140, 619-630 (2010)[PubMed]
- Carette, J. E., Guimaraes, C. P., Varadarajan, M. et al.: Haploid genetic screens in human cells identify host factors used by pathogens. Science, 326, 1231-1235 (2009)[PubMed]
- Kotecki, M., Reddy, P. S. & Cochran, B. H.: Isolation and characterization of a near-haploid human cell line. Exp. Cell Res., 252, 273-280 (1999)[PubMed]
- Cong, L., Ran, F. A., Cox, D. et al.: Multiplex genome engineering using CRISPR/Cas systems. Science, 339, 819-823 (2013)[PubMed]
- Saito, K., Fujimura-Kamada, K., Furuta, N. et al.: Cdc50p, a protein required for polarized growth, associates with the Drs2p P-type ATPase implicated in phospholipid translocation in Saccharomyces cerevisiae. Mol. Biol. Cell, 15, 3418-3432 (2004)[PubMed]
- Takatsu, H., Baba, K., Shima, T. et al.: ATP9B, a P4-ATPase (a putative aminophospholipid translocase), localizes to the trans-Golgi network in a CDC50 protein-independent manner. J. Biol. Chem., 286, 38159-38167 (2011)[PubMed]
- Coleman, J. A., Quazi, F. & Molday, R. S.: Mammalian P4-ATPases and ABC transporters and their role in phospholipid transport. Biochim. Biophys. Acta, 1831, 555-574 (2013)[PubMed]
- Verhoven, B., Schlegel, R. A. & Williamson, P.: Mechanisms of phosphatidylserine exposure, a phagocyte recognition signal, on apoptotic T lymphocytes. J. Exp. Med., 182, 1597-1601 (1995)[PubMed]
- Suzuki, J., Denning, D. P., Imanishi, E. et al.: Xk-related protein 8 and CED-8 promote phosphatidylserine exposure in apoptotic cells. Science, 341, 403-406 (2013)[PubMed] [新着論文レビュー]
著者プロフィール
略歴:2009年 大阪大学大学院生命機能研究科 修了,同年 京都大学大学院医学研究科 研究員を経て,2011年より同 助教
研究テーマ:細胞膜におけるリン脂質の非対称性の分布の分子機構と,その生理的および病態的な意義.
関心事:次世代シークエンサーを用いた機能スクリーニング系の開発とその応用.
長田 重一(Shigekazu Nagata)
京都大学大学院医学研究科 教授.
研究室URL:http://www2.mfour.med.kyoto-u.ac.jp/~nagata/index.html
© 2014 瀬川勝盛・長田重一 Licensed under CC 表示 2.1 日本