胎児型の横紋筋肉腫におけるMYOD1遺伝子の変異はPI3K-AKT経路の変異と協調して臨床的な悪性群を規定する
高阪真路・Marc Ladanyi
(米国Memorial Sloan Kettering Cancer Center,Department of Pathology)
email:高阪真路
DOI: 10.7875/first.author.2014.074
A recurrent neomorphic mutation in MYOD1 defines a clinically aggressive subset of embryonal rhabdomyosarcoma associated with PI3K-AKT pathway mutations.
Shinji Kohsaka, Neerav Shukla, Nabahet Ameur, Tatsuo Ito, Charlotte K. Y. Ng, Lu Wang, Diana Lim, Angela Marchetti, Agnes Viale, Mono Pirun, Nicholas D. Socci, Li-Xuan Qin, Raf Sciot, Julia Bridge, Samuel Singer, Paul Meyers, Leonard H. Wexler, Frederic G. Barr, Snjezana Dogan, Jonathan A. Fletcher, Jorge S. Reis-Filho, Marc Ladanyi
Nature Genetics, 46, 595-600 (2014)
横紋筋肉腫は骨格筋系の細胞の性質をもつ腫瘍であり,小児の軟部肉腫のなかでもっとも多く発生する.胞巣型と胎児型とに大きく分類され,胞巣型では転座によるPAX3-FOXO1融合遺伝子あるいはPAX7-FOXO1融合遺伝子の形成が筋原性の終末分化を阻害することが知られているが,胎児型においては同様の遺伝学的な変化は発見されていない.筆者らは,全エキソームの塩基配列の決定により,胎児型の横紋筋肉腫において筋原性の転写因子であるMYOD1の122番目のLeuがArgに置換した体細胞変異を発見し,この変異をもつ症例は予後が不良であること,また,PI3K-AKT経路の変異を頻繁に併発することを見い出した.この変異型MYOD1は,過去の変異誘導実験において,野生型MYOD1の機能を阻害しMYC認識配列に結合して分化の誘導から増殖への切り替えをひき起こすことが示唆されていたが,筆者らによる機能の解析はこの予想を確定した.MYOD1の122番目のLeuのArgへの変異は横紋筋肉腫における悪性群を規定するため,今後,この高リスク群に対する治療の個別化および分子標的治療法の確立がもとめられる.
肉腫は間葉系細胞を起源とする腫瘍であり,これまで正確な組織診断が困難であったが,近年,組織に特異的な染色体の転座からキメラ遺伝子変異が発見され,がん化の分子機構が明らかになりつつある1).横紋筋肉腫は,その全体の2/3は10歳未満の子どもに発生し,転移をともなう場合には5年生存率が30%にみたない予後の悪い疾患である.全体の約70%をしめる胎児型と約20%をしめる胞巣型とに大きく分類され,胞巣型では転座によるPAX3-FOXO1融合遺伝子あるいはPAX7-FOXO1融合遺伝子の形成が筋原性の終末分化を阻害することが知られている.一方で,胎児型においては過去に第11染色体短腕15の機能欠失型変異,および,RAS遺伝子,FGFR4遺伝子,PIK3CA遺伝子の活性化変異が報告されたが,いずれも臨床的に明らかなサブセットを規定する変異ではなかった2-5).
20例(胞巣型9例と胎児型11例)の横紋筋肉腫において全エキソームの塩基配列を決定し,8例(胞巣型2例と胎児型6例)において全トランスクリプトームの塩基配列を決定した.患者の診断のときの年齢は,胞巣型で1~25歳,胎児型で1~21歳であった.胎児型2例にて,MYOD1遺伝子において365番目のTのGへの点変異が認められ,その産物MYOD1において122番目のLeuのArgへの置換をひき起こすことが判明した.2例とも原発腫瘍から得た検体であり,正常な組織から得た検体においては変異が認められなかったため,体細胞変異であることが示された.全トランスクリプトーム塩基配列の決定は変異をもつ2例のうち1例のみ実施されたが,変異型の対立遺伝子が高度に発現していることが確認された.MYOD1は塩基性HLH型の転写因子であり,HLHドメインはその二量体化に,塩基性ドメインはDNAとの結合に寄与する6).122番目のLeuのArgへの変異は塩基性ドメインに位置し,すべての筋原性の塩基性HLH型の転写因子においてこのLeuはよく保存されており,一方で,MYCファミリーに属する塩基性HLH型の転写因子においてこの部位はArgである.
特筆すべきことに,MYOD1の122番目のLeuのArgへの変異は20年以上まえに実験的に作製されており,この変異がMYOD1にMYC様の悪性形質を付加するかどうかが検討され,変異型MYOD1はMYOD1認識配列に結合するが,野生型のMYOD1と競合してMYOD1の標的となる遺伝子の発現を誘導せず,一方で,MYC認識配列に結合してMYCの標的となる遺伝子の発現制御を混乱させる可能性が示され,このMYOD1の転写活性の欠失による分化の抑制とMYC様の形質による増殖の活性化が横紋筋肉腫の発がんの鍵になると仮定されていた7).
この変異の発生率をさらにくわしく検討するため,93例の胎児型の横紋筋肉腫を追加し,質量分析法にもとづく遺伝子タイピングを施行したところ,8例において同様の変異が確認され,全体で約10%の症例(104例中10例)にこの変異の認められることが判明した.全25例の胞巣型の横紋筋肉腫においてはMYOD1遺伝子に変異は認められなかった.また,ほかの筋原性の塩基性HLH型の転写因子におけるLeuの変異について101例の胎児型の横紋筋肉腫を検査したが,いずれにも変異は認められなかった.
MYOD1の変異をもつ症例は細胞密度が高く,紡錘形細胞を散見し,免疫染色によりMYOD1染色の強陽性像がみられ,病理学的に胎児型の横紋筋肉腫における紡錘形細胞亜型と重なる症例8) がみられた.注目すべきことに,この変異をもつ10例のうち9例は青年から成人期において診断されており,頭頸部に好発し,女性に多かった.さらに,この変異をもつ患者の生命予後は変異をもたない患者に比べ有意に不良であった.
過去の機能解析では,122番目のLeuがArgに置換した変異型MYOD1はMYOD1認識配列およびMYC認識配列と結合し遺伝子発現を制御することが示された7).このデータを拡大するため,筋原性の細胞分化に対するこの変異型MYOD1の影響について評価した.マウスの筋芽細胞であるC2C12細胞に野生型のMYOD1,変異型MYOD1,MYCを導入し,筋肉への分化が誘導される条件での培養における形態学的な変化を比較した.野生型MYOD1を導入した細胞では分化指数の上昇および筋肉細胞の融合が観察されたが,変異型MYOD1を導入した細胞ではこれらはみられなかった.過去の報告と一致して9),MYCの導入により筋肉の分化は制限され筋肉細胞の融合は高度に抑制された.野生型MYOD1を導入した細胞では細胞増殖の低下が観察されたが,変異型MYOD1を導入した細胞では細胞増殖に変化はみられなかった.軟寒天培地における足場に非依存性な増殖能の検討において,変異型MYOD1を導入した細胞ではコロニー数が増加したが,コロニーの大きさはMYCを導入した細胞に比べ小さかった.通常の培地での培養における同様の実験では,筋原性の細胞分化は野生型MYOD1を導入した細胞でのみ観察された.
過去に筆者らは,胎児型の横紋筋肉腫60例のうち3例においてPIK3CA遺伝子の変異を同定した2).驚くべきことに,その3例はいずれもMYOD1の122番目のLeuのArgへの変異をもち,このMYOD1の変異とPIK3CA遺伝子の変異とのあいだには相関があった.さらに,MYOD1の変異をもつ症例2例においてPTEN遺伝子が欠損しており,PI3K-AKT経路との関連が考えられた.
これらの変異の協調作用を評価するため,1047番目のHisがArgに置換した変異型PIK3CA,および,122番目のLeuがArgに置換した変異型MYOD1をC2C12細胞に導入し,その影響を判定した.この変異型PIK3CAはそれ自体が分化指数および融合指数を低下させたが,野生型MYOD1を導入した細胞ではそれらの変化はみられず,一方で,変異型MYOD1を導入した細胞において筋原性の細胞分化は完全に抑制された.変異型PIK3CAの導入により細胞増殖は上昇したが,軟寒天培地におけるコロニーの形成は変異型PIK3CAを導入した細胞および変異型MYOD1を導入した細胞において増加した.
変異型PIK3CAと変異型MYOD1とのin vivoにおける協調作用を腫瘍の移植により判定した.変異型PIK3CAあるいは変異型MYOD1の単独での導入においてもin vivoにおけるC2C12細胞の増殖は亢進したが,変異型PIK3CAおよび変異型MYOD1を導入した細胞ではより急速に増大する巨大な腫瘍が形成された.この二重変異をもつ腫瘍は胎児型の横紋筋肉腫の特徴を模倣しており,核におけるMYOD1の強陽性像がみられ,核分裂像がめだち,核に高度の異型がみられた.
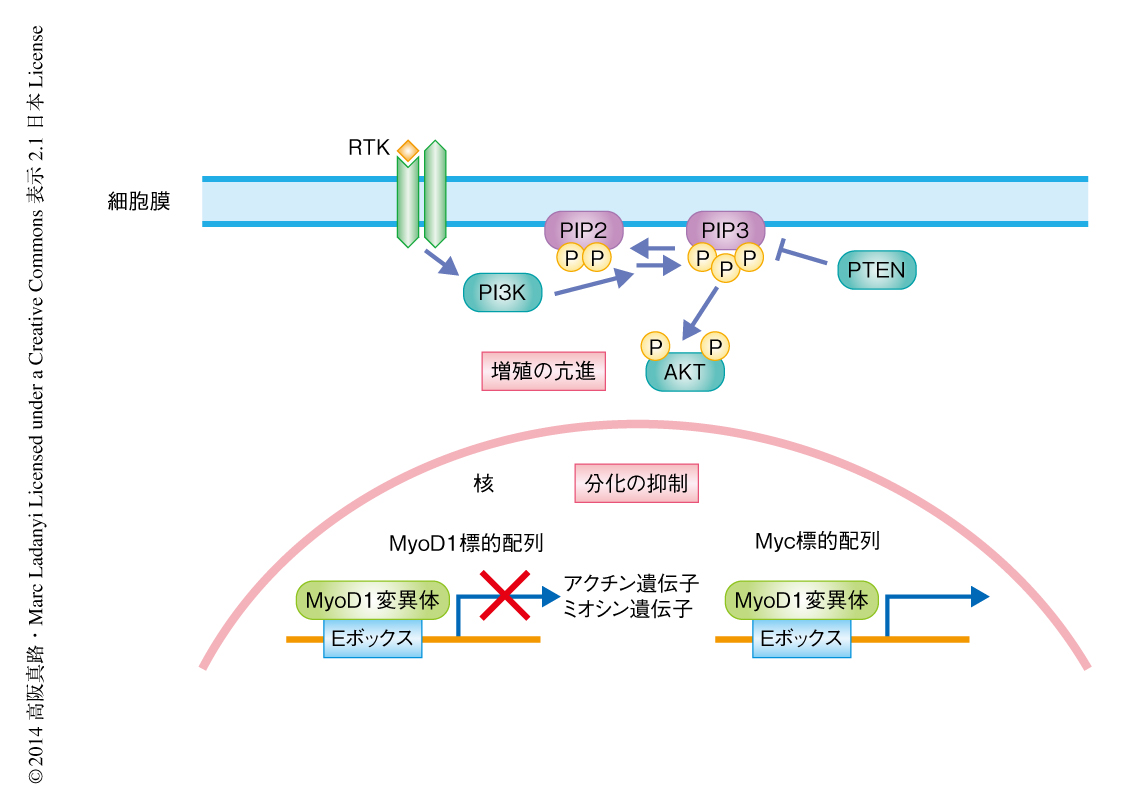
122番目のLeuがArgに置換した変異型MYOD1の転写因子として機能を検討するため,野生型のMYOD1,変異型MYOD1,MYCを細胞に導入し遺伝子発現の変化を比較した.C2C12細胞において,変異型MYOD1を導入した細胞およびMYCを導入した細胞において発現上昇あるいは発現低下のみられた遺伝子の数は,変異型MYOD1を導入した細胞および野生型MYODを導入した細胞において発現上昇あるいは発現低下のみられた遺伝子の数に比べ,有意に多かった.ヒトの正常な線維芽細胞であるBJ細胞において,変異型MYOD1を導入した細胞およびMYCを導入した細胞において発現低下のみられた遺伝子の数は,変異型MYOD1を導入した細胞および野生型MYODを導入した細胞において発現低下のみられた遺伝子の数に比べ有意に多かったが,発現上昇に関しては有意な差はなかった.目的変数なしの階層的クラスタリングにおいて,変異型MYOD1を導入したC2C12細胞における遺伝子の発現は,MYCを導入した細胞あるいは野生型MYODを導入した細胞における遺伝子の発現とは独立したクラスターを形成し,BJ細胞において,変異型MYOD1を導入した細胞における遺伝子の発現はMYCを導入した細胞における遺伝子の発現と近いクラスターを形成し,対照となる細胞における遺伝子の発現と野生型MYOD1を導入した細胞における遺伝子の発現は近いクラスターを形成した.筋肉の分化にかかわる遺伝子の発現を解析したところ,野生型MYOD1を導入した細胞においては発現上昇,変異型MYOD1を導入した細胞では発現低下が認められ,変異型MYOD1のもつ分化の抑制のはたらきと一致した.さらに,遺伝子の発現をGSEA(gene set enrichment analysis)法により解析したところ,MYCの標的となる遺伝子が変異型MYOD1を導入したC2C12細胞において有意に濃縮されていることが判明した.以上の結果は,過去のゲルシフト法やプロモーター解析によるデータと一致し,122番目のLeuがArgに置換した変異型MYOD1は新しい形質を獲得してMYC認識配列に結合し遺伝子発現を制御することが示された(図1).
胎児型の横紋筋肉腫において第11染色体短腕15の機能欠失型変異が頻繁に生じることが報告されており,実際に,機能欠失型変異の解析,および,遺伝子型の決定における野生型と変異型との比較においても,MYOD1遺伝子に変異をもつ10例のうち5例に野生型の対立遺伝子の欠失が示唆された.これは一方で,胎児型の横紋筋肉腫において野生型MYOD1の欠失は必ずしも必要ないことを意味した.このことから,3つの筋原性の遺伝子,Myh1遺伝子,Acta1遺伝子,Myog遺伝子に対する変異型MYOD1のドミナントネガティブな効果について,等量の野生型MYOD1および変異型MYOD1を導入することにより評価した.興味深いことに,Myh1遺伝子,Acta1遺伝子,Myog遺伝子の発現は野生型MYOD1および変異型MYOD1を導入した場合,野生型MYOD1を単独で導入した場合に比べ,それぞれ84%,61%,84%の発現低下が認められた.これは,野生型MYOD1の存在下においても変異型MYOD1は標的とする筋原性遺伝子の発現を非比例性に抑制したことを意味し,この変異型MYOD1のドミナントネガティブな効果を示唆した.
MYOD1はヒストン修飾酵素をリクルートし,ヒストンH3の4番目のLysのモノメチル化およびヒストンH3の27番目のLysのアセチル化を上昇させることにより,筋肉の分化を促進させることが知られている10).クロマチン免疫沈降法により,3つの筋管細胞に特異的な遺伝子,Mly1遺伝子,Myl2遺伝子,Casq2遺伝子において,122番目のLeuがArgに置換した変異型MYOD1を導入した細胞ではヒストンH3の27番目のLysがトリメチル化およびヒストンH3の4番目のLysがモノメチル化したプロモーター領域へのMYOD1の結合が増加したのに対し,野生型MYOD1を導入した細胞ではMYOD1の結合はみられなかった.さらに,クロマチン免疫沈降-塩基配列決定法により,野生型MYOD1により特異的に上昇する99の遺伝子のヒストン修飾について解析したところ,変異型MYOD1を導入した細胞のみ,ヒストンH3の27番目のLysのトリメチル化およびヒストンH3の4番目のLysのモノメチル化の有意な上昇が確認された.MYCの標的となる遺伝子11) におけるヒストン修飾について解析したところ,ヒストンH3の4番目のLysのトリメチル化は,野生型MYOD1あるいは変異型MYOD1のいずれを導入した細胞においても上昇したが,変異型MYOD1を導入した細胞においては野生型MYOD1を導入した細胞に比べ有意に強力なMYOD1の結合が認められた.これにより,ヒストン修飾の解析においても,122番目のLeuがArgに置換した変異型MYOD1がMYC様の転写活性をもつことが示唆された.
胎児型の横紋筋肉腫においては,過去に第11染色体腕15の機能欠失型変異,および,RAS遺伝子,FGFR4遺伝子,PIK3CA遺伝子の活性化変異が報告されていたが,いずれも臨床的に明らかなサブセットを規定する変異ではなかった.それに対し,122番目のLeuがArgに置換した変異型MYOD1は青年から成人期の患者に発症し,頭頸部に好発し,紡錘形細胞亜型に重なる特徴をもち,生命予後は不良である,という臨床的な悪性群を規定する.じつは,予後不良なのは胎児型より胞巣型において特徴的であり,もうひとつの胞巣型との類似点として,PAX-FOXO1融合遺伝子は筋芽細胞においてMYOD1の標的となる遺伝子の発現を抑制し分化を停止させることがある.筋肉の分化におけるさまざまな過程は4つの筋原性のタンパク質が順序だてて活性化されることにより制御されており,PAX-FOXO1融合遺伝子や変異型MYOD1はこの分化プログラムをMYOD1の段階で阻害する役割を担っているようだ.PIK3CA遺伝子の変異は全体の約5%とあまり一般的ではないが,MYOD1の変異をもつ症例において有意に大きな割合をしめることが見い出され,ほかの症例においてPTEN遺伝子の欠損も認められた.最近,ほかの小児腫瘍である神経芽細胞腫において,MYCNの増幅がクロム親和性細胞の分化を阻害し,ALKの活性化が増殖シグナルの恒常的な活性化をもたらすことが報告されたが12),胎児型の横紋筋肉腫においても同様に,変異型MYOD1が筋原性の分化の誘導を阻害し,PI3K-AKT経路の活性化が増殖シグナルを恒常化し発がんに寄与すると予想された(図1).MYOD1の122番目のLeuのArgへの変異は横紋筋肉腫の臨床的な悪性群を規定するため,今後,この高リスク群に対する治療の個別化および分子標的治療法の確立がもとめられる.
略歴:2011年 北海道大学大学院医学研究科博士課程 修了,2012年より米国Memorial Sloan Kettering Cancer Centerポスドク.
研究テーマ:肉腫における分子標的治療法の確立.
抱負:医師として苦しんでいる患者の助けになる研究をしていきたい.
Marc Ladanyi
米国Memorial Sloan Kettering Cancer CenterにてActing Chief.
研究室URL:http://www.mskcc.org/research/lab/marc-ladanyi
© 2014 高阪真路・Marc Ladanyi Licensed under CC 表示 2.1 日本
(米国Memorial Sloan Kettering Cancer Center,Department of Pathology)
email:高阪真路
DOI: 10.7875/first.author.2014.074
A recurrent neomorphic mutation in MYOD1 defines a clinically aggressive subset of embryonal rhabdomyosarcoma associated with PI3K-AKT pathway mutations.
Shinji Kohsaka, Neerav Shukla, Nabahet Ameur, Tatsuo Ito, Charlotte K. Y. Ng, Lu Wang, Diana Lim, Angela Marchetti, Agnes Viale, Mono Pirun, Nicholas D. Socci, Li-Xuan Qin, Raf Sciot, Julia Bridge, Samuel Singer, Paul Meyers, Leonard H. Wexler, Frederic G. Barr, Snjezana Dogan, Jonathan A. Fletcher, Jorge S. Reis-Filho, Marc Ladanyi
Nature Genetics, 46, 595-600 (2014)
要 約
横紋筋肉腫は骨格筋系の細胞の性質をもつ腫瘍であり,小児の軟部肉腫のなかでもっとも多く発生する.胞巣型と胎児型とに大きく分類され,胞巣型では転座によるPAX3-FOXO1融合遺伝子あるいはPAX7-FOXO1融合遺伝子の形成が筋原性の終末分化を阻害することが知られているが,胎児型においては同様の遺伝学的な変化は発見されていない.筆者らは,全エキソームの塩基配列の決定により,胎児型の横紋筋肉腫において筋原性の転写因子であるMYOD1の122番目のLeuがArgに置換した体細胞変異を発見し,この変異をもつ症例は予後が不良であること,また,PI3K-AKT経路の変異を頻繁に併発することを見い出した.この変異型MYOD1は,過去の変異誘導実験において,野生型MYOD1の機能を阻害しMYC認識配列に結合して分化の誘導から増殖への切り替えをひき起こすことが示唆されていたが,筆者らによる機能の解析はこの予想を確定した.MYOD1の122番目のLeuのArgへの変異は横紋筋肉腫における悪性群を規定するため,今後,この高リスク群に対する治療の個別化および分子標的治療法の確立がもとめられる.
はじめに
肉腫は間葉系細胞を起源とする腫瘍であり,これまで正確な組織診断が困難であったが,近年,組織に特異的な染色体の転座からキメラ遺伝子変異が発見され,がん化の分子機構が明らかになりつつある1).横紋筋肉腫は,その全体の2/3は10歳未満の子どもに発生し,転移をともなう場合には5年生存率が30%にみたない予後の悪い疾患である.全体の約70%をしめる胎児型と約20%をしめる胞巣型とに大きく分類され,胞巣型では転座によるPAX3-FOXO1融合遺伝子あるいはPAX7-FOXO1融合遺伝子の形成が筋原性の終末分化を阻害することが知られている.一方で,胎児型においては過去に第11染色体短腕15の機能欠失型変異,および,RAS遺伝子,FGFR4遺伝子,PIK3CA遺伝子の活性化変異が報告されたが,いずれも臨床的に明らかなサブセットを規定する変異ではなかった2-5).
1.約10%の胎児型の横紋筋肉腫においてMYOD1の122番目のLeuのArgへの変異が認められる
20例(胞巣型9例と胎児型11例)の横紋筋肉腫において全エキソームの塩基配列を決定し,8例(胞巣型2例と胎児型6例)において全トランスクリプトームの塩基配列を決定した.患者の診断のときの年齢は,胞巣型で1~25歳,胎児型で1~21歳であった.胎児型2例にて,MYOD1遺伝子において365番目のTのGへの点変異が認められ,その産物MYOD1において122番目のLeuのArgへの置換をひき起こすことが判明した.2例とも原発腫瘍から得た検体であり,正常な組織から得た検体においては変異が認められなかったため,体細胞変異であることが示された.全トランスクリプトーム塩基配列の決定は変異をもつ2例のうち1例のみ実施されたが,変異型の対立遺伝子が高度に発現していることが確認された.MYOD1は塩基性HLH型の転写因子であり,HLHドメインはその二量体化に,塩基性ドメインはDNAとの結合に寄与する6).122番目のLeuのArgへの変異は塩基性ドメインに位置し,すべての筋原性の塩基性HLH型の転写因子においてこのLeuはよく保存されており,一方で,MYCファミリーに属する塩基性HLH型の転写因子においてこの部位はArgである.
特筆すべきことに,MYOD1の122番目のLeuのArgへの変異は20年以上まえに実験的に作製されており,この変異がMYOD1にMYC様の悪性形質を付加するかどうかが検討され,変異型MYOD1はMYOD1認識配列に結合するが,野生型のMYOD1と競合してMYOD1の標的となる遺伝子の発現を誘導せず,一方で,MYC認識配列に結合してMYCの標的となる遺伝子の発現制御を混乱させる可能性が示され,このMYOD1の転写活性の欠失による分化の抑制とMYC様の形質による増殖の活性化が横紋筋肉腫の発がんの鍵になると仮定されていた7).
この変異の発生率をさらにくわしく検討するため,93例の胎児型の横紋筋肉腫を追加し,質量分析法にもとづく遺伝子タイピングを施行したところ,8例において同様の変異が確認され,全体で約10%の症例(104例中10例)にこの変異の認められることが判明した.全25例の胞巣型の横紋筋肉腫においてはMYOD1遺伝子に変異は認められなかった.また,ほかの筋原性の塩基性HLH型の転写因子におけるLeuの変異について101例の胎児型の横紋筋肉腫を検査したが,いずれにも変異は認められなかった.
2.MYOD1の変異をもつ症例の臨床病理学的な特徴
MYOD1の変異をもつ症例は細胞密度が高く,紡錘形細胞を散見し,免疫染色によりMYOD1染色の強陽性像がみられ,病理学的に胎児型の横紋筋肉腫における紡錘形細胞亜型と重なる症例8) がみられた.注目すべきことに,この変異をもつ10例のうち9例は青年から成人期において診断されており,頭頸部に好発し,女性に多かった.さらに,この変異をもつ患者の生命予後は変異をもたない患者に比べ有意に不良であった.
3.筋原性の細胞分化および細胞増殖に対する変異型MYOD1の影響
過去の機能解析では,122番目のLeuがArgに置換した変異型MYOD1はMYOD1認識配列およびMYC認識配列と結合し遺伝子発現を制御することが示された7).このデータを拡大するため,筋原性の細胞分化に対するこの変異型MYOD1の影響について評価した.マウスの筋芽細胞であるC2C12細胞に野生型のMYOD1,変異型MYOD1,MYCを導入し,筋肉への分化が誘導される条件での培養における形態学的な変化を比較した.野生型MYOD1を導入した細胞では分化指数の上昇および筋肉細胞の融合が観察されたが,変異型MYOD1を導入した細胞ではこれらはみられなかった.過去の報告と一致して9),MYCの導入により筋肉の分化は制限され筋肉細胞の融合は高度に抑制された.野生型MYOD1を導入した細胞では細胞増殖の低下が観察されたが,変異型MYOD1を導入した細胞では細胞増殖に変化はみられなかった.軟寒天培地における足場に非依存性な増殖能の検討において,変異型MYOD1を導入した細胞ではコロニー数が増加したが,コロニーの大きさはMYCを導入した細胞に比べ小さかった.通常の培地での培養における同様の実験では,筋原性の細胞分化は野生型MYOD1を導入した細胞でのみ観察された.
4.MYOD1遺伝子の変異とPIK3CA遺伝子の変異との協調
過去に筆者らは,胎児型の横紋筋肉腫60例のうち3例においてPIK3CA遺伝子の変異を同定した2).驚くべきことに,その3例はいずれもMYOD1の122番目のLeuのArgへの変異をもち,このMYOD1の変異とPIK3CA遺伝子の変異とのあいだには相関があった.さらに,MYOD1の変異をもつ症例2例においてPTEN遺伝子が欠損しており,PI3K-AKT経路との関連が考えられた.
これらの変異の協調作用を評価するため,1047番目のHisがArgに置換した変異型PIK3CA,および,122番目のLeuがArgに置換した変異型MYOD1をC2C12細胞に導入し,その影響を判定した.この変異型PIK3CAはそれ自体が分化指数および融合指数を低下させたが,野生型MYOD1を導入した細胞ではそれらの変化はみられず,一方で,変異型MYOD1を導入した細胞において筋原性の細胞分化は完全に抑制された.変異型PIK3CAの導入により細胞増殖は上昇したが,軟寒天培地におけるコロニーの形成は変異型PIK3CAを導入した細胞および変異型MYOD1を導入した細胞において増加した.
変異型PIK3CAと変異型MYOD1とのin vivoにおける協調作用を腫瘍の移植により判定した.変異型PIK3CAあるいは変異型MYOD1の単独での導入においてもin vivoにおけるC2C12細胞の増殖は亢進したが,変異型PIK3CAおよび変異型MYOD1を導入した細胞ではより急速に増大する巨大な腫瘍が形成された.この二重変異をもつ腫瘍は胎児型の横紋筋肉腫の特徴を模倣しており,核におけるMYOD1の強陽性像がみられ,核分裂像がめだち,核に高度の異型がみられた.
5.変異型MYOD1は異常な転写因子として機能する
122番目のLeuがArgに置換した変異型MYOD1の転写因子として機能を検討するため,野生型のMYOD1,変異型MYOD1,MYCを細胞に導入し遺伝子発現の変化を比較した.C2C12細胞において,変異型MYOD1を導入した細胞およびMYCを導入した細胞において発現上昇あるいは発現低下のみられた遺伝子の数は,変異型MYOD1を導入した細胞および野生型MYODを導入した細胞において発現上昇あるいは発現低下のみられた遺伝子の数に比べ,有意に多かった.ヒトの正常な線維芽細胞であるBJ細胞において,変異型MYOD1を導入した細胞およびMYCを導入した細胞において発現低下のみられた遺伝子の数は,変異型MYOD1を導入した細胞および野生型MYODを導入した細胞において発現低下のみられた遺伝子の数に比べ有意に多かったが,発現上昇に関しては有意な差はなかった.目的変数なしの階層的クラスタリングにおいて,変異型MYOD1を導入したC2C12細胞における遺伝子の発現は,MYCを導入した細胞あるいは野生型MYODを導入した細胞における遺伝子の発現とは独立したクラスターを形成し,BJ細胞において,変異型MYOD1を導入した細胞における遺伝子の発現はMYCを導入した細胞における遺伝子の発現と近いクラスターを形成し,対照となる細胞における遺伝子の発現と野生型MYOD1を導入した細胞における遺伝子の発現は近いクラスターを形成した.筋肉の分化にかかわる遺伝子の発現を解析したところ,野生型MYOD1を導入した細胞においては発現上昇,変異型MYOD1を導入した細胞では発現低下が認められ,変異型MYOD1のもつ分化の抑制のはたらきと一致した.さらに,遺伝子の発現をGSEA(gene set enrichment analysis)法により解析したところ,MYCの標的となる遺伝子が変異型MYOD1を導入したC2C12細胞において有意に濃縮されていることが判明した.以上の結果は,過去のゲルシフト法やプロモーター解析によるデータと一致し,122番目のLeuがArgに置換した変異型MYOD1は新しい形質を獲得してMYC認識配列に結合し遺伝子発現を制御することが示された(図1).
胎児型の横紋筋肉腫において第11染色体短腕15の機能欠失型変異が頻繁に生じることが報告されており,実際に,機能欠失型変異の解析,および,遺伝子型の決定における野生型と変異型との比較においても,MYOD1遺伝子に変異をもつ10例のうち5例に野生型の対立遺伝子の欠失が示唆された.これは一方で,胎児型の横紋筋肉腫において野生型MYOD1の欠失は必ずしも必要ないことを意味した.このことから,3つの筋原性の遺伝子,Myh1遺伝子,Acta1遺伝子,Myog遺伝子に対する変異型MYOD1のドミナントネガティブな効果について,等量の野生型MYOD1および変異型MYOD1を導入することにより評価した.興味深いことに,Myh1遺伝子,Acta1遺伝子,Myog遺伝子の発現は野生型MYOD1および変異型MYOD1を導入した場合,野生型MYOD1を単独で導入した場合に比べ,それぞれ84%,61%,84%の発現低下が認められた.これは,野生型MYOD1の存在下においても変異型MYOD1は標的とする筋原性遺伝子の発現を非比例性に抑制したことを意味し,この変異型MYOD1のドミナントネガティブな効果を示唆した.
MYOD1はヒストン修飾酵素をリクルートし,ヒストンH3の4番目のLysのモノメチル化およびヒストンH3の27番目のLysのアセチル化を上昇させることにより,筋肉の分化を促進させることが知られている10).クロマチン免疫沈降法により,3つの筋管細胞に特異的な遺伝子,Mly1遺伝子,Myl2遺伝子,Casq2遺伝子において,122番目のLeuがArgに置換した変異型MYOD1を導入した細胞ではヒストンH3の27番目のLysがトリメチル化およびヒストンH3の4番目のLysがモノメチル化したプロモーター領域へのMYOD1の結合が増加したのに対し,野生型MYOD1を導入した細胞ではMYOD1の結合はみられなかった.さらに,クロマチン免疫沈降-塩基配列決定法により,野生型MYOD1により特異的に上昇する99の遺伝子のヒストン修飾について解析したところ,変異型MYOD1を導入した細胞のみ,ヒストンH3の27番目のLysのトリメチル化およびヒストンH3の4番目のLysのモノメチル化の有意な上昇が確認された.MYCの標的となる遺伝子11) におけるヒストン修飾について解析したところ,ヒストンH3の4番目のLysのトリメチル化は,野生型MYOD1あるいは変異型MYOD1のいずれを導入した細胞においても上昇したが,変異型MYOD1を導入した細胞においては野生型MYOD1を導入した細胞に比べ有意に強力なMYOD1の結合が認められた.これにより,ヒストン修飾の解析においても,122番目のLeuがArgに置換した変異型MYOD1がMYC様の転写活性をもつことが示唆された.
おわりに
胎児型の横紋筋肉腫においては,過去に第11染色体腕15の機能欠失型変異,および,RAS遺伝子,FGFR4遺伝子,PIK3CA遺伝子の活性化変異が報告されていたが,いずれも臨床的に明らかなサブセットを規定する変異ではなかった.それに対し,122番目のLeuがArgに置換した変異型MYOD1は青年から成人期の患者に発症し,頭頸部に好発し,紡錘形細胞亜型に重なる特徴をもち,生命予後は不良である,という臨床的な悪性群を規定する.じつは,予後不良なのは胎児型より胞巣型において特徴的であり,もうひとつの胞巣型との類似点として,PAX-FOXO1融合遺伝子は筋芽細胞においてMYOD1の標的となる遺伝子の発現を抑制し分化を停止させることがある.筋肉の分化におけるさまざまな過程は4つの筋原性のタンパク質が順序だてて活性化されることにより制御されており,PAX-FOXO1融合遺伝子や変異型MYOD1はこの分化プログラムをMYOD1の段階で阻害する役割を担っているようだ.PIK3CA遺伝子の変異は全体の約5%とあまり一般的ではないが,MYOD1の変異をもつ症例において有意に大きな割合をしめることが見い出され,ほかの症例においてPTEN遺伝子の欠損も認められた.最近,ほかの小児腫瘍である神経芽細胞腫において,MYCNの増幅がクロム親和性細胞の分化を阻害し,ALKの活性化が増殖シグナルの恒常的な活性化をもたらすことが報告されたが12),胎児型の横紋筋肉腫においても同様に,変異型MYOD1が筋原性の分化の誘導を阻害し,PI3K-AKT経路の活性化が増殖シグナルを恒常化し発がんに寄与すると予想された(図1).MYOD1の122番目のLeuのArgへの変異は横紋筋肉腫の臨床的な悪性群を規定するため,今後,この高リスク群に対する治療の個別化および分子標的治療法の確立がもとめられる.
文 献
- Taylor, B. S., Barretina, J., Maki, R. G. et al.: Advances in sarcoma genomics and new therapeutic targets. Nat. Rev. Cancer, 11, 541-557 (2011)[PubMed]
- Shukla, N., Ameur, N., Yilmaz, I. et al.: Oncogene mutation profiling of pediatric solid tumors reveals significant subsets of embryonal rhabdomyosarcoma and neuroblastoma with mutated genes in growth signaling pathways. Clin. Cancer Res., 18, 748-757 (2012)[PubMed]
- Taylor, J. G. 6th, Cheuk, A. T., Tsang, P. S. et al.: Identification of FGFR4-activating mutations in human rhabdomyosarcomas that promote metastasis in xenotransplanted models. J. Clin. Invest., 119, 3395-3407 (2009)[PubMed]
- Stratton, M. R., Fisher, C., Gusterson, B. A. et al.: Detection of point mutations in N-ras and K-ras genes of human embryonal rhabdomyosarcomas using oligonucleotide probes and the polymerase chain reaction. Cancer Res., 49, 6324-6327 (1989)[PubMed]
- Davicioni, E., Anderson, M. J., Finckenstein, F. G. et al.: Molecular classification of rhabdomyosarcoma: genotypic and phenotypic determinants of diagnosis: a report from the Children's Oncology Group. Am. J. Pathol., 174, 550-564 (2009)[PubMed]
- Ledent, V., Paquet, O. & Vervoort, M.: Phylogenetic analysis of the human basic helix-loop-helix proteins. Genome Biol., 3, RESEARCH0030 (2002)[PubMed]
- Van Antwerp, M. E., Chen, D. G., Chang, C. et al.: A point mutation in the MyoD basic domain imparts c-Myc-like properties. Proc. Natl. Acad. Sci. USA, 89, 9010-9014 (1992)[PubMed]
- Carroll, S. J. & Nodit, L.: Spindle cell rhabdomyosarcoma: a brief diagnostic review and differential diagnosis. Arch. Pathol. Lab. Med., 137, 1155-1158 (2013)[PubMed]
- Crescenzi, M., Crouch, D. H. & Tato, F.: Transformation by myc prevents fusion but not biochemical differentiation of C2C12 myoblasts: mechanisms of phenotypic correction in mixed culture with normal cells. J. Cell Biol., 125, 1137-1145 (1994)[PubMed]
- Asp, P., Blum, R., Vethantham, V. et al.: Genome-wide remodeling of the epigenetic landscape during myogenic differentiation. Proc. Natl. Acad. Sci. USA, 108, E149-E158 (2011)[PubMed]
- Chen, X., Xu, H., Yuan, P. et al.: Integration of external signaling pathways with the core transcriptional network in embryonic stem cells. Cell, 133, 1106-1117 (2008)[PubMed]
- Zhu, S., Lee, J.S., Guo, F. et al.: Activated ALK collaborates with MYCN in neuroblastoma pathogenesis. Cancer Cell, 21, 362-373 (2012)[PubMed]
著者プロフィール
略歴:2011年 北海道大学大学院医学研究科博士課程 修了,2012年より米国Memorial Sloan Kettering Cancer Centerポスドク.
研究テーマ:肉腫における分子標的治療法の確立.
抱負:医師として苦しんでいる患者の助けになる研究をしていきたい.
Marc Ladanyi
米国Memorial Sloan Kettering Cancer CenterにてActing Chief.
研究室URL:http://www.mskcc.org/research/lab/marc-ladanyi
© 2014 高阪真路・Marc Ladanyi Licensed under CC 表示 2.1 日本