チオ糖の生合成における硫黄の導入反応
佐々木栄太・Hung-wen Liu
(米国Texas大学Austin校Department of Chemistry)
email:佐々木栄太
DOI: 10.7875/first.author.2014.078
Co-opting sulphur-carrier proteins from primary metabolic pathways for 2-thiosugar biosynthesis.
Eita Sasaki, Xuan Zhang, He G. Sun, Mei-Yeh Jade Lu, Tsung-lin Liu, Albert Ou, Jeng-yi Li, Yu-hsiang Chen, Steven E. Ealick, Hung-wen Liu
Nature, 510, 427-431 (2014)
硫黄は生命に必須の元素であり,硫黄を含む有機化合物は自然界に普遍的に存在する.近年,硫黄を含む補酵素や硫黄により修飾された塩基の生合成の研究により,生体において1次代謝産物のもつ炭素と硫黄とのあいだの結合の多くが,ラジカル種を介した反応,あるいは,硫黄供与タンパク質の活性部位において形成されたペルスルフィドやチオカルボキシレートからの硫黄の導入反応により形成されることが明らかになってきた.しかしながら,微生物や植物が生産する多様な2次代謝産物における硫黄の導入反応の詳細についてはいまだよくわかっていないものが多い.この論文では,放線菌Amycolatopsis orientalisにより産生される抗腫瘍性の抗生物質BE-7585Aの構造にみられる2-チオグルコースに注目し,その炭素と硫黄とのあいだの結合の形成に必要な一連の酵素を見い出すことに成功した.また,同定した酵素の生化学的な機能解析,および,硫黄供与タンパク質と硫黄受容タンパク質との複合体のX線結晶構造解析を行い,チオ糖の生合成における硫黄の導入反応の全容を明らかにした.
自然界に存在する豊富な2次代謝産物には,デオキシ糖をはじめとして,ニトロ基(-NO2)やスルフヒドリル基(-SH)などをもつユニークな糖が多く知られている1).このような糖を含む有機化合物において,糖の部位は物理化学的な性質に影響することはもちろん,しばしば分子認識部位として生物活性の強度や特異性において重要な役割をはたす2).したがって,これらユニークな糖の生合成の機構を分子レベルで解き明かすことは,天然には存在しない新規の医薬品を創出するためにも有用である3).しかし,炭素と硫黄とのあいだの結合をもつチオ糖の生合成の機構については,キャベツ,ブロッコリー,クロカラシなどのフウチョウソウ目の植物により生成されるグルコシノレート類の生合成経路が示されている例のほか,ほとんどわかっていない.
筆者らは,放線菌Amycolatopsis orientalis subsp. vinearia BA-07585株により産生される2-チオグルコースを含む抗生物質BE-7585Aの生合成遺伝子クラスターを同定し,チオ糖の合成に関与すると推測されるタンパク質BexXを見い出した4).BexXのアミノ酸配列は,硫黄を含むチアゾール環をもつチアミンの生合成に重要な酵素であるThiGと相同性を示した.さらに,BexXを発現して精製しヒドリド還元と質量分析とにより,BexXはグルコース6-リン酸と特異的に共有結合することが明らかにされた5).これらの結果は,BexXが2-チオグルコース合成酵素であることを強く示唆したが,目的とする硫黄の導入反応について直接的な証拠は得られていなかった.
通常,放線菌による2次代謝産物の生合成に必要な一連の遺伝子は,ゲノムの一部に遺伝子クラスターとしてかたまって存在することが知られている.実際に,さきに同定されたBE-7585A生合成遺伝子クラスターからは,BexXをコードする遺伝子のほか,BE-7585Aに含まれるアングサイクリン骨格およびデオキシ糖を合成するための一連の酵素をコードする遺伝子がみつかっている.一方,チアミンの生合成においては,ThiGと基質との複合体に硫黄供与タンパク質であるThiSからの硫黄の導入反応が起こることが報告されている6).BexXとThiGとの相同性から,2-チオ糖の生合成においてもThiSのような硫黄供与タンパク質の関与を予想したが,BE-7585A生合成遺伝子クラスターにそのようなタンパク質をコードする遺伝子はみつからなかった.そこで,遺伝子クラスターの外に存在する独立した遺伝子の関与をうたがい,BE-7585Aを産生する放線菌A. orientalisのゲノム解析から硫黄の導入反応にかかわる可能性の高いタンパク質をコードする遺伝子を網羅的に探索することにした.
BexXとグルコース6-リン酸との複合体に硫黄を導入する可能性の高いタンパク質として,A. orientalisのゲノムから,4種類の硫黄担体タンパク質としてThiS,MoaD,CysO,MoaD2,および,5種類のシステイン脱硫酵素,5種類のロダネーゼ相同体をコードする遺伝子を選び出した.このうち,ThiS,MoaD,CysOは,それぞれ,チアミン,モリブドプテリン,システインという1次代謝産物の生合成遺伝子クラスターにコードされている.一方,MoaD2をコードする遺伝子は,これらの生合成遺伝子クラスターとは独立して存在しているためその内在性の機能は定かではないが,MoaDとの相同性からMoaDのはたらきをおぎなう可能性があると考えられた.さきに述べたように,BexXとThiGはアミノ酸レベルで相同性を示す.そこで,チアミンの生合成経路においてThiGと基質との複合体に硫黄を供与することが知られている硫黄担体タンパク質ThiSが,2次代謝産物であるチオ糖の生合成経路においても借用されるのではないかという仮説をたてた.
硫黄担体タンパク質は65~100アミノ酸残基からなり,真核生物のユビキチン様の立体構造をもつことが知られている7).C末端には特徴的なGly-Gly配列があり,ユビキチン活性化酵素様の酵素によりアデニル化される.枯草菌や大腸菌といった細菌におけるチアミンの生合成においては活性化酵素ThiFがThiSのアデニル化を担うことが知られているが,A. orientalisのゲノムから見い出したチアミンの生合成遺伝子クラスターはThiFをコードする遺伝子が欠落していた.そこで,A. orientalisのゲノムにおいてThiFと相同性を示すThiSの活性化酵素を探索したところ,唯一,N末端側にThiF様のドメイン,C末端側にロダネーゼ様のドメインをもつMoeZを発見した.興味深いことに,A. orientalisのゲノムにあるモリブドプテリンの生合成遺伝子クラスターおよびシステインの生合成遺伝子クラスターにも,ThiFのような硫黄担体タンパク質の活性化酵素の遺伝子は存在していなかったことから,MoeZはA. orientalisにおいてすべての硫黄担体タンパク質にはたらく万能の活性化酵素である可能性が示唆された8,9).
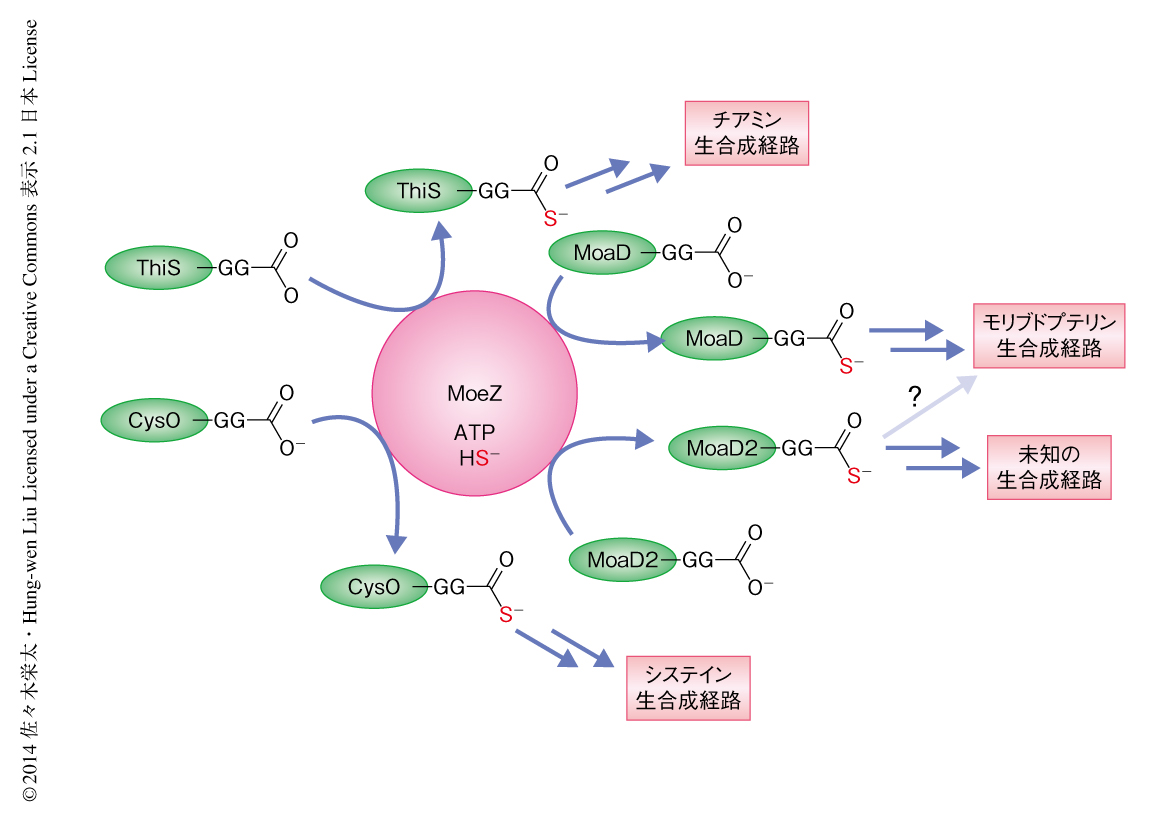
MoeZの硫黄担体タンパク質に対する活性化能を調べるため,ThiS,MoaD,CysO,MoaD2という4つの硫黄担体タンパク質とMoeZをそれぞれ発現し精製した.それぞれの硫黄担体タンパク質にMoeZ,ATP,HS-をくわえて質量分析法により解析したところ,MoeZの存在下でのみ,すべての硫黄担体タンパク質がアデニル化をへてチオカルボキシレートに活性化されることが明らかになった.つまり予想どおり,MoeZはA. orientalisにおけるすべての硫黄担体タンパク質を活性化することが示唆された(図1).
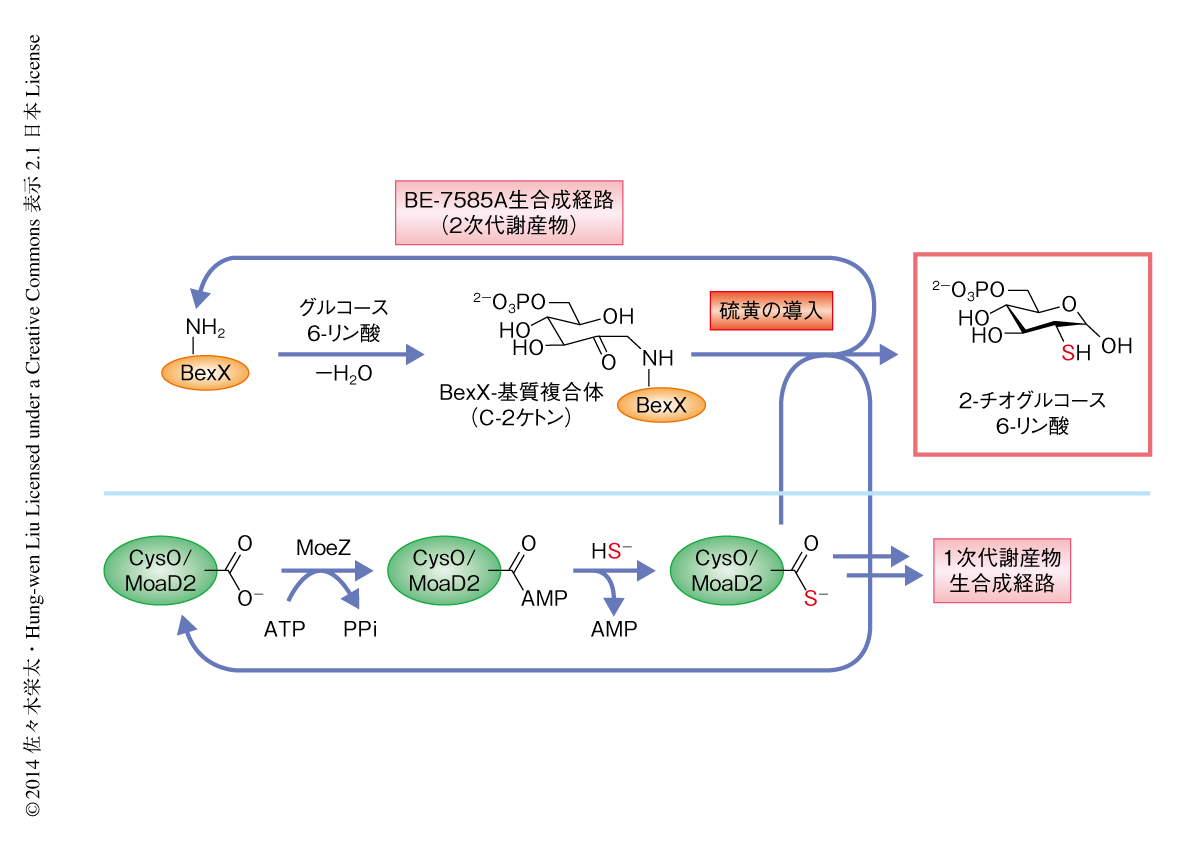
チオ糖の生合成のためチアミンの生合成経路からThiSが借用されているのではないかという仮説を検証するため,BexXとグルコース6-リン酸との複合体にThiS活性体をくわえて硫黄の導入の有無を調べたが,期待に反して,ThiSからの硫黄の導入を支持する証拠は得られなかった.そこで,別の2種類の硫黄担体タンパク質CysOおよびMoaD2の活性体についても同様の試験を行った(MoaDは,発現量が少なく得られた精製純度が低かったため,以下の実験には用いなかった).CysO活性体あるいはMoaD2活性体をくわえる前後でBexXとグルコース6-リン酸との複合体の質量分析法により解析した結果,CysO活性体あるいはMoaD2活性体をくわえたのちにはBexXとグルコース6-リン酸との複合体に由来するシグナルが消失し,遊離のBexXに由来するシグナルのみが観測された.これは,硫黄担体タンパク質からの硫黄の導入により,BexXとグルコース6-リン酸との複合体から生成物である2-チオグルコース6-リン酸が遊離したことを示唆した.そこで,2-チオ糖の生成のより直接的な証拠を得るため,反応溶液にチオール基に選択的な反応試薬mBBrをくわえて高速液体クロマトグラフィーにより分析した.その結果,ThiSではなく,CysOあるいはMoaD2を硫黄担体タンパク質として用いたときのみ,2-チオグルコース6-リン酸誘導体を得ることができた.つまり,A. orientalisのもつ硫黄担体タンパク質のなかには,1次代謝産物の生合成経路と2次代謝産物の生合成経路とをかけわたす潜在性をもつものの存在することが明らかになった(図2).
これまでの細菌における硫黄担体タンパク質の研究により,活性型の硫黄担体タンパク質はそれぞれ個別の硫黄受容タンパク質と相互作用して硫黄の導入をひき起こすことが知られていた10).BexXとThiGがアミノ酸レベルでの相同性をもつにもかかわらず,ThiGへ硫黄を導入するThiSはBexXへの硫黄の導入を起こしえない一方,CysOあるいはMoaD2からBexXへの硫黄の導入がひき起こされることは不思議であった.この疑問に答えるため,BexXとCysOとの複合体のX線結晶構造解析を行い,BexX-MoaD2複合体モデルおよびBexX-ThiS複合体モデルと比較した.その結果,BexXへ硫黄を導入するCysOおよびMoaD2は,BexXとの境界となる部位にThiSにはない2つのαヘリックス構造をもち,複合体を形成したときの相互作用部位の表面積がThiSと比べ約1.6倍も大きくなりうることがわかった.さらに,BexX-CysO複合体の結晶構造と枯草菌のThiG-ThiS複合体の結晶構造とを比較すると,BexXとThiGの立体構造はよく重なった一方,CysOとThiSはうまく重ならないことがみてとれた.つまり,それぞれの硫黄担体タンパク質がよく似た構造をもち,かつ,そのC末端にあるチオカルボキシレートが硫黄受容タンパク質の活性部位に挿入されるという共通点をもっていたとしても,適切な硫黄担体タンパク質と硫黄受容タンパク質のペアを形成するかどうかは,複合体の境界部位の相互作用に大きく依存することが示唆された.
A. orientalisのもつ硫黄担体タンパク質の活性化酵素であるMoeZのC末端側にあるロダネーゼ様ドメインの硫黄の転移能について生化学的に解析した.ロダネーゼ様ドメインの活性部位にあるCysはS2O32-との反応によってペルスルフィド(R-S-S-H)を形成することが知られている.ペルスルフィドは代表的な硫黄供与体のひとつであり,MoeZのN末端側にあるThiF様のドメインによりアデニル化された硫黄担体タンパク質への硫黄の導入を担うことが予想された.これを検証するため,MoeZをATPおよびS2O32-の存在のもと硫黄担体タンパク質にくわえると,予想どおり,硫黄担体タンパク質がチオカルボキシレートへと活性化されることが確認された.一方,ロダネーゼ様ドメインの活性部位のCysをAlaに置換したMoeZ変異体を用いて同様の実験を行ったところ,硫黄担体タンパク質は同じ程度にアデニル化したにもかかわらず,S2O32-から硫黄担体タンパク質への硫黄の導入は観察されなかった.また,S2O32-の代わりにシステインとシステイン脱硫酵素を硫黄供与体として用いて同様の実験を行うと,システインに含まれる硫黄は,まずシステイン脱硫酵素に転移してペルスルフィドを形成し,つづいてMoeZのロダネーゼ様ドメインの活性部位にあるCysに転移し,最終的に硫黄担体タンパク質のC末端に導入される,という経路が確認された.以上の結果,MoeZはN末端側およびC末端側にある2つのドメインを用いて,硫黄担体タンパク質のアデニル化と硫黄の転移という2つの機能を触媒することがわかった.
放線菌A. orientalisのゲノム解析とそれにつづく生化学的な機能解析により,2-チオ糖の生合成における硫黄の導入には1次代謝産物の生合成のための一連の硫黄輸送機構の借用が必要なことが明らかになった.硫黄を含む2次代謝産物が比較的まれであることを考えると,このような機構を用いた硫黄の導入は自然の選んだ合理的な戦略であるといえる.硫黄供与タンパク質と硫黄受容タンパク質が必ずしも同一の生合成遺伝子クラスターに存在しないという結果は,自然界における別種の硫黄を含む化合物の生合成経路を明らかにするうえで,また,多くのゲノムにおいてみつかっている休眠型の生合成遺伝子クラスターのなかからみすごされている可能性のある新規の硫黄を含む有機化合物を発見するうえで,重要な知見となるだろう.
略歴:2011年 米国Texas大学Austin校 修了,同年 東京大学大学院薬学系研究科 特任研究員を経て,スイスFederal Institute of Technology Zurich校 ポスドク.
研究テーマ:チオ糖の生合成,新規の酵素反応の開拓,機能性かご型タンパク質の創出.
関心事:科学者と芸術家との関係.
Hung-wen Liu
米国Texas大学Austin校Professor.
研究室URL:http://uts.cc.utexas.edu/~liulab/
© 2014 佐々木栄太・Hung-wen Liu Licensed under CC 表示 2.1 日本
(米国Texas大学Austin校Department of Chemistry)
email:佐々木栄太
DOI: 10.7875/first.author.2014.078
Co-opting sulphur-carrier proteins from primary metabolic pathways for 2-thiosugar biosynthesis.
Eita Sasaki, Xuan Zhang, He G. Sun, Mei-Yeh Jade Lu, Tsung-lin Liu, Albert Ou, Jeng-yi Li, Yu-hsiang Chen, Steven E. Ealick, Hung-wen Liu
Nature, 510, 427-431 (2014)
要 約
硫黄は生命に必須の元素であり,硫黄を含む有機化合物は自然界に普遍的に存在する.近年,硫黄を含む補酵素や硫黄により修飾された塩基の生合成の研究により,生体において1次代謝産物のもつ炭素と硫黄とのあいだの結合の多くが,ラジカル種を介した反応,あるいは,硫黄供与タンパク質の活性部位において形成されたペルスルフィドやチオカルボキシレートからの硫黄の導入反応により形成されることが明らかになってきた.しかしながら,微生物や植物が生産する多様な2次代謝産物における硫黄の導入反応の詳細についてはいまだよくわかっていないものが多い.この論文では,放線菌Amycolatopsis orientalisにより産生される抗腫瘍性の抗生物質BE-7585Aの構造にみられる2-チオグルコースに注目し,その炭素と硫黄とのあいだの結合の形成に必要な一連の酵素を見い出すことに成功した.また,同定した酵素の生化学的な機能解析,および,硫黄供与タンパク質と硫黄受容タンパク質との複合体のX線結晶構造解析を行い,チオ糖の生合成における硫黄の導入反応の全容を明らかにした.
はじめに
自然界に存在する豊富な2次代謝産物には,デオキシ糖をはじめとして,ニトロ基(-NO2)やスルフヒドリル基(-SH)などをもつユニークな糖が多く知られている1).このような糖を含む有機化合物において,糖の部位は物理化学的な性質に影響することはもちろん,しばしば分子認識部位として生物活性の強度や特異性において重要な役割をはたす2).したがって,これらユニークな糖の生合成の機構を分子レベルで解き明かすことは,天然には存在しない新規の医薬品を創出するためにも有用である3).しかし,炭素と硫黄とのあいだの結合をもつチオ糖の生合成の機構については,キャベツ,ブロッコリー,クロカラシなどのフウチョウソウ目の植物により生成されるグルコシノレート類の生合成経路が示されている例のほか,ほとんどわかっていない.
筆者らは,放線菌Amycolatopsis orientalis subsp. vinearia BA-07585株により産生される2-チオグルコースを含む抗生物質BE-7585Aの生合成遺伝子クラスターを同定し,チオ糖の合成に関与すると推測されるタンパク質BexXを見い出した4).BexXのアミノ酸配列は,硫黄を含むチアゾール環をもつチアミンの生合成に重要な酵素であるThiGと相同性を示した.さらに,BexXを発現して精製しヒドリド還元と質量分析とにより,BexXはグルコース6-リン酸と特異的に共有結合することが明らかにされた5).これらの結果は,BexXが2-チオグルコース合成酵素であることを強く示唆したが,目的とする硫黄の導入反応について直接的な証拠は得られていなかった.
通常,放線菌による2次代謝産物の生合成に必要な一連の遺伝子は,ゲノムの一部に遺伝子クラスターとしてかたまって存在することが知られている.実際に,さきに同定されたBE-7585A生合成遺伝子クラスターからは,BexXをコードする遺伝子のほか,BE-7585Aに含まれるアングサイクリン骨格およびデオキシ糖を合成するための一連の酵素をコードする遺伝子がみつかっている.一方,チアミンの生合成においては,ThiGと基質との複合体に硫黄供与タンパク質であるThiSからの硫黄の導入反応が起こることが報告されている6).BexXとThiGとの相同性から,2-チオ糖の生合成においてもThiSのような硫黄供与タンパク質の関与を予想したが,BE-7585A生合成遺伝子クラスターにそのようなタンパク質をコードする遺伝子はみつからなかった.そこで,遺伝子クラスターの外に存在する独立した遺伝子の関与をうたがい,BE-7585Aを産生する放線菌A. orientalisのゲノム解析から硫黄の導入反応にかかわる可能性の高いタンパク質をコードする遺伝子を網羅的に探索することにした.
1.4種類の硫黄担体タンパク質と万能の活性化酵素MoeZ
BexXとグルコース6-リン酸との複合体に硫黄を導入する可能性の高いタンパク質として,A. orientalisのゲノムから,4種類の硫黄担体タンパク質としてThiS,MoaD,CysO,MoaD2,および,5種類のシステイン脱硫酵素,5種類のロダネーゼ相同体をコードする遺伝子を選び出した.このうち,ThiS,MoaD,CysOは,それぞれ,チアミン,モリブドプテリン,システインという1次代謝産物の生合成遺伝子クラスターにコードされている.一方,MoaD2をコードする遺伝子は,これらの生合成遺伝子クラスターとは独立して存在しているためその内在性の機能は定かではないが,MoaDとの相同性からMoaDのはたらきをおぎなう可能性があると考えられた.さきに述べたように,BexXとThiGはアミノ酸レベルで相同性を示す.そこで,チアミンの生合成経路においてThiGと基質との複合体に硫黄を供与することが知られている硫黄担体タンパク質ThiSが,2次代謝産物であるチオ糖の生合成経路においても借用されるのではないかという仮説をたてた.
硫黄担体タンパク質は65~100アミノ酸残基からなり,真核生物のユビキチン様の立体構造をもつことが知られている7).C末端には特徴的なGly-Gly配列があり,ユビキチン活性化酵素様の酵素によりアデニル化される.枯草菌や大腸菌といった細菌におけるチアミンの生合成においては活性化酵素ThiFがThiSのアデニル化を担うことが知られているが,A. orientalisのゲノムから見い出したチアミンの生合成遺伝子クラスターはThiFをコードする遺伝子が欠落していた.そこで,A. orientalisのゲノムにおいてThiFと相同性を示すThiSの活性化酵素を探索したところ,唯一,N末端側にThiF様のドメイン,C末端側にロダネーゼ様のドメインをもつMoeZを発見した.興味深いことに,A. orientalisのゲノムにあるモリブドプテリンの生合成遺伝子クラスターおよびシステインの生合成遺伝子クラスターにも,ThiFのような硫黄担体タンパク質の活性化酵素の遺伝子は存在していなかったことから,MoeZはA. orientalisにおいてすべての硫黄担体タンパク質にはたらく万能の活性化酵素である可能性が示唆された8,9).
MoeZの硫黄担体タンパク質に対する活性化能を調べるため,ThiS,MoaD,CysO,MoaD2という4つの硫黄担体タンパク質とMoeZをそれぞれ発現し精製した.それぞれの硫黄担体タンパク質にMoeZ,ATP,HS-をくわえて質量分析法により解析したところ,MoeZの存在下でのみ,すべての硫黄担体タンパク質がアデニル化をへてチオカルボキシレートに活性化されることが明らかになった.つまり予想どおり,MoeZはA. orientalisにおけるすべての硫黄担体タンパク質を活性化することが示唆された(図1).
2.硫黄の導入反応の実現とBexXと硫黄担体タンパク質との複合体の構造解析
チオ糖の生合成のためチアミンの生合成経路からThiSが借用されているのではないかという仮説を検証するため,BexXとグルコース6-リン酸との複合体にThiS活性体をくわえて硫黄の導入の有無を調べたが,期待に反して,ThiSからの硫黄の導入を支持する証拠は得られなかった.そこで,別の2種類の硫黄担体タンパク質CysOおよびMoaD2の活性体についても同様の試験を行った(MoaDは,発現量が少なく得られた精製純度が低かったため,以下の実験には用いなかった).CysO活性体あるいはMoaD2活性体をくわえる前後でBexXとグルコース6-リン酸との複合体の質量分析法により解析した結果,CysO活性体あるいはMoaD2活性体をくわえたのちにはBexXとグルコース6-リン酸との複合体に由来するシグナルが消失し,遊離のBexXに由来するシグナルのみが観測された.これは,硫黄担体タンパク質からの硫黄の導入により,BexXとグルコース6-リン酸との複合体から生成物である2-チオグルコース6-リン酸が遊離したことを示唆した.そこで,2-チオ糖の生成のより直接的な証拠を得るため,反応溶液にチオール基に選択的な反応試薬mBBrをくわえて高速液体クロマトグラフィーにより分析した.その結果,ThiSではなく,CysOあるいはMoaD2を硫黄担体タンパク質として用いたときのみ,2-チオグルコース6-リン酸誘導体を得ることができた.つまり,A. orientalisのもつ硫黄担体タンパク質のなかには,1次代謝産物の生合成経路と2次代謝産物の生合成経路とをかけわたす潜在性をもつものの存在することが明らかになった(図2).
これまでの細菌における硫黄担体タンパク質の研究により,活性型の硫黄担体タンパク質はそれぞれ個別の硫黄受容タンパク質と相互作用して硫黄の導入をひき起こすことが知られていた10).BexXとThiGがアミノ酸レベルでの相同性をもつにもかかわらず,ThiGへ硫黄を導入するThiSはBexXへの硫黄の導入を起こしえない一方,CysOあるいはMoaD2からBexXへの硫黄の導入がひき起こされることは不思議であった.この疑問に答えるため,BexXとCysOとの複合体のX線結晶構造解析を行い,BexX-MoaD2複合体モデルおよびBexX-ThiS複合体モデルと比較した.その結果,BexXへ硫黄を導入するCysOおよびMoaD2は,BexXとの境界となる部位にThiSにはない2つのαヘリックス構造をもち,複合体を形成したときの相互作用部位の表面積がThiSと比べ約1.6倍も大きくなりうることがわかった.さらに,BexX-CysO複合体の結晶構造と枯草菌のThiG-ThiS複合体の結晶構造とを比較すると,BexXとThiGの立体構造はよく重なった一方,CysOとThiSはうまく重ならないことがみてとれた.つまり,それぞれの硫黄担体タンパク質がよく似た構造をもち,かつ,そのC末端にあるチオカルボキシレートが硫黄受容タンパク質の活性部位に挿入されるという共通点をもっていたとしても,適切な硫黄担体タンパク質と硫黄受容タンパク質のペアを形成するかどうかは,複合体の境界部位の相互作用に大きく依存することが示唆された.
3.MoeZによる硫黄担体タンパク質の活性化の機構
A. orientalisのもつ硫黄担体タンパク質の活性化酵素であるMoeZのC末端側にあるロダネーゼ様ドメインの硫黄の転移能について生化学的に解析した.ロダネーゼ様ドメインの活性部位にあるCysはS2O32-との反応によってペルスルフィド(R-S-S-H)を形成することが知られている.ペルスルフィドは代表的な硫黄供与体のひとつであり,MoeZのN末端側にあるThiF様のドメインによりアデニル化された硫黄担体タンパク質への硫黄の導入を担うことが予想された.これを検証するため,MoeZをATPおよびS2O32-の存在のもと硫黄担体タンパク質にくわえると,予想どおり,硫黄担体タンパク質がチオカルボキシレートへと活性化されることが確認された.一方,ロダネーゼ様ドメインの活性部位のCysをAlaに置換したMoeZ変異体を用いて同様の実験を行ったところ,硫黄担体タンパク質は同じ程度にアデニル化したにもかかわらず,S2O32-から硫黄担体タンパク質への硫黄の導入は観察されなかった.また,S2O32-の代わりにシステインとシステイン脱硫酵素を硫黄供与体として用いて同様の実験を行うと,システインに含まれる硫黄は,まずシステイン脱硫酵素に転移してペルスルフィドを形成し,つづいてMoeZのロダネーゼ様ドメインの活性部位にあるCysに転移し,最終的に硫黄担体タンパク質のC末端に導入される,という経路が確認された.以上の結果,MoeZはN末端側およびC末端側にある2つのドメインを用いて,硫黄担体タンパク質のアデニル化と硫黄の転移という2つの機能を触媒することがわかった.
おわりに
放線菌A. orientalisのゲノム解析とそれにつづく生化学的な機能解析により,2-チオ糖の生合成における硫黄の導入には1次代謝産物の生合成のための一連の硫黄輸送機構の借用が必要なことが明らかになった.硫黄を含む2次代謝産物が比較的まれであることを考えると,このような機構を用いた硫黄の導入は自然の選んだ合理的な戦略であるといえる.硫黄供与タンパク質と硫黄受容タンパク質が必ずしも同一の生合成遺伝子クラスターに存在しないという結果は,自然界における別種の硫黄を含む化合物の生合成経路を明らかにするうえで,また,多くのゲノムにおいてみつかっている休眠型の生合成遺伝子クラスターのなかからみすごされている可能性のある新規の硫黄を含む有機化合物を発見するうえで,重要な知見となるだろう.
文 献
- Lin, C. -I., McCarty, R. M. & Liu, H. -w.: The biosynthesis of nitrogen-, sulfur-, and high-carbon chain-containing sugars. Chem. Soc. Rev., 42, 4377-4407 (2013)[PubMed]
- Schlunzen, F., Zarivach, R., Harms, J. et al.: Structural basis for the interaction ofantibiotics with the peptidyl transferase centre in eubacteria. Nature, 413, 814-821 (2001)[PubMed]
- Thibodeaux, C. J., Melancon, C. E. & Liu, H. -w.: Unusual sugar biosynthesis and natural product glycodiversification. Nature, 446, 1008-1016 (2007)[PubMed]
- Sasaki, E., Ogasawara, Y. & Liu, H. -w.: A biosynthetic pathway for BE-7585A, a 2-thiosugar-containing angucycline-type natural product. J. Am. Chem. Soc., 132, 7405-7417 (2010)[PubMed]
- Sasaki, E. & Liu, H. -w.: Mechanistic studies of the biosynthesis of 2-thiosugar: evidence for the formation of an enzyme-bound 2-ketohexose intermediate in BexX-catalyzed reaction. J. Am. Chem. Soc., 132, 15544-15546 (2010)[PubMed]
- Jurgenson, C. T., Begley, T. P. & Ealick, S. E.: The structural and biochemical foundations of thiamin biosynthesis. Annu. Rev. Biochem., 78, 569-603 (2009)[PubMed]
- Iyer, L. M., Burroughs, A. M. & Aravind, L.: The prokaryotic antecedents of the ubiquitin-signaling system and the early evolution of ubiquitinlike β-grasp domains. Genome Biol., 7, R60 (2006)[PubMed]
- Burroughs, A. M., Iyer, L. M. & Aravind, L.: Natural history of the E1-like superfamily: implication for adenylation, sulfur transfer, and ubiquitin conjugation. Proteins, 75, 895-910 (2009)[PubMed]
- Shigi, N., Sakaguchi, Y., Asai, S. et al.: Common thiolation mechanism in the biosynthesis of tRNA thiouridine and sulphur-containing cofactors. EMBO J., 27, 3267-3278 (2008)[PubMed]
- Jurgenson, C. T., Burns, K. E., Begley, T. P. et al.: Crystal structure of a sulfur carrier protein complex found in the cysteine biosynthetic pathway of Mycobacterium tuberculosis. Biochemistry, 47, 10354-10364 (2008)[PubMed]
著者プロフィール
略歴:2011年 米国Texas大学Austin校 修了,同年 東京大学大学院薬学系研究科 特任研究員を経て,スイスFederal Institute of Technology Zurich校 ポスドク.
研究テーマ:チオ糖の生合成,新規の酵素反応の開拓,機能性かご型タンパク質の創出.
関心事:科学者と芸術家との関係.
Hung-wen Liu
米国Texas大学Austin校Professor.
研究室URL:http://uts.cc.utexas.edu/~liulab/
© 2014 佐々木栄太・Hung-wen Liu Licensed under CC 表示 2.1 日本