マウスの精子幹細胞は異なる状態をくり返し行き来している
原 健士朗・吉田松生
(基礎生物学研究所 生殖細胞研究部門)
email:原 健士朗,吉田松生
DOI: 10.7875/first.author.2014.063
Mouse spermatogenic stem cells continually interconvert between equipotent singly isolated and syncytial states.
Kenshiro Hara, Toshinori Nakagawa, Hideki Enomoto, Mikiko Suzuki, Masayuki Yamamoto, Benjamin D. Simons, Shosei Yoshida
Cell Stem Cell, 14, 658-672 (2014)
哺乳動物における精子の形成は精子幹細胞の自己維持と分化によりささえられている.これまで,精子幹細胞の実体については,固定標本の観察にもとづいて幹細胞のすがたを推定した“Asモデル”が広く受け入れられていた.このモデルを実験的に検証するには生きた状態の未分化な細胞を解析する必要があったが,これはこれまでの技術では困難であった.近年,筆者らの研究グループは,精巣のライブイメージング法やパルス標識法などを開発しマウスの精巣のなかの生きた細胞の解析を可能にしてきた.この研究では,これらの技術を利用して精巣のなかの未分化な細胞の挙動を解析し,精子幹細胞の実体をあらためて問い直した.その結果,精子幹細胞は異なる状態をくり返し行き来しているという知られざる性質が明らかになった.
哺乳動物の精巣では繁殖の期間をつうじて安定的かつ継続的に精子がつくりつづけられている.これは,精子幹細胞の絶え間ない“未分化細胞の維持”と“分化細胞の供給”によりささえられている.最近の十数年のあいだ,幹細胞の移植アッセイ法や体外培養技術の開発により,精子幹細胞の制御機構に関する研究はめざましい進歩をとげている.しかし,生きた精巣のなかの精子幹細胞の実体やその挙動についての理解は進んでいなかった.
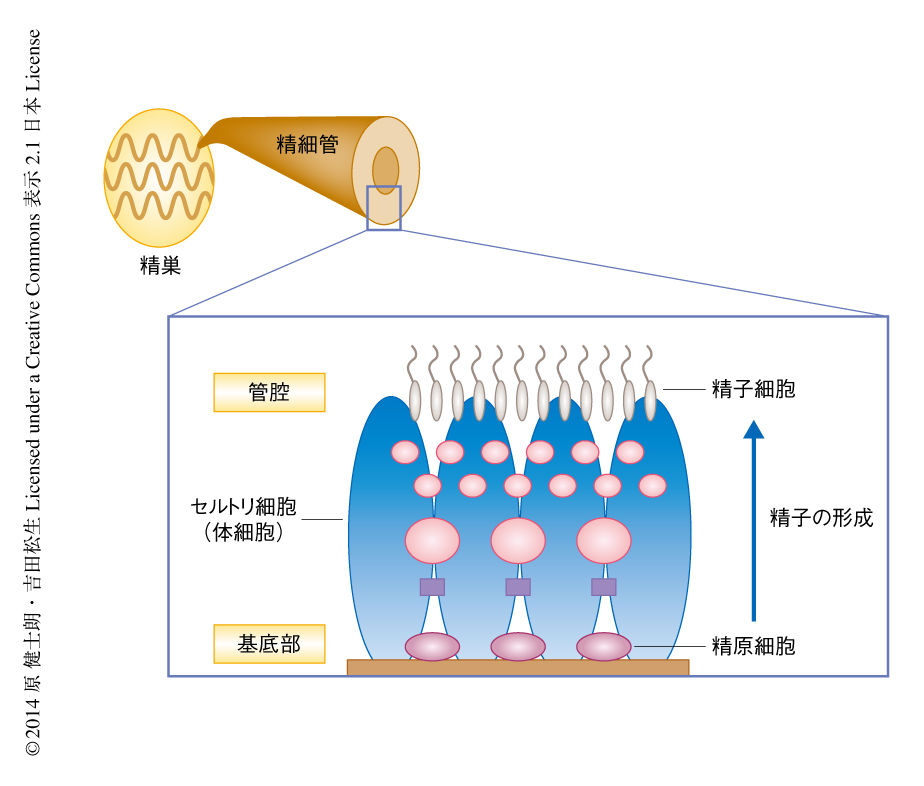
マウスにおいて,精子は精巣の内部で折りたたまれた精細管とよばれるシンプルな管構造のなかで形成される(図1).精細管の上皮は,精子幹細胞を含む未分化な細胞(精原細胞)から精子細胞にいたるまでのさまざまな分化の段階の生殖細胞と,これを支持するセルトリ細胞の2種類の細胞種により構成される.精子幹細胞は精細管の基底部に位置し,未分化細胞の維持と分化細胞の供給とを行う.生みだされた分化細胞は,数回の体細胞分裂ののち,管腔の側へと移動しながら減数分裂を開始し精子へと分化する.精子へと分化する細胞のユニークな特徴は,同調的な不完全分裂により複数の細胞が細胞のあいだの架橋を介して連結した合胞体の構造を形成することである.概して,合胞体の長さが短いものほど未分化,長いものほど分化の進んだ細胞と考えられている.
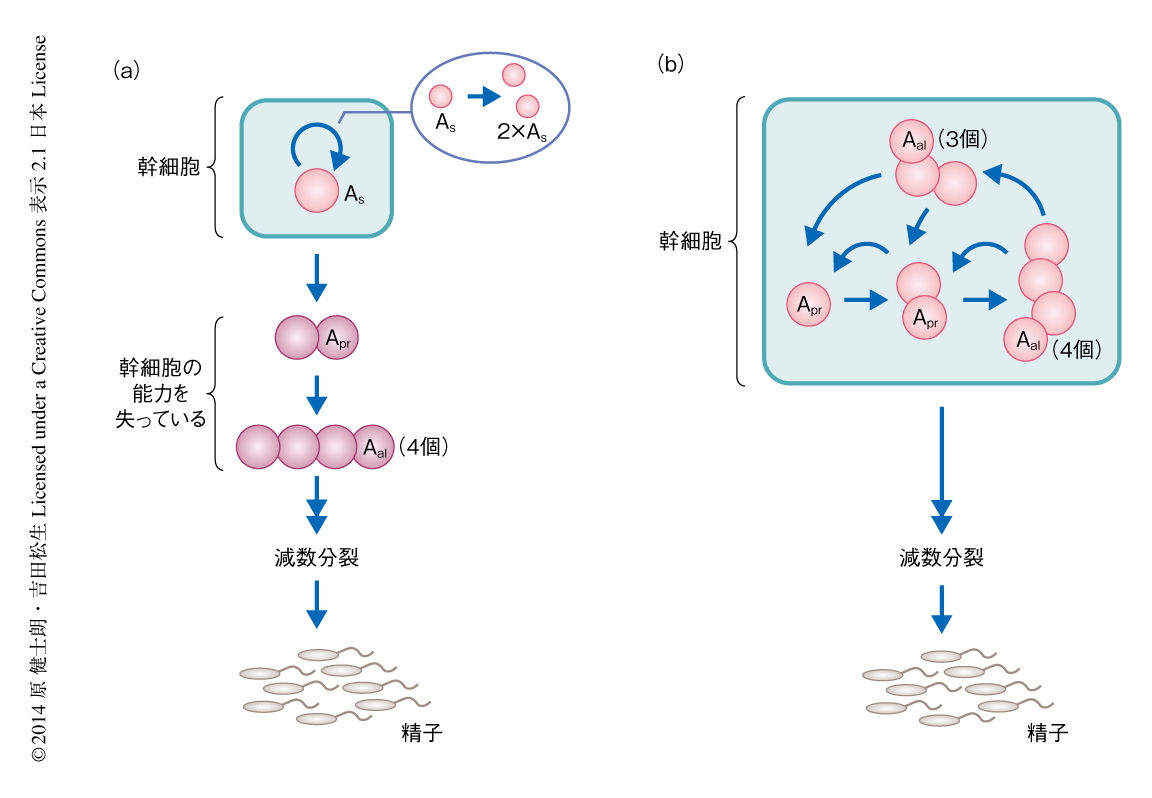
未分化な精原細胞のうち,形態的に,ひとつひとつがバラバラに1個で存在する細胞をAsingle(As),2個の細胞の連結した合胞体をApaired(Apr),3個以上の細胞の連結した合胞体をAaligned(Aal)と区別してよぶ.これまで,1個で存在する細胞のみが幹細胞であり,合胞体は分化に不可逆にコミットした細胞であるとする仮説(Asモデル)が広く受け入れられてきた1,2)(図2a).このモデルは,固定標本の詳細な観察にもとづいて生きた精子幹細胞のすがたを推定したものであり,未分化な精原細胞の大半をしめる1個で存在する細胞と2n(2,4,8,...)個の細胞の連結した合胞体をシンプルかつ包括的にとらえた当時の最高のモデルであった.しかし,精巣のなかにはごく少数ながら2n以外(3,5,6,...)の数の細胞の連結した合胞体が観察されていた.これらの合胞体はAsモデルでは説明できず,このモデルでは正常でない細胞として扱われてきた.一方,形態による分類と並行して,最近では,遺伝子発現による分類もなされている.未分化な精原細胞を遺伝子発現でみた場合,1個で存在する細胞,2個の細胞の連結した合胞体,3個以上の細胞の連結した合胞体は,不均一な遺伝子発現により,機能の異なる2つの細胞集団に大別されることが明らかにされている3).ひとつは,おもに1個で存在する細胞および2個の細胞の連結した合胞体により構成される,精子幹細胞を含むもっとも未分化な細胞集団であるGFRα1陽性細胞である.もうひとつは,おもに3個以上の細胞の連結した合胞体により構成される,定常な状態においてほとんどは分化の運命をたどるNeurogenin3(Ngn3)陽性細胞である.近年,筆者らの研究グループは,蛍光タンパク質を利用した精巣のライブイメージング法やパルス標識法などを開発し,マウスの精巣のなかの生きた細胞の解析を可能にしてきたが4,5),最近,Ngn3陽性細胞の挙動をin vivoにおける精巣のライブイメージング法により解析し,Ngn3陽性を示す合胞体は,まれに断片化して1個で存在する細胞や短い合胞体を新たに生みだすことを見い出した3).この合胞体の断片化の観察は,合胞体が不可逆的に分化すると考えるAsモデルとは一致しないように思われた.
2n以外の数の細胞の連結した合胞体の存在や合胞体の断片化など,原型のAsモデルのままでは説明のつかない一連の観察は,このモデルを見直す必要性をうったえるものであった.Asモデルの実験的な検証のためには,生きた未分化細胞の時間をこえた挙動を解析することが必須である.これまで,もっとも未分化なGFRα1陽性細胞の挙動は検証されておらず,この研究では,GFRα1陽性細胞をライブイメージング法,パルス標識法,そして,数理モデルにより解析し,知られざる精子幹細胞の実体とその挙動を解明することをめざした.
1個で存在する細胞および2個の細胞の連結した合胞体と少数の3個以上の細胞の連結した合胞体を含むGFRα1陽性細胞の幹細胞としての機能,すなわち,その自己維持および分化について検証するため,パルス標識法を用いてGFRα1陽性細胞のクローン運命の推移について解析した.パルス標識としては,GFRα1陽性を示す1個で存在する細胞,2個の細胞の連結した合胞体,3個以上の細胞の連結した合胞体をGFPにより不可逆的に標識し,GFRα1の発現を維持しているか,それとも発現を失って分化するかを,数日から1年以上にわたり追跡する方法を採用した.
実験の結果,個々のGFRα1陽性細胞に由来するクローンは,すぐに分化して消失するものもあればさかんに増殖するものもあり,バラバラな運命をたどることが明らかになった.さらに,個々のGFRα1陽性細胞の運命は時間のたつごとに多様さを増し複雑になった.この結果から,少なくともひとつひとつのGFRα1陽性細胞だけをみるかぎり,自己維持と分化とのバランスはとれていないことが自明であった.しかし,100個以上のバラバラなクローンのデータを平均化したところ,驚いたことに,集団レベルでは未分化細胞の維持と分化細胞の供給とを完全に両立する幹細胞として機能することがわかった.
この結果は,個々のGFRα1陽性細胞はバラバラな運命をたどりつつも,分化により失われたGFRα1陽性細胞をそのまわりで増殖したGFRα1陽性細胞が完璧におぎなうことにより,集団としては定常の状態を維持していることを意味した.このような幹細胞性の維持の様式は,1細胞レベルにおいて自己維持と分化を達成する分裂非対称と区別して,“集団非対称”とよばれる6,7).
つぎなる疑問は,多様な運命を生みだす過程におけるGFRα1陽性細胞のふるまいであった.そこで,in vivoにおける精巣のライブイメージング法によりGFRα1陽性細胞の挙動を調べた.1回に約72時間の観察が可能であり,これをくり返しのべ8000時間以上の映像を取得し解析した.
Asモデルでは,1個で存在する細胞の完全な細胞分裂(1個で存在する細胞が2個に増える)と,不完全な細胞分裂(1個で存在する細胞が2個の細胞の連結した合胞体になる.1個で存在する細胞が1個失われる)の頻度はつりあっていなくてはならない(図2a).この仮説を検証するため,1個で存在する細胞の細胞分裂のパターンに着目した.その結果,予想とは異なり,1個で存在する細胞が細胞分裂する場合,ほとんどは不完全な細胞分裂により2個の細胞の連結した合胞体になることが明らかになった.この結果は,1個で存在する細胞の集団のみでは1個で存在する細胞の数を維持できないことを意味した.したがって,2個の細胞の連結した合胞体や3個以上の細胞の連結した合胞体からなる細胞の集団からの,1個で存在する細胞の供給を想定する必要があった.
2個以上の細胞の連結した合胞体の映像を解析した結果,細胞分裂に匹敵する高い頻度で,2個以上の細胞の連結した合胞体が断片化してバラバラに分かれ,1個で存在する細胞や短い合胞体を新たに生みだすようすが観察された.以上のGFRα1陽性細胞の集団の挙動をすべてまとめたところ,GFRα1陽性を示す細胞は,不完全な細胞分裂と合胞体の断片化により互いの状態を行き来していることが明らかになった.また興味深いことに,細胞分裂および断片化の発生は,異なるタイプのGFRα1陽性を示す細胞に共通して同じ頻度で起こっていた.
ライブイメージング法による映像からGFRα1陽性細胞の経時的な位置を解析した結果,GFRα1陽性細胞は精上皮の基底部の不特定の場所を無秩序に動きまわっていることが明らかになった.となりあった幹細胞が入れ替わるためには,幹細胞が動く必要がある.観察されたGFRα1陽性細胞の動きは,精子幹細胞の集団非対称の達成において必須のプロセスであると考えられた.
パルス標識法およびライブイメージング法による結果から,精子幹細胞のバラバラなクローン運命,異なる状態のあいだの行き来,活発な動きなどが明らかになったが,これらの複雑な挙動をすべて包括したGFRα1陽性細胞の動態は,直観にたより理解することがむずかしかった.一方で,細胞分裂と断片化がGFRα1陽性細胞のかたちの違いにかかわらず同じ頻度で起こるという結果は,複雑な挙動の裏にかくされたシンプルな規則を暗示しているようにも思われた.そこで,数理モデル解析により,実際に測定した数々のデータを包括的に説明するGFRα1陽性細胞の動態の解明に挑戦した.
GFRα1陽性細胞の動態の基本原理をとらえるため,ライブイメージング法により観察されたGFRα1陽性細胞のふるまいを可能なかぎりシンプルにin silicoにおいてモデル化した.すなわち,仮想の精細管に配置したGFRα1陽性を示す1個で存在する細胞,2個の細胞の連結した合胞体,3個以上の細胞の連結した合胞体がランダムに細胞分裂と断片化とをくり返し,断片化により新たに生まれた1個で存在する細胞や短い合胞体は動いてとなりあった細胞と入れ替わる,というモデルを構築した.パラメーターは細胞分裂の頻度および断片化の頻度の2つのみで,それぞれライブイメージング法により実測した値を用いた.そして,この数理モデルがその構築とは独立しているパルス標識の実験の結果を予測できるかどうかを検証することにより,モデルの信頼性を検証した.
解析の結果,数理モデルはパルス標識により実測された数日から1年以上にわたる複雑なGFRα1陽性細胞のクローン運命を高い精度で説明することができた.興味深いことに,この数理モデルはAsモデルでは説明できなかった2n以外の数の細胞の連結した合胞体の存在も正確に予測した.さらに,この数理モデルは定常な状態のデータだけではなく,組織傷害ののちの再生の過程におけるGFRα1陽性細胞の運命も説明することができた.これらの結果は,この数理モデルが多くの実験の結果を包括的に説明する信頼性の高いものであることを明確に示しており,GFRα1陽性細胞は細胞分裂と断片化とをくり返してマウスの一生にわたる精子の形成をささえていることが強く示唆された.特筆すべきは,いっけん複雑なGFRα1陽性細胞の動態が,細胞分裂の頻度と断片化の頻度のたった2つのパラメーターのみにより制御されていることであった.
筆者らは,ウェットな実験とドライな理論との融合によるGFRα1陽性細胞の挙動の解析から,マウスの精子幹細胞は細胞分裂と断片化により1個で存在する細胞,2個の細胞の連結した合胞体,3個以上の細胞の連結した合胞体のあいだをくり返し行き来しながら,どれも区別なく等しく幹細胞として機能していると結論づけた(図2b).一般に,Asモデルにおける1個で存在する細胞のように,組織幹細胞とはひとつの特別なタイプの細胞のことをさし示すと考えられがちであるが,この研究からは,マウスの精子幹細胞は異なる状態をくり返し行き来する知られざる性質をもつことが明らかになった.筆者らは,この性質のことを“幹細胞の動的不均一性”(dynamic heterogeneity)とよんでいる.興味深いことに,最近,ポピュラーな幹細胞モデルであるマウスの毛包幹細胞や小腸上皮幹細胞でも同様の性質が見い出されたことから8,9),幹細胞の動的不均一性はさまざまな組織幹細胞に共通する性質かもしれないと考えている.
略歴:2009年 東京大学大学院農学生命科学研究科博士課程 修了,同年 基礎生物学研究所 ポスドクを経て,2010年より同 助教.
研究テーマ:哺乳動物における精子の形成.
抱負:哺乳類における配偶子の形成のしくみを解き明かしていきたい.
吉田 松生(Shosei Yoshida)
基礎生物学研究所 教授.
研究室URL:http://www.nibb.ac.jp/germcell/index.html
© 2014 原 健士朗・吉田松生 Licensed under CC 表示 2.1 日本
(基礎生物学研究所 生殖細胞研究部門)
email:原 健士朗,吉田松生
DOI: 10.7875/first.author.2014.063
Mouse spermatogenic stem cells continually interconvert between equipotent singly isolated and syncytial states.
Kenshiro Hara, Toshinori Nakagawa, Hideki Enomoto, Mikiko Suzuki, Masayuki Yamamoto, Benjamin D. Simons, Shosei Yoshida
Cell Stem Cell, 14, 658-672 (2014)
要 約
哺乳動物における精子の形成は精子幹細胞の自己維持と分化によりささえられている.これまで,精子幹細胞の実体については,固定標本の観察にもとづいて幹細胞のすがたを推定した“Asモデル”が広く受け入れられていた.このモデルを実験的に検証するには生きた状態の未分化な細胞を解析する必要があったが,これはこれまでの技術では困難であった.近年,筆者らの研究グループは,精巣のライブイメージング法やパルス標識法などを開発しマウスの精巣のなかの生きた細胞の解析を可能にしてきた.この研究では,これらの技術を利用して精巣のなかの未分化な細胞の挙動を解析し,精子幹細胞の実体をあらためて問い直した.その結果,精子幹細胞は異なる状態をくり返し行き来しているという知られざる性質が明らかになった.
はじめに
哺乳動物の精巣では繁殖の期間をつうじて安定的かつ継続的に精子がつくりつづけられている.これは,精子幹細胞の絶え間ない“未分化細胞の維持”と“分化細胞の供給”によりささえられている.最近の十数年のあいだ,幹細胞の移植アッセイ法や体外培養技術の開発により,精子幹細胞の制御機構に関する研究はめざましい進歩をとげている.しかし,生きた精巣のなかの精子幹細胞の実体やその挙動についての理解は進んでいなかった.
マウスにおいて,精子は精巣の内部で折りたたまれた精細管とよばれるシンプルな管構造のなかで形成される(図1).精細管の上皮は,精子幹細胞を含む未分化な細胞(精原細胞)から精子細胞にいたるまでのさまざまな分化の段階の生殖細胞と,これを支持するセルトリ細胞の2種類の細胞種により構成される.精子幹細胞は精細管の基底部に位置し,未分化細胞の維持と分化細胞の供給とを行う.生みだされた分化細胞は,数回の体細胞分裂ののち,管腔の側へと移動しながら減数分裂を開始し精子へと分化する.精子へと分化する細胞のユニークな特徴は,同調的な不完全分裂により複数の細胞が細胞のあいだの架橋を介して連結した合胞体の構造を形成することである.概して,合胞体の長さが短いものほど未分化,長いものほど分化の進んだ細胞と考えられている.
未分化な精原細胞のうち,形態的に,ひとつひとつがバラバラに1個で存在する細胞をAsingle(As),2個の細胞の連結した合胞体をApaired(Apr),3個以上の細胞の連結した合胞体をAaligned(Aal)と区別してよぶ.これまで,1個で存在する細胞のみが幹細胞であり,合胞体は分化に不可逆にコミットした細胞であるとする仮説(Asモデル)が広く受け入れられてきた1,2)(図2a).このモデルは,固定標本の詳細な観察にもとづいて生きた精子幹細胞のすがたを推定したものであり,未分化な精原細胞の大半をしめる1個で存在する細胞と2n(2,4,8,...)個の細胞の連結した合胞体をシンプルかつ包括的にとらえた当時の最高のモデルであった.しかし,精巣のなかにはごく少数ながら2n以外(3,5,6,...)の数の細胞の連結した合胞体が観察されていた.これらの合胞体はAsモデルでは説明できず,このモデルでは正常でない細胞として扱われてきた.一方,形態による分類と並行して,最近では,遺伝子発現による分類もなされている.未分化な精原細胞を遺伝子発現でみた場合,1個で存在する細胞,2個の細胞の連結した合胞体,3個以上の細胞の連結した合胞体は,不均一な遺伝子発現により,機能の異なる2つの細胞集団に大別されることが明らかにされている3).ひとつは,おもに1個で存在する細胞および2個の細胞の連結した合胞体により構成される,精子幹細胞を含むもっとも未分化な細胞集団であるGFRα1陽性細胞である.もうひとつは,おもに3個以上の細胞の連結した合胞体により構成される,定常な状態においてほとんどは分化の運命をたどるNeurogenin3(Ngn3)陽性細胞である.近年,筆者らの研究グループは,蛍光タンパク質を利用した精巣のライブイメージング法やパルス標識法などを開発し,マウスの精巣のなかの生きた細胞の解析を可能にしてきたが4,5),最近,Ngn3陽性細胞の挙動をin vivoにおける精巣のライブイメージング法により解析し,Ngn3陽性を示す合胞体は,まれに断片化して1個で存在する細胞や短い合胞体を新たに生みだすことを見い出した3).この合胞体の断片化の観察は,合胞体が不可逆的に分化すると考えるAsモデルとは一致しないように思われた.
2n以外の数の細胞の連結した合胞体の存在や合胞体の断片化など,原型のAsモデルのままでは説明のつかない一連の観察は,このモデルを見直す必要性をうったえるものであった.Asモデルの実験的な検証のためには,生きた未分化細胞の時間をこえた挙動を解析することが必須である.これまで,もっとも未分化なGFRα1陽性細胞の挙動は検証されておらず,この研究では,GFRα1陽性細胞をライブイメージング法,パルス標識法,そして,数理モデルにより解析し,知られざる精子幹細胞の実体とその挙動を解明することをめざした.
1.個々のGFRα1陽性細胞はバラバラな運命をたどるが集団レベルでは幹細胞として機能する
1個で存在する細胞および2個の細胞の連結した合胞体と少数の3個以上の細胞の連結した合胞体を含むGFRα1陽性細胞の幹細胞としての機能,すなわち,その自己維持および分化について検証するため,パルス標識法を用いてGFRα1陽性細胞のクローン運命の推移について解析した.パルス標識としては,GFRα1陽性を示す1個で存在する細胞,2個の細胞の連結した合胞体,3個以上の細胞の連結した合胞体をGFPにより不可逆的に標識し,GFRα1の発現を維持しているか,それとも発現を失って分化するかを,数日から1年以上にわたり追跡する方法を採用した.
実験の結果,個々のGFRα1陽性細胞に由来するクローンは,すぐに分化して消失するものもあればさかんに増殖するものもあり,バラバラな運命をたどることが明らかになった.さらに,個々のGFRα1陽性細胞の運命は時間のたつごとに多様さを増し複雑になった.この結果から,少なくともひとつひとつのGFRα1陽性細胞だけをみるかぎり,自己維持と分化とのバランスはとれていないことが自明であった.しかし,100個以上のバラバラなクローンのデータを平均化したところ,驚いたことに,集団レベルでは未分化細胞の維持と分化細胞の供給とを完全に両立する幹細胞として機能することがわかった.
この結果は,個々のGFRα1陽性細胞はバラバラな運命をたどりつつも,分化により失われたGFRα1陽性細胞をそのまわりで増殖したGFRα1陽性細胞が完璧におぎなうことにより,集団としては定常の状態を維持していることを意味した.このような幹細胞性の維持の様式は,1細胞レベルにおいて自己維持と分化を達成する分裂非対称と区別して,“集団非対称”とよばれる6,7).
2.GFRα1発現細胞は不完全な細胞分裂と合胞体の断片化により維持されている
つぎなる疑問は,多様な運命を生みだす過程におけるGFRα1陽性細胞のふるまいであった.そこで,in vivoにおける精巣のライブイメージング法によりGFRα1陽性細胞の挙動を調べた.1回に約72時間の観察が可能であり,これをくり返しのべ8000時間以上の映像を取得し解析した.
Asモデルでは,1個で存在する細胞の完全な細胞分裂(1個で存在する細胞が2個に増える)と,不完全な細胞分裂(1個で存在する細胞が2個の細胞の連結した合胞体になる.1個で存在する細胞が1個失われる)の頻度はつりあっていなくてはならない(図2a).この仮説を検証するため,1個で存在する細胞の細胞分裂のパターンに着目した.その結果,予想とは異なり,1個で存在する細胞が細胞分裂する場合,ほとんどは不完全な細胞分裂により2個の細胞の連結した合胞体になることが明らかになった.この結果は,1個で存在する細胞の集団のみでは1個で存在する細胞の数を維持できないことを意味した.したがって,2個の細胞の連結した合胞体や3個以上の細胞の連結した合胞体からなる細胞の集団からの,1個で存在する細胞の供給を想定する必要があった.
2個以上の細胞の連結した合胞体の映像を解析した結果,細胞分裂に匹敵する高い頻度で,2個以上の細胞の連結した合胞体が断片化してバラバラに分かれ,1個で存在する細胞や短い合胞体を新たに生みだすようすが観察された.以上のGFRα1陽性細胞の集団の挙動をすべてまとめたところ,GFRα1陽性を示す細胞は,不完全な細胞分裂と合胞体の断片化により互いの状態を行き来していることが明らかになった.また興味深いことに,細胞分裂および断片化の発生は,異なるタイプのGFRα1陽性を示す細胞に共通して同じ頻度で起こっていた.
ライブイメージング法による映像からGFRα1陽性細胞の経時的な位置を解析した結果,GFRα1陽性細胞は精上皮の基底部の不特定の場所を無秩序に動きまわっていることが明らかになった.となりあった幹細胞が入れ替わるためには,幹細胞が動く必要がある.観察されたGFRα1陽性細胞の動きは,精子幹細胞の集団非対称の達成において必須のプロセスであると考えられた.
3.マウスの一生にわたる精子の形成はGFRα1陽性細胞の細胞分裂と断片化とのくり返しによりささえられる
パルス標識法およびライブイメージング法による結果から,精子幹細胞のバラバラなクローン運命,異なる状態のあいだの行き来,活発な動きなどが明らかになったが,これらの複雑な挙動をすべて包括したGFRα1陽性細胞の動態は,直観にたより理解することがむずかしかった.一方で,細胞分裂と断片化がGFRα1陽性細胞のかたちの違いにかかわらず同じ頻度で起こるという結果は,複雑な挙動の裏にかくされたシンプルな規則を暗示しているようにも思われた.そこで,数理モデル解析により,実際に測定した数々のデータを包括的に説明するGFRα1陽性細胞の動態の解明に挑戦した.
GFRα1陽性細胞の動態の基本原理をとらえるため,ライブイメージング法により観察されたGFRα1陽性細胞のふるまいを可能なかぎりシンプルにin silicoにおいてモデル化した.すなわち,仮想の精細管に配置したGFRα1陽性を示す1個で存在する細胞,2個の細胞の連結した合胞体,3個以上の細胞の連結した合胞体がランダムに細胞分裂と断片化とをくり返し,断片化により新たに生まれた1個で存在する細胞や短い合胞体は動いてとなりあった細胞と入れ替わる,というモデルを構築した.パラメーターは細胞分裂の頻度および断片化の頻度の2つのみで,それぞれライブイメージング法により実測した値を用いた.そして,この数理モデルがその構築とは独立しているパルス標識の実験の結果を予測できるかどうかを検証することにより,モデルの信頼性を検証した.
解析の結果,数理モデルはパルス標識により実測された数日から1年以上にわたる複雑なGFRα1陽性細胞のクローン運命を高い精度で説明することができた.興味深いことに,この数理モデルはAsモデルでは説明できなかった2n以外の数の細胞の連結した合胞体の存在も正確に予測した.さらに,この数理モデルは定常な状態のデータだけではなく,組織傷害ののちの再生の過程におけるGFRα1陽性細胞の運命も説明することができた.これらの結果は,この数理モデルが多くの実験の結果を包括的に説明する信頼性の高いものであることを明確に示しており,GFRα1陽性細胞は細胞分裂と断片化とをくり返してマウスの一生にわたる精子の形成をささえていることが強く示唆された.特筆すべきは,いっけん複雑なGFRα1陽性細胞の動態が,細胞分裂の頻度と断片化の頻度のたった2つのパラメーターのみにより制御されていることであった.
おわりに
筆者らは,ウェットな実験とドライな理論との融合によるGFRα1陽性細胞の挙動の解析から,マウスの精子幹細胞は細胞分裂と断片化により1個で存在する細胞,2個の細胞の連結した合胞体,3個以上の細胞の連結した合胞体のあいだをくり返し行き来しながら,どれも区別なく等しく幹細胞として機能していると結論づけた(図2b).一般に,Asモデルにおける1個で存在する細胞のように,組織幹細胞とはひとつの特別なタイプの細胞のことをさし示すと考えられがちであるが,この研究からは,マウスの精子幹細胞は異なる状態をくり返し行き来する知られざる性質をもつことが明らかになった.筆者らは,この性質のことを“幹細胞の動的不均一性”(dynamic heterogeneity)とよんでいる.興味深いことに,最近,ポピュラーな幹細胞モデルであるマウスの毛包幹細胞や小腸上皮幹細胞でも同様の性質が見い出されたことから8,9),幹細胞の動的不均一性はさまざまな組織幹細胞に共通する性質かもしれないと考えている.
文 献
- Huckins, C.: The spermatogonial stem cell population in adult rats. I. Their morphology, proliferation and maturation. Anat. Rec., 169, 533-557 (1971)[PubMed]
- Oakberg, E. F.: Spermatogonial stem-cell renewal in the mouse. Anat. Rec., 169, 515-531 (1971)[PubMed]
- Nakagawa, T., Sharma, M., Nabeshima, Y. et al.: Functional hierarchy and reversibility within the murine spermatogenic stem cell compartment. Science, 328, 62-67 (2010)[PubMed]
- Yoshida, S., Sukeno, M. & Nabeshima, Y.: A vasculature-associated niche for undifferentiated spermatogonia in the mouse testis. Science, 317, 1722-1726 (2007)[PubMed]
- Nakagawa, T., Nabeshima, Y. & Yoshida, S.: Functional identification of the actual and potential stem cell compartments in mouse spermatogenesis. Dev. Cell, 12, 195-206 (2007)[PubMed]
- Watt, F. M. & Hogan, B. L.: Out of Eden: stem cells and their niches. Science, 287, 1427-1430 (2000)[PubMed]
- Klein, A. M., Nakagawa, T., Ichikawa, R. et al.: Mouse germ line stem cells undergo rapid and stochastic turnover. Cell Stem Cell, 7, 214-224 (2010)[PubMed]
- Rompolas, P., Mesa, K. R. & Greco, V.: Spatial organization within a niche as a determinant of stem-cell fate. Nature, 502, 513-518 (2013)[PubMed]
- Ritsma, L., Ellenbroek, S. I., Zomer, A. et al.: Intestinal crypt homeostasis revealed at single-stem-cell level by in vivo live imaging. Nature, 507, 362-365 (2014)[PubMed]
著者プロフィール
略歴:2009年 東京大学大学院農学生命科学研究科博士課程 修了,同年 基礎生物学研究所 ポスドクを経て,2010年より同 助教.
研究テーマ:哺乳動物における精子の形成.
抱負:哺乳類における配偶子の形成のしくみを解き明かしていきたい.
吉田 松生(Shosei Yoshida)
基礎生物学研究所 教授.
研究室URL:http://www.nibb.ac.jp/germcell/index.html
© 2014 原 健士朗・吉田松生 Licensed under CC 表示 2.1 日本