膜組み込み酵素YidCによるタンパク質の細胞膜への組み込みの分子機構
熊崎 薫1・千葉志信2・塚崎智也3・濡木 理1
(1東京大学大学院理学系研究科 生物科学専攻構造生命科学研究室,2京都産業大学総合生命科学部 生命システム学科,3奈良先端科学技術大学院大学バイオサイエンス研究科 膜分子複合機能学研究室)
email:熊崎 薫,千葉志信,塚崎智也,濡木 理
DOI: 10.7875/first.author.2014.057
Structural basis of Sec-independent membrane protein insertion by YidC.
Kaoru Kumazaki, Shinobu Chiba, Mizuki Takemoto, Arata Furukawa, Ken-ichi Nishiyama, Yasunori Sugano, Takaharu Mori, Naoshi Dohmae, Kunio Hirata, Yoshiko Nakada-Nakura, Andrés D. Maturana, Yoshiki Tanaka, Hiroyuki Mori, Yuji Sugita, Fumio Arisaka, Koreaki Ito, Ryuichiro Ishitani, Tomoya Tsukazaki, Osamu Nureki
Nature, 509, 516-520 (2014)
細胞膜には生命活動に不可欠な多くの膜タンパク質が埋め込まれて機能している.膜組み込み酵素YidCは細菌から高等生物のオルガネラまで広く保存された膜タンパク質であり,新規に生合成されたタンパク質の細胞膜への組み込みに関与する.今回,筆者らは,YidCの結晶構造を2.4Å分解能で解明した.YidCは5回膜貫通型タンパク質で,親水性のアミノ酸残基を多く含む正電荷を帯びた“親水的な溝”を5本の膜貫通ヘリックスの内側にもっていた.この溝は,細胞の内側および細胞膜の側には開いていた一方,疎水性のコアにより細胞の外側には閉じていた.結晶構造にもとづく遺伝学的および生化学的な解析により,基質タンパク質がYidCの親水的な溝と相互作用することや,溝の中心に位置する保存されたArgがYidCの機能において重要であることが明らかになった.これらの知見から,YidCが正電荷を帯びた溝により疎水的な細胞膜の内部に親水的な環境を形成し,細胞膜の内部において基質タンパク質の細胞外領域と相互作用することにより基質タンパク質を細胞膜へと引き込み,タンパク質の細胞膜への組み込みを達成するという分子機構を提唱した.
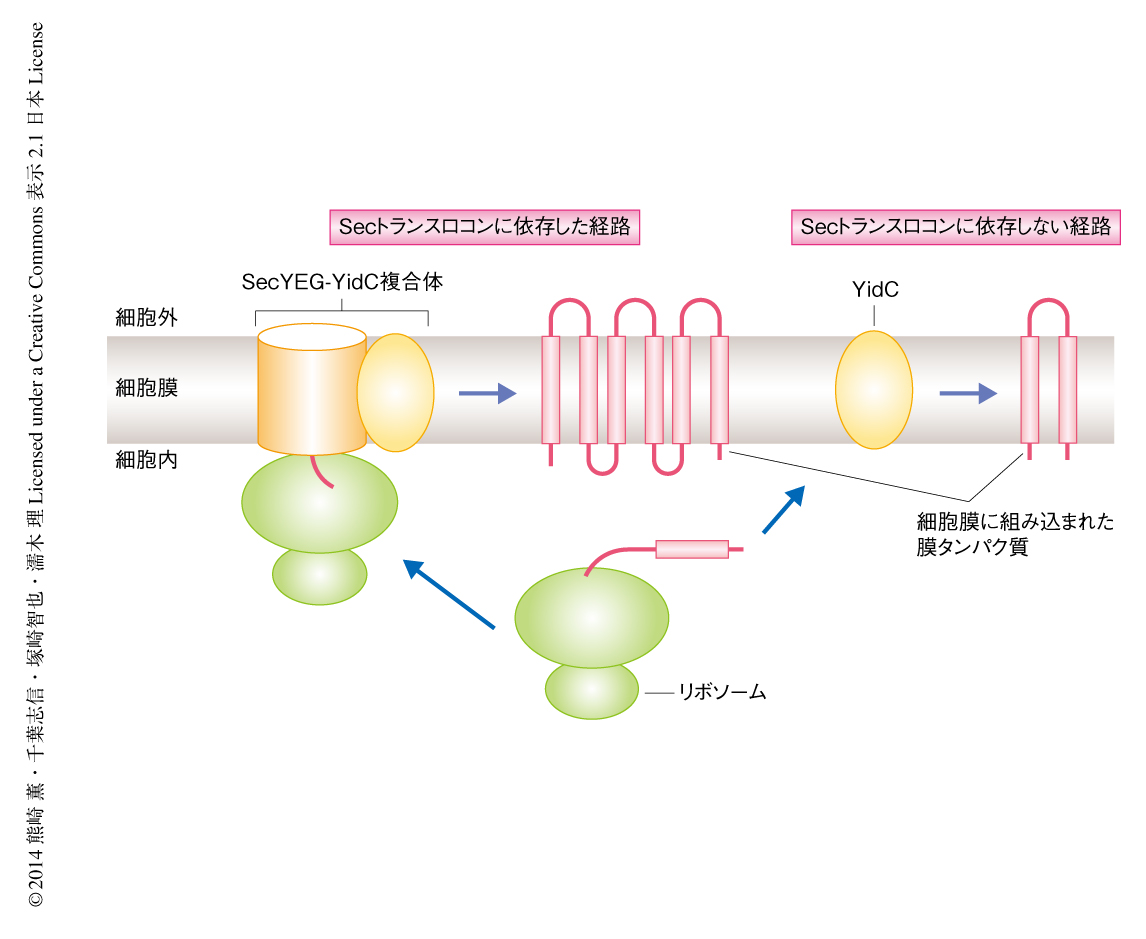
リボソームにおいて新規に生合成された膜タンパク質は,細胞膜へとターゲティングされたのち,細胞膜に存在する膜組み込み装置により細胞膜に組み込まれる.真正細菌の細胞膜ではこの膜組み込み装置として,すべての生物に保存された膜透過・膜組み込みチャネルであるSecトランスロコン,および,膜組み込み酵素YidCが機能している.YidCは,Secトランスロコンと協働して膜タンパク質のフォールディングを促進する分子シャペロンとしてはたらくほか,単独でいくつかのタンパク質を細胞膜に組み込む(図1).その基質となるタンパク質には呼吸鎖複合体のサブユニットも含まれており,細菌の生育において必須である1,2).
タンパク質の細胞膜への組み込みにおいては,基質タンパク質の細胞外領域が細胞膜を透過するとともに,膜貫通領域が細胞膜の内部へと移行する.親水的な細胞外領域が疎水的な細胞膜を透過するのには大きなエネルギー障壁が存在するが,Secトランスロコンは10本の膜貫通ヘリックスにより親水的なチャネルを形成し,細胞外領域をチャネルの内部を透過させることによりこのエネルギー障壁を克服していると考えられている3,4).一方で,YidCは保存された5本の膜貫通ヘリックスをもっており,過去に報告されたYidCと翻訳途中のリボソームとの複合体のクライオ電子顕微鏡による構造から,YidCは二量体としてSecトランスロコンと同様に基質タンパク質を透過させるためのチャネルを形成するというモデルが提唱されていた5).しかしながら,YidCの高分解能での立体構造は報告されておらず,その分子機構の詳細は不明であった.
タンパク質のC末端にGFPタグを付加しその安定性および単分散性を見積もる手法である蛍光検出ゲルろ過クロマトグラフィー法6) を用いて36種類のYidCをスクリーニングし,真正細菌Bacillus haloduransに由来するYidCが構造解析に適していることを見い出した.精製したYidCを脂質キュービック相法により結晶化し,コンストラクトの異なる2つのYidC(YidC 27-266およびYidC27-267)の結晶構造を,それぞれ,2.4Å(PDB ID:3WO6)および3.2Å(PDB ID:3WO7)の分解能で決定した.結晶においてYidCは単量体として存在していた.このことは,ごく最近,YidCが単量体として機能するという報告7,8) がたてつづけになされたこととも一致し,YidCが単量体として機能することが強く示唆された.
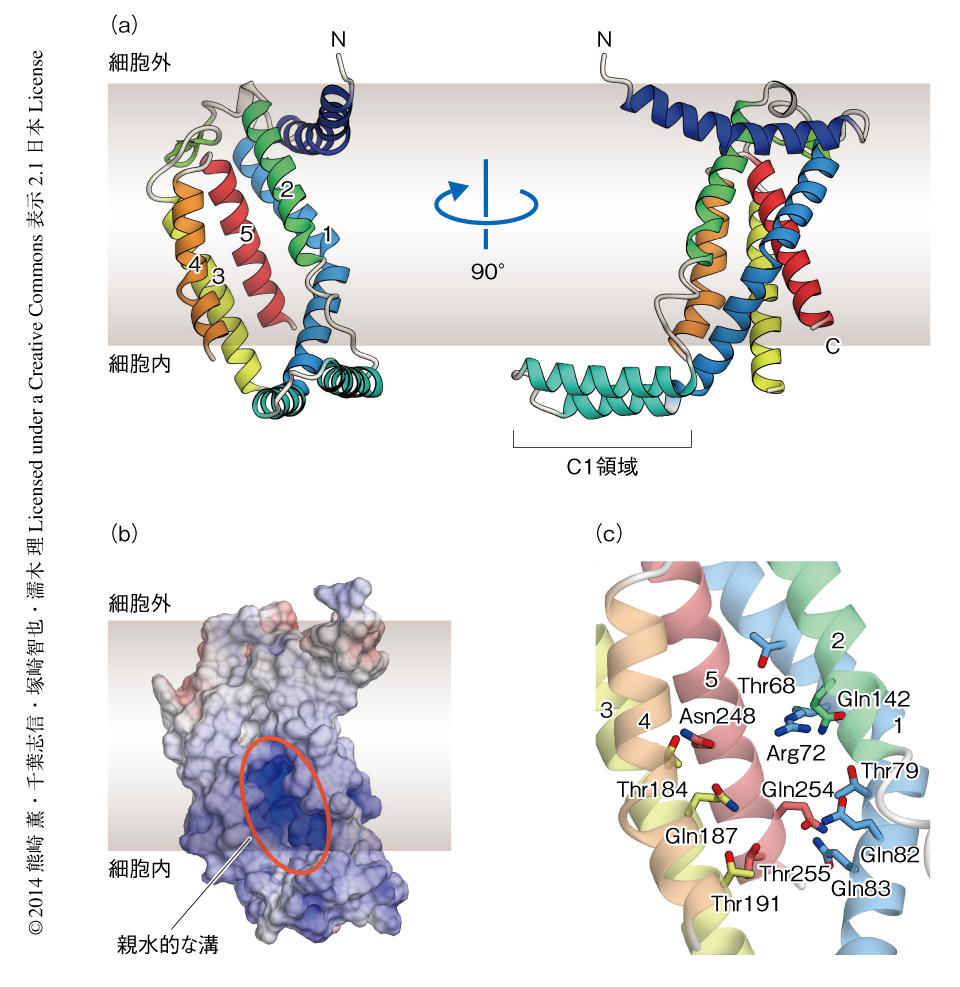
結晶構造からYidCが新規のフォールドをもつ5回膜貫通型タンパク質であることが明らかになった(図2a).YidCは,細胞外にあるN末端領域(E1領域),5本の膜貫通ヘリックス(膜貫通ヘリックス1~膜貫通ヘリックス5)からなるコア領域,膜貫通ヘリックスをつなぐ2つの細胞外領域(E2領域およびE3領域)と2つの細胞内領域(C1領域およびC2領域),細胞内にあるC末端領域(C3領域)から構成されていた.E1領域は1本のαヘリックス,C1領域は2本のαヘリックスからなり,これらのαヘリックスはコア領域から細胞膜に対し平行に突き出ていた.E1領域は両親媒性であり,αヘリックスの片方の面が細胞膜に埋もれている一方で,C1領域は親水的なアミノ酸残基に富んでおり,細胞質に露出していると考えられた.
コンストラクトの異なるYidC27-266とYidC27-267の結晶構造を比較すると,コア領域はよく重なるのに対し,C1領域の2本のαヘリックスは35度ほど回転しており位置が大きくずれていた.また,YidC27-266の分子モデルを脂質二重膜に埋め込んで分子動力学シミュレーションを行ったところ,C1領域は大きくゆれ動いていた.これらのことから,C1領域は非常にフレキシブルであることが示唆された.そこで,C1領域がYidCの機能に重要であるかどうかを調べるため,枯草菌(Bacillus subtilis)におけるYidCのオーソログであるSpoIIIJの遺伝学的な解析を行った.SpoIIIJの基質タンパク質であるMifMの細胞膜への組み込みが低下するとβガラクトシダーゼの発現が誘導される枯草菌9) を用いてSpoIIIJ変異体におけるMifMの細胞膜への組み込みの活性を調べたほか,枯草菌のもつ2つのYidCオーソログ(SpoIIIJおよびYidC2)を欠損させることによる致死性の表現型をSpoIIIJ変異体により相補させることでSpoIIIJ変異体の活性を調べた.これらの解析の結果,C1領域を欠損させたSpoIIIJ変異体は活性が大きく低下したことから,C1領域がYidCの機能において重要な役割をもつことが明らかになった.
YidCの膜貫通ヘリックスの細胞外側は疎水的なアミノ酸残基を多く含んでおり,非常に密に相互作用して疎水性コアを形成していた.一方,細胞内側は膜貫通ヘリックスどうしの相互作用が弱く,膜貫通ヘリックスの内部に溝が形成されていた(図2b).この溝は親水的なアミノ酸残基を多く含んでおり(図2c),とくに,Arg72は溝の中心に位置しそのカウンターイオンとなるアミノ酸残基が近傍に存在しないため,溝の内部の分子表面は正電荷を帯びていた(図2b).この親水的な溝は,細胞の内側および細胞膜の側には開いていた一方,疎水性のコアにより細胞の外側には閉じていた.結晶構造において溝の内部に水分子は観察されなかったが,極性をもつアミノ酸残基が多く存在していたことから,溝の内部には多くの水分子が含まれていると考えられた.分子動力学シミュレーションにおいても,YidCの溝の内部にはつねに20分子ほどの水分子が存在しており,これらのことから,YidCが細胞膜の内部に親水的な環境をつくりだしていることが強く示唆された.そこで,この親水的な溝がYidCの機能に重要であるかどうかを調べるため,さきに述べた枯草菌を用いた遺伝学的な手法によりYidCのオーソログであるSpoIIIJの変異体の解析を行った.その結果,溝の内部に存在する広く保存された親水的な残基のうち,Arg73(B. haloduransにおいてArg72に相当する)をAlaに置換したSpoIIIJ変異体の活性のみが大きく低下した.さらに,このArg73をさまざまなアミノ酸残基に置換したところ,それらの変異体の多くは活性が大きく低下したが,Lysに置換した変異体では活性の低下は小さかった.このことから,親水的な溝に存在する塩基性アミノ酸残基がYidCの機能において重要であることが明らかになった.
YidCの基質タンパク質であるMifMは1回膜貫通型タンパク質であり,N末端側の細胞外領域に2つ,膜貫通領域に1つの酸性アミノ酸残基をもつ.YidCの活性には親水的な溝に存在する塩基性アミノ酸残基が重要であること,YidCのある基質タンパク質の細胞膜への組み込みにおいて細胞外領域の酸性アミノ酸残基が重要であるという報告のあったことから,基質タンパク質の細胞外領域にある酸性アミノ酸残基がYidCの親水的な溝にあるArgと相互作用する可能性が考えられた.そこで,さきに述べた枯草菌を用いた遺伝学的な手法によりMifMの変異体の解析を行った.その結果,MifMの細胞外領域あるいは膜貫通ヘリックスの細胞外側の面に存在する酸性アミノ酸残基を中性アミノ酸残基に置換すると,MifMの細胞膜への組み込みの効率が低下することがわかった.この効率の低下は,酸性アミノ酸残基の数を減らせば減らすほどより顕著になり,3つある酸性アミノ酸残基をすべて中性アミノ酸残基に置換したMifM変異体は,その細胞膜への組み込みの効率がいちじるしく低下した.さらに,YidCの親水的な溝の内部に光架橋剤を導入してMifMとともに大腸菌に発現させることで部位特異的な光架橋実験を行った.その結果,YidCとMifMとの架橋産物が検出され,YidCが親水的な溝を介してMifMと相互作用することが示された.
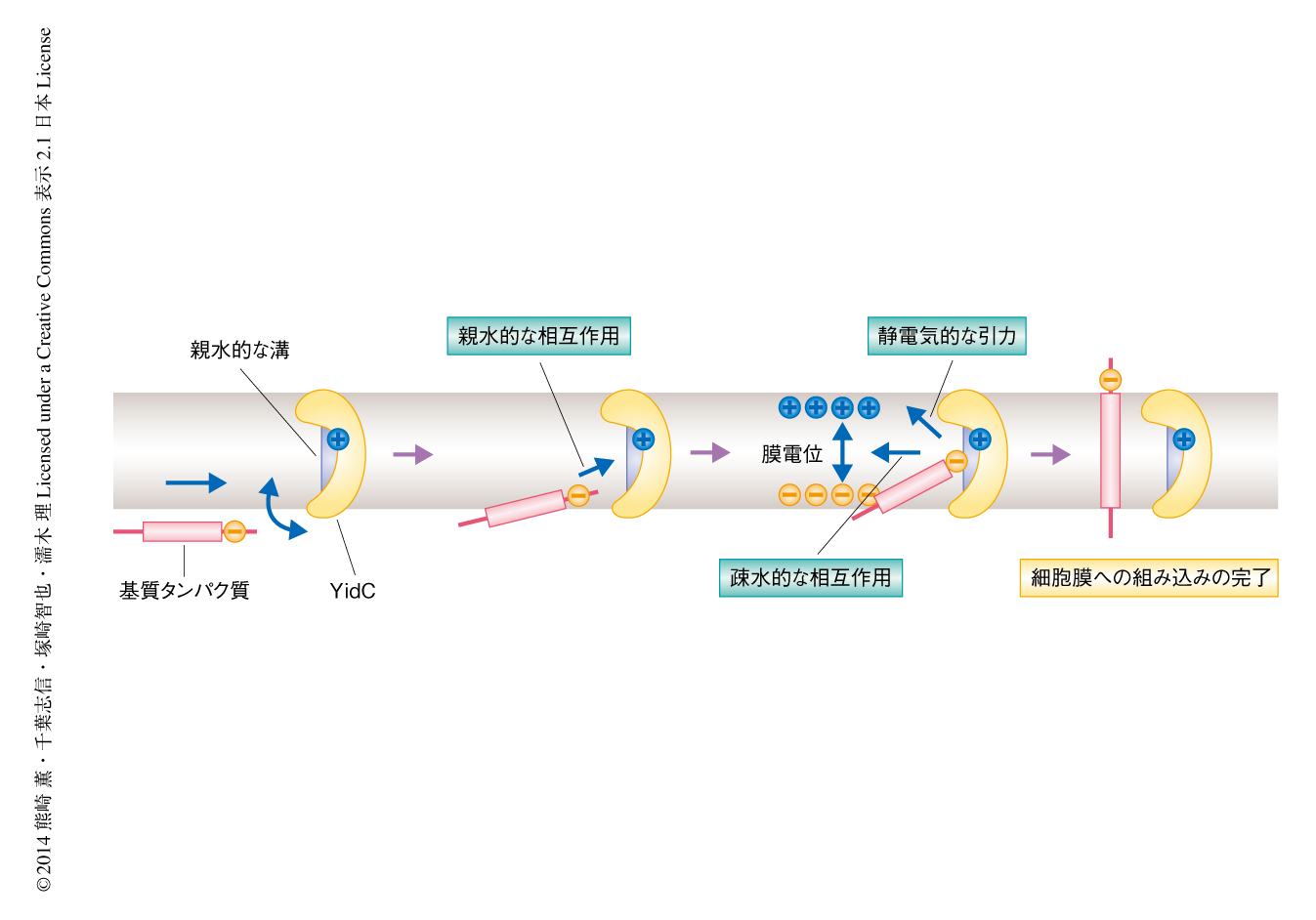
YidCの結晶構造と遺伝学的および生化学的な解析の結果から,以下のようなYidCによる1回膜貫通型タンパク質の細胞膜への組み込みのモデルを提唱した(図3).リボソームにおいて生合成され細胞膜へとターゲティングされた基質タンパク質は,まずYidCのフレキシブルなC1領域と結合する.つづいて,基質タンパク質の親水的な細胞外領域がYidCの親水的な溝と結合することにより,基質タンパク質は細胞膜の内部へと引き込まれる.そののち,基質タンパク質の膜貫通領域がYidCから解離して細胞膜に放出されるとともに,細胞外領域が細胞膜を透過する.過去の知見も総合すると,基質タンパク質の放出のステップは,基質タンパク質の膜貫通領域と脂質分子のアシル鎖とのあいだに生じる疎水性相互作用や,基質タンパク質の細胞外領域に存在する酸性アミノ酸残基が膜電位からうける電気泳動的な引力により促進されるものと考えられた.これまで,YidCは二量体を形成することによりSecトランスロコンと同様にチャネル様の構造を形成すると提唱されていた5).しかしながら,今回の構造解析および機能解析の結果から,YidCはSecトランスロコンとは異なる独自の分子機構によりタンパク質を細胞膜に組み込むことが示唆された.すなわち,YidCは疎水的な細胞膜の内部に親水的な環境をつくりだすことにより,基質タンパク質の親水性の細胞外領域が細胞膜を透過する際のエネルギー障壁を下げ,それにより細胞膜への組み込みを達成するものと考えられた.
筆者らは,今回の研究により,YidCの結晶構造を明らかにし,その立体構造にもとづいた遺伝学的および生化学的な解析により,YidCによるタンパク質の細胞膜への組み込みの分子機構の一端を明らかにした.YidCのX線結晶構造解析に成功し,はじめてその構造を目にしたときには,細胞膜と平行に突き出たαヘリックスなど,そのユニークさに非常に驚かされた.さらに予想外であったことに,結晶構造には過去の研究から提唱されていた“チャネル”は存在していなかった.このことから,同じくタンパク質を細胞膜へ組み込むSecトランスロコンとはまったく異なる分子機構によりYidCははたらいていることが強く示唆された.そして,のちの機能解析により親水的な溝の重要性が明らかになり,さきに述べたような,タンパク質の細胞膜への組み込みのモデルを提唱するにいたった.今回のモデルはタンパク質の細胞膜への組み込みの分子機構としては新しいものであったため,この分野の研究者に受け入れられるかどうか少し不安があったが,そのようななかで参加した海外のある学会では“make senseだ”という声を多く聞くことができ,ほっとした.ただ,たったひとつの結晶構造だけでは,タンパク質の細胞膜への組み込みというダイナミックな反応機構を完全に理解することはできない.さらに,YidCの分子シャペロンとしての機能など,その分子機構には不明な点が多く残されている.この結晶構造をもとに,今後,さらに研究を発展させていきたい.
略歴:東京大学大学院理学系研究科博士課程 在学中.
研究テーマ:タンパク質の細胞膜への組み込みの機構の構造基盤.
関心事:タンパク質の生合成および輸送.
千葉 志信(Shinobu Chiba)
京都産業大学総合生命科学部 准教授.
塚崎 智也(Tomoya Tsukazaki)
奈良先端科学技術大学院大学バイオサイエンス研究科 准教授.科学技術振興機構 さきがけ研究者 兼任.
研究室URL:http://bsw3.naist.jp/tsukazaki/
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2014 熊崎 薫・千葉志信・塚崎智也・濡木 理 Licensed under CC 表示 2.1 日本
(1東京大学大学院理学系研究科 生物科学専攻構造生命科学研究室,2京都産業大学総合生命科学部 生命システム学科,3奈良先端科学技術大学院大学バイオサイエンス研究科 膜分子複合機能学研究室)
email:熊崎 薫,千葉志信,塚崎智也,濡木 理
DOI: 10.7875/first.author.2014.057
Structural basis of Sec-independent membrane protein insertion by YidC.
Kaoru Kumazaki, Shinobu Chiba, Mizuki Takemoto, Arata Furukawa, Ken-ichi Nishiyama, Yasunori Sugano, Takaharu Mori, Naoshi Dohmae, Kunio Hirata, Yoshiko Nakada-Nakura, Andrés D. Maturana, Yoshiki Tanaka, Hiroyuki Mori, Yuji Sugita, Fumio Arisaka, Koreaki Ito, Ryuichiro Ishitani, Tomoya Tsukazaki, Osamu Nureki
Nature, 509, 516-520 (2014)
要 約
細胞膜には生命活動に不可欠な多くの膜タンパク質が埋め込まれて機能している.膜組み込み酵素YidCは細菌から高等生物のオルガネラまで広く保存された膜タンパク質であり,新規に生合成されたタンパク質の細胞膜への組み込みに関与する.今回,筆者らは,YidCの結晶構造を2.4Å分解能で解明した.YidCは5回膜貫通型タンパク質で,親水性のアミノ酸残基を多く含む正電荷を帯びた“親水的な溝”を5本の膜貫通ヘリックスの内側にもっていた.この溝は,細胞の内側および細胞膜の側には開いていた一方,疎水性のコアにより細胞の外側には閉じていた.結晶構造にもとづく遺伝学的および生化学的な解析により,基質タンパク質がYidCの親水的な溝と相互作用することや,溝の中心に位置する保存されたArgがYidCの機能において重要であることが明らかになった.これらの知見から,YidCが正電荷を帯びた溝により疎水的な細胞膜の内部に親水的な環境を形成し,細胞膜の内部において基質タンパク質の細胞外領域と相互作用することにより基質タンパク質を細胞膜へと引き込み,タンパク質の細胞膜への組み込みを達成するという分子機構を提唱した.
はじめに
リボソームにおいて新規に生合成された膜タンパク質は,細胞膜へとターゲティングされたのち,細胞膜に存在する膜組み込み装置により細胞膜に組み込まれる.真正細菌の細胞膜ではこの膜組み込み装置として,すべての生物に保存された膜透過・膜組み込みチャネルであるSecトランスロコン,および,膜組み込み酵素YidCが機能している.YidCは,Secトランスロコンと協働して膜タンパク質のフォールディングを促進する分子シャペロンとしてはたらくほか,単独でいくつかのタンパク質を細胞膜に組み込む(図1).その基質となるタンパク質には呼吸鎖複合体のサブユニットも含まれており,細菌の生育において必須である1,2).
タンパク質の細胞膜への組み込みにおいては,基質タンパク質の細胞外領域が細胞膜を透過するとともに,膜貫通領域が細胞膜の内部へと移行する.親水的な細胞外領域が疎水的な細胞膜を透過するのには大きなエネルギー障壁が存在するが,Secトランスロコンは10本の膜貫通ヘリックスにより親水的なチャネルを形成し,細胞外領域をチャネルの内部を透過させることによりこのエネルギー障壁を克服していると考えられている3,4).一方で,YidCは保存された5本の膜貫通ヘリックスをもっており,過去に報告されたYidCと翻訳途中のリボソームとの複合体のクライオ電子顕微鏡による構造から,YidCは二量体としてSecトランスロコンと同様に基質タンパク質を透過させるためのチャネルを形成するというモデルが提唱されていた5).しかしながら,YidCの高分解能での立体構造は報告されておらず,その分子機構の詳細は不明であった.
1.YidCの結晶構造
タンパク質のC末端にGFPタグを付加しその安定性および単分散性を見積もる手法である蛍光検出ゲルろ過クロマトグラフィー法6) を用いて36種類のYidCをスクリーニングし,真正細菌Bacillus haloduransに由来するYidCが構造解析に適していることを見い出した.精製したYidCを脂質キュービック相法により結晶化し,コンストラクトの異なる2つのYidC(YidC 27-266およびYidC27-267)の結晶構造を,それぞれ,2.4Å(PDB ID:3WO6)および3.2Å(PDB ID:3WO7)の分解能で決定した.結晶においてYidCは単量体として存在していた.このことは,ごく最近,YidCが単量体として機能するという報告7,8) がたてつづけになされたこととも一致し,YidCが単量体として機能することが強く示唆された.
結晶構造からYidCが新規のフォールドをもつ5回膜貫通型タンパク質であることが明らかになった(図2a).YidCは,細胞外にあるN末端領域(E1領域),5本の膜貫通ヘリックス(膜貫通ヘリックス1~膜貫通ヘリックス5)からなるコア領域,膜貫通ヘリックスをつなぐ2つの細胞外領域(E2領域およびE3領域)と2つの細胞内領域(C1領域およびC2領域),細胞内にあるC末端領域(C3領域)から構成されていた.E1領域は1本のαヘリックス,C1領域は2本のαヘリックスからなり,これらのαヘリックスはコア領域から細胞膜に対し平行に突き出ていた.E1領域は両親媒性であり,αヘリックスの片方の面が細胞膜に埋もれている一方で,C1領域は親水的なアミノ酸残基に富んでおり,細胞質に露出していると考えられた.
2.C1領域のフレキシビリティ
コンストラクトの異なるYidC27-266とYidC27-267の結晶構造を比較すると,コア領域はよく重なるのに対し,C1領域の2本のαヘリックスは35度ほど回転しており位置が大きくずれていた.また,YidC27-266の分子モデルを脂質二重膜に埋め込んで分子動力学シミュレーションを行ったところ,C1領域は大きくゆれ動いていた.これらのことから,C1領域は非常にフレキシブルであることが示唆された.そこで,C1領域がYidCの機能に重要であるかどうかを調べるため,枯草菌(Bacillus subtilis)におけるYidCのオーソログであるSpoIIIJの遺伝学的な解析を行った.SpoIIIJの基質タンパク質であるMifMの細胞膜への組み込みが低下するとβガラクトシダーゼの発現が誘導される枯草菌9) を用いてSpoIIIJ変異体におけるMifMの細胞膜への組み込みの活性を調べたほか,枯草菌のもつ2つのYidCオーソログ(SpoIIIJおよびYidC2)を欠損させることによる致死性の表現型をSpoIIIJ変異体により相補させることでSpoIIIJ変異体の活性を調べた.これらの解析の結果,C1領域を欠損させたSpoIIIJ変異体は活性が大きく低下したことから,C1領域がYidCの機能において重要な役割をもつことが明らかになった.
3.正電荷を帯びた親水的な溝
YidCの膜貫通ヘリックスの細胞外側は疎水的なアミノ酸残基を多く含んでおり,非常に密に相互作用して疎水性コアを形成していた.一方,細胞内側は膜貫通ヘリックスどうしの相互作用が弱く,膜貫通ヘリックスの内部に溝が形成されていた(図2b).この溝は親水的なアミノ酸残基を多く含んでおり(図2c),とくに,Arg72は溝の中心に位置しそのカウンターイオンとなるアミノ酸残基が近傍に存在しないため,溝の内部の分子表面は正電荷を帯びていた(図2b).この親水的な溝は,細胞の内側および細胞膜の側には開いていた一方,疎水性のコアにより細胞の外側には閉じていた.結晶構造において溝の内部に水分子は観察されなかったが,極性をもつアミノ酸残基が多く存在していたことから,溝の内部には多くの水分子が含まれていると考えられた.分子動力学シミュレーションにおいても,YidCの溝の内部にはつねに20分子ほどの水分子が存在しており,これらのことから,YidCが細胞膜の内部に親水的な環境をつくりだしていることが強く示唆された.そこで,この親水的な溝がYidCの機能に重要であるかどうかを調べるため,さきに述べた枯草菌を用いた遺伝学的な手法によりYidCのオーソログであるSpoIIIJの変異体の解析を行った.その結果,溝の内部に存在する広く保存された親水的な残基のうち,Arg73(B. haloduransにおいてArg72に相当する)をAlaに置換したSpoIIIJ変異体の活性のみが大きく低下した.さらに,このArg73をさまざまなアミノ酸残基に置換したところ,それらの変異体の多くは活性が大きく低下したが,Lysに置換した変異体では活性の低下は小さかった.このことから,親水的な溝に存在する塩基性アミノ酸残基がYidCの機能において重要であることが明らかになった.
4.YidCと基質タンパク質との相互作用
YidCの基質タンパク質であるMifMは1回膜貫通型タンパク質であり,N末端側の細胞外領域に2つ,膜貫通領域に1つの酸性アミノ酸残基をもつ.YidCの活性には親水的な溝に存在する塩基性アミノ酸残基が重要であること,YidCのある基質タンパク質の細胞膜への組み込みにおいて細胞外領域の酸性アミノ酸残基が重要であるという報告のあったことから,基質タンパク質の細胞外領域にある酸性アミノ酸残基がYidCの親水的な溝にあるArgと相互作用する可能性が考えられた.そこで,さきに述べた枯草菌を用いた遺伝学的な手法によりMifMの変異体の解析を行った.その結果,MifMの細胞外領域あるいは膜貫通ヘリックスの細胞外側の面に存在する酸性アミノ酸残基を中性アミノ酸残基に置換すると,MifMの細胞膜への組み込みの効率が低下することがわかった.この効率の低下は,酸性アミノ酸残基の数を減らせば減らすほどより顕著になり,3つある酸性アミノ酸残基をすべて中性アミノ酸残基に置換したMifM変異体は,その細胞膜への組み込みの効率がいちじるしく低下した.さらに,YidCの親水的な溝の内部に光架橋剤を導入してMifMとともに大腸菌に発現させることで部位特異的な光架橋実験を行った.その結果,YidCとMifMとの架橋産物が検出され,YidCが親水的な溝を介してMifMと相互作用することが示された.
5.YidCによるタンパク質の細胞膜への組み込みのモデル
YidCの結晶構造と遺伝学的および生化学的な解析の結果から,以下のようなYidCによる1回膜貫通型タンパク質の細胞膜への組み込みのモデルを提唱した(図3).リボソームにおいて生合成され細胞膜へとターゲティングされた基質タンパク質は,まずYidCのフレキシブルなC1領域と結合する.つづいて,基質タンパク質の親水的な細胞外領域がYidCの親水的な溝と結合することにより,基質タンパク質は細胞膜の内部へと引き込まれる.そののち,基質タンパク質の膜貫通領域がYidCから解離して細胞膜に放出されるとともに,細胞外領域が細胞膜を透過する.過去の知見も総合すると,基質タンパク質の放出のステップは,基質タンパク質の膜貫通領域と脂質分子のアシル鎖とのあいだに生じる疎水性相互作用や,基質タンパク質の細胞外領域に存在する酸性アミノ酸残基が膜電位からうける電気泳動的な引力により促進されるものと考えられた.これまで,YidCは二量体を形成することによりSecトランスロコンと同様にチャネル様の構造を形成すると提唱されていた5).しかしながら,今回の構造解析および機能解析の結果から,YidCはSecトランスロコンとは異なる独自の分子機構によりタンパク質を細胞膜に組み込むことが示唆された.すなわち,YidCは疎水的な細胞膜の内部に親水的な環境をつくりだすことにより,基質タンパク質の親水性の細胞外領域が細胞膜を透過する際のエネルギー障壁を下げ,それにより細胞膜への組み込みを達成するものと考えられた.
おわりに
筆者らは,今回の研究により,YidCの結晶構造を明らかにし,その立体構造にもとづいた遺伝学的および生化学的な解析により,YidCによるタンパク質の細胞膜への組み込みの分子機構の一端を明らかにした.YidCのX線結晶構造解析に成功し,はじめてその構造を目にしたときには,細胞膜と平行に突き出たαヘリックスなど,そのユニークさに非常に驚かされた.さらに予想外であったことに,結晶構造には過去の研究から提唱されていた“チャネル”は存在していなかった.このことから,同じくタンパク質を細胞膜へ組み込むSecトランスロコンとはまったく異なる分子機構によりYidCははたらいていることが強く示唆された.そして,のちの機能解析により親水的な溝の重要性が明らかになり,さきに述べたような,タンパク質の細胞膜への組み込みのモデルを提唱するにいたった.今回のモデルはタンパク質の細胞膜への組み込みの分子機構としては新しいものであったため,この分野の研究者に受け入れられるかどうか少し不安があったが,そのようななかで参加した海外のある学会では“make senseだ”という声を多く聞くことができ,ほっとした.ただ,たったひとつの結晶構造だけでは,タンパク質の細胞膜への組み込みというダイナミックな反応機構を完全に理解することはできない.さらに,YidCの分子シャペロンとしての機能など,その分子機構には不明な点が多く残されている.この結晶構造をもとに,今後,さらに研究を発展させていきたい.
文 献
- Samuelson, J. C., Chen, M., Jiang, F. et al.: YidC mediates membrane protein insertion in bacteria. Nature, 406, 637-641 (2000)[PubMed]
- Dalbey, R. E., Kuhn, A., Zhu, L. et al.: The membrane insertase YidC. Biochim. Biophys. Acta, 1843, 1489-1496 (2014)[PubMed]
- Van den Berg, B., Clemons, W. M. Jr, Collinson, I. et al.: X-ray structure of a protein-conducting channel. Nature, 427, 36-44 (2004)[PubMed]
- Tsukazaki, T., Mori, H., Fukai, S. et al.: Conformational transition of Sec machinery inferred from bacterial SecYE structures. Nature, 455, 988-991 (2008)[PubMed]
- Kohler, R., Boehringer, D., Greber, B. et al.: YidC and Oxa1 form dimeric insertion pores on the translating ribosome. Mol. Cell, 34, 344-353 (2009)[PubMed]
- Kawate, T. & Gouaux, E.: Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure, 14, 673-681 (2006)[PubMed]
- Seitl, I., Wickles, S., Beckmann, R. et al.: The C-terminal regions of YidC from Rhodopirellula baltica and Oceanicaulis alexandrii bind to ribosomes and partially substitute for SRP receptor function in Escherichia coli. Mol. Microbiol., 91, 408-421 (2014)[PubMed]
- Kedrov, A., Sustarsic, M., de Keyzer, J. et al.: Elucidating the native architecture of the YidC: ribosome complex. J. Mol. Biol., 425, 4112-4124 (2013)[PubMed]
- Chiba, S., Lamsa, A. & Pogliano, K.: A ribosome-nascent chain sensor of membrane protein biogenesis in Bacillus subtilis. EMBO J., 28, 3461-3475 (2009)[PubMed]
著者プロフィール
略歴:東京大学大学院理学系研究科博士課程 在学中.
研究テーマ:タンパク質の細胞膜への組み込みの機構の構造基盤.
関心事:タンパク質の生合成および輸送.
千葉 志信(Shinobu Chiba)
京都産業大学総合生命科学部 准教授.
塚崎 智也(Tomoya Tsukazaki)
奈良先端科学技術大学院大学バイオサイエンス研究科 准教授.科学技術振興機構 さきがけ研究者 兼任.
研究室URL:http://bsw3.naist.jp/tsukazaki/
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2014 熊崎 薫・千葉志信・塚崎智也・濡木 理 Licensed under CC 表示 2.1 日本