脱ユビキチン化酵素OTULINとユビキチンリガーゼHOIPとの相互作用による転写因子NF-κBの制御
阿久津誠人1・川崎政人2・Ivan Dikic 1
(1ドイツBuchmann Institute for Molecular Life Sciences,2物質構造科学研究所構造生物学研究センター)
email:阿久津誠人
DOI: 10.7875/first.author.2014.056
Binding of OTULIN to the PUB domain of HOIP controls NF-κB signaling.
Veronique Schaeffer, Masato Akutsu, Michael H. Olma, Ligia C. Gomes, Masato Kawasaki, Ivan Dikic
Molecular Cell, 54, 349-361 (2014)
直鎖状ポリユビキチン鎖は免疫反応および炎症反応の制御に関与しており,転写因子NF-κBからのシグナル伝達経路において重要な役割をはたしている.直鎖状ポリユビキチン鎖はユビキチンリガーゼであるHOIPを含むLUBAC複合体により合成され,特異的な脱ユビキチン化酵素OTULINにより分解されるが,この相反する機能をもつ2つのタンパク質による直鎖状ポリユビキチン鎖の制御機構の詳細は,まだ完全には解明されていない.筆者らは,HOIPとOTULINが直接に結合することにより,直鎖状ポリユビキチン鎖を介してNF-κBシグナル伝達経路を制御していることを報告した.HOIPのもつPUBドメインは,OTULINあるいは分子シャペロンVCP/p97のもつPIMモチーフと直接に結合した.X線結晶構造解析により,OTULINのPIMモチーフにある保存されたTyrがHOIPのPUBドメインとの結合に重要であること,および,このTyrのリン酸化により相互作用が制御されていることが示された.これらの相互作用は生体においてOTULINをTNF受容体複合体へとリクルートするのに必要であり,HOIPによるNF-κBシグナル伝達経路の活性化と拮抗していた.
ユビキチンはタンパク質の翻訳後修飾分子としてはたらき,生体において多くの機能を制御している.ユビキチンのC末端にあるGlyは,ほかのユビキチンにあるLysの側鎖のεアミノ基,あるいは,N末端にあるMetのαアミノ基とアミド結合することにより,ポリユビキチン鎖を形成する.どのLysあるいはN末端のMetと結合するかにより,Lys48ポリユビキチン鎖,Lys63ポリユビキチン鎖,あるいは,直鎖状ポリユビキチン鎖など,立体構造の異なるさまざまなポリユビキチン鎖が形成される.これらのポリユビキチン鎖はそれぞれ異なる翻訳後修飾分子としてはたらき,生体において多様な役割をはたす1).
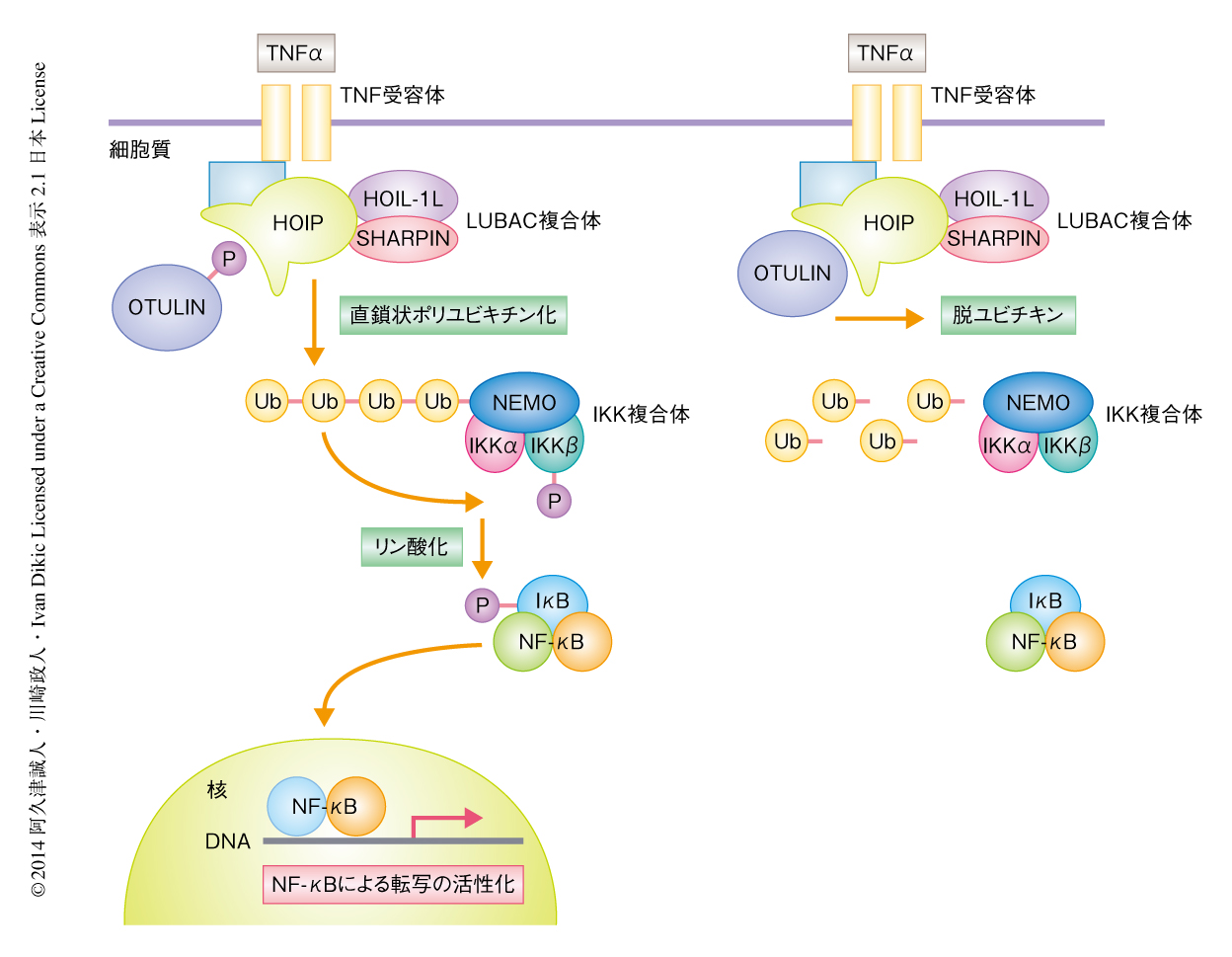
転写因子NF-κBは免疫反応および炎症反応などにかかわるさまざまな遺伝子の転写活性を制御している.通常,NF-κBはその阻害タンパク質であるIκBと結合した不活性な状態として細胞質に存在する.ウイルスへの感染,TNFαあるいは炎症性サイトカインなどの細胞外からの刺激により,IκBはリン酸化やLys48ポリユビキチン化といった修飾をうけプロテアソームに運ばれて分解される.IκBが分解されるとNF-κBは活性化されて核へと移動し,標的となる遺伝子の転写を開始する2)(図1).
直鎖状ポリユビキチンはNF-κBの活性化において重要な役割をはたしている.IκBをリン酸化するIκBキナーゼ(IKK)複合体は,2つの触媒サブユニットIKKαとIKKβ,および,制御サブユニットIKKγ(別名NEMO)の3つのサブユニットから構成されている.そして,HOIP,HOIL-1L,SHARPINから構成される,直鎖状ポリユビキチン鎖に特異的なユビキチンリガーゼであるLUBAC(linear ubiquitin chain assembly complex)複合体によるNEMOの直鎖状ポリユビキチン化が,IKK複合体の活性化そしてNF-κBの制御を行う.
筆者らは,脱ユビキチン化酵素OTULINとユビキチンリガーゼHOIPとの相互作用による転写因子NF-κBの制御について報告した.HOIPは,N末端側の機能未知のPUBドメイン,複数のジンクフィンガードメイン,UBAドメイン,C末端側のユビキチンリガーゼの活性中心を構成するRBRドメインから構成されている.PUBドメインはタンパク質間相互作用にかかわるドメインとして同定され,これまで,HOIPのほか,ATPase活性をもつ分子シャペロンVCP/p97の補因子として知られているUBXD1や,糖タンパク質の糖鎖を切断する加水分解酵素PNGaseなどがPUBドメインをもつことが知られている3).VCP/p97はATPの加水分解によりタンパク質複合体から基質タンパク質を分離する機能をもち,さまざまな補因子とともに小胞体関連分解(ERAD)などの制御を行う4).これら補因子の多くはVCP/p97のN末端側に結合するが,UBXD1やPNGaseはPUBドメインを介してC末端側に結合する.最近,直鎖状ポリユビキチン鎖を特異的に切断する脱ユビキチン化酵素としてOTULINが同定された5,6).OTULINはC末端側に脱ユビキチン化酵素の活性中心を構成するOTUドメインをもち,N末端側の領域はHOIPとの結合に関与すると提案されていた.
筆者らは,OTULINのもつPIMモチーフおよびVCP/p97のC末端にあるPIMモチーフは,HOIPのもつPUBドメインと直接に結合することを明らかにした.LUBAC複合体のX線結晶構造解析の結果,HOIPのPUBドメインのOTULINに対する特徴的な結合様式,および,PIMモチーフのリン酸化による結合の制御機構が示された.さらには,生体においてこれらタンパク質の直接的な結合がNF-κBシグナル伝達機構を制御していることが明らかにされた.
安定同位体により標識したアミノ酸を取り込ませた培養細胞とOrbitrap型の質量分析装置を用いてLUBAC複合体と相互作用するタンパク質を探索した結果,HOIPと相互作用するタンパク質として直鎖状ユビキチン鎖に特異的な脱ユビキチン化酵素であるOTULINを同定した.組換えタンパク質およびその変異体を用いたin vitroタンパク質相互作用実験により,OTULINはHOIPと直接に結合すること,HOIPのN末端側にあるPUBドメインがOTULINと結合することが明らかになった.
HOIPのPUBドメインの結晶化を行い,単波長異常分散法によりX線結晶構造を決定した.HOIPのPUBドメインは9つのαヘリックスと3つの逆平行βストランドから構成されており,N末端側の3つのαヘリックスを除き,PNGaseのPUBドメインと構造を共有していた.HOIPのPUBドメインは,βストランドであるβ1と,αヘリックスであるH5,H6,H7により形成される保存された疎水性領域をもっていた.この疎水性領域は,VCP/p97のC末端と結合するPNGaseのPUBドメインの形成する疎水性ポケットと同様であった.PNGaseのPUBドメインの形成する疎水性ポケットはおもにVCP/p97のTyr805と相互作用しているので,PUBドメインに共通するこの疎水性領域をΨ-Yポケットとよぶことにした(図2).
HOIPのPUBドメインとPNGaseのPUBドメインの対応するΨ-Yポケットの構造の比較から,等価なアミノ酸残基であるHOIPのLys99およびPNGaseのArg55の側鎖の配向の違いをみたところ,PNGaseのArg55のグアニジン基はVCP/p97のC末端のカルボキシル基と相互作用するが,HOIPのPUBドメインのLys99の側鎖は保存されたAsn101のアミド基の存在により反転していた(図2).この異なる側鎖の配向により,HOIPのPUBドメインはタンパク質のC末端だけでなく,タンパク質の中央も認識できる可能性が示唆された.
HOIPのPUBドメインの形成するΨ-Yのポケットに点変異を導入して結合実験を行うことにより,OTULINおよびVCP/p97はPUBドメインの保存されたΨ-Yのポケットを介してHOIPのPUBドメインと直接に結合することが示された.さらに,等温滴定型熱量測定法を用いた親和性の定量化により,HOIPのPUBドメインのOTULINに対する親和性は,p97に対する親和性よりもはるかに高いことがわかった.つぎに,変異体を用いたGSTプルダウンアッセイにより,HOIPのPUBドメインとの結合に必要なOTULINの領域を同定した.興味深いことに,この領域はPNGaseのPUBドメインと結合するVCP/p97のC末端に似たアミノ酸配列を含んでいた.
HOIPとOTULIN,あるいは,HOIPとVCP/p97とのあいだの相互作用について調べるため,HOIPのPUBドメインとOTULINのPIMモチーフとの複合体のX線結晶構造,および,HOIPのPUBドメインとVCP/p97のC末端にあるPIMモチーフとの複合体のX線結晶構造を,それぞれ分子置換法により決定した.HOIPのPUBドメインに対するOTULINのPIMモチーフあるいはVCP/p97のPIMモチーフの相対的な配置は,基本的に同じであった.それぞれのPIMモチーフは,疎水性残基であるOTULINのMet55およびVCP/p97のLeu804がHOIPのPUBドメインの形成するΨ-Yポケットにおさまり,水素結合やファンデルワールス相互作用によりHOIPのPUBドメインと複合体を形成していた.PIMモチーフにあるTyrがこの複合体の形成にとくに重要な役割をはたしていた.OTULINのTyr56およびVCP/p97のTyr805はΨ-Yポケットに深く入り込み,その水酸基は,HOIPのAsn85のアミド基,HOIPのTyr82の主鎖の酸素原子,さらには,水分子を介してHOIPのTyr124の水酸基と水素結合を形成していた.
OTULINのPIMモチーフにあるTyr56に対し,Ala,Phe,Gluへの変異体を作製し,PUBドメインに対する結合をGSTプルダウンアッセイにより検討した.同じく芳香族基をもつPheへの変異体においてもいちじるしい結合力の低下を示したことから,Tyr56の水酸基のPUBドメインとの結合における重要性が再確認された.
興味深いことに,OTULINのTyr56は細胞内でリン酸化されることが報告されている.Tyr56の水酸基とHOIPのPUBドメインとのあいだの水素結合がこの2つのタンパク質の相互作用に必要なことから,Tyrの水酸基へのリン酸基の修飾は結合を阻害することが予想された.実際に,Tyr56のリン酸化したOTULINのPIMモチーフは等温滴定型熱量測定法を用いた親和性の定量化においてPUBドメインとの結合を示さなかった.
HOIPとOTULINとの相互作用の生体における役割を調べるため,TNFαの刺激によるOTULINのTNF受容体へのリクルートにつき解析した.内因性のHOIPおよびOTULINはTNFαの刺激から2分後に活性化されたTNF受容体にリクルートされた.OTULINのTNF受容体へのリクルートは刺激から15分後にピークに達し,そのあと徐々に減少した.これは,以前に報告されている,HOIPのTNF受容体へのリクルートの時間経過と一致していた.さらに,活性化されたTNF受容体への野生型OTULINのリクルートを免疫沈降法により確認したが,Tyr56をPheに置換したOTULIN変異体の検出量は有意に減少した.これは,OTULINがHOIPのPUBドメインと直接に結合することにより活性化したTNF受容体にリクルートされていることを示唆した.
Tyr56をPheに置換したOTULIN変異体を用いて,TNFαにより誘導されるNF-κBシグナルの伝達におけるOTULINとHOIPとの相互作用の役割について調べた.内因性OTULINのノックダウンにより,IκBαのリン酸化の増加,NF-κBの核への移行,そして,転写の活性化が観察された.野生型OTULINの過剰発現はOTULINノックダウンによるこれらの効果を打ち消したが,Tyr56をPheに置換したOTULIN変異体の過剰発現は効果を打ち消さなかった.このOTULIN変異体は野生型OTULINと同等の脱ユビキチン化活性をもつことから,これらの違いは脱ユビキチン化活性の低下によるものではなく,OTULINとHOIPとの相互作用の低下によるものと思われた.野生型OTULINと結合しないHOIP変異体を用いると,OTULINによるNF-κBシグナル伝達経路の阻害効果は著しく低下した.これらの結果は,OTULINとHOIPとのあいだの直接的な結合はNF-κBシグナル伝達経路の活性化を制限するのに重要であることを示した.
この研究により,HOIPのもつPUBドメインのOTULINに対する特徴的な結合様式,および,PIMモチーフのリン酸化による結合の制御機構,さらには,生体においてこれらの結合がNF-κBシグナル伝達機構を制御するのに重要であることが明らかにされた.これらPUBドメインとPIMモチーフとの相互作用は,リン酸化だけではなくユビキチン化によっても制御されている可能性がある.さきに述べたように,HOIPのPUBドメインにあるLys99の側鎖は,それと等価であるPNGaseのArg55の側鎖の配向と比べ反転していた(図2).この点において,HOIPのPUBドメインはほかのPUBドメインとは異なり,タンパク質のC末端にあるPIMモチーフだけでなくタンパク質の中央に存在するPIMモチーフとも結合することができる.興味深いことに,生体におけるさまざまなタンパク質のユビキチン化部位を特定するプロテオミクス研究の結果から,HOIPのLys99はユビキチン化されることが報告されている7).HOIPのLys99の位置および側鎖の配向から,このユビキチン化がOTULINのPIMモチーフとの相互作用を阻害するが,VCP/p97のC末端にあるPIMモチーフとの相互作用は阻害しない可能性が考えられる.さらなる実験による検証が必要とされるが,HOIPのLys99のユビキチン化は,HOIPとOTULINあるいはVCP/p97とのあいだの相互作用の制御において重要な役割をはたしている可能性がある.HOIPのPUBドメインとほかのエフェクタータンパク質との相互作用を調べることは,直鎖状ポリユビキチン化によるNF-κBシグナル伝達経路の制御機構のさらなる解明につながる.筆者らは,HOIPとOTULINとの相互作用がリン酸化やユビキチン化などの翻訳後修飾により制御されながら,TNFαの刺激によるNF-κBシグナル伝達経路の活性化を制御していることを報告した.
なお,英国のグループも,同様の報告をMolecular Cell誌の同じ号に発表した8).
略歴:2007年 総合研究大学院大学物質構造科学研究科 修了,同年 カナダToronto大学 ポスドク,2008年 英国MRC Laboratory of Molecular Biologyポスドク,2011年 ドイツBuchmann Institute for Molecular Life Sciencesポスドクを経て,2014年より同 グループリーダー.
研究テーマ:細胞内タンパク質輸送.
関心事:タンパク質複合体のX線結晶構造解析.
川崎 政人(Masato Kawasaki)
物質構造科学研究所構造生物学研究センター 准教授.
Ivan Dikic
ドイツGoethe大学School of MedicineにてDirector.
© 2014 阿久津誠人・川崎政人・Ivan Dikic Licensed under CC 表示 2.1 日本
(1ドイツBuchmann Institute for Molecular Life Sciences,2物質構造科学研究所構造生物学研究センター)
email:阿久津誠人
DOI: 10.7875/first.author.2014.056
Binding of OTULIN to the PUB domain of HOIP controls NF-κB signaling.
Veronique Schaeffer, Masato Akutsu, Michael H. Olma, Ligia C. Gomes, Masato Kawasaki, Ivan Dikic
Molecular Cell, 54, 349-361 (2014)
要 約
直鎖状ポリユビキチン鎖は免疫反応および炎症反応の制御に関与しており,転写因子NF-κBからのシグナル伝達経路において重要な役割をはたしている.直鎖状ポリユビキチン鎖はユビキチンリガーゼであるHOIPを含むLUBAC複合体により合成され,特異的な脱ユビキチン化酵素OTULINにより分解されるが,この相反する機能をもつ2つのタンパク質による直鎖状ポリユビキチン鎖の制御機構の詳細は,まだ完全には解明されていない.筆者らは,HOIPとOTULINが直接に結合することにより,直鎖状ポリユビキチン鎖を介してNF-κBシグナル伝達経路を制御していることを報告した.HOIPのもつPUBドメインは,OTULINあるいは分子シャペロンVCP/p97のもつPIMモチーフと直接に結合した.X線結晶構造解析により,OTULINのPIMモチーフにある保存されたTyrがHOIPのPUBドメインとの結合に重要であること,および,このTyrのリン酸化により相互作用が制御されていることが示された.これらの相互作用は生体においてOTULINをTNF受容体複合体へとリクルートするのに必要であり,HOIPによるNF-κBシグナル伝達経路の活性化と拮抗していた.
はじめに
ユビキチンはタンパク質の翻訳後修飾分子としてはたらき,生体において多くの機能を制御している.ユビキチンのC末端にあるGlyは,ほかのユビキチンにあるLysの側鎖のεアミノ基,あるいは,N末端にあるMetのαアミノ基とアミド結合することにより,ポリユビキチン鎖を形成する.どのLysあるいはN末端のMetと結合するかにより,Lys48ポリユビキチン鎖,Lys63ポリユビキチン鎖,あるいは,直鎖状ポリユビキチン鎖など,立体構造の異なるさまざまなポリユビキチン鎖が形成される.これらのポリユビキチン鎖はそれぞれ異なる翻訳後修飾分子としてはたらき,生体において多様な役割をはたす1).
転写因子NF-κBは免疫反応および炎症反応などにかかわるさまざまな遺伝子の転写活性を制御している.通常,NF-κBはその阻害タンパク質であるIκBと結合した不活性な状態として細胞質に存在する.ウイルスへの感染,TNFαあるいは炎症性サイトカインなどの細胞外からの刺激により,IκBはリン酸化やLys48ポリユビキチン化といった修飾をうけプロテアソームに運ばれて分解される.IκBが分解されるとNF-κBは活性化されて核へと移動し,標的となる遺伝子の転写を開始する2)(図1).
直鎖状ポリユビキチンはNF-κBの活性化において重要な役割をはたしている.IκBをリン酸化するIκBキナーゼ(IKK)複合体は,2つの触媒サブユニットIKKαとIKKβ,および,制御サブユニットIKKγ(別名NEMO)の3つのサブユニットから構成されている.そして,HOIP,HOIL-1L,SHARPINから構成される,直鎖状ポリユビキチン鎖に特異的なユビキチンリガーゼであるLUBAC(linear ubiquitin chain assembly complex)複合体によるNEMOの直鎖状ポリユビキチン化が,IKK複合体の活性化そしてNF-κBの制御を行う.
筆者らは,脱ユビキチン化酵素OTULINとユビキチンリガーゼHOIPとの相互作用による転写因子NF-κBの制御について報告した.HOIPは,N末端側の機能未知のPUBドメイン,複数のジンクフィンガードメイン,UBAドメイン,C末端側のユビキチンリガーゼの活性中心を構成するRBRドメインから構成されている.PUBドメインはタンパク質間相互作用にかかわるドメインとして同定され,これまで,HOIPのほか,ATPase活性をもつ分子シャペロンVCP/p97の補因子として知られているUBXD1や,糖タンパク質の糖鎖を切断する加水分解酵素PNGaseなどがPUBドメインをもつことが知られている3).VCP/p97はATPの加水分解によりタンパク質複合体から基質タンパク質を分離する機能をもち,さまざまな補因子とともに小胞体関連分解(ERAD)などの制御を行う4).これら補因子の多くはVCP/p97のN末端側に結合するが,UBXD1やPNGaseはPUBドメインを介してC末端側に結合する.最近,直鎖状ポリユビキチン鎖を特異的に切断する脱ユビキチン化酵素としてOTULINが同定された5,6).OTULINはC末端側に脱ユビキチン化酵素の活性中心を構成するOTUドメインをもち,N末端側の領域はHOIPとの結合に関与すると提案されていた.
筆者らは,OTULINのもつPIMモチーフおよびVCP/p97のC末端にあるPIMモチーフは,HOIPのもつPUBドメインと直接に結合することを明らかにした.LUBAC複合体のX線結晶構造解析の結果,HOIPのPUBドメインのOTULINに対する特徴的な結合様式,および,PIMモチーフのリン酸化による結合の制御機構が示された.さらには,生体においてこれらタンパク質の直接的な結合がNF-κBシグナル伝達機構を制御していることが明らかにされた.
1.OTULINはHOIPと直接に結合する
安定同位体により標識したアミノ酸を取り込ませた培養細胞とOrbitrap型の質量分析装置を用いてLUBAC複合体と相互作用するタンパク質を探索した結果,HOIPと相互作用するタンパク質として直鎖状ユビキチン鎖に特異的な脱ユビキチン化酵素であるOTULINを同定した.組換えタンパク質およびその変異体を用いたin vitroタンパク質相互作用実験により,OTULINはHOIPと直接に結合すること,HOIPのN末端側にあるPUBドメインがOTULINと結合することが明らかになった.
2.HOIPのPUBドメインのX線結晶構造
HOIPのPUBドメインの結晶化を行い,単波長異常分散法によりX線結晶構造を決定した.HOIPのPUBドメインは9つのαヘリックスと3つの逆平行βストランドから構成されており,N末端側の3つのαヘリックスを除き,PNGaseのPUBドメインと構造を共有していた.HOIPのPUBドメインは,βストランドであるβ1と,αヘリックスであるH5,H6,H7により形成される保存された疎水性領域をもっていた.この疎水性領域は,VCP/p97のC末端と結合するPNGaseのPUBドメインの形成する疎水性ポケットと同様であった.PNGaseのPUBドメインの形成する疎水性ポケットはおもにVCP/p97のTyr805と相互作用しているので,PUBドメインに共通するこの疎水性領域をΨ-Yポケットとよぶことにした(図2).
HOIPのPUBドメインとPNGaseのPUBドメインの対応するΨ-Yポケットの構造の比較から,等価なアミノ酸残基であるHOIPのLys99およびPNGaseのArg55の側鎖の配向の違いをみたところ,PNGaseのArg55のグアニジン基はVCP/p97のC末端のカルボキシル基と相互作用するが,HOIPのPUBドメインのLys99の側鎖は保存されたAsn101のアミド基の存在により反転していた(図2).この異なる側鎖の配向により,HOIPのPUBドメインはタンパク質のC末端だけでなく,タンパク質の中央も認識できる可能性が示唆された.
3.HOIPのPUBドメインとOTULINとの複合体のX線結晶構造
HOIPのPUBドメインの形成するΨ-Yのポケットに点変異を導入して結合実験を行うことにより,OTULINおよびVCP/p97はPUBドメインの保存されたΨ-Yのポケットを介してHOIPのPUBドメインと直接に結合することが示された.さらに,等温滴定型熱量測定法を用いた親和性の定量化により,HOIPのPUBドメインのOTULINに対する親和性は,p97に対する親和性よりもはるかに高いことがわかった.つぎに,変異体を用いたGSTプルダウンアッセイにより,HOIPのPUBドメインとの結合に必要なOTULINの領域を同定した.興味深いことに,この領域はPNGaseのPUBドメインと結合するVCP/p97のC末端に似たアミノ酸配列を含んでいた.
HOIPとOTULIN,あるいは,HOIPとVCP/p97とのあいだの相互作用について調べるため,HOIPのPUBドメインとOTULINのPIMモチーフとの複合体のX線結晶構造,および,HOIPのPUBドメインとVCP/p97のC末端にあるPIMモチーフとの複合体のX線結晶構造を,それぞれ分子置換法により決定した.HOIPのPUBドメインに対するOTULINのPIMモチーフあるいはVCP/p97のPIMモチーフの相対的な配置は,基本的に同じであった.それぞれのPIMモチーフは,疎水性残基であるOTULINのMet55およびVCP/p97のLeu804がHOIPのPUBドメインの形成するΨ-Yポケットにおさまり,水素結合やファンデルワールス相互作用によりHOIPのPUBドメインと複合体を形成していた.PIMモチーフにあるTyrがこの複合体の形成にとくに重要な役割をはたしていた.OTULINのTyr56およびVCP/p97のTyr805はΨ-Yポケットに深く入り込み,その水酸基は,HOIPのAsn85のアミド基,HOIPのTyr82の主鎖の酸素原子,さらには,水分子を介してHOIPのTyr124の水酸基と水素結合を形成していた.
4.Tyr56のリン酸化はOTULINとHOIPとの相互作用を制御する
OTULINのPIMモチーフにあるTyr56に対し,Ala,Phe,Gluへの変異体を作製し,PUBドメインに対する結合をGSTプルダウンアッセイにより検討した.同じく芳香族基をもつPheへの変異体においてもいちじるしい結合力の低下を示したことから,Tyr56の水酸基のPUBドメインとの結合における重要性が再確認された.
興味深いことに,OTULINのTyr56は細胞内でリン酸化されることが報告されている.Tyr56の水酸基とHOIPのPUBドメインとのあいだの水素結合がこの2つのタンパク質の相互作用に必要なことから,Tyrの水酸基へのリン酸基の修飾は結合を阻害することが予想された.実際に,Tyr56のリン酸化したOTULINのPIMモチーフは等温滴定型熱量測定法を用いた親和性の定量化においてPUBドメインとの結合を示さなかった.
5.OTULINとHOIPとの相互作用による転写因子NF-κBの制御
HOIPとOTULINとの相互作用の生体における役割を調べるため,TNFαの刺激によるOTULINのTNF受容体へのリクルートにつき解析した.内因性のHOIPおよびOTULINはTNFαの刺激から2分後に活性化されたTNF受容体にリクルートされた.OTULINのTNF受容体へのリクルートは刺激から15分後にピークに達し,そのあと徐々に減少した.これは,以前に報告されている,HOIPのTNF受容体へのリクルートの時間経過と一致していた.さらに,活性化されたTNF受容体への野生型OTULINのリクルートを免疫沈降法により確認したが,Tyr56をPheに置換したOTULIN変異体の検出量は有意に減少した.これは,OTULINがHOIPのPUBドメインと直接に結合することにより活性化したTNF受容体にリクルートされていることを示唆した.
Tyr56をPheに置換したOTULIN変異体を用いて,TNFαにより誘導されるNF-κBシグナルの伝達におけるOTULINとHOIPとの相互作用の役割について調べた.内因性OTULINのノックダウンにより,IκBαのリン酸化の増加,NF-κBの核への移行,そして,転写の活性化が観察された.野生型OTULINの過剰発現はOTULINノックダウンによるこれらの効果を打ち消したが,Tyr56をPheに置換したOTULIN変異体の過剰発現は効果を打ち消さなかった.このOTULIN変異体は野生型OTULINと同等の脱ユビキチン化活性をもつことから,これらの違いは脱ユビキチン化活性の低下によるものではなく,OTULINとHOIPとの相互作用の低下によるものと思われた.野生型OTULINと結合しないHOIP変異体を用いると,OTULINによるNF-κBシグナル伝達経路の阻害効果は著しく低下した.これらの結果は,OTULINとHOIPとのあいだの直接的な結合はNF-κBシグナル伝達経路の活性化を制限するのに重要であることを示した.
おわりに
この研究により,HOIPのもつPUBドメインのOTULINに対する特徴的な結合様式,および,PIMモチーフのリン酸化による結合の制御機構,さらには,生体においてこれらの結合がNF-κBシグナル伝達機構を制御するのに重要であることが明らかにされた.これらPUBドメインとPIMモチーフとの相互作用は,リン酸化だけではなくユビキチン化によっても制御されている可能性がある.さきに述べたように,HOIPのPUBドメインにあるLys99の側鎖は,それと等価であるPNGaseのArg55の側鎖の配向と比べ反転していた(図2).この点において,HOIPのPUBドメインはほかのPUBドメインとは異なり,タンパク質のC末端にあるPIMモチーフだけでなくタンパク質の中央に存在するPIMモチーフとも結合することができる.興味深いことに,生体におけるさまざまなタンパク質のユビキチン化部位を特定するプロテオミクス研究の結果から,HOIPのLys99はユビキチン化されることが報告されている7).HOIPのLys99の位置および側鎖の配向から,このユビキチン化がOTULINのPIMモチーフとの相互作用を阻害するが,VCP/p97のC末端にあるPIMモチーフとの相互作用は阻害しない可能性が考えられる.さらなる実験による検証が必要とされるが,HOIPのLys99のユビキチン化は,HOIPとOTULINあるいはVCP/p97とのあいだの相互作用の制御において重要な役割をはたしている可能性がある.HOIPのPUBドメインとほかのエフェクタータンパク質との相互作用を調べることは,直鎖状ポリユビキチン化によるNF-κBシグナル伝達経路の制御機構のさらなる解明につながる.筆者らは,HOIPとOTULINとの相互作用がリン酸化やユビキチン化などの翻訳後修飾により制御されながら,TNFαの刺激によるNF-κBシグナル伝達経路の活性化を制御していることを報告した.
なお,英国のグループも,同様の報告をMolecular Cell誌の同じ号に発表した8).
文 献
- Komander, D., Rape, M.: The ubiquitin code. Annu. Rev. Biochem., 81, 203-229 (2012)[PubMed]
- Iwai, K.: Diverse roles of the ubiquitin system in NF-κB activation. Biochim. Biophys. Acta, 1843, 129-136 (2014)[PubMed]
- Suzuki, T., Park, H., Till, E. A. et al.: The PUB domain: a putative protein-protein interaction domain implicated in the ubiquitin-proteasome pathway. Biochem. Biophys. Res. Commun., 287, 1083-1087 (2001)[PubMed]
- Wolf, D. H. & Stolz, A.: The Cdc48 machine in endoplasmic reticulum associated protein degradation. Biochim. Biophys. Acta, 1823, 117-124 (2012)[PubMed]
- Rivkin, E., Almeida, S. M., Ceccarelli, D. F. et al.: The linear ubiquitin-specific deubiquitinase gumby regulates angiogenesis. Nature, 498, 318-324 (2013)[PubMed]
- Keusekotten, K., Elliott, P. R., Glockner, L. et al.: OTULIN antagonizes LUBAC signaling by specifically hydrolyzing Met1-linked polyubiquitin. Cell, 153, 1312-1326 (2013)[PubMed]
- Wagner, S. A., Beli, P., Weinert, B. T. et al.: A proteome-wide, quantitative survey of in vivo ubiquitylation sites reveals widespread regulatory roles. Mol. Cell. Proteomics, 10, M111.013284 (2011)[PubMed]
- Elliott, P. R., Nielsen, S. V., Marco-Casanova, P. et al.: Molecular basis and regulation of OTULIN-LUBAC interaction. Mol. Cell, 54, 335-348 (2014)[PubMed]
著者プロフィール
略歴:2007年 総合研究大学院大学物質構造科学研究科 修了,同年 カナダToronto大学 ポスドク,2008年 英国MRC Laboratory of Molecular Biologyポスドク,2011年 ドイツBuchmann Institute for Molecular Life Sciencesポスドクを経て,2014年より同 グループリーダー.
研究テーマ:細胞内タンパク質輸送.
関心事:タンパク質複合体のX線結晶構造解析.
川崎 政人(Masato Kawasaki)
物質構造科学研究所構造生物学研究センター 准教授.
Ivan Dikic
ドイツGoethe大学School of MedicineにてDirector.
© 2014 阿久津誠人・川崎政人・Ivan Dikic Licensed under CC 表示 2.1 日本