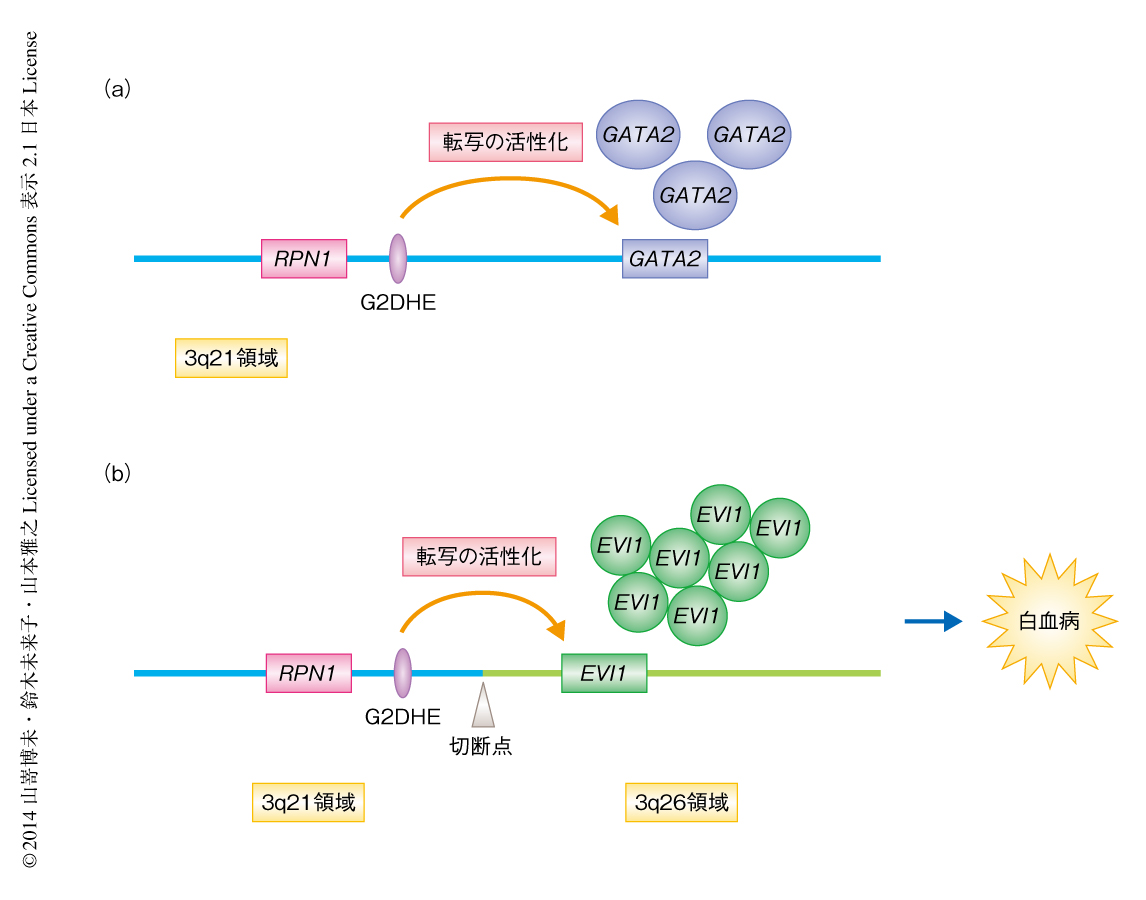
第3染色体における逆位ではGATA2遺伝子のエンハンサーがEVI1遺伝子の発現を活性化することにより白血病が発症する
山嵜博未・鈴木未来子・山本雅之
(東北大学大学院医学系研究科 医化学分野)
email:山本雅之
DOI: 10.7875/first.author.2014.050
A remote GATA2 hematopoietic enhancer drives leukemogenesis in inv(3)(q21;q26) by activating EVI1 expression.
Hiromi Yamazaki, Mikiko Suzuki, Akihito Otsuki, Ritsuko Shimizu, Emery H. Bresnick, James Douglas Engel, Masayuki Yamamoto
Cancer Cell, 25, 415-427 (2014)
第3染色体の3q21領域と3q26領域とのあいだの転座および逆位は,急性骨髄性白血病および骨髄異形成症候群の予後不良につながることが知られている.この転座および逆位をもつ白血病細胞では3q26領域に存在するEVI1遺伝子が高く発現しており,これが白血病の発症の原因となっている.このEVI1遺伝子の高発現には3q21領域に存在するなんらかのエンハンサーの関与することが予想されたが,そのエンハンサーは同定されておらず,転座および逆位を起こした対立遺伝子においてEVI1遺伝子がどのような機序により異常に高発現しているのかは不明であった.筆者らは,2つの大腸菌人工染色体を連結する技術を用いてヒトの3q21領域と3q26領域とのあいだの逆位を再現し,このコンストラクトをもつトランスジェニックマウスを作製した.このトランスジェニックマウスでは造血細胞に特異的にEVI1遺伝子の高発現がみられ,24週齢以降に白血病を発症した.一方,このコンストラクトから3q21領域に位置するGATA2遺伝子のエンハンサーのみを欠損したトランスジェニックマウスを作製したところ,造血細胞におけるEVI1遺伝子の発現は有意に低下し白血病の発症は抑制された.これらの結果より,3q21領域と3q26領域とのあいだの逆位によりEVI1遺伝子に近接したGATA2遺伝子のエンハンサーがEVI1遺伝子の転写を活性化することにより,白血病の発症を誘導することが明らかになった.
染色体の転座および逆位による遺伝子構造の変化は遺伝子の発現の異常を惹起しがんをひき起こす.とくに,造血器の腫瘍の領域においては古くからさかんに研究がなされ,さまざまな種類の転座および逆位が報告されている.染色体の転座および逆位によりひき起こされる遺伝子の異常には2つの種類がある.ひとつは,2つの遺伝子がタンパク質をコードする領域において組換えを起こすことにより異常な融合タンパク質をつくりだすものである.もうひとつは,遺伝子発現の制御領域(エンハンサー)が別の原がん遺伝子の近傍に移動することにより原がん遺伝子の発現の異常をもたらすものである.融合タンパク質の機能は続々と明らかにされており,その治療法の開発が進んでいる.一方で,原がん遺伝子の発現の異常による場合は,広い範囲のゲノム領域からエンハンサーをみつけだすのが困難であるため,融合タンパク質の場合に比べ研究は遅れている.
第3染色体の3q21領域と3q26領域とのあいだの転座および逆位は,急性骨髄性白血病および骨髄異形成症候群の一部でみつかっており,この転座および逆位をともなう白血病はきわめて予後が悪いことが知られている1).この転座および逆位を起こした対立遺伝子では3q26領域に位置する原がん遺伝子であるEVI1遺伝子が高く発現する2,3).EVI1は正常な造血幹細胞および造血前駆細胞の維持において必須の役割をはたす転写因子であるが,造血細胞におけるEVI1の過剰な発現は白血病の発症を誘導することが報告されている4-6).3q21領域と3q26領域とのあいだの転座および逆位において,3q21領域に位置するなんらかのエンハンサーがEVI1遺伝子の転写を活性化することにより白血病を発症することが予想されていたが,そのエンハンサーの実体はまったくわかっていなかった.
造血幹細胞および造血前駆細胞の維持に必須の転写因子GATA2の研究において,培養細胞を用いた実験により,マウスのGata2遺伝子の転写開始点の上流77 kbに遺伝子発現の制御領域の存在することが示されていた7).そこで,この領域がマウスの個体において造血幹細胞および造血前駆細胞におけるGata2遺伝子のエンハンサーとしてはたらくかどうか検証した.マウスのGata2遺伝子の上流186 kbを含むDNA断片にGFP遺伝子を連結したコンストラクトを用いてレポータートランスジェニックマウスを作製したところ,GFPの発現は内在性のGata2遺伝子の発現プロファイルを再現し,造血幹細胞および造血前駆細胞において高く発現した.一方で,Gata2遺伝子の転写開始点の上流77 kbの領域を欠損したレポータートランスジェニックマウスにおいては,造血幹細胞および造血前駆細胞におけるGFPの蛍光は減弱していた.以上の結果より,上流77 kbの領域がマウスの造血幹細胞および造血前駆細胞においてGata2遺伝子のエンハンサーとしてはたらくことが個体のレベルにて明らかになった.このことから,この領域をGATA2遺伝子遠位造血エンハンサー(GATA2 hematopoietic distal enhancer:G2DHE)と命名した.
このG2DHEはヒトとマウスのあいだで高度に保存されていた.興味深いことに,ヒトのG2DHEの下流には3q21領域と3q26領域とのあいだの転座および逆位における切断点が集中して存在する3,8).この事実にもとづき,本来はGATA2遺伝子のエンハンサーとしてはたらくG2DHEが,3q21領域と3q26領域とのあいだの転座および逆位によりEVI1遺伝子を活性化しているのではないかという仮説をたてた.
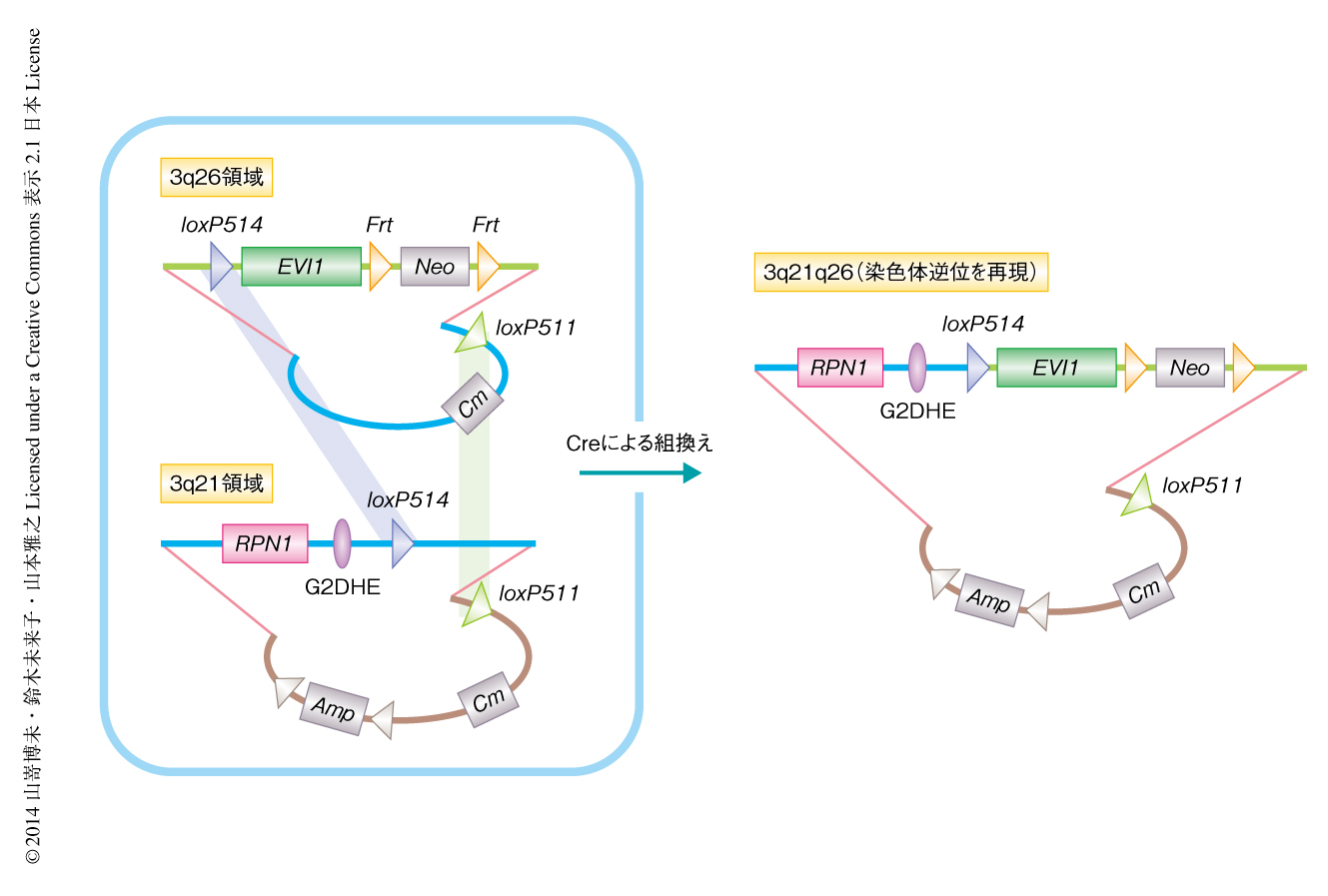
3q21領域と3q26領域とのあいだで転座および逆位を起こした対立遺伝子においてEVI1遺伝子の活性化にはたらくエンハンサーを明らかにするため,大腸菌人工染色体(bacterial artificial chromosome:BAC)を用いたトランスジェニックマウスの技術を応用して,ヒトの3q21領域と3q26領域とのあいだに逆位を起こした対立遺伝子の遺伝子座をもつモデルマウスを作製した.筆者らは以前より,BACを用いることにより100 kb以上にわたる広い範囲のDNAをもつトランスジェニックマウスを作製する技術を確立してきた.それにくわえ,この研究では,筆者らの共同研究者が開発した2つのBACクローンをCre-loxP系を用いて結合する技術9) を導入した.一般に,Cre-loxP系はCre組換え酵素の発現により2カ所のloxP配列で挟まれた領域を除去する目的で使用されるが,この技術はloxP配列に変異を導入したloxP511配列およびloxP514配列を用いて,2つのBACクローンのあいだで組換えを行うものである(図1).
まず,ヒトゲノムBACクローンライブラリーより3q21領域と3q26領域をそれぞれ含む2つのBACクローンを選び,逆位を起こす切断点の部分に相同組換えによりloxP514配列を導入した.つぎに,逆位を起こす切断点の部分のloxP514配列とBACベクターの内部に導入したloxP511配列とのあいだで組換えを起こし連結させることにより,3q21領域と3q26領域とのあいだに逆位をもつBACクローンを作製した(図1).このBACクローンを用いて,3系統のトランスジェニックマウスを樹立した.この染色体逆位モデルマウスのおのおのの組織においてEVI1遺伝子の発現を解析したところ,内在性のマウスEvi1遺伝子は肺および腎臓において高い発現がみられたのに対し,外来性のEVI1遺伝子の発現は造血組織において特異的であった.さらに,骨髄においておのおのの血球系統および分化段階の造血細胞について調べたところ,造血幹細胞および造血前駆細胞において特異的に外来性のEVI1遺伝子の高発現が認められた.これらのことから,3q21領域には造血幹細胞および造血前駆細胞においてEVI1遺伝子の活性化にはたらくエンハンサーが存在し,これがEVI1遺伝子の高発現を誘導することが示唆された.
作製された染色体逆位モデルマウスがヒトにおける3q21領域と3q26領域との転座および逆位により起こる症状を再現するかどうか調べるため,3系統のトランスジェニックマウスを長期的に観察したところ,24週齢以降より白血球の数の急激な増加を示す個体が出現した.さらに,野生型のマウスと比較し生存率がいちじるしく低下していた.白血球の数が高い値を示した個体に関して詳細に解析したところ,軽度の貧血および脾腫を呈し,末梢血には芽球が観察された.また,肝臓や肺などの組織において白血球の浸潤が認められた.これらの結果より,染色体逆位モデルマウスは白血病を発症して致死となっていることが明らかになった.
染色体逆位モデルマウスがどのような種類の白血病を発症しているのかを明らかにするため,末梢血の白血病細胞のフローサイトメトリーによる解析および形態学的な解析を行った.その結果,2系統のトランスジェニックマウスではヒトにおける3q21領域と3q26領域との転座および逆位により発症するのと一致した骨髄性白血病を,1系統のトランスジェニックマウスではリンパ球性白血病を発症することがわかった.骨髄性白血病を発症するトランスジェニックマウスの系統はリンパ球性白血病を発症するトランスジェニックマウスの系統と比較しより高いEVI1遺伝子の発現を示したことから,EVI1遺伝子の発現量が白血病の種類と関係することが予想された.
染色体逆位モデルマウスの骨髄細胞を免疫不全マウスに移植し経過を観察した.レシピエントマウスは移植ののち30~40日のうちにすべての個体が白血病を発症し死亡した.さらに,白血病細胞の解析によりレシピエントマウスはドナーマウスと同じ種類の白血病を発症していることがわかった.このように,染色体逆位モデルマウスから得られた白血病細胞はレシピエントマウスの個体においても自律的に増殖し,白血病の病態を再現できることが明らかになった.
G2DHEが染色体逆位モデルマウスにおいてEVI1遺伝子の発現を誘導するかどうかを検証するため,3q21領域と3q26領域との逆位をもつBACクローンからG2DHEを欠損したコンストラクトを作製し,これを用いてトランスジェニックマウスを作製した.3q21領域と3q26領域との逆位をもつトランスジェニックマウスは24週齢以降に白血病の発症が原因で生存率が低下したのに対し,そこからG2DHEを欠損したトランスジェニックマウスでは白血病の発症が抑制された.EVI1遺伝子の発現量の違いが白血病の発症に寄与することが考えられたため,白血病を発症するまえの12週齢のマウスを用いてEVI1遺伝子の発現量を解析した.その結果,G2DHEを欠損した染色体逆位モデルマウスの造血幹細胞および造血前駆細胞におけるEVI1遺伝子の発現は,G2DHEの欠損のない染色体逆位モデルマウスと比較し有意に低下していることがわかった.また,興味深いことに,染色体逆位モデルマウスの骨髄には造血幹細胞および造血前駆細胞を含むLin陰性Sca-1陽性c-kit陽性細胞の画分に,野生型のマウスには認められないCD34強陽性Flt3陰性細胞が蓄積していることを発見した.このような異常な細胞の増加はG2DHEを欠損した染色体逆位モデルマウスの骨髄には認められなかったことから,白血病の発症の指標となる可能性が考えられた.CD34強陽性Flt3陰性細胞が白血病細胞あるいは白血病幹細胞の前駆細胞であるかどうかは現在のところ不明であるが,今後の解析により詳細な性状の理解が期待される.以上の結果より,G2DHEは染色体逆位モデルマウスにおいてEVI1遺伝子の活性化を介して白血病の発症に寄与することが明らかとなった.
この研究により,正常な細胞では造血幹細胞および造血前駆細胞においてGATA2遺伝子を発現させるはたらきをもつエンハンサーG2DHEは,3q21領域と3q26領域との転座および逆位によりEVI1遺伝子に近接し,造血幹細胞および造血前駆細胞においてEVI1遺伝子の転写を活性化することにより白血病の発症を誘導することが明らかになった(図2).ほぼ同時に発表された論文においても,ヒトの白血病細胞を用いた実験から同様の結論が示されている10).今後は,G2DHEによるEVI1遺伝子の転写の活性化について,詳細な機構の解明が期待される.それにより,エンハンサーを標的とした治療法の開発へとつながることが考えられる.また,BACクローン連結技術を用いた新規の転座あるいは逆位のモデルマウスの確立が,研究の遅れているほかの転座あるいは逆位による症例にも応用されることにより,多くの疾患の発症機構の解明にも役だつことを期待している.
略歴:2013年 東北大学大学院医学系研究科にて博士号取得,同年より弘前大学大学院医学研究科 助教.
研究テーマ:転写制御の破綻による発がんの機構.
抱負:加齢にともなうがんや神経変性疾患などの病態形成のしくみを解き明かしたい.
鈴木 未来子(Mikiko Suzuki)
略歴:2008年 筑波大学大学院人間総合科学研究科にて博士号取得,同年 東北大学大学院医学系研究科 研究員,2010年 同 助教を経て,2013年 同 講師.
研究テーマ:遺伝子制御領域の変異による疾患の発症の機構.
抱負:大規模ゲノムシークエンス解析と臨床研究とのあいだをつなぐマウスモデルをつくりたい.
山本 雅之(Masayuki Yamamoto)
東北大学大学院医学系研究科 教授.
研究室URL:http://www.dmbc.med.tohoku.ac.jp/official/
© 2014 山嵜博未・鈴木未来子・山本雅之 Licensed under CC 表示 2.1 日本
(東北大学大学院医学系研究科 医化学分野)
email:山本雅之
DOI: 10.7875/first.author.2014.050
A remote GATA2 hematopoietic enhancer drives leukemogenesis in inv(3)(q21;q26) by activating EVI1 expression.
Hiromi Yamazaki, Mikiko Suzuki, Akihito Otsuki, Ritsuko Shimizu, Emery H. Bresnick, James Douglas Engel, Masayuki Yamamoto
Cancer Cell, 25, 415-427 (2014)
要 約
第3染色体の3q21領域と3q26領域とのあいだの転座および逆位は,急性骨髄性白血病および骨髄異形成症候群の予後不良につながることが知られている.この転座および逆位をもつ白血病細胞では3q26領域に存在するEVI1遺伝子が高く発現しており,これが白血病の発症の原因となっている.このEVI1遺伝子の高発現には3q21領域に存在するなんらかのエンハンサーの関与することが予想されたが,そのエンハンサーは同定されておらず,転座および逆位を起こした対立遺伝子においてEVI1遺伝子がどのような機序により異常に高発現しているのかは不明であった.筆者らは,2つの大腸菌人工染色体を連結する技術を用いてヒトの3q21領域と3q26領域とのあいだの逆位を再現し,このコンストラクトをもつトランスジェニックマウスを作製した.このトランスジェニックマウスでは造血細胞に特異的にEVI1遺伝子の高発現がみられ,24週齢以降に白血病を発症した.一方,このコンストラクトから3q21領域に位置するGATA2遺伝子のエンハンサーのみを欠損したトランスジェニックマウスを作製したところ,造血細胞におけるEVI1遺伝子の発現は有意に低下し白血病の発症は抑制された.これらの結果より,3q21領域と3q26領域とのあいだの逆位によりEVI1遺伝子に近接したGATA2遺伝子のエンハンサーがEVI1遺伝子の転写を活性化することにより,白血病の発症を誘導することが明らかになった.
はじめに
染色体の転座および逆位による遺伝子構造の変化は遺伝子の発現の異常を惹起しがんをひき起こす.とくに,造血器の腫瘍の領域においては古くからさかんに研究がなされ,さまざまな種類の転座および逆位が報告されている.染色体の転座および逆位によりひき起こされる遺伝子の異常には2つの種類がある.ひとつは,2つの遺伝子がタンパク質をコードする領域において組換えを起こすことにより異常な融合タンパク質をつくりだすものである.もうひとつは,遺伝子発現の制御領域(エンハンサー)が別の原がん遺伝子の近傍に移動することにより原がん遺伝子の発現の異常をもたらすものである.融合タンパク質の機能は続々と明らかにされており,その治療法の開発が進んでいる.一方で,原がん遺伝子の発現の異常による場合は,広い範囲のゲノム領域からエンハンサーをみつけだすのが困難であるため,融合タンパク質の場合に比べ研究は遅れている.
第3染色体の3q21領域と3q26領域とのあいだの転座および逆位は,急性骨髄性白血病および骨髄異形成症候群の一部でみつかっており,この転座および逆位をともなう白血病はきわめて予後が悪いことが知られている1).この転座および逆位を起こした対立遺伝子では3q26領域に位置する原がん遺伝子であるEVI1遺伝子が高く発現する2,3).EVI1は正常な造血幹細胞および造血前駆細胞の維持において必須の役割をはたす転写因子であるが,造血細胞におけるEVI1の過剰な発現は白血病の発症を誘導することが報告されている4-6).3q21領域と3q26領域とのあいだの転座および逆位において,3q21領域に位置するなんらかのエンハンサーがEVI1遺伝子の転写を活性化することにより白血病を発症することが予想されていたが,そのエンハンサーの実体はまったくわかっていなかった.
1.GATA2遺伝子の遠位エンハンサーは造血細胞におけるGATA2遺伝子の発現に必須である
造血幹細胞および造血前駆細胞の維持に必須の転写因子GATA2の研究において,培養細胞を用いた実験により,マウスのGata2遺伝子の転写開始点の上流77 kbに遺伝子発現の制御領域の存在することが示されていた7).そこで,この領域がマウスの個体において造血幹細胞および造血前駆細胞におけるGata2遺伝子のエンハンサーとしてはたらくかどうか検証した.マウスのGata2遺伝子の上流186 kbを含むDNA断片にGFP遺伝子を連結したコンストラクトを用いてレポータートランスジェニックマウスを作製したところ,GFPの発現は内在性のGata2遺伝子の発現プロファイルを再現し,造血幹細胞および造血前駆細胞において高く発現した.一方で,Gata2遺伝子の転写開始点の上流77 kbの領域を欠損したレポータートランスジェニックマウスにおいては,造血幹細胞および造血前駆細胞におけるGFPの蛍光は減弱していた.以上の結果より,上流77 kbの領域がマウスの造血幹細胞および造血前駆細胞においてGata2遺伝子のエンハンサーとしてはたらくことが個体のレベルにて明らかになった.このことから,この領域をGATA2遺伝子遠位造血エンハンサー(GATA2 hematopoietic distal enhancer:G2DHE)と命名した.
このG2DHEはヒトとマウスのあいだで高度に保存されていた.興味深いことに,ヒトのG2DHEの下流には3q21領域と3q26領域とのあいだの転座および逆位における切断点が集中して存在する3,8).この事実にもとづき,本来はGATA2遺伝子のエンハンサーとしてはたらくG2DHEが,3q21領域と3q26領域とのあいだの転座および逆位によりEVI1遺伝子を活性化しているのではないかという仮説をたてた.
2.大腸菌人工染色体を用いた新規の染色体逆位モデルマウスの作製
3q21領域と3q26領域とのあいだで転座および逆位を起こした対立遺伝子においてEVI1遺伝子の活性化にはたらくエンハンサーを明らかにするため,大腸菌人工染色体(bacterial artificial chromosome:BAC)を用いたトランスジェニックマウスの技術を応用して,ヒトの3q21領域と3q26領域とのあいだに逆位を起こした対立遺伝子の遺伝子座をもつモデルマウスを作製した.筆者らは以前より,BACを用いることにより100 kb以上にわたる広い範囲のDNAをもつトランスジェニックマウスを作製する技術を確立してきた.それにくわえ,この研究では,筆者らの共同研究者が開発した2つのBACクローンをCre-loxP系を用いて結合する技術9) を導入した.一般に,Cre-loxP系はCre組換え酵素の発現により2カ所のloxP配列で挟まれた領域を除去する目的で使用されるが,この技術はloxP配列に変異を導入したloxP511配列およびloxP514配列を用いて,2つのBACクローンのあいだで組換えを行うものである(図1).
まず,ヒトゲノムBACクローンライブラリーより3q21領域と3q26領域をそれぞれ含む2つのBACクローンを選び,逆位を起こす切断点の部分に相同組換えによりloxP514配列を導入した.つぎに,逆位を起こす切断点の部分のloxP514配列とBACベクターの内部に導入したloxP511配列とのあいだで組換えを起こし連結させることにより,3q21領域と3q26領域とのあいだに逆位をもつBACクローンを作製した(図1).このBACクローンを用いて,3系統のトランスジェニックマウスを樹立した.この染色体逆位モデルマウスのおのおのの組織においてEVI1遺伝子の発現を解析したところ,内在性のマウスEvi1遺伝子は肺および腎臓において高い発現がみられたのに対し,外来性のEVI1遺伝子の発現は造血組織において特異的であった.さらに,骨髄においておのおのの血球系統および分化段階の造血細胞について調べたところ,造血幹細胞および造血前駆細胞において特異的に外来性のEVI1遺伝子の高発現が認められた.これらのことから,3q21領域には造血幹細胞および造血前駆細胞においてEVI1遺伝子の活性化にはたらくエンハンサーが存在し,これがEVI1遺伝子の高発現を誘導することが示唆された.
3.染色体逆位モデルマウスは白血病を発症する
作製された染色体逆位モデルマウスがヒトにおける3q21領域と3q26領域との転座および逆位により起こる症状を再現するかどうか調べるため,3系統のトランスジェニックマウスを長期的に観察したところ,24週齢以降より白血球の数の急激な増加を示す個体が出現した.さらに,野生型のマウスと比較し生存率がいちじるしく低下していた.白血球の数が高い値を示した個体に関して詳細に解析したところ,軽度の貧血および脾腫を呈し,末梢血には芽球が観察された.また,肝臓や肺などの組織において白血球の浸潤が認められた.これらの結果より,染色体逆位モデルマウスは白血病を発症して致死となっていることが明らかになった.
染色体逆位モデルマウスがどのような種類の白血病を発症しているのかを明らかにするため,末梢血の白血病細胞のフローサイトメトリーによる解析および形態学的な解析を行った.その結果,2系統のトランスジェニックマウスではヒトにおける3q21領域と3q26領域との転座および逆位により発症するのと一致した骨髄性白血病を,1系統のトランスジェニックマウスではリンパ球性白血病を発症することがわかった.骨髄性白血病を発症するトランスジェニックマウスの系統はリンパ球性白血病を発症するトランスジェニックマウスの系統と比較しより高いEVI1遺伝子の発現を示したことから,EVI1遺伝子の発現量が白血病の種類と関係することが予想された.
染色体逆位モデルマウスの骨髄細胞を免疫不全マウスに移植し経過を観察した.レシピエントマウスは移植ののち30~40日のうちにすべての個体が白血病を発症し死亡した.さらに,白血病細胞の解析によりレシピエントマウスはドナーマウスと同じ種類の白血病を発症していることがわかった.このように,染色体逆位モデルマウスから得られた白血病細胞はレシピエントマウスの個体においても自律的に増殖し,白血病の病態を再現できることが明らかになった.
4.エンハンサーG2DHEは逆位を起こした対立遺伝子においてEVI1遺伝子の転写を活性化し白血病の発症を誘導する
G2DHEが染色体逆位モデルマウスにおいてEVI1遺伝子の発現を誘導するかどうかを検証するため,3q21領域と3q26領域との逆位をもつBACクローンからG2DHEを欠損したコンストラクトを作製し,これを用いてトランスジェニックマウスを作製した.3q21領域と3q26領域との逆位をもつトランスジェニックマウスは24週齢以降に白血病の発症が原因で生存率が低下したのに対し,そこからG2DHEを欠損したトランスジェニックマウスでは白血病の発症が抑制された.EVI1遺伝子の発現量の違いが白血病の発症に寄与することが考えられたため,白血病を発症するまえの12週齢のマウスを用いてEVI1遺伝子の発現量を解析した.その結果,G2DHEを欠損した染色体逆位モデルマウスの造血幹細胞および造血前駆細胞におけるEVI1遺伝子の発現は,G2DHEの欠損のない染色体逆位モデルマウスと比較し有意に低下していることがわかった.また,興味深いことに,染色体逆位モデルマウスの骨髄には造血幹細胞および造血前駆細胞を含むLin陰性Sca-1陽性c-kit陽性細胞の画分に,野生型のマウスには認められないCD34強陽性Flt3陰性細胞が蓄積していることを発見した.このような異常な細胞の増加はG2DHEを欠損した染色体逆位モデルマウスの骨髄には認められなかったことから,白血病の発症の指標となる可能性が考えられた.CD34強陽性Flt3陰性細胞が白血病細胞あるいは白血病幹細胞の前駆細胞であるかどうかは現在のところ不明であるが,今後の解析により詳細な性状の理解が期待される.以上の結果より,G2DHEは染色体逆位モデルマウスにおいてEVI1遺伝子の活性化を介して白血病の発症に寄与することが明らかとなった.
おわりに
この研究により,正常な細胞では造血幹細胞および造血前駆細胞においてGATA2遺伝子を発現させるはたらきをもつエンハンサーG2DHEは,3q21領域と3q26領域との転座および逆位によりEVI1遺伝子に近接し,造血幹細胞および造血前駆細胞においてEVI1遺伝子の転写を活性化することにより白血病の発症を誘導することが明らかになった(図2).ほぼ同時に発表された論文においても,ヒトの白血病細胞を用いた実験から同様の結論が示されている10).今後は,G2DHEによるEVI1遺伝子の転写の活性化について,詳細な機構の解明が期待される.それにより,エンハンサーを標的とした治療法の開発へとつながることが考えられる.また,BACクローン連結技術を用いた新規の転座あるいは逆位のモデルマウスの確立が,研究の遅れているほかの転座あるいは逆位による症例にも応用されることにより,多くの疾患の発症機構の解明にも役だつことを期待している.
文 献
- Lugthart, S., van Drunen, E., van Norden, Y. et al.: High EVI1 levels predict adverse outcome in acute myeloid leukemia: prevalence of EVI1 overexpression and chromosome 3q26 abnormalities underestimated. Blood, 111, 4329-4337 (2008)[PubMed]
- Morishita, K., Parganas, E., William, C. L. et al.: Activation of EVI1 gene expression in human acute myelogenous leukemias by translocations spanning 300-400 kilobases on chromosome band 3q26. Proc. Natl. Acad. Sci. USA, 89, 3937-3941 (1992)[PubMed]
- Suzukawa, K., Parganas, E., Gajjar, A. et al.: Identification of a breakpoint cluster region 3' of the ribophorin I gene at 3q21 associated with the transcriptional activation of the EVI1 gene in acute myelogenous leukemias with inv(3)(q21q26). Blood, 84, 2681-2688 (1994)[PubMed]
- Yoshimi, A., Goyama, S., Watanabe-Okochi, N. et al.: Evi1 represses PTEN expression and activates PI3K/AKT/mTOR via interactions with polycomb proteins. Blood, 117, 3617-3628 (2011)[PubMed]
- Goyama, S., Yamamoto, G., Shimabe, M. et al.: Evi-1 is a critical regulator for hematopoietic stem cells and transformed leukemic cells. Cell Stem Cell, 3, 207-220 (2008)[PubMed]
- Kataoka, K., Sato, T., Yoshimi, A. et al.: Evi1 is essential for hematopoietic stem cell self-renewal, and its expression marks hematopoietic cells with long-term multilineage repopulating activity. J. Exp. Med., 208, 2403-2416 (2011)[PubMed]
- Grass, J. A., Jing, H., Kim, S. I. et al.: Distinct functions of dispersed GATA factor complexes at an endogenous gene locus. Mol. Cell. Biol., 26, 7056-7067 (2006)[PubMed]
- Suzukawa, K., Taki, T., Abe, T. et al.: Identification of translocational breakpoints within the intron region before the last coding exon (exon 12) of the EVI1 gene in two cases of CML-BC with inv(3)(q21q26). Genomics, 42, 356-360 (1997)[PubMed]
- Brandt, W., Khandekar, M., Suzuki, N. et al.: Defining the functional boundaries of the Gata2 locus by rescue with a linked bacterial artificial chromosome transgene. J. Biol. Chem., 283, 8976-8983 (2008)[PubMed]
- Groschel, S., Sanders, M. A., Hoogenboezem, R. et al.: A single oncogenic enhancer-rearrangement causes concomitant deregulation of EVI1 and GATA2 in leukemia. Cell, 157, 369-381 (2014)[PubMed]
著者プロフィール
略歴:2013年 東北大学大学院医学系研究科にて博士号取得,同年より弘前大学大学院医学研究科 助教.
研究テーマ:転写制御の破綻による発がんの機構.
抱負:加齢にともなうがんや神経変性疾患などの病態形成のしくみを解き明かしたい.
鈴木 未来子(Mikiko Suzuki)
略歴:2008年 筑波大学大学院人間総合科学研究科にて博士号取得,同年 東北大学大学院医学系研究科 研究員,2010年 同 助教を経て,2013年 同 講師.
研究テーマ:遺伝子制御領域の変異による疾患の発症の機構.
抱負:大規模ゲノムシークエンス解析と臨床研究とのあいだをつなぐマウスモデルをつくりたい.
山本 雅之(Masayuki Yamamoto)
東北大学大学院医学系研究科 教授.
研究室URL:http://www.dmbc.med.tohoku.ac.jp/official/
© 2014 山嵜博未・鈴木未来子・山本雅之 Licensed under CC 表示 2.1 日本