新生仔の大脳皮質第4層における神経回路の再編の2光子顕微鏡によるイメージング
水野秀信・岩里琢治
(国立遺伝学研究所 形質遺伝研究部門)
email:水野秀信,岩里琢治
DOI: 10.7875/first.author.2014.049
NMDAR-regulated dynamics of layer 4 neuronal dendrites during thalamocortical reorganization in neonates.
Hidenobu Mizuno, Wenshu Luo, Etsuko Tarusawa, Yoshikazu M. Saito, Takuya Sato, Yumiko Yoshimura, Shigeyoshi Itohara, Takuji Iwasato
Neuron, 82, 365-379 (2014)
新生仔の大脳皮質では視床からの入力に依存して視床皮質回路の再編が起こる.しかしながら,方法論の不備のためそのダイナミクスおよび基盤となる分子機構は知られていない.筆者らは,バレル構造をもつマウスの体性感覚野の特徴を利用して,その一端を解明した.バレルの内側にかたまって投射する視床皮質軸索と,視床皮質軸索とシナプスを形成するバレル細胞の樹状突起を,それぞれ緑色と赤色に蛍光標識することに成功した.2光子顕微鏡によるタイムラプスイメージングを行ったところ,新生仔期のバレル細胞の樹状突起は伸縮しながらバレルの内側に枝を広げることがわかった.一方,NMDA型グルタミン酸受容体を欠損したバレル細胞では,樹状突起はさらに大きく伸縮しながら正しい接合相手の存在しないバレルの外側にも枝を広げた.この研究により,哺乳類の新生仔における視床皮質回路の再編がはじめて直接的に観察された.さらに,NMDA型グルタミン酸受容体は樹状突起の伸縮を細胞自律的に制御することにより,正確な視床皮質回路の形成に貢献することが示唆された.
ヒトの脳の表面の大部分をしめる大脳皮質(新皮質)は哺乳類に特有の構造であり,知覚,運動,思考,記憶など高度な情報処理を担う.成人の大脳皮質の神経回路は精密かつ複雑だが,出生のときには未熟でおおまかにしかできていない.生まれてからさまざまな刺激をうけるなかで大脳皮質の神経回路は成長するが1,2),生まれた直後の大脳皮質における神経回路の再編の実際の過程や分子機構は,いままでほとんどわかっていなかった.筆者らは,バレル構造をもつというマウスの体性感覚野(バレル野)の特徴を利用し,この問題に取り組んだ.バレルはマウスやラットのバレル野第4層に特徴的にみられる組織学的な構造であり,1本のヒゲからの入力を伝達するすべての視床皮質軸索の終末は,1個のバレルの内側にクラスターを形成する3,4).一方,第4層星状ニューロン(バレル細胞)はおもにバレルの縁に位置し,樹状突起をバレルの内側のみに広げて視床皮質軸索とシナプスを形成する.こうした精緻な神経回路は新生仔期においてヒゲや視床からの入力に依存して形成されるが,この正確な神経回路により,ヒゲとバレルは機能的にも厳密な1対1対応をなす.この研究では,新生仔の大脳皮質における視床皮質回路の再編の過程をin vivoにおいてイメージングする最初のステップとして,マウスのバレル細胞の樹状突起が正しい接合相手の存在するバレルの内側にむかって枝を広げる過程に焦点をしぼって解析した.
新生仔マウスにてバレル細胞の樹状突起の形態をin vivoにおいて観察するためには,大脳皮質のニューロンをまばらかつ高輝度に標識することが必須である.子宮内電気穿孔法を用いることにより第4層のニューロンに選択的に遺伝子を導入することはできるが,通常の方法では標識されるニューロンが過密になるため細胞の形態の解析は困難であった5).筆者らは,tTA/TRE増幅系を利用して,ごく少数の細胞でのみ目的の遺伝子およびCre組換え酵素の遺伝子の発現を増幅する手法を開発し,“スーパーノバ法”と名づけた.この手法を子宮内電気穿孔法と組み合わせることにより,赤色蛍光タンパク質(RFP)を第4層にまばらに発現させ,バレル細胞の樹状突起の形態を可視化することに成功した.
また,スーパーノバ法ではRFPとともにCre組換え酵素も高く発現するため,RFPにより標識された細胞において遺伝子を特異的にノックアウトできることも期待された.GFPレポーターマウスを用いてその効率を検証したところ,RFPにより高輝度に標識された第4層のニューロン(樹状突起の形態の解析が可能なもの)のすべてにおいて,Cre組換え酵素による組換えを確認できた.逆に,組換えのある細胞のすべてがRFPに陽性であった.さらに,この方法によりNMDA型グルタミン酸受容体の必須サブユニットであるNR1をノックアウトしたマウスから得た大脳皮質の急性切片において,RFPにより標識されたバレル細胞からホールセル記録を行ったところ,そのすべてにおいてNMDA型グルタミン酸受容体が欠損していることを確認できた.
以上の結果から,スーパーノバ法により大脳皮質の層について選択的に単一のニューロンを高輝度に蛍光標識できること,また同時に,蛍光標識された細胞において特異的に遺伝子をノックアウトできることが示された.今回,開発されたスーパーノバ法は,大脳皮質だけでなく,電気穿孔法による遺伝子導入が可能なあらゆる組織に適用できる.細胞をin vivoにおいてまばらに標識し,標識された細胞において特異的に遺伝子をノックアウトする方法としては,これまでにMADM法などマウスの遺伝学を用いた手法が報告されている6,7).しかし,これらの手法を用いるためには費用や施設のうえで大きな制約がある.また,1回の実験に1年以上かかることから,さまざまな機能をもつ蛍光タンパク質など日進月歩の周辺技術をすばやく取り入れることができない.スーパーノバ法はこうした従来法の弱点を克服しており,細胞自律的な遺伝子機能の解析のため有用である.
生体においてバレル細胞の樹状突起がバレルの内側に枝を広げる過程を観察するためには,視床皮質軸索を蛍光標識することが必要である.感覚系の視床核において特異的に発現するセロトニントランスポーターの発現制御領域を含むことが期待されるマウスBACクローンを用いて,膜移行型の緑色蛍光タンパク質(GFP)を発現するトランスジェニックマウスを作製した.このトランスジェニックマウスでは視床皮質軸索が高輝度に標識されており,個々のバレルの内側に集積する視床皮質軸索の終末を,切片を作製することなく観察することができた.
このトランスジェニックマウスとスーパーノバ法による標識とを組み合わせることにより,視床皮質回路を構成する視床皮質軸索(プレ側)とバレル細胞の樹状突起(ポスト側)とをそれぞれGFP(緑色)とRFP(赤色)で同時に標識することに成功した.
スーパーノバ法を用いて単一の細胞でNMDA型グルタミン酸受容体の必須サブユニットであるNR1をノックアウトしたとき,樹状突起の再編が細胞自律的に障害されるかどうかを固定した組織の切片において調べた.生後16日齢の成熟したバレル細胞の樹状突起について調べたところ,対照となる細胞とNR1を欠損した細胞とのあいだで全長に差はなかった.しかしながら,NR1を欠損した細胞では対照となる細胞と比較して,樹状突起の長さがバレルの内側で短く,バレルの外側で長かった.その結果,NR1を欠損した細胞におけるバレルの内側にある樹状突起の割合は,対照となる細胞より小さかった.これらの結果は,バレル細胞においてNMDA型グルタミン酸受容体が細胞自律的に樹状突起の再編に関与するという報告と合致した6,8).
これまでに報告のない新生仔期において,対照となる細胞とNR1を欠損した細胞とで樹状突起の形態を比較した.生後4日齢では,対照となる細胞とNR1を欠損した細胞とで樹状突起の形態に有意な差はなかった.対照となる細胞ではバレルの内側の樹状突起の長さは生後4日齢に比べ生後6日齢において有意に長く,一方,バレルの外側の樹状突起の長さは生後6日齢と生後4日齢とで差がなかった.その結果,生後6日齢でのバレルの内側にある樹状突起の割合は,生後4日齢より大きかった.一方,NR1を欠損した細胞では生後6日齢でのバレルの内側および外側の樹状突起の長さはどちらも生後4日齢のものより長く,バレルの内側にある樹状突起の割合は生後4日齢と同じ程度であった.これらの結果は,生後4日齢から生後6日齢にかけて,細胞自律的なNMDA型グルタミン酸受容体の機能が樹状突起の再編を制御することを示した.
2光子顕微鏡によりバレル細胞の樹状突起のin vivoにおけるタイムラプス観察を行った.生後4日齢あるいは生後5日齢の新生仔マウスのバレル細胞を9時間あるいは18時間にわたり観察したが,とくに生後5日齢における18時間のイメージングの結果を詳細に解析した.1本ごとの樹状突起をみると,バレルの内側でも外側でも伸縮していることが観察された.しかしながら,細胞全体の樹状突起をみると,時間とともにバレルの内側にある樹状突起の割合が増加した.以上の結果は,新生仔の大脳皮質において,バレル細胞の樹状突起は活発に伸縮をくり返しながら,全体としては視床皮質軸索の終末がクラスターを形成するバレルの内側に枝を広げることを示した.
NMDA型グルタミン酸受容体の必須サブユニットであるNR1を欠損した細胞の樹状突起のin vivoにおけるタイムラプス観察を行った.NR1を欠損した細胞では対照となる細胞と同様に,樹状突起の個々の枝はバレルの内側でも外側でも伸縮していた.しかし,その伸縮の程度は対照となる細胞に比べ有意に大きかった.また,細胞全体でみると樹状突起はバレルの内側にも外側にも同様に伸びていることがわかった.これらの結果は,細胞自律的なNMDA型グルタミン酸受容体の機能が,樹状突起のダイナミクスの抑制およびバレルの内側への樹状突起の広がりに関与することを示した.
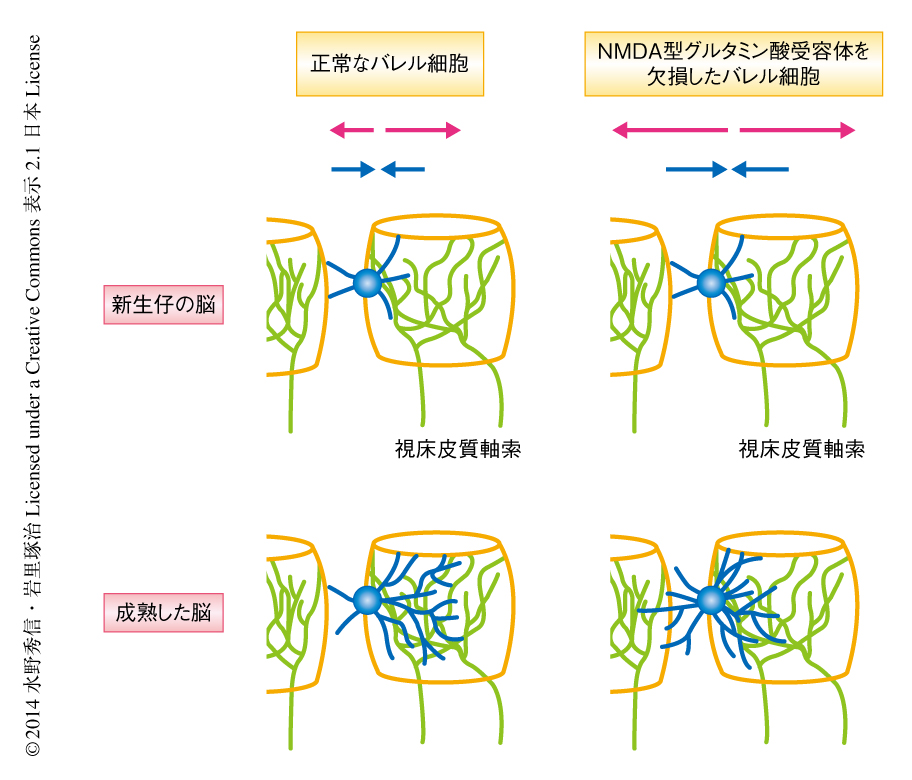
新生仔の大脳皮質のin vivoにおけるイメージングおよび組織学的な解析により,視床皮質回路の再編にともなうバレル細胞の樹状突起のダイナミクスの一端が明らかになった.バレル細胞の樹状突起はバレルの内側でも外側でも激しく伸縮していたが(図1),これはシナプスを形成する相手(プレ側)である視床皮質軸索の終末を探しているためと考えられた.一方,NMDA型グルタミン酸受容体の必須サブユニットであるNR1を欠損した細胞の樹状突起は対照となる細胞と比較して有意に大きな伸縮を示した(図1).このことは,正しくシナプスを形成したバレル細胞では樹状突起がNMDA型グルタミン酸受容体シグナルにより安定化されることを意味すると考えられた.成体ではバレルの内側に投射する視床皮質軸索だけでなく,バレルの外側に投射する別の経路の存在がいくつか知られているが,イメージングを行った生後4日齢あるいは生後5日齢の時期にはこうしたバレルの外側への投射経路はまだできていない.したがって,新生仔期のバレル細胞はバレルの内側でのみ視床皮質軸索からの入力をうけると考えられ,そのとき,樹状突起においてNMDA型グルタミン酸受容体がはたらくはずである.したがって,NR1を欠損した細胞と対照となる細胞とでバレルの内側だけでなくバレルの外側でも樹状突起の伸縮の度合いに差のある原因として,バレルの内側に起因するNMDA型グルタミン酸受容体シグナルが,バレルの外側も含めバレル細胞全体の樹状突起の伸縮の程度を制御していることが考えられた(NMDA型グルタミン酸受容体の細胞全体における機能).また,バレルの外側への枝の広がりもNMDA型グルタミン酸受容体の同様の機能により制御されていると考えられた.こうしたNMDA型グルタミン酸受容体の細胞全体における機能は,CREB,CREST,NeuroD2などCa2+に依存的な転写因子の作用を介して起こるのかもしれない.また同時に,NR1を欠損した細胞とは異なり,野生型の細胞では全体としてバレルの内側に樹状突起の枝を広げた.NMDA型グルタミン酸受容体は入力をうけた樹状突起において局所的に退縮を抑制し伸長を促進するはたらきがあるのかもしれない(NMDA型グルタミン酸受容体の局所的な機能).NMDA型グルタミン酸受容体の局所的な機能は,karilin-7やα-chimaerinなどの細胞骨格タンパク質の制御を介している可能性がある9).また,神経活動に依存的な転写因子であるBTBD3は,NMDA型グルタミン酸受容体の局所的な機能においてその下流ではたらくタンパク質の有力な候補である10).
この研究では,新たに開発した神経回路の標識技術を2光子顕微鏡による観察と組み合わせることにより,新生仔マウスの大脳皮質において神経回路が正しく形成される過程,および,NMDA型グルタミン酸受容体シグナルの阻害により神経回路が正しく形成されない過程の両方を,直接的に観察することにはじめて成功した.現在,筆者らは,さまざまな関連技術を開発しながら観察技術のさらなる向上に取り組んでいる.今後も,マウスのバレル野を主要なモデルとして,より高い時間解像度および空間解像度での,樹状突起やスパインなど,より長期にわたる細胞形態のイメージングや,神経活動のイメージングなどに取り組んでいく.こうした研究により,哺乳類の新生仔の大脳皮質のなかで何が起こっているかをさらに明らかにしたい.
略歴:2009年 京都大学大学院理学研究科 修了,同年より国立遺伝学研究所 助教.
研究テーマ:脳神経回路の形成機構を局所回路および単一細胞のレベルで明らかにする.
抱負:重要だが困難な研究テーマや技術に挑戦することにより,新たな研究分野を開拓したい.
岩里 琢治(Takuji Iwasato)
国立遺伝学研究所 教授.
研究室URL:http://homepage3.nifty.com/iwasato/
© 2014 水野秀信・岩里琢治 Licensed under CC 表示 2.1 日本
(国立遺伝学研究所 形質遺伝研究部門)
email:水野秀信,岩里琢治
DOI: 10.7875/first.author.2014.049
NMDAR-regulated dynamics of layer 4 neuronal dendrites during thalamocortical reorganization in neonates.
Hidenobu Mizuno, Wenshu Luo, Etsuko Tarusawa, Yoshikazu M. Saito, Takuya Sato, Yumiko Yoshimura, Shigeyoshi Itohara, Takuji Iwasato
Neuron, 82, 365-379 (2014)
要 約
新生仔の大脳皮質では視床からの入力に依存して視床皮質回路の再編が起こる.しかしながら,方法論の不備のためそのダイナミクスおよび基盤となる分子機構は知られていない.筆者らは,バレル構造をもつマウスの体性感覚野の特徴を利用して,その一端を解明した.バレルの内側にかたまって投射する視床皮質軸索と,視床皮質軸索とシナプスを形成するバレル細胞の樹状突起を,それぞれ緑色と赤色に蛍光標識することに成功した.2光子顕微鏡によるタイムラプスイメージングを行ったところ,新生仔期のバレル細胞の樹状突起は伸縮しながらバレルの内側に枝を広げることがわかった.一方,NMDA型グルタミン酸受容体を欠損したバレル細胞では,樹状突起はさらに大きく伸縮しながら正しい接合相手の存在しないバレルの外側にも枝を広げた.この研究により,哺乳類の新生仔における視床皮質回路の再編がはじめて直接的に観察された.さらに,NMDA型グルタミン酸受容体は樹状突起の伸縮を細胞自律的に制御することにより,正確な視床皮質回路の形成に貢献することが示唆された.
はじめに
ヒトの脳の表面の大部分をしめる大脳皮質(新皮質)は哺乳類に特有の構造であり,知覚,運動,思考,記憶など高度な情報処理を担う.成人の大脳皮質の神経回路は精密かつ複雑だが,出生のときには未熟でおおまかにしかできていない.生まれてからさまざまな刺激をうけるなかで大脳皮質の神経回路は成長するが1,2),生まれた直後の大脳皮質における神経回路の再編の実際の過程や分子機構は,いままでほとんどわかっていなかった.筆者らは,バレル構造をもつというマウスの体性感覚野(バレル野)の特徴を利用し,この問題に取り組んだ.バレルはマウスやラットのバレル野第4層に特徴的にみられる組織学的な構造であり,1本のヒゲからの入力を伝達するすべての視床皮質軸索の終末は,1個のバレルの内側にクラスターを形成する3,4).一方,第4層星状ニューロン(バレル細胞)はおもにバレルの縁に位置し,樹状突起をバレルの内側のみに広げて視床皮質軸索とシナプスを形成する.こうした精緻な神経回路は新生仔期においてヒゲや視床からの入力に依存して形成されるが,この正確な神経回路により,ヒゲとバレルは機能的にも厳密な1対1対応をなす.この研究では,新生仔の大脳皮質における視床皮質回路の再編の過程をin vivoにおいてイメージングする最初のステップとして,マウスのバレル細胞の樹状突起が正しい接合相手の存在するバレルの内側にむかって枝を広げる過程に焦点をしぼって解析した.
1.単一のニューロンの蛍光標識および標識細胞に特異的な遺伝子ノックアウトを可能とするスーパーノバ法の開発
新生仔マウスにてバレル細胞の樹状突起の形態をin vivoにおいて観察するためには,大脳皮質のニューロンをまばらかつ高輝度に標識することが必須である.子宮内電気穿孔法を用いることにより第4層のニューロンに選択的に遺伝子を導入することはできるが,通常の方法では標識されるニューロンが過密になるため細胞の形態の解析は困難であった5).筆者らは,tTA/TRE増幅系を利用して,ごく少数の細胞でのみ目的の遺伝子およびCre組換え酵素の遺伝子の発現を増幅する手法を開発し,“スーパーノバ法”と名づけた.この手法を子宮内電気穿孔法と組み合わせることにより,赤色蛍光タンパク質(RFP)を第4層にまばらに発現させ,バレル細胞の樹状突起の形態を可視化することに成功した.
また,スーパーノバ法ではRFPとともにCre組換え酵素も高く発現するため,RFPにより標識された細胞において遺伝子を特異的にノックアウトできることも期待された.GFPレポーターマウスを用いてその効率を検証したところ,RFPにより高輝度に標識された第4層のニューロン(樹状突起の形態の解析が可能なもの)のすべてにおいて,Cre組換え酵素による組換えを確認できた.逆に,組換えのある細胞のすべてがRFPに陽性であった.さらに,この方法によりNMDA型グルタミン酸受容体の必須サブユニットであるNR1をノックアウトしたマウスから得た大脳皮質の急性切片において,RFPにより標識されたバレル細胞からホールセル記録を行ったところ,そのすべてにおいてNMDA型グルタミン酸受容体が欠損していることを確認できた.
以上の結果から,スーパーノバ法により大脳皮質の層について選択的に単一のニューロンを高輝度に蛍光標識できること,また同時に,蛍光標識された細胞において特異的に遺伝子をノックアウトできることが示された.今回,開発されたスーパーノバ法は,大脳皮質だけでなく,電気穿孔法による遺伝子導入が可能なあらゆる組織に適用できる.細胞をin vivoにおいてまばらに標識し,標識された細胞において特異的に遺伝子をノックアウトする方法としては,これまでにMADM法などマウスの遺伝学を用いた手法が報告されている6,7).しかし,これらの手法を用いるためには費用や施設のうえで大きな制約がある.また,1回の実験に1年以上かかることから,さまざまな機能をもつ蛍光タンパク質など日進月歩の周辺技術をすばやく取り入れることができない.スーパーノバ法はこうした従来法の弱点を克服しており,細胞自律的な遺伝子機能の解析のため有用である.
2.in vivoにおいてバレルを可視化するためのトランスジェニックマウスの開発
生体においてバレル細胞の樹状突起がバレルの内側に枝を広げる過程を観察するためには,視床皮質軸索を蛍光標識することが必要である.感覚系の視床核において特異的に発現するセロトニントランスポーターの発現制御領域を含むことが期待されるマウスBACクローンを用いて,膜移行型の緑色蛍光タンパク質(GFP)を発現するトランスジェニックマウスを作製した.このトランスジェニックマウスでは視床皮質軸索が高輝度に標識されており,個々のバレルの内側に集積する視床皮質軸索の終末を,切片を作製することなく観察することができた.
このトランスジェニックマウスとスーパーノバ法による標識とを組み合わせることにより,視床皮質回路を構成する視床皮質軸索(プレ側)とバレル細胞の樹状突起(ポスト側)とをそれぞれGFP(緑色)とRFP(赤色)で同時に標識することに成功した.
3.新生仔におけるバレル細胞の樹状突起の再編のNMDA型グルタミン酸受容体による細胞自律的な制御
スーパーノバ法を用いて単一の細胞でNMDA型グルタミン酸受容体の必須サブユニットであるNR1をノックアウトしたとき,樹状突起の再編が細胞自律的に障害されるかどうかを固定した組織の切片において調べた.生後16日齢の成熟したバレル細胞の樹状突起について調べたところ,対照となる細胞とNR1を欠損した細胞とのあいだで全長に差はなかった.しかしながら,NR1を欠損した細胞では対照となる細胞と比較して,樹状突起の長さがバレルの内側で短く,バレルの外側で長かった.その結果,NR1を欠損した細胞におけるバレルの内側にある樹状突起の割合は,対照となる細胞より小さかった.これらの結果は,バレル細胞においてNMDA型グルタミン酸受容体が細胞自律的に樹状突起の再編に関与するという報告と合致した6,8).
これまでに報告のない新生仔期において,対照となる細胞とNR1を欠損した細胞とで樹状突起の形態を比較した.生後4日齢では,対照となる細胞とNR1を欠損した細胞とで樹状突起の形態に有意な差はなかった.対照となる細胞ではバレルの内側の樹状突起の長さは生後4日齢に比べ生後6日齢において有意に長く,一方,バレルの外側の樹状突起の長さは生後6日齢と生後4日齢とで差がなかった.その結果,生後6日齢でのバレルの内側にある樹状突起の割合は,生後4日齢より大きかった.一方,NR1を欠損した細胞では生後6日齢でのバレルの内側および外側の樹状突起の長さはどちらも生後4日齢のものより長く,バレルの内側にある樹状突起の割合は生後4日齢と同じ程度であった.これらの結果は,生後4日齢から生後6日齢にかけて,細胞自律的なNMDA型グルタミン酸受容体の機能が樹状突起の再編を制御することを示した.
4.新生仔におけるバレル細胞の樹状突起の再編の2光子顕微鏡によるタイムラプス観察
2光子顕微鏡によりバレル細胞の樹状突起のin vivoにおけるタイムラプス観察を行った.生後4日齢あるいは生後5日齢の新生仔マウスのバレル細胞を9時間あるいは18時間にわたり観察したが,とくに生後5日齢における18時間のイメージングの結果を詳細に解析した.1本ごとの樹状突起をみると,バレルの内側でも外側でも伸縮していることが観察された.しかしながら,細胞全体の樹状突起をみると,時間とともにバレルの内側にある樹状突起の割合が増加した.以上の結果は,新生仔の大脳皮質において,バレル細胞の樹状突起は活発に伸縮をくり返しながら,全体としては視床皮質軸索の終末がクラスターを形成するバレルの内側に枝を広げることを示した.
5.NMDA型グルタミン酸受容体を欠損したバレル細胞の樹状突起の再編のタイムラプス観察
NMDA型グルタミン酸受容体の必須サブユニットであるNR1を欠損した細胞の樹状突起のin vivoにおけるタイムラプス観察を行った.NR1を欠損した細胞では対照となる細胞と同様に,樹状突起の個々の枝はバレルの内側でも外側でも伸縮していた.しかし,その伸縮の程度は対照となる細胞に比べ有意に大きかった.また,細胞全体でみると樹状突起はバレルの内側にも外側にも同様に伸びていることがわかった.これらの結果は,細胞自律的なNMDA型グルタミン酸受容体の機能が,樹状突起のダイナミクスの抑制およびバレルの内側への樹状突起の広がりに関与することを示した.
6.バレル細胞の樹状突起の精緻化における“ダイナミックモデル”
新生仔の大脳皮質のin vivoにおけるイメージングおよび組織学的な解析により,視床皮質回路の再編にともなうバレル細胞の樹状突起のダイナミクスの一端が明らかになった.バレル細胞の樹状突起はバレルの内側でも外側でも激しく伸縮していたが(図1),これはシナプスを形成する相手(プレ側)である視床皮質軸索の終末を探しているためと考えられた.一方,NMDA型グルタミン酸受容体の必須サブユニットであるNR1を欠損した細胞の樹状突起は対照となる細胞と比較して有意に大きな伸縮を示した(図1).このことは,正しくシナプスを形成したバレル細胞では樹状突起がNMDA型グルタミン酸受容体シグナルにより安定化されることを意味すると考えられた.成体ではバレルの内側に投射する視床皮質軸索だけでなく,バレルの外側に投射する別の経路の存在がいくつか知られているが,イメージングを行った生後4日齢あるいは生後5日齢の時期にはこうしたバレルの外側への投射経路はまだできていない.したがって,新生仔期のバレル細胞はバレルの内側でのみ視床皮質軸索からの入力をうけると考えられ,そのとき,樹状突起においてNMDA型グルタミン酸受容体がはたらくはずである.したがって,NR1を欠損した細胞と対照となる細胞とでバレルの内側だけでなくバレルの外側でも樹状突起の伸縮の度合いに差のある原因として,バレルの内側に起因するNMDA型グルタミン酸受容体シグナルが,バレルの外側も含めバレル細胞全体の樹状突起の伸縮の程度を制御していることが考えられた(NMDA型グルタミン酸受容体の細胞全体における機能).また,バレルの外側への枝の広がりもNMDA型グルタミン酸受容体の同様の機能により制御されていると考えられた.こうしたNMDA型グルタミン酸受容体の細胞全体における機能は,CREB,CREST,NeuroD2などCa2+に依存的な転写因子の作用を介して起こるのかもしれない.また同時に,NR1を欠損した細胞とは異なり,野生型の細胞では全体としてバレルの内側に樹状突起の枝を広げた.NMDA型グルタミン酸受容体は入力をうけた樹状突起において局所的に退縮を抑制し伸長を促進するはたらきがあるのかもしれない(NMDA型グルタミン酸受容体の局所的な機能).NMDA型グルタミン酸受容体の局所的な機能は,karilin-7やα-chimaerinなどの細胞骨格タンパク質の制御を介している可能性がある9).また,神経活動に依存的な転写因子であるBTBD3は,NMDA型グルタミン酸受容体の局所的な機能においてその下流ではたらくタンパク質の有力な候補である10).
おわりに
この研究では,新たに開発した神経回路の標識技術を2光子顕微鏡による観察と組み合わせることにより,新生仔マウスの大脳皮質において神経回路が正しく形成される過程,および,NMDA型グルタミン酸受容体シグナルの阻害により神経回路が正しく形成されない過程の両方を,直接的に観察することにはじめて成功した.現在,筆者らは,さまざまな関連技術を開発しながら観察技術のさらなる向上に取り組んでいる.今後も,マウスのバレル野を主要なモデルとして,より高い時間解像度および空間解像度での,樹状突起やスパインなど,より長期にわたる細胞形態のイメージングや,神経活動のイメージングなどに取り組んでいく.こうした研究により,哺乳類の新生仔の大脳皮質のなかで何が起こっているかをさらに明らかにしたい.
文 献
- Katz, L. C. & Shatz, C. J.: Synaptic activity and the construction of cortical circuits. Science, 274, 1133-1138 (1996)[PubMed]
- Iwasato, T., Datwani, A., Wolf, A. M. et al.: Cortex-restricted disruption of NMDAR1 impairs neuronal patterns in the barrel cortex. Nature, 406, 726-731 (2000)[PubMed]
- Fox, K.: Barrel Cortex. Cambridge University Press, Cambridge (2008)
- Woolsey, T. A. & Van der Loos, H.: The structural organization of layer IV in the somatosensory region (SI) of mouse cerebral cortex. The description of a cortical field composed of discrete cytoarchitectonic units. Brain Res., 17, 205-242 (1970)[PubMed]
- Mizuno, H., Hirano, T. & Tagawa, Y.: Evidence for activity-dependent cortical wiring: formation of interhemispheric connections in neonatal mouse visual cortex requires projection neuron activity. J. Neurosci., 27, 6760-6770 (2007)[PubMed]
- Espinosa, J. S., Wheeler, D. G., Tsien, R. W. et al.: Uncoupling dendrite growth and patterning: single cell knockout analysis of NMDA receptor 2B. Neuron, 62, 205-217 (2009)[PubMed]
- Zong, H., Espinosa, J. S., Su, H. H. et al.: Mosaic analysis with double markers in mice. Cell, 121, 479-492 (2005)[PubMed]
- Datwani, A., Iwasato, T., Itohara, S. et al.: NMDA receptor-dependent pattern transfer from afferents to postsynaptic cells and dendritic differentiation in the barrel cortex. Mol. Cell Neurosci., 21, 477-492 (2002)[PubMed]
- Iwasato, T., Katoh, H., Nishimaru, H. et al.: Rac-GAP α-chimerin regulates motor-circuit formation as a key mediator of EphrinB3/EphA4 forward signaling. Cell, 130, 742-753 (2007)[PubMed]
- Matsui, A., Tran, M., Yoshida, A. C. et al.: BTBD3 controls dendrite orientation toward active axons in mammalian neocortex. Science, 342, 1114-1118 (2013)[PubMed] [新着論文レビュー]
著者プロフィール
略歴:2009年 京都大学大学院理学研究科 修了,同年より国立遺伝学研究所 助教.
研究テーマ:脳神経回路の形成機構を局所回路および単一細胞のレベルで明らかにする.
抱負:重要だが困難な研究テーマや技術に挑戦することにより,新たな研究分野を開拓したい.
岩里 琢治(Takuji Iwasato)
国立遺伝学研究所 教授.
研究室URL:http://homepage3.nifty.com/iwasato/
© 2014 水野秀信・岩里琢治 Licensed under CC 表示 2.1 日本