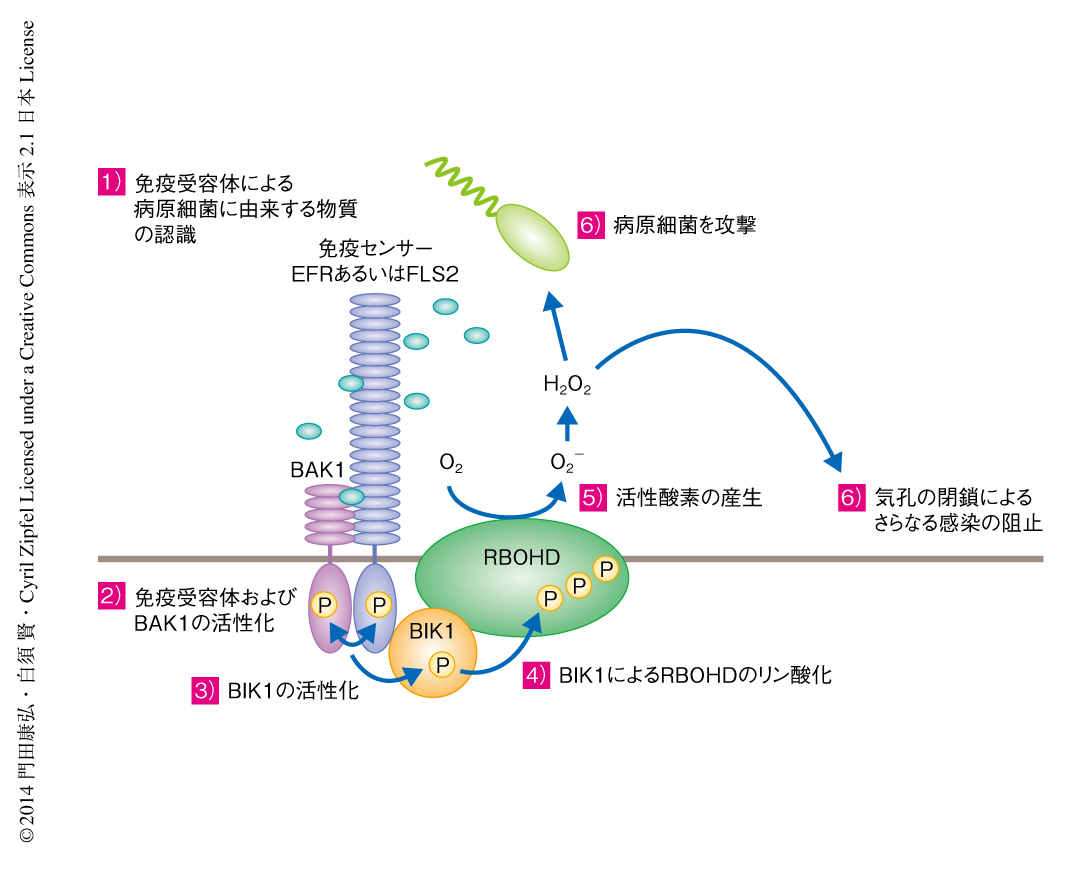
植物の免疫受容体はリン酸化酵素BIK1を介して活性酸素産生酵素RBOHDを活性化し病原細菌を撃退する
門田康弘1・白須 賢2・Cyril Zipfel 1
(1英国The Sainsbury Laboratory,2理化学研究所環境資源科学研究センター 植物免疫研究グループ)
email:門田康弘
DOI: 10.7875/first.author.2014.044
Direct regulation of the NADPH oxidase RBOHD by the PRR-associated kinase BIK1 during plant immunity.
Yasuhiro Kadota, Jan Sklenar, Paul Derbyshire, Lena Stransfeld, Shuta Asai, Vardis Ntoukakis, Jonathan DG Jones, Ken Shirasu, Frank Menke, Alexandra Jones, Cyril Zipfel
Molecular Cell, 54, 43-55 (2014)
植物は細胞膜型免疫受容体により病原細菌の侵入を認識し,活性酸素の産生や病原細菌の侵入経路である気孔の閉鎖,抗菌性物質の合成といったさまざまな防御応答を誘導する.しかし,免疫受容体が細胞内においてどのようにシグナルを伝達しこれらの防御応答を誘導するのか,その詳細なしくみは解明されていなかった.筆者らは,免疫受容体と複合体を形成するタンパク質を探索することにより,活性酸素を産生する酵素RBOHDを発見した.植物において病原細菌の感染の直後に誘導される活性酸素の産生は病害抵抗性において重要な役割を担うことが示唆されていたが,その活性化の機構の全貌は長年にわたり謎のままであった.そこで,免疫受容体から活性酸素の産生までのシグナル伝達を詳細に解析したところ,免疫受容体は受容体様細胞質キナーゼファミリーに属するBIK1を介してRBOHDをリン酸化し活性化することが明らかになった.また,活性酸素は毒性因子として病原細菌を直接に攻撃するだけでなく,シグナル伝達因子としてもはたらく.実際に,BIK1を介してRBOHDにより産生された活性酸素は,病原細菌のおもな侵入経路である気孔の閉鎖を誘導することにより病原細菌の侵入を防ぐことがわかった.この研究により,免疫受容体から防御応答のひとつである活性酸素の産生までのシグナル伝達がはじめて分子レベルで解明された.この成果は,今後の免疫受容体のシグナル伝達の研究の根幹をなす重要な知見になると思われる.
植物は病原微生物が共通にもつ鞭毛タンパク質や細胞壁構成物質などの分子PAMP(pathogen-associated molecular pattern,病原細菌関連分子パターン)を細胞膜型免疫受容体により認識し病原細菌の侵入を感知する1).病原細菌の侵入を認識すると,植物は数分以内に感染部位において活性酸素を産生する2).そののち,数時間以内に病原細菌のおもな侵入経路である気孔を閉鎖するとともに,感染部位の細胞壁を強化することにより感染の拡大を阻止する.さらに数時間から数十時間で抗菌性物質を合成し,感染部位に放出して病原細菌を撃退すると考えられている.これまでの研究により,PAMPや免疫受容体の分子実体が少しずつ明らかになってきたが,免疫受容体が細胞内においてどのようにシグナルを伝達しこれらの防御応答を誘導するのか,そのしくみについては明らかにされていなかった.そこで,筆者らは,免疫受容体と複合体を形成するタンパク質を探索し,免疫受容体からのシグナル伝達を分子レベルで解明することをめざした.
アブラナ科の植物は細胞膜型免疫受容体であるEFRにより,病原細菌の翻訳伸長因子EF-Tuに由来するペプチドelf18を認識する3).EFRは細胞外にあるロイシンリッチリピート領域によりelf18を認識し,細胞内にあるキナーゼ領域により基質タンパク質をリン酸化することでシグナルを伝達すると考えられる.EFRはelf18を認識するとリン酸化酵素であるBAK1と結合して互いにリン酸化しあうことで活性化される4).活性化されたEFRおよびBAK1は受容体様細胞質キナーゼファミリーに属するBIK1をリン酸化し活性化する5,6).筆者らは,EFRからのシグナル伝達について解明するため,EFRと複合体を形成するタンパク質を探索した.植物から共免疫沈降法によりEFR複合体を精製し,液体クロマトグラフィー-質量分析法を用いてその構成タンパク質を同定した.その結果,活性酸素の産生を担う酵素RBOHD(respiratory burst oxidase homologue D)を発見した.さらに,RBOHDはEFRと複合体を形成するだけでなく,病原細菌の鞭毛タンパク質に由来するペプチドflg22を認識する免疫受容体FLS2とも複合体を形成することがわかった.
植物が病原細菌の認識ののち活性酸素を産生する現象は1983年に発見され4),産生された活性酸素は病害抵抗性において重要な役割を担うと考えられてきた.この活性酸素の産生においてはRBOHDが主要な役割を担う7).リン酸化プロテオーム研究により,RBOHDはPAMPの処理ののちすみやかにリン酸化されることが報告され8,9),RBOHDの活性化にはリン酸化による制御が重要であることが示唆された.しかし,どのリン酸化酵素がRBOHDをすみやかかつ感染部位に特異的にリン酸化し活性化するのか,その活性化の機構については長年にわたり謎のままであった.
RBOHDはEFRと複合体を形成することが明らかになったことから,EFR複合体に存在するリン酸化酵素がRBOHDを直接にリン酸化する可能性が示唆された.in vitroリン酸化実験および結合実験により,EFR複合体に存在するリン酸化酵素のうち,BIK1がRBOHDのN末端領域と直接に結合し非常に強くリン酸化することがわかった.さらに,免疫沈降実験により,植物体においてBIK1はRBOHDと複合体を形成することがわかった.そして,elf18を認識したEFRおよびBAK1がBIK1をリン酸化すると,リン酸化されたBIK1はRBOHDとより強く結合してRBOHDをリン酸化することがわかった.このことから,elf18を認識したEFRがBIK1を介してRBOHDをリン酸化するというシグナル伝達が明らかになった.
液体クロマトグラフィー-質量分析法によりBIK1によるRBOHDのリン酸化部位を同定したところ,BIK1はRBOHDのもつ3カ所のセリン残基,Ser39,Ser339,Ser343を特異的にリン酸化することがわかった.BIK1と同じ機能をもつPBL1およびBIK1を両方とも欠損した二重欠損変異体では,PAMPの処理により誘導されるこれらのリン酸化は著しく減少することがわかった.さらに,植物体におけるこれらのリン酸化はelf18による処理ののち数分以内からはじまり,活性酸素の産生にさきだち起こった.また,病原細菌の鞭毛タンパク質に由来するペプチドflg22および病原微生物に由来するキチンを処理すると,elf18を処理したときと同様にこれらのセリン残基は強くリン酸化されたことから,BIK1によるRBOHDのリン酸化はさまざまな免疫受容体の下流において同様に起こることが示唆された.
BIK1によるリン酸化がRBOHDの活性化に及ぼす影響を調べるため,リン酸化部位であるSer39,Ser339,Ser343に変異を導入しPAMPにより誘導される活性酸素の産生について調べた.RBOHDのSer39,Ser339,Ser343をアラニン残基に置換すると,さまざまなPAMPにより誘導される活性酸素の産生は起こらなくなった.一方,RBOHDのSer39あるいはSer339をグルタミン酸残基へと置換して疑似リン酸化型変異体にすると活性酸素の産生は増加した.よって,BIK1によるRBOHDのリン酸化が活性酸素の産生に必須であることが明らかになった.
活性酸素は毒性因子として病原細菌を直接に攻撃するだけでなく,シグナル伝達因子としてもはたらくと考えられている.実際,病原細菌のおもな侵入経路である葉の気孔を閉鎖するのに,活性酸素は重要な役割を担う10).BIK1によりリン酸化されるRBOHDの3カ所のセリン残基をアラニン残基に置換した植物は,elf18あるいはflg22を認識しても気孔を閉鎖できなかった.さらに,この植物は病原細菌に対する抵抗性が低下しそれらの増殖を抑制できなかった.このことから,BIK1を介してRBOHDにより産生された活性酸素は植物の病害抵抗性において重要な役割をはたすことがわかった.
この研究により,免疫受容体から防御応答のひとつである活性酸素の産生までのシグナル伝達がはじめて分子レベルで解明された(図1).この成果は,免疫受容体からのシグナル伝達を研究するうえで根幹をなす重要な知見になると思われる.さらに,RBOHDを介した活性酸素の産生は,病害に対する応答だけでなく,さまざまな器官形成,乾燥,塩害,高温,傷害などに対する環境ストレス応答,病害虫に対する応答などにも重要な役割をはたす.よって,この研究により解明されたRBOHDの新規の制御機構は,これらの生理現象を誘導する分子機構の解明にも貢献すると思われる.今後,BIK1によるRBOHDのリン酸化がRBOHDの立体構造やそのほかの制御機構に及ぼす影響を調べることにより,BIK1によるリン酸化から活性化までの詳細な分子機構が明らかになると思われる.
略歴:2005年 東京理科大学大学院理工学研究科博士課程 修了,2006年 理化学研究所植物科学研究センター 研究員,2010年 英国The Sainsbury Laboratory研究員を経て,2014年より理化学研究所環境資源科学研究センター 研究員.
研究テーマ:植物免疫におけるシグナル伝達系.
抱負:イクメン研究者.
白須 賢(Ken Shirasu)
理化学研究所環境資源科学研究所 グループディレクター.
Cyril Zipfel
英国The Sainsbury Laboratoryシニアグループディレクター.
研究室URL:http://www.tsl.ac.uk/%5C/research/cyril-zipfel/index.htm
© 2014 門田康弘・白須 賢・Cyril Zipfel Licensed under CC 表示 2.1 日本
(1英国The Sainsbury Laboratory,2理化学研究所環境資源科学研究センター 植物免疫研究グループ)
email:門田康弘
DOI: 10.7875/first.author.2014.044
Direct regulation of the NADPH oxidase RBOHD by the PRR-associated kinase BIK1 during plant immunity.
Yasuhiro Kadota, Jan Sklenar, Paul Derbyshire, Lena Stransfeld, Shuta Asai, Vardis Ntoukakis, Jonathan DG Jones, Ken Shirasu, Frank Menke, Alexandra Jones, Cyril Zipfel
Molecular Cell, 54, 43-55 (2014)
要 約
植物は細胞膜型免疫受容体により病原細菌の侵入を認識し,活性酸素の産生や病原細菌の侵入経路である気孔の閉鎖,抗菌性物質の合成といったさまざまな防御応答を誘導する.しかし,免疫受容体が細胞内においてどのようにシグナルを伝達しこれらの防御応答を誘導するのか,その詳細なしくみは解明されていなかった.筆者らは,免疫受容体と複合体を形成するタンパク質を探索することにより,活性酸素を産生する酵素RBOHDを発見した.植物において病原細菌の感染の直後に誘導される活性酸素の産生は病害抵抗性において重要な役割を担うことが示唆されていたが,その活性化の機構の全貌は長年にわたり謎のままであった.そこで,免疫受容体から活性酸素の産生までのシグナル伝達を詳細に解析したところ,免疫受容体は受容体様細胞質キナーゼファミリーに属するBIK1を介してRBOHDをリン酸化し活性化することが明らかになった.また,活性酸素は毒性因子として病原細菌を直接に攻撃するだけでなく,シグナル伝達因子としてもはたらく.実際に,BIK1を介してRBOHDにより産生された活性酸素は,病原細菌のおもな侵入経路である気孔の閉鎖を誘導することにより病原細菌の侵入を防ぐことがわかった.この研究により,免疫受容体から防御応答のひとつである活性酸素の産生までのシグナル伝達がはじめて分子レベルで解明された.この成果は,今後の免疫受容体のシグナル伝達の研究の根幹をなす重要な知見になると思われる.
はじめに
植物は病原微生物が共通にもつ鞭毛タンパク質や細胞壁構成物質などの分子PAMP(pathogen-associated molecular pattern,病原細菌関連分子パターン)を細胞膜型免疫受容体により認識し病原細菌の侵入を感知する1).病原細菌の侵入を認識すると,植物は数分以内に感染部位において活性酸素を産生する2).そののち,数時間以内に病原細菌のおもな侵入経路である気孔を閉鎖するとともに,感染部位の細胞壁を強化することにより感染の拡大を阻止する.さらに数時間から数十時間で抗菌性物質を合成し,感染部位に放出して病原細菌を撃退すると考えられている.これまでの研究により,PAMPや免疫受容体の分子実体が少しずつ明らかになってきたが,免疫受容体が細胞内においてどのようにシグナルを伝達しこれらの防御応答を誘導するのか,そのしくみについては明らかにされていなかった.そこで,筆者らは,免疫受容体と複合体を形成するタンパク質を探索し,免疫受容体からのシグナル伝達を分子レベルで解明することをめざした.
1.免疫受容体は活性酸素産生酵素RBOHDと複合体を形成する
アブラナ科の植物は細胞膜型免疫受容体であるEFRにより,病原細菌の翻訳伸長因子EF-Tuに由来するペプチドelf18を認識する3).EFRは細胞外にあるロイシンリッチリピート領域によりelf18を認識し,細胞内にあるキナーゼ領域により基質タンパク質をリン酸化することでシグナルを伝達すると考えられる.EFRはelf18を認識するとリン酸化酵素であるBAK1と結合して互いにリン酸化しあうことで活性化される4).活性化されたEFRおよびBAK1は受容体様細胞質キナーゼファミリーに属するBIK1をリン酸化し活性化する5,6).筆者らは,EFRからのシグナル伝達について解明するため,EFRと複合体を形成するタンパク質を探索した.植物から共免疫沈降法によりEFR複合体を精製し,液体クロマトグラフィー-質量分析法を用いてその構成タンパク質を同定した.その結果,活性酸素の産生を担う酵素RBOHD(respiratory burst oxidase homologue D)を発見した.さらに,RBOHDはEFRと複合体を形成するだけでなく,病原細菌の鞭毛タンパク質に由来するペプチドflg22を認識する免疫受容体FLS2とも複合体を形成することがわかった.
2.受容体様細胞質キナーゼBIK1はRBOHDと直接に結合しリン酸化する
植物が病原細菌の認識ののち活性酸素を産生する現象は1983年に発見され4),産生された活性酸素は病害抵抗性において重要な役割を担うと考えられてきた.この活性酸素の産生においてはRBOHDが主要な役割を担う7).リン酸化プロテオーム研究により,RBOHDはPAMPの処理ののちすみやかにリン酸化されることが報告され8,9),RBOHDの活性化にはリン酸化による制御が重要であることが示唆された.しかし,どのリン酸化酵素がRBOHDをすみやかかつ感染部位に特異的にリン酸化し活性化するのか,その活性化の機構については長年にわたり謎のままであった.
RBOHDはEFRと複合体を形成することが明らかになったことから,EFR複合体に存在するリン酸化酵素がRBOHDを直接にリン酸化する可能性が示唆された.in vitroリン酸化実験および結合実験により,EFR複合体に存在するリン酸化酵素のうち,BIK1がRBOHDのN末端領域と直接に結合し非常に強くリン酸化することがわかった.さらに,免疫沈降実験により,植物体においてBIK1はRBOHDと複合体を形成することがわかった.そして,elf18を認識したEFRおよびBAK1がBIK1をリン酸化すると,リン酸化されたBIK1はRBOHDとより強く結合してRBOHDをリン酸化することがわかった.このことから,elf18を認識したEFRがBIK1を介してRBOHDをリン酸化するというシグナル伝達が明らかになった.
3.BIK1はRBOHDのもつ3カ所のセリン残基を特異的にリン酸化する
液体クロマトグラフィー-質量分析法によりBIK1によるRBOHDのリン酸化部位を同定したところ,BIK1はRBOHDのもつ3カ所のセリン残基,Ser39,Ser339,Ser343を特異的にリン酸化することがわかった.BIK1と同じ機能をもつPBL1およびBIK1を両方とも欠損した二重欠損変異体では,PAMPの処理により誘導されるこれらのリン酸化は著しく減少することがわかった.さらに,植物体におけるこれらのリン酸化はelf18による処理ののち数分以内からはじまり,活性酸素の産生にさきだち起こった.また,病原細菌の鞭毛タンパク質に由来するペプチドflg22および病原微生物に由来するキチンを処理すると,elf18を処理したときと同様にこれらのセリン残基は強くリン酸化されたことから,BIK1によるRBOHDのリン酸化はさまざまな免疫受容体の下流において同様に起こることが示唆された.
4.BIK1によるリン酸化はRBOHDの活性化に必須である
BIK1によるリン酸化がRBOHDの活性化に及ぼす影響を調べるため,リン酸化部位であるSer39,Ser339,Ser343に変異を導入しPAMPにより誘導される活性酸素の産生について調べた.RBOHDのSer39,Ser339,Ser343をアラニン残基に置換すると,さまざまなPAMPにより誘導される活性酸素の産生は起こらなくなった.一方,RBOHDのSer39あるいはSer339をグルタミン酸残基へと置換して疑似リン酸化型変異体にすると活性酸素の産生は増加した.よって,BIK1によるRBOHDのリン酸化が活性酸素の産生に必須であることが明らかになった.
5.RBOHDにより産生される活性酸素は病害抵抗性において重要な役割をはたす
活性酸素は毒性因子として病原細菌を直接に攻撃するだけでなく,シグナル伝達因子としてもはたらくと考えられている.実際,病原細菌のおもな侵入経路である葉の気孔を閉鎖するのに,活性酸素は重要な役割を担う10).BIK1によりリン酸化されるRBOHDの3カ所のセリン残基をアラニン残基に置換した植物は,elf18あるいはflg22を認識しても気孔を閉鎖できなかった.さらに,この植物は病原細菌に対する抵抗性が低下しそれらの増殖を抑制できなかった.このことから,BIK1を介してRBOHDにより産生された活性酸素は植物の病害抵抗性において重要な役割をはたすことがわかった.
おわりに
この研究により,免疫受容体から防御応答のひとつである活性酸素の産生までのシグナル伝達がはじめて分子レベルで解明された(図1).この成果は,免疫受容体からのシグナル伝達を研究するうえで根幹をなす重要な知見になると思われる.さらに,RBOHDを介した活性酸素の産生は,病害に対する応答だけでなく,さまざまな器官形成,乾燥,塩害,高温,傷害などに対する環境ストレス応答,病害虫に対する応答などにも重要な役割をはたす.よって,この研究により解明されたRBOHDの新規の制御機構は,これらの生理現象を誘導する分子機構の解明にも貢献すると思われる.今後,BIK1によるRBOHDのリン酸化がRBOHDの立体構造やそのほかの制御機構に及ぼす影響を調べることにより,BIK1によるリン酸化から活性化までの詳細な分子機構が明らかになると思われる.
文 献
- Monaghan, J. & Zipfel, C.: Plant pattern recognition receptor complexes at the plasma membrane. Curr. Opin. Plant Biol., 15, 349-357 (2012)[PubMed]
- Doke, N.: Involvement of superoxide anion generation in the hypersensitive response of potato tuber tissues to infection with an incompatible race of Phytophthora infestans and to the hyphal wall components. Physiol. Plant Pathol., 23, 345-357 (1983)
- Zipfel, C., Kunze, G., Chinchilla, D. et al.: Perception of the bacterial PAMP EF-Tu by the receptor EFR restricts Agrobacterium-mediated transformation. Cell, 125, 749-760 (2006)[PubMed]
- Chinchilla, D., Zipfel, C., Robatzek, S. et al.: A flagellin-induced complex of the receptor FLS2 and BAK1 initiates plant defence. Nature, 448, 497-500 (2007)[PubMed]
- Lu, D., Wu, S., Gao, X. et al.: A receptor-like cytoplasmic kinase, BIK1, associates with a flagellin receptor complex to initiate plant innate immunity. Proc. Natl. Acad. Sci. USA, 107, 496-501 (2010)[PubMed]
- Zhang, J., Li, W., Xiang, T. et al.: Receptor-like cytoplasmic kinases integrate signaling from multiple plant immune receptors and are targeted by a Pseudomonas syringae effector. Cell Host Microbe, 7, 290-301 (2010)[PubMed]
- Torres, M. A., Dangl, J. L. & Jones, J. D.: Arabidopsis gp91phox homologues AtrbohD and AtrbohF are required for accumulation of reactive oxygen intermediates in the plant defense response. Proc. Natl. Acad. Sci. USA, 99, 517-522 (2002)[PubMed]
- Nuhse, T. S., Bottrill, A. R., Jones, A. M. E. et al.: Quantitative phosphoproteomic analysis of plasma membrane proteins reveals regulatory mechanisms of plant innate immune responses. Plant J., 51, 931-940 (2007)[PubMed]
- Benschop, J. J., Mohammed, S., O'Flaherty, M. et al.: Quantitative phosphoproteomics of early elicitor signaling in Arabidopsis. Mol. Cell Proteomics, 6, 1198-1214 (2007)[PubMed]
- Mersmann, S., Bourdais, G., Rietz, S. et al.: Ethylene signaling regulates accumulation of the FLS2 receptor and is required for the oxidative burst contributing to plant immunity. Plant Physiol., 154, 391-400 (2010)[PubMed]
著者プロフィール
略歴:2005年 東京理科大学大学院理工学研究科博士課程 修了,2006年 理化学研究所植物科学研究センター 研究員,2010年 英国The Sainsbury Laboratory研究員を経て,2014年より理化学研究所環境資源科学研究センター 研究員.
研究テーマ:植物免疫におけるシグナル伝達系.
抱負:イクメン研究者.
白須 賢(Ken Shirasu)
理化学研究所環境資源科学研究所 グループディレクター.
Cyril Zipfel
英国The Sainsbury Laboratoryシニアグループディレクター.
研究室URL:http://www.tsl.ac.uk/%5C/research/cyril-zipfel/index.htm
© 2014 門田康弘・白須 賢・Cyril Zipfel Licensed under CC 表示 2.1 日本