電位依存性プロトンチャネルの結晶構造
竹下浩平1・岡村康司2・中川敦史1
(1大阪大学蛋白質研究所 超分子構造解析学,2大阪大学大学院医学系研究科 統合生理学)
email:竹下浩平,岡村康司,中川敦史
DOI: 10.7875/first.author.2014.040
X-ray crystal structure of voltage-gated proton channel.
Kohei Takeshita, Souhei Sakata, Eiki Yamashita, Yuichiro Fujiwara, Akira Kawanabe, Tatsuki Kurokawa, Yoshifumi Okochi, Makoto Matsuda, Hirotaka Narita, Yasushi Okamura, Atsushi Nakagawa
Nature Structural & Molecular Biology, 21, 352-357 (2014)
細胞膜は細胞の内外のイオンの分布差により膜電位を生じており,ニューロンにおいては,膜電位の変化が電位依存性イオンチャネルによる神経伝達における電気的なシグナルの発生および伝達を可能にしている.この膜電位の変化は4つの膜貫通領域により構成される膜電位センサーの正電荷に富んだ4番目の膜貫通領域により感受されるが,その活性化の機構など動作原理については不明な点が残っている.筆者らは,もっともコンパクトな膜電位センサーのみからなる電位依存性プロトンチャネルVSOPの結晶構造を明らかにした.その構造は,4つの膜貫通領域のうち,膜電位センサーのスイッチである4番目の膜貫通領域が細胞質にあるコイルドコイル領域とひとつながりの長いヘリックスを形成した,閉じた和傘のようなかたちであった.細胞の外側にはVSOPのプロトンチャネル活性を阻害するZn2+が結合し,4番目の膜貫通領域は静止膜電位の状態の負電荷により細胞の内側にシフトし,脱分極変化を感受することができるような位置にあることがわかった.これは,膜電位センサーとして長年の謎であった静止状態を示す構造であった.また,プロトンの透過経路は内部にある2つの疎水性バリアにより水分子の侵入をふさぐことで閉じており,VSOPは静止状態においてプロトンを漏洩しないような巧妙で厳密な制御機構をもつことが示唆された.
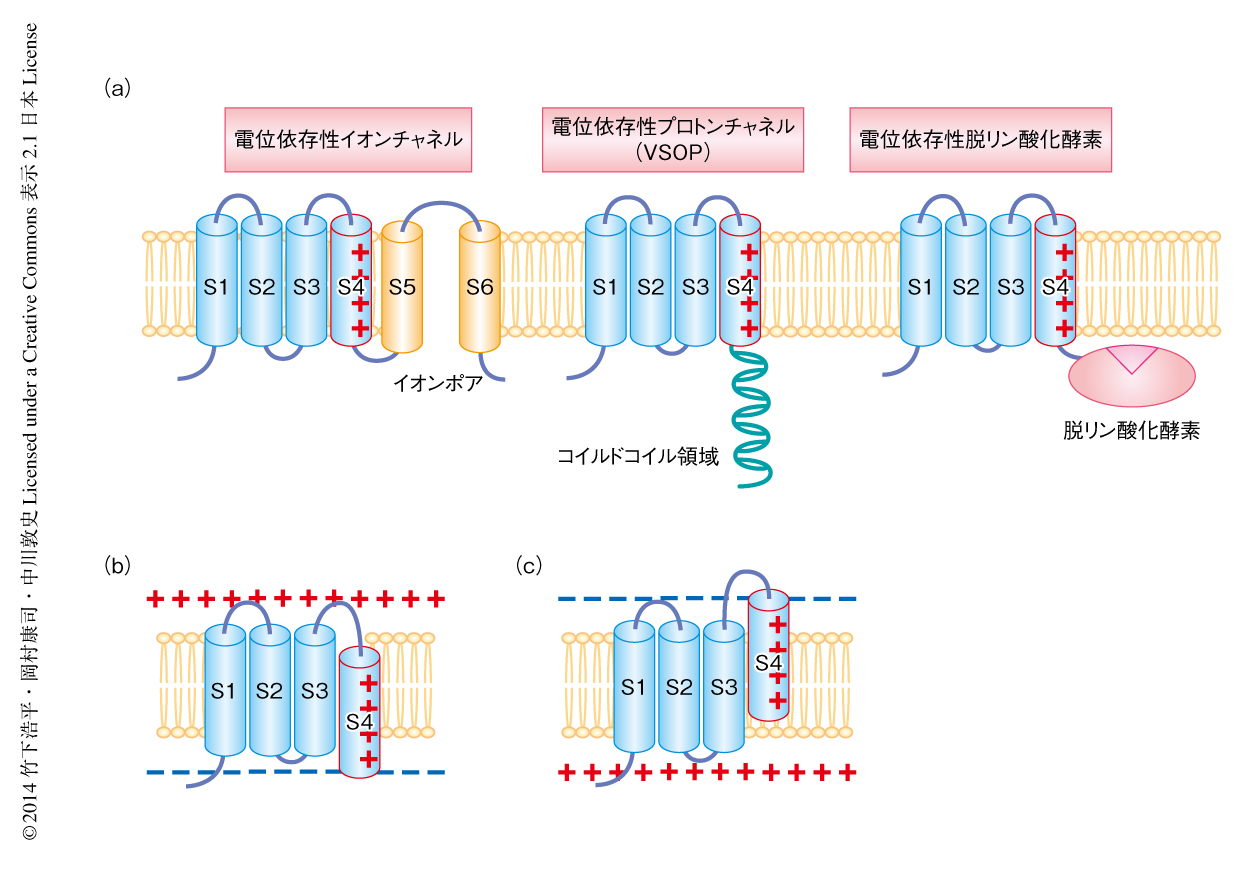
イカの巨大神経軸索を用いた神経伝達機構に関する研究がはじまって以来およそ50年,電位依存性イオンチャネルの研究は積み重ねられ,現在では,X線結晶構造解析の成果によりその分子機構は原子分解能のレベルで詳細に理解されつつある.電位依存性Na+チャネルや電位依存性K+チャネルなど典型的な電位依存性イオンチャネルは,1番目から4番目の膜貫通領域により構成される“膜電位センサー”と,5番目と6番目の膜貫通領域により構成される“イオンポア”からなる,6回膜貫通型を基本構造とした膜タンパク質である(図1a).この膜電位センサーの4番目の膜貫通領域には塩基性アミノ酸残基が周期的に分布し正電荷を帯びている.通常,細胞膜の内部は細胞の内外のイオンの分布差により負に分極した状態になっているため,正電荷を帯びた4番目の膜貫通領域は細胞の内側にシフトしており(図1b),脱分極により細胞膜の内部の分極状態が正にかたむくと正電荷を帯びた4番目の膜貫通領域は反発して細胞の外側へとシフトする(図1c).この細胞膜の分極状態を感受した膜電位センサーの動きが連結するイオンポアの開閉を制御している.
この膜電位センサーは6回膜貫通型の電位依存性イオンチャネルに特徴的なものであると考えられてきたが,2005年,イオンポアの部分がホスホイノシトールリン酸脱リン酸化酵素として知られるPTENと類似した構造に置き替わった電位依存性ホスファターゼが見い出され1,2)(図1a),さらに2006年,イオンポアの部分を欠損した膜電位センサーのみからなる電位依存性プロトンチャネルVSOP(voltage sensor only protein,別名Hv1)が同定された3)(図1a).これら新規の膜電位センサー型タンパク質の発見をきっかけとして,膜電位センサーをもつタンパク質はこれまで知られていた6回膜貫通型のイオンチャネルだけではなく,より広範なファミリーを形成していることが知られるようになった.すなわち,生体においてはさまざまな膜電位センサー型タンパク質が細胞膜の分極状態の変化を利用してさまざまな生理機能を制御しているという,膜電位センサー型タンパク質の研究における新たな潮流が生み出された4).このように,膜電位センサーはモジュールとして,あるときはイオンポアと,あるときは脱リン酸化酵素と共役し,さらには,膜電位センサーのみでプロトンの透過経路を形成するなど,多様性に富んだはたらきをしている.
この研究は,VSOPのプロトンチャネルとしての分子機構の解明だけでなく,膜電位センサー型タンパク質のなかでもっともコンパクトなVSOPをモデルとして,膜電位センサーがどのように活性化するのかという動作原理の解明をめざした.
プロトンが電位に依存して細胞膜を透過することは以前より示唆されていたが,その分子実体が不明であったため生理機能との関係性については不明な点が多かった.しかし,VSOPが同定されたのち,そのさまざまかつ重要な生理機能がつぎつぎと明らかになってきた.たとえば,マクロファージや好中球といった貪食細胞が細菌などの異物を排除する際には,VSOPがファゴソーム膜に存在するNADPHオキシダーゼの基質としてのプロトンを供給することにより殺菌作用を示す活性酸素種の産生を促進し,一方で,副産物であるプロトンを細胞外へと排出することによりNADPHオキシダーゼの活性を維持している5).また,ヒトの精子においては,VSOPがプロトンを排出することで鞭毛の内部のpHがアルカリ性にかたむき,精子の運動のトリガーとなるpH依存性Ca2+チャネルが活性化することにより精子の運動が制御されていることが報告され,VSOPが精子の運動のストッパー装置として機能している可能性が示された6).さらに,転移性乳がんにおいてVSOPが高く発現していること7),VSOPが虚血性脳障害の増悪に関与していること8) なども報告されている.
このように,VSOPは細胞膜の分極状態の変化を利用してプロトンの供給やpHを制御することにより,さまざまな生理機能を制御していると考えられる.
VSOPは哺乳動物から植物性プランクトンにいたるまで生物界に広く存在する.一般に,X線結晶構造解析のためには試料となる組換えタンパク質を高純度かつ大量に必要とするため,さまざまな生物種から組換えタンパク質の発現に最適なものを選択することが多い.筆者らは,マウスのESTデータベースからVSOPを同定し,そののち,機能解析を詳細に進め知見を蓄積していたので,原子構造と機能解析とを相互的にスマートに理解するため,あえてマウスに由来するVSOPの構造を決定することにした.しかしながら,哺乳動物に由来する膜タンパク質の大量発現および精製は困難であり,さまざまなコンストラクトおよび組換え発現系を試行錯誤したが,さっぱりうまくいかなかった.そのような状況のなか,マウスのVSOPの細胞質にあるコイルドコイル領域の結晶構造解析ならびに機能解析を進めたところ,このコイルドコイル領域は一般的なコイルドコイル領域に比べ熱安定性の低いことが判明した9).そこから,より安定なコイルドコイル領域と入れ替えることによりVSOPの安定性を向上させることができるのではないかと考え,VSOPのコイルドコイル領域を出芽酵母に由来するロイシンジッパータンパク質GCN4のコイルドコイル領域と入れ替えたキメラ体を調製したところ,大量かつ安定な組換えタンパク質を得ることができ,その結晶化にも成功した.さらに,結晶化の再現性や分解能の改善のためコンストラクトを改良し,GCN4とのキメラにくわえ,2番目および3番目の膜貫通領域の細胞質側の半分を電位依存性ホスファターゼCi-VSPのもつ膜電位センサーの対応する領域と入れ替えたキメラ体を作製することにより,VSOPの結晶構造の決定に成功した(PDB ID:3WKV).
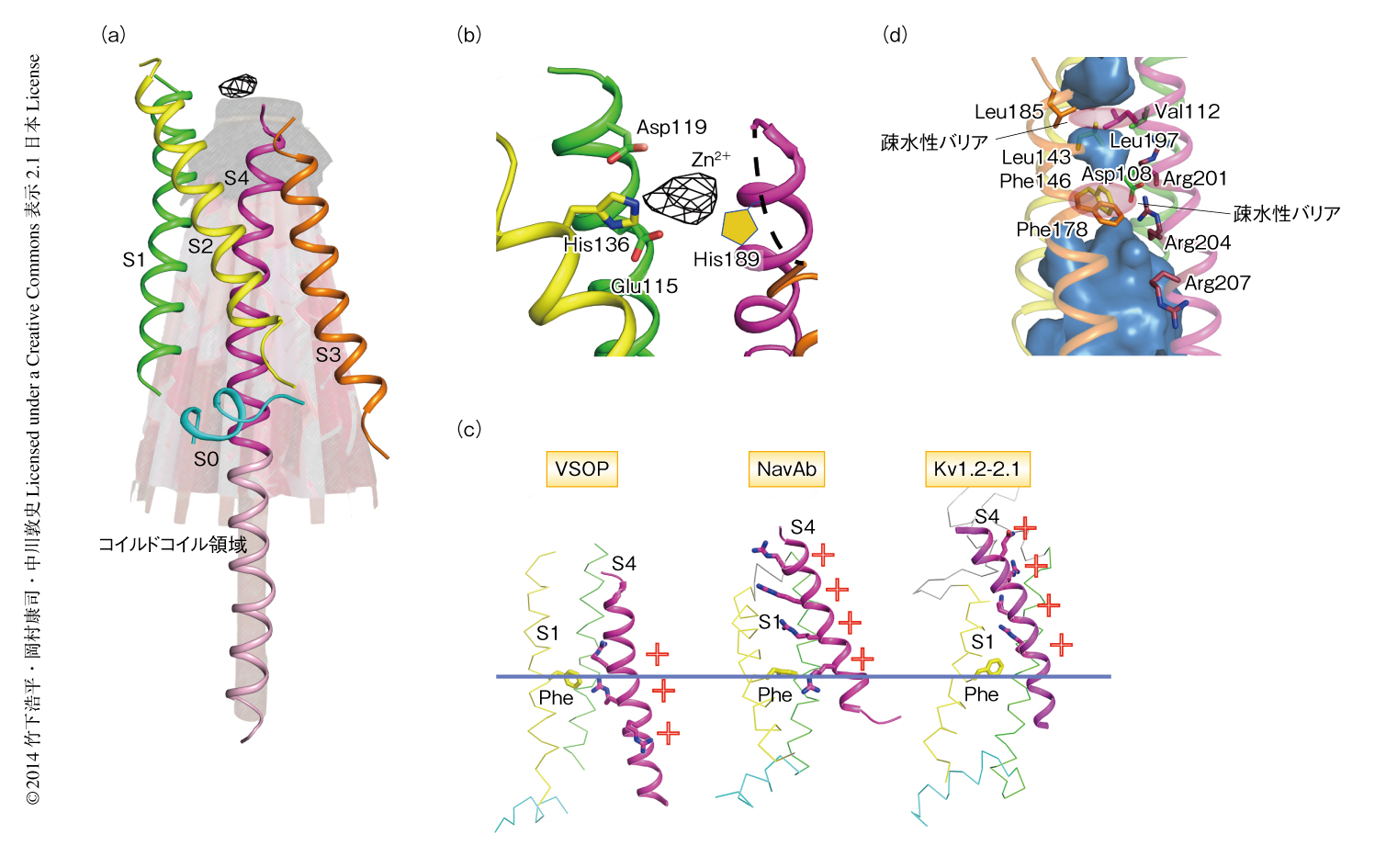
結晶構造から,VSOPはこれまで知られていた膜電位センサーのように4つの膜貫通領域から構成されており,とくに,正電荷を帯びた4番目の膜貫通領域と細胞質にあるコイルドコイル領域とはひとつながりのヘリックスを形成していた.4つの膜貫通領域は比較的平行に並び細胞質の側が少し開いたような構造をしており,まるで閉じた和傘のようなかたちをしていた(図2a).
Zn2+はVSOPの電位に依存的な活性化の過程を阻害することによりプロトンチャネルの活性を抑制することが知られている10).幸運にも,今回の結晶構造においてZn2+の存在を示す異常散乱シグナルが検出された.このシグナルはVSOPの細胞外側の部分にみられ,その周辺には2つのヒスチジン残基の存在が示唆された.この2つのヒスチジン残基はVSOPへのZn2+の結合に重要であることは報告されていたが,プロトマーにつき1個のZn2+の結合することがはじめてわかった.そのほかにも,Zn2+の近くに2つの負電荷アミノ酸残基が存在することがわかり(図2b),変異体の解析により,これらのアミノ酸残基はZn2+との結合に重要であることが判明した.さきに述べたように,Zn2+はVSOPの活性化を阻害する.つまり,活性化したVSOPにZn2+を添加しても活性は阻害されない.このことは,Zn2+の結合したVSOPは活性化のまえの状態を示していることにほかならなかった.膜電位センサーが活性化するまえということは,細胞内が細胞外よりも負に分極した状態で静的に安定し,分極状態が正にかたむく脱分極を感受できる構造であるということである.実際に,VSOPの4番目の膜貫通領域はほかの電位依存性イオンチャネルの活性型の膜電位センサーと比べ明らかに細胞の内側へとシフトしていた(図2c).すなわち,今回のVSOPの結晶構造は静止状態にある膜電位センサーのものであることが強く示唆された.
今回のVSOPの結晶構造は,プロトンチャネル活性を阻害するZn2+が結合し,膜電位センサーの機能中心である4番目の膜貫通領域が細胞膜の内側へとシフトした,静止状態の構造を強く反映したものであった.つまり,プロトンを透過させない構造であることがうかがえた.実際に,VSOPの内部の水が入りうる部分をみてみると,かなり深くまで水が入りうる部分が存在したが,疎水性アミノ酸残基により構成された疎水性バリアにより細胞外および細胞内への水分子の侵入は遮断されていることがわかった(図2d).プロトンは水分子や負電荷アミノ酸残基の側鎖をバケツリレー形式により移動することにより透過していると考えられたが,その水分子のネットワークが遮断されていたことは,静止状態のVSOPの構造はプロトンチャネルが閉じた構造を示していることにほかならないだろう.
ここまでの話から,“たんにVSOPの結晶構造を解いただけか?”と感じた読者もいるかもしれない.しかし,今回の研究結果は,膜電位センサーの動作原理における2つのブラックボックスを明らかにした点で重要な成果と考えられる.その1つ目は,これまでに解かれた電位依存性イオンチャネルの膜電位センサーの結晶構造はすべて活性化状態のものであり,VSOPの結晶構造は静止状態のものとしてはじめてであったことである.2つ目は,一般に膜電位センサーは2価の金属イオンにより活性化が阻害されることが報告されているが,今回の解かれた結晶構造は膜電位センサーに金属イオンが結合した状態のものとしてもはじめてであったことである.したがって,今回のVSOPの結晶構造は,分子として新規の構造であったと同時に,膜電位センサーの長年の構造学的なブラックボックスの一端を明らかにしたものであるといえる.
このように膜電位センサーの構造学的な2つのブラックボックスを明らかにしたことは,VSOPのみならず,ほかの電位依存性イオンチャネルが膜電位の変化を感受した際にどのように作動してイオンポアの開閉に連動するのかという分子機構の解明のヒントになると期待され,電位依存性イオンチャネルが関係するさまざまな疾患の新たな治療薬の開発にもつながる可能性をひめている.
これまで,膜タンパク質の結晶構造の解析における試料の調製を効率的に検討する手法として,GFPの蛍光とゲルろ過とを組み合わせたハイスループット解析およびその成功例が数多く報告されている.当初,筆者らも,この方法を導入して条件検討を開始したが,結晶化のためにデザインしたGFP融合タンパク質によってはカラム樹脂に非特異的に吸着するものやGFPを融合することにより不溶性になるものがあったため,ハイスループットなスクリーニングができず,コンストラクトを変更するたびに精製および結晶化に適した界面活性剤を検討する必要があり,たいへんに苦労した.
多様な生理機能に関与するVSOPの構造生物学な研究は,膜電位に依存してプロトンを透過させるイオンチャネルとしての生理学的な分子機構を詳細に理解するだけではなく,さまざまな膜電位センサー型タンパク質に共通のモジュールとして膜電位センサーの動作原理を理解するためのすぐれたモデルとしての重要性も高い.とくに,膜電位センサーの静止状態における構造は不明であったが,VSOPが膜電位差のないときには完全に閉じた構造でありZn2+により活性が阻害されたことから,VSOPは静止状態の結晶構造が解きやすいのではないかと考えていた.結果として,幸運にも結晶構造を明らかにすることができた.静止状態の膜電位センサーがどのような構造をしているかは長年にわたりブラックボックスであったため,論文の投稿にあたっては査読者から多くの指摘をうけるだろうと予測していた.ところが,Zn2+が結合しプロトンチャネル活性が阻害されたVSOPの4番目の膜貫通領域は,静止状態であることを意味する細胞の内側へのシフトを示してしており,そのとき,プロトンの透過経路は閉じた状態であるという3つの構造学的な議論が認められて,論文はほぼ修正なしに受理された.
今後は,脂質キュービックフェーズ法による高分解能での結晶構造の解析や,VSOPの活性化状態の結晶構造を明らかにすることを中心に研究を進め,膜電位センサーをもつタンパク質のうち,なぜVSOPだけがプロトンを膜電位に依存して透過させるのかを明らかするとともに,膜電位センサーの動作原理を理解したいと考えている.
略歴:2004年 九州大学大学院薬学研究院博士課程 修了,同年 佐賀大学医学部 博士研究員,2005年 大阪大学蛋白質研究所 特任研究員を経て,2013年より大阪大学未来戦略機構 特任助教.
研究テーマ:タンパク質科学,X線結晶構造解析学.
関心事:大学院教育と育児.
岡村 康司(Yasushi Okamura)
大阪大学大学院医学系研究科 教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/phys2/okamura/
中川 敦史(Atsushi Nakagawa)
大阪大学蛋白質研究所 教授.
研究室URL:http://www.protein.osaka-u.ac.jp/rcsfp/supracryst/jp/
© 2014 竹下浩平・岡村康司・中川敦史 Licensed under CC 表示 2.1 日本
(1大阪大学蛋白質研究所 超分子構造解析学,2大阪大学大学院医学系研究科 統合生理学)
email:竹下浩平,岡村康司,中川敦史
DOI: 10.7875/first.author.2014.040
X-ray crystal structure of voltage-gated proton channel.
Kohei Takeshita, Souhei Sakata, Eiki Yamashita, Yuichiro Fujiwara, Akira Kawanabe, Tatsuki Kurokawa, Yoshifumi Okochi, Makoto Matsuda, Hirotaka Narita, Yasushi Okamura, Atsushi Nakagawa
Nature Structural & Molecular Biology, 21, 352-357 (2014)
要 約
細胞膜は細胞の内外のイオンの分布差により膜電位を生じており,ニューロンにおいては,膜電位の変化が電位依存性イオンチャネルによる神経伝達における電気的なシグナルの発生および伝達を可能にしている.この膜電位の変化は4つの膜貫通領域により構成される膜電位センサーの正電荷に富んだ4番目の膜貫通領域により感受されるが,その活性化の機構など動作原理については不明な点が残っている.筆者らは,もっともコンパクトな膜電位センサーのみからなる電位依存性プロトンチャネルVSOPの結晶構造を明らかにした.その構造は,4つの膜貫通領域のうち,膜電位センサーのスイッチである4番目の膜貫通領域が細胞質にあるコイルドコイル領域とひとつながりの長いヘリックスを形成した,閉じた和傘のようなかたちであった.細胞の外側にはVSOPのプロトンチャネル活性を阻害するZn2+が結合し,4番目の膜貫通領域は静止膜電位の状態の負電荷により細胞の内側にシフトし,脱分極変化を感受することができるような位置にあることがわかった.これは,膜電位センサーとして長年の謎であった静止状態を示す構造であった.また,プロトンの透過経路は内部にある2つの疎水性バリアにより水分子の侵入をふさぐことで閉じており,VSOPは静止状態においてプロトンを漏洩しないような巧妙で厳密な制御機構をもつことが示唆された.
はじめに
イカの巨大神経軸索を用いた神経伝達機構に関する研究がはじまって以来およそ50年,電位依存性イオンチャネルの研究は積み重ねられ,現在では,X線結晶構造解析の成果によりその分子機構は原子分解能のレベルで詳細に理解されつつある.電位依存性Na+チャネルや電位依存性K+チャネルなど典型的な電位依存性イオンチャネルは,1番目から4番目の膜貫通領域により構成される“膜電位センサー”と,5番目と6番目の膜貫通領域により構成される“イオンポア”からなる,6回膜貫通型を基本構造とした膜タンパク質である(図1a).この膜電位センサーの4番目の膜貫通領域には塩基性アミノ酸残基が周期的に分布し正電荷を帯びている.通常,細胞膜の内部は細胞の内外のイオンの分布差により負に分極した状態になっているため,正電荷を帯びた4番目の膜貫通領域は細胞の内側にシフトしており(図1b),脱分極により細胞膜の内部の分極状態が正にかたむくと正電荷を帯びた4番目の膜貫通領域は反発して細胞の外側へとシフトする(図1c).この細胞膜の分極状態を感受した膜電位センサーの動きが連結するイオンポアの開閉を制御している.
この膜電位センサーは6回膜貫通型の電位依存性イオンチャネルに特徴的なものであると考えられてきたが,2005年,イオンポアの部分がホスホイノシトールリン酸脱リン酸化酵素として知られるPTENと類似した構造に置き替わった電位依存性ホスファターゼが見い出され1,2)(図1a),さらに2006年,イオンポアの部分を欠損した膜電位センサーのみからなる電位依存性プロトンチャネルVSOP(voltage sensor only protein,別名Hv1)が同定された3)(図1a).これら新規の膜電位センサー型タンパク質の発見をきっかけとして,膜電位センサーをもつタンパク質はこれまで知られていた6回膜貫通型のイオンチャネルだけではなく,より広範なファミリーを形成していることが知られるようになった.すなわち,生体においてはさまざまな膜電位センサー型タンパク質が細胞膜の分極状態の変化を利用してさまざまな生理機能を制御しているという,膜電位センサー型タンパク質の研究における新たな潮流が生み出された4).このように,膜電位センサーはモジュールとして,あるときはイオンポアと,あるときは脱リン酸化酵素と共役し,さらには,膜電位センサーのみでプロトンの透過経路を形成するなど,多様性に富んだはたらきをしている.
この研究は,VSOPのプロトンチャネルとしての分子機構の解明だけでなく,膜電位センサー型タンパク質のなかでもっともコンパクトなVSOPをモデルとして,膜電位センサーがどのように活性化するのかという動作原理の解明をめざした.
1.電位依存性プロトンチャネルの生理機能
プロトンが電位に依存して細胞膜を透過することは以前より示唆されていたが,その分子実体が不明であったため生理機能との関係性については不明な点が多かった.しかし,VSOPが同定されたのち,そのさまざまかつ重要な生理機能がつぎつぎと明らかになってきた.たとえば,マクロファージや好中球といった貪食細胞が細菌などの異物を排除する際には,VSOPがファゴソーム膜に存在するNADPHオキシダーゼの基質としてのプロトンを供給することにより殺菌作用を示す活性酸素種の産生を促進し,一方で,副産物であるプロトンを細胞外へと排出することによりNADPHオキシダーゼの活性を維持している5).また,ヒトの精子においては,VSOPがプロトンを排出することで鞭毛の内部のpHがアルカリ性にかたむき,精子の運動のトリガーとなるpH依存性Ca2+チャネルが活性化することにより精子の運動が制御されていることが報告され,VSOPが精子の運動のストッパー装置として機能している可能性が示された6).さらに,転移性乳がんにおいてVSOPが高く発現していること7),VSOPが虚血性脳障害の増悪に関与していること8) なども報告されている.
このように,VSOPは細胞膜の分極状態の変化を利用してプロトンの供給やpHを制御することにより,さまざまな生理機能を制御していると考えられる.
2.VSOPの結晶構造
VSOPは哺乳動物から植物性プランクトンにいたるまで生物界に広く存在する.一般に,X線結晶構造解析のためには試料となる組換えタンパク質を高純度かつ大量に必要とするため,さまざまな生物種から組換えタンパク質の発現に最適なものを選択することが多い.筆者らは,マウスのESTデータベースからVSOPを同定し,そののち,機能解析を詳細に進め知見を蓄積していたので,原子構造と機能解析とを相互的にスマートに理解するため,あえてマウスに由来するVSOPの構造を決定することにした.しかしながら,哺乳動物に由来する膜タンパク質の大量発現および精製は困難であり,さまざまなコンストラクトおよび組換え発現系を試行錯誤したが,さっぱりうまくいかなかった.そのような状況のなか,マウスのVSOPの細胞質にあるコイルドコイル領域の結晶構造解析ならびに機能解析を進めたところ,このコイルドコイル領域は一般的なコイルドコイル領域に比べ熱安定性の低いことが判明した9).そこから,より安定なコイルドコイル領域と入れ替えることによりVSOPの安定性を向上させることができるのではないかと考え,VSOPのコイルドコイル領域を出芽酵母に由来するロイシンジッパータンパク質GCN4のコイルドコイル領域と入れ替えたキメラ体を調製したところ,大量かつ安定な組換えタンパク質を得ることができ,その結晶化にも成功した.さらに,結晶化の再現性や分解能の改善のためコンストラクトを改良し,GCN4とのキメラにくわえ,2番目および3番目の膜貫通領域の細胞質側の半分を電位依存性ホスファターゼCi-VSPのもつ膜電位センサーの対応する領域と入れ替えたキメラ体を作製することにより,VSOPの結晶構造の決定に成功した(PDB ID:3WKV).
結晶構造から,VSOPはこれまで知られていた膜電位センサーのように4つの膜貫通領域から構成されており,とくに,正電荷を帯びた4番目の膜貫通領域と細胞質にあるコイルドコイル領域とはひとつながりのヘリックスを形成していた.4つの膜貫通領域は比較的平行に並び細胞質の側が少し開いたような構造をしており,まるで閉じた和傘のようなかたちをしていた(図2a).
3.Zn2+結合型の静止状態の構造
Zn2+はVSOPの電位に依存的な活性化の過程を阻害することによりプロトンチャネルの活性を抑制することが知られている10).幸運にも,今回の結晶構造においてZn2+の存在を示す異常散乱シグナルが検出された.このシグナルはVSOPの細胞外側の部分にみられ,その周辺には2つのヒスチジン残基の存在が示唆された.この2つのヒスチジン残基はVSOPへのZn2+の結合に重要であることは報告されていたが,プロトマーにつき1個のZn2+の結合することがはじめてわかった.そのほかにも,Zn2+の近くに2つの負電荷アミノ酸残基が存在することがわかり(図2b),変異体の解析により,これらのアミノ酸残基はZn2+との結合に重要であることが判明した.さきに述べたように,Zn2+はVSOPの活性化を阻害する.つまり,活性化したVSOPにZn2+を添加しても活性は阻害されない.このことは,Zn2+の結合したVSOPは活性化のまえの状態を示していることにほかならなかった.膜電位センサーが活性化するまえということは,細胞内が細胞外よりも負に分極した状態で静的に安定し,分極状態が正にかたむく脱分極を感受できる構造であるということである.実際に,VSOPの4番目の膜貫通領域はほかの電位依存性イオンチャネルの活性型の膜電位センサーと比べ明らかに細胞の内側へとシフトしていた(図2c).すなわち,今回のVSOPの結晶構造は静止状態にある膜電位センサーのものであることが強く示唆された.
4.静止状態のVSOPの内部には疎水性バリアが存在する
今回のVSOPの結晶構造は,プロトンチャネル活性を阻害するZn2+が結合し,膜電位センサーの機能中心である4番目の膜貫通領域が細胞膜の内側へとシフトした,静止状態の構造を強く反映したものであった.つまり,プロトンを透過させない構造であることがうかがえた.実際に,VSOPの内部の水が入りうる部分をみてみると,かなり深くまで水が入りうる部分が存在したが,疎水性アミノ酸残基により構成された疎水性バリアにより細胞外および細胞内への水分子の侵入は遮断されていることがわかった(図2d).プロトンは水分子や負電荷アミノ酸残基の側鎖をバケツリレー形式により移動することにより透過していると考えられたが,その水分子のネットワークが遮断されていたことは,静止状態のVSOPの構造はプロトンチャネルが閉じた構造を示していることにほかならないだろう.
5.膜電位センサーの動作原理の謎
ここまでの話から,“たんにVSOPの結晶構造を解いただけか?”と感じた読者もいるかもしれない.しかし,今回の研究結果は,膜電位センサーの動作原理における2つのブラックボックスを明らかにした点で重要な成果と考えられる.その1つ目は,これまでに解かれた電位依存性イオンチャネルの膜電位センサーの結晶構造はすべて活性化状態のものであり,VSOPの結晶構造は静止状態のものとしてはじめてであったことである.2つ目は,一般に膜電位センサーは2価の金属イオンにより活性化が阻害されることが報告されているが,今回の解かれた結晶構造は膜電位センサーに金属イオンが結合した状態のものとしてもはじめてであったことである.したがって,今回のVSOPの結晶構造は,分子として新規の構造であったと同時に,膜電位センサーの長年の構造学的なブラックボックスの一端を明らかにしたものであるといえる.
このように膜電位センサーの構造学的な2つのブラックボックスを明らかにしたことは,VSOPのみならず,ほかの電位依存性イオンチャネルが膜電位の変化を感受した際にどのように作動してイオンポアの開閉に連動するのかという分子機構の解明のヒントになると期待され,電位依存性イオンチャネルが関係するさまざまな疾患の新たな治療薬の開発にもつながる可能性をひめている.
おわりに
これまで,膜タンパク質の結晶構造の解析における試料の調製を効率的に検討する手法として,GFPの蛍光とゲルろ過とを組み合わせたハイスループット解析およびその成功例が数多く報告されている.当初,筆者らも,この方法を導入して条件検討を開始したが,結晶化のためにデザインしたGFP融合タンパク質によってはカラム樹脂に非特異的に吸着するものやGFPを融合することにより不溶性になるものがあったため,ハイスループットなスクリーニングができず,コンストラクトを変更するたびに精製および結晶化に適した界面活性剤を検討する必要があり,たいへんに苦労した.
多様な生理機能に関与するVSOPの構造生物学な研究は,膜電位に依存してプロトンを透過させるイオンチャネルとしての生理学的な分子機構を詳細に理解するだけではなく,さまざまな膜電位センサー型タンパク質に共通のモジュールとして膜電位センサーの動作原理を理解するためのすぐれたモデルとしての重要性も高い.とくに,膜電位センサーの静止状態における構造は不明であったが,VSOPが膜電位差のないときには完全に閉じた構造でありZn2+により活性が阻害されたことから,VSOPは静止状態の結晶構造が解きやすいのではないかと考えていた.結果として,幸運にも結晶構造を明らかにすることができた.静止状態の膜電位センサーがどのような構造をしているかは長年にわたりブラックボックスであったため,論文の投稿にあたっては査読者から多くの指摘をうけるだろうと予測していた.ところが,Zn2+が結合しプロトンチャネル活性が阻害されたVSOPの4番目の膜貫通領域は,静止状態であることを意味する細胞の内側へのシフトを示してしており,そのとき,プロトンの透過経路は閉じた状態であるという3つの構造学的な議論が認められて,論文はほぼ修正なしに受理された.
今後は,脂質キュービックフェーズ法による高分解能での結晶構造の解析や,VSOPの活性化状態の結晶構造を明らかにすることを中心に研究を進め,膜電位センサーをもつタンパク質のうち,なぜVSOPだけがプロトンを膜電位に依存して透過させるのかを明らかするとともに,膜電位センサーの動作原理を理解したいと考えている.
文 献
- Murata, Y., Iwasaki, H., Sasaki, M. et al.: Phosphoinositide phosphatase activity coupled to an intrinsic voltage sensor. Nature, 435, 1239-1243 (2005)[PubMed]
- Sasaki, M., Takagi, M. & Okamura, Y.: A voltage sensor-domain protein is a voltage-gated proton channel. Science, 312, 589-592 (2006)[PubMed]
- Matsuda, M., Takeshita, K., Kurokawa, T. et al.: Crystal structure of the cytoplasmic phosphatase and tensin homolog (PTEN)-like region of Ciona intestinalis voltage-sensing phosphatase provides insight into substrate specificity and redox regulation of the phosphoinositide phosphatase activity. J. Biol. Chem., 286, 23368-23377 (2011)[PubMed]
- Okamura, Y.: Biodiversity of voltage sensor domain proteins. Pflugers Arch., 454, 361-371 (2007)[PubMed]
- Okochi, Y., Sasaki, M., Iwasaki, H. et al.: Voltage-gated proton channel is expressed on phagosomes. Biochem. Biophys. Res. Commun., 382, 274-279 (2009)[PubMed]
- Lishko, P. V., Botchkina, I. L., Fedorenko, A. et al.: Acid extrusion from human spermatozoa is mediated by flagellar voltage-gated proton channel. Cell, 140, 327-337 (2010)[PubMed]
- Wang, Y., Li, S. J., Wu, X. et al.: Clinicopathological and biological significance of human voltage-gated proton channel Hv1 protein overexpression in breast cancer. J. Biol. Chem., 287, 13877-13888 (2012)[PubMed]
- Wu, L. J., Wu, G., Akhavan Sharif, M. et al.: The voltage-gated proton channel Hv1 enhances brain damage from ischemic stroke. Nat. Neurosci., 15, 565-573 (2012)[PubMed]
- Fujiwara, Y., Kurokawa, T., Takeshita, K. et al.: The cytoplasmic coiled-coil mediates cooperative gating temperature sensitivity in the voltage-gated H+ channel Hv1. Nat. Commun., 3, 816 (2012)[PubMed]
- Cherny, V. V. & DeCoursey, T. E.: pH-dependent inhibition of voltage-gated H+ currents in rat alveolar epithelial cells by Zn2+ and other divalent cations. J. Gen. Physiol., 114, 819-838 (1999)[PubMed]
著者プロフィール
略歴:2004年 九州大学大学院薬学研究院博士課程 修了,同年 佐賀大学医学部 博士研究員,2005年 大阪大学蛋白質研究所 特任研究員を経て,2013年より大阪大学未来戦略機構 特任助教.
研究テーマ:タンパク質科学,X線結晶構造解析学.
関心事:大学院教育と育児.
岡村 康司(Yasushi Okamura)
大阪大学大学院医学系研究科 教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/phys2/okamura/
中川 敦史(Atsushi Nakagawa)
大阪大学蛋白質研究所 教授.
研究室URL:http://www.protein.osaka-u.ac.jp/rcsfp/supracryst/jp/
© 2014 竹下浩平・岡村康司・中川敦史 Licensed under CC 表示 2.1 日本