自然リンパ球は間質細胞および免疫細胞のシグナルを統合することにより辺縁帯B細胞からの抗体の産生を増強する
宮島倫生・Sidonia Fagarasan
(理化学研究所統合生命医科学研究センター 粘膜免疫研究チーム)
email:宮島倫生
DOI: 10.7875/first.author.2014.039
Innate lymphoid cells integrate stromal and immunological signals to enhance antibody production by splenic marginal zone B cells.
Giuliana Magri, Michio Miyajima, Sabrina Bascones, Arthur Mortha, Irene Puga, Linda Cassis, Carolina M. Barra, Laura Comerma, Aleksey Chudnovskiy, Maurizio Gentile, David Llige, Montserrat Cols, Sergi Serrano, Juan Ignacio Aróstegui, Manel Juan, Jordi Yagüe, Miriam Merad, Sidonia Fagarasan, Andrea Cerutti
Nature Immunology, 15, 354-364 (2014)
自然リンパ球は上皮細胞や一部の免疫細胞などを制御することが示されていたものの,B細胞に対する影響についてはながらく不明であった.今回,筆者らは,自然リンパ球が脾臓において,自然免疫様のB細胞である辺縁帯B細胞によるT細胞に非依存性の抗体産生を増強していることを見い出した.自然リンパ球は辺縁帯B細胞に近接して局在し,辺縁帯B細胞の生存,分化,増殖および抗体の産生を促進していた.また,自然リンパ球は辺縁帯の間質細胞の生存および活性化を促進する一方で,間質細胞からの生存シグナルを受容するというクロストークにより抗体産生の場を形成していた.さらに,自然リンパ球は好中球を誘引しその生存を促進することにより,好中球による辺縁帯B細胞および形質細胞の補助作用を促進していた.このように,自然リンパ球は脾臓の辺縁帯において間質細胞および免疫細胞からのシグナルを統合し,抗体の産生を直接的かつ間接的に制御していることが示された.
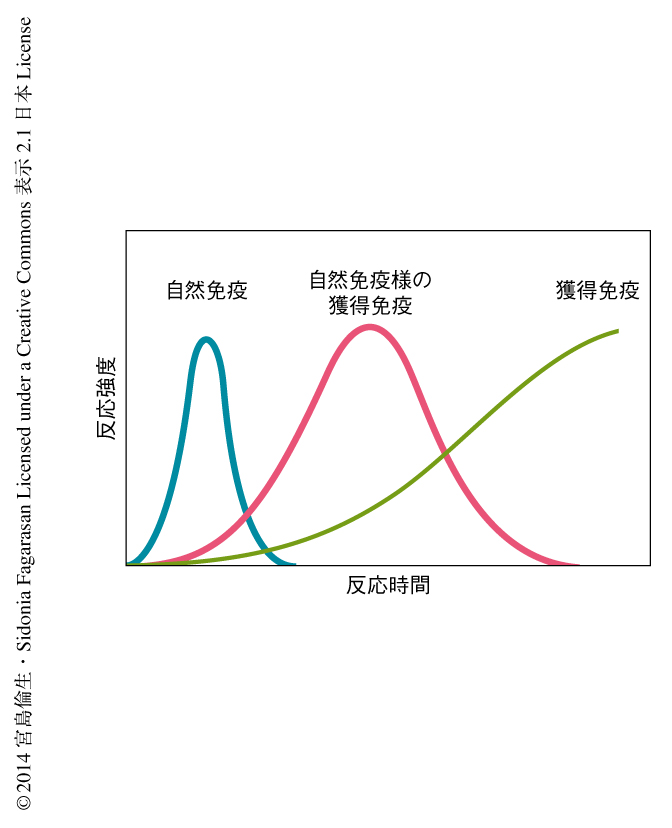
これまで,免疫系は自然免疫系と獲得免疫系とに二分されてきた.自然免疫は非特異的な免疫応答であり免疫記憶を欠くのに対し,獲得免疫は特異的な抗原の認識および免疫記憶を特徴とする,というのが一般的な説明である.しかし,このような見解は免疫系の正確な分類ではなくなってきている.というのも,自然免疫系と獲得免疫系という伝統的な境界を不明瞭にするような多くの細胞が同定されてきているからである.すなわち,γδT細胞やナチュラルキラーT細胞などの自然免疫様のT細胞や,B1細胞や辺縁帯B細胞などの自然免疫様のB細胞が知られるところとなった.これらの細胞は限定された抗原受容体のレパトワをもち,迅速な自然免疫応答と一定の時間を要する獲得免疫応答とのあいだをうめ,その橋渡しをすると考えられている細胞である(図1).
このように,自然免疫系と獲得免疫系との境界を不明瞭にする細胞のひとつに,自然リンパ球がある.自然リンパ球は1型から3型までのグループに分けられ,抗菌免疫応答や炎症応答において重要な役割をもつ.また,近年の研究により,自然リンパ球は特異的な抗原受容体を欠くにもかかわらず,ヘルパーT細胞に対応したマスター転写因子を発現し,エフェクターサイトカインを迅速に産生できることが明らかになった1).しかし一方で,これまで自然リンパ球の抗体産生における役割はほとんどわかっていなかった.そこで,筆者らは,自然リンパ球の抗体産生における役割を明らかにすることにした.
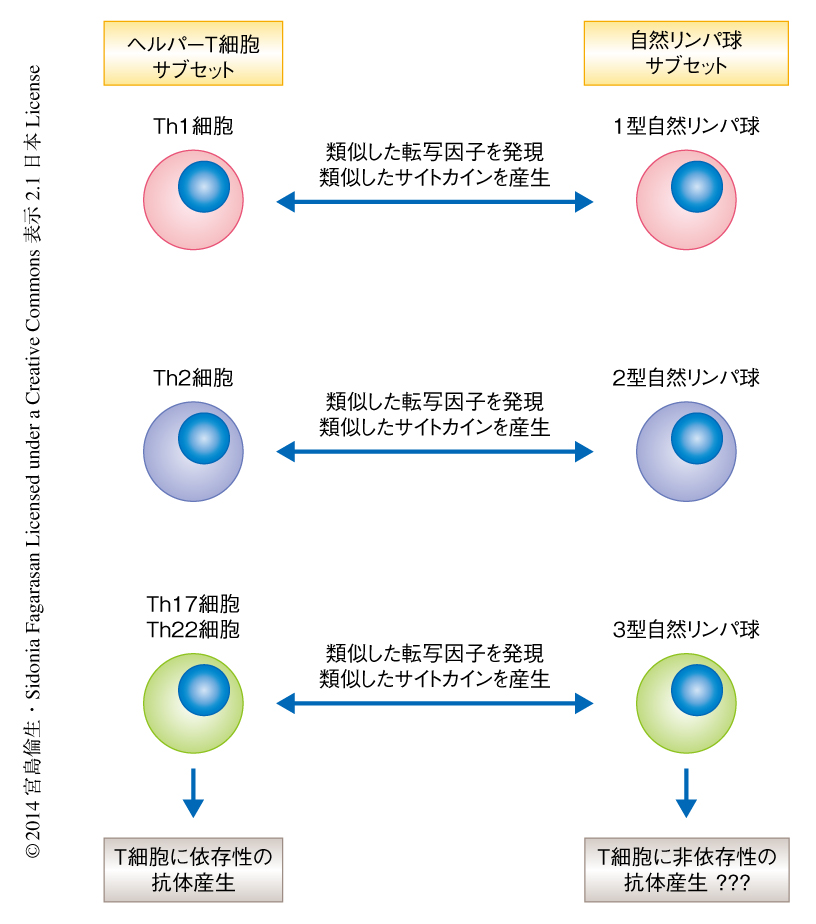
抗体の産生は宿主の免疫応答において重要な反応のひとつであり,T細胞に依存性の抗体産生と非依存性の抗体産生の2種類に分けられることが知られている.筆者らのアイデアは単純であった.ヘルパーT細胞サブセットがT細胞に依存性の抗体の産生を制御しているのであれば,それと対応したサイトカインを産生する自然リンパ球サブセットはT細胞に非依存性の抗体の産生を制御しているのではないか,というアイデアである.そこで,“自然リンパ球はT細胞に非依存性の抗体産生を制御しているのか?”,もし,そうであれば“自然リンパ球はどのようにT細胞に非依存性の抗体産生を制御しているのか?”という問いをたて検証することにした(図2).
脾臓は体内で最大の血液フィルターである.とくに,辺縁帯は循環系と免疫系との接点になっており,血液に由来する微生物などに暴露されつづける環境である2).辺縁帯B細胞は自然免疫様のB細胞であり,血液に由来する抗原に対するT細胞に非依存性の抗体の産生により,抗原の迅速な除去に役だっていることが知られている3).一方で,自然リンパ球は粘膜において外界からの異物に対する免疫応答や炎症応答に重要な役割をもつことが知られている1).これまで,ヒトの脾臓において自然リンパ球の存在は報告されていなかったものの,辺縁帯は血液に由来する抗原に暴露されつづける環境であり粘膜との類似性がみられることから,辺縁帯に自然リンパ球が存在しその恒常性の維持を担っている可能性が考えられた.そこで,この研究は,脾臓における自然リンパ球と辺縁帯B細胞との関係に焦点をあてて解析を行い,さきの問いに答えることを試みた.
これまで,ヒトの脾臓における自然リンパ球の報告はなかったことから,ヒトの脾臓に自然リンパ球が存在するかどうか検討した.フローサイトメトリーおよび定量リアルタイムPCR法による解析の結果,脾臓は粘膜細胞に局在する3型自然リンパ球に類似した表面マーカーをもつ細胞を含み,その細胞は3型自然リンパ球に特徴的な遺伝子を発現していた.このことから,脾臓は3型自然リンパ球をもつことが示された.さらに,脾臓の切片の免疫染色により,3型自然リンパ球に特徴的なRORγt陽性の自然リンパ球は辺縁帯に局在することが示唆された.このように,ヒトの脾臓には3型自然リンパ球が存在し,辺縁帯に局在することが明らかになった.
粘膜において3型自然リンパ球は間質細胞と相互作用していることが知られている4).そこで,ヒトの脾臓の辺縁帯において間質細胞の同定を試みた.脾臓の切片の免疫染色により,辺縁帯の自然リンパ球の近傍において間質細胞のマーカーに陽性の細胞が認められた.さらに,このような間質細胞マーカーを発現する細胞はフローサイトメトリーによっても検出されたことから,ヒトの脾臓の辺縁帯における間質細胞の存在が裏づけられた.また,フローサイトメトリーおよび定量リアルタイムPCR法により,間質細胞はToll様受容体にくわえ,自然リンパ球の生存あるいは誘引にはたらくタンパク質を高く発現していることが明らかになったことから,微生物の構成物により間質細胞を恒常的に活性化する機構の存在が示唆された.さらに,単離培養実験により,自然リンパ球は間質細胞に由来するサイトカインに応答して間質細胞との接着に重要なα4β7インテグリンの発現を誘導することが示された.その一方で,間質細胞は自然リンパ球において高く発現するTNFαなどに応答して,ICAM-1など自然リンパ球との接着分子の発現を誘導することが認められたことから,脾臓における自然リンパ球と間質細胞とのあいだのクロストークの存在が示唆された.
自然リンパ球は脾臓において辺縁帯に局在していたことから,自然リンパ球は辺縁帯B細胞を制御している可能性が考えられた.免疫染色や定量リアルタイムPCR法により,自然リンパ球は辺縁帯B細胞の近傍に局在すること,また,B細胞や形質細胞の補助タンパク質を高く発現していることが明らかになった.また,このような自然リンパ球におけるB細胞や形質細胞の補助タンパク質の発現は,フローサイトメトリーおよび酵素免疫定量法によっても裏づけられた.共培養実験により,脾臓の自然リンパ球は辺縁帯B細胞の生存,増殖,抗体の産生,形質細胞への分化を直接的に促進しうることが示された.さらに,間質細胞および自然リンパ球の両者と共培養した辺縁帯B細胞は,間質細胞あるいは自然リンパ球のどちらかのみと共培養した辺縁帯B細胞と比較して,抗体の産生および形質細胞への分化が促進された.以上の結果から,ヒトの脾臓の自然リンパ球は間質細胞と協調して辺縁帯B細胞を活性化することが示唆された.
ヒトの脾臓において辺縁帯B細胞は好中球と相互作用することが知られており,サイトカインの1種であるGM-CSFは好中球の生存および活性化に重要であることが知られている5).一方で,GM-CSFの産生に転写因子RORγtが関与することから6),脾臓の自然リンパ球によるGM-CSFを介した好中球の制御や辺縁帯B細胞の制御の可能性について検討した.
脾臓組織の免疫染色により,自然リンパ球は辺縁帯において好中球と近接して局在することが示された一方,定量リアルタイムPCR法により脾臓の自然リンパ球はGM-CSFを高く発現することが示された.GM-CSFは好中球のB細胞補助活性を増強することから,GM-CSFを産生する自然リンパ球がB細胞補助活性を誘導するかどうか共培養実験により検討した.その結果,脾臓の自然リンパ球の存在のもとで好中球は生存が促進されたほか,CD11bなどの活性化タンパク質の発現の上昇および接着分子の発現の低下といった典型的なB細胞補助活性型の細胞特性を獲得した.これらの好中球の生存の促進および活性化は抗GM-CSF抗体の添加により抑制されたことから,GM-CSFを介した自然リンパ球の好中球の制御が明らかになった.さらに,自然リンパ球との共培養により,好中球は辺縁帯B細胞による抗体産生能を増強させた.このように,ヒトの脾臓において自然リンパ球はGM-CSFの産生をつうじて好中球を刺激し,辺縁帯B細胞の応答を増強している可能性が示唆された.
生体内における脾臓の自然リンパ球の抗体産生への寄与について明らかにするため,RORγtノックアウトマウスを解析した.RORγtは3型自然リンパ球の分化に不可欠な転写因子であり,RORγtノックアウトマウスは3型自然リンパ球を欠損すること,また,RORγt陽性3型自然リンパ球は脾臓にも存在することが知られている7,8).フローサイトメトリーにより,RORγtノックアウトマウスは野生型マウスと比較して,脾臓における自然リンパ球の数が著しく減少していることが示された.このことから,マウスの脾臓の自然リンパ球についても,3型自然リンパ球が主要であると考えられた.このことは,定量リアルタイムPCR法によりマウスの脾臓の自然リンパ球は3型自然リンパ球に特徴的な遺伝子を高く発現するという結果が得られたことからも裏づけられた.
自然リンパ球のT細胞に非依存性の抗体産生への寄与について明らかにするため,RORγtとCD3とのダブルノックアウトマウスを解析した.マウスにおいては免疫グロブリンMおよび免疫グロブリンG3がT細胞に非依存性に産生される抗体であることが知られているが,RORγt CD3ダブルノックアウトマウスはCD3ノックアウトマウスと比較して,免疫グロブリンG3陽性の形質芽細胞の数および免疫グロブリンG3陽性の形質細胞の数が減少していたと同時に,血清における免疫グロブリンG3の濃度が減少していた.このことから,3型自然リンパ球はT細胞に非依存性の免疫グロブリンG3の産生を制御していることが示された.
生体内における自然リンパ球による辺縁帯B細胞の補助機能をより生理的な条件において詳細に調べるため,近年になり報告された,自然リンパ球除去マウスの系を利用した9).自然リンパ球除去マウスは対照マウスと比較して,自然リンパ球の数の減少にくわえ,免疫グロブリンG3陽性の形質芽細胞の数,免疫グロブリンG3陽性の形質細胞の数,血清における免疫グロブリンG3の濃度の減少が認められた.さらに,自然リンパ球除去マウスは対照マウスと比較して,T細胞に非依存性の抗原であるTNP-FICOLLに対する免疫グロブリンG3抗体の産生が有意に低下していた.このことから,3型自然リンパ球はT細胞に非依存性の免疫グロブリンG3の産生を制御していることが裏づけられた.
さらに,RORγt欠損マウスに自然リンパ球を再構成させたキメラマウスを用いて,脾臓の自然リンパ球のT細胞に非依存性の抗体産生における役割について検討した.自然リンパ球再構成キメラマウスは自然リンパ球が再構成されていない対照マウスと比較して,免疫グロブリンG3陽性の形質芽細胞の数,免疫グロブリンG3陽性の形質細胞の数,血清における免疫グロブリンG3の濃度が増加していた.このことからも,3型自然リンパ球はT細胞に非依存性の免疫グロブリンG3の産生を制御していることが裏づけられた.
これら3つのマウスの系では,血清における免疫グロブリンMの濃度や免疫グロブリンM陽性の形質細胞の数の減少はみられなかったことから,マウスの脾臓の自然リンパ球はおもに辺縁帯B細胞におけるT細胞に非依存性の免疫グロブリンG3の産生に重要であると考えられた.以上の結果から,自然リンパ球は生体内において免疫グロブリンG3陽性の形質芽細胞の数,免疫グロブリンG3陽性の形質細胞の数,血清における免疫グロブリンG3の濃度を適切に維持するのに必要かつ十分であることが示された.
自然リンパ球の好中球のホメオスタシスにおける役割について調べた.RORγt CD3ダブルノックアウトマウスは対照となるCD3ノックアウトマウスと比較して好中球の数が減少していたのにくわえ,自然リンパ球再構成キメラマウスは自然リンパ球が再構成されていない対照マウスと比較して好中球の数が増加していたことから,マウスの脾臓の自然リンパ球は好中球の脾臓への局在に必要かつ十分であることが明らかになった.脾臓の好中球の免疫グロブリンG3の産生への寄与について明らかにするため,抗Ly6G抗体により好中球を除去したマウスを解析した.好中球除去マウスは対照マウスと比較して,免疫グロブリンG3陽性の形質細胞の数および血清における免疫グロブリンG3の濃度が有意に減少していた.このように,自然リンパ球とは異なり,好中球はおもに免疫グロブリンG3産生細胞の終末分化を制御することによりT細胞に非依存性の免疫グロブリンG3の産生に寄与していることが示唆された.
生体内における脾臓の自然リンパ球による好中球の制御の分子機構について検討した.定量リアルタイムPCR法により,マウスの脾臓の自然リンパ球はほかの白血球と比較してGM-CSFを高く発現していることが示された.また一方で,自然リンパ球を欠損したRag1 IL2rgダブルノックアウトマウスは自然リンパ球をもつRag1ノックアウトマウスと比較して好中球の数が減少しており,自然リンパ球の養子免疫細胞移入により好中球の数は増加あるいは回復することが示された.さらに,GM-CSFノックアウトマウスに由来する自然リンパ球細胞の養子免疫細胞移入では好中球の数の回復はみられなかった.以上の結果から,脾臓の自然リンパ球はGM-CSFの産生を介して好中球を誘引し,好中球と協調して抗体の産生を増強しているものと考えられた.
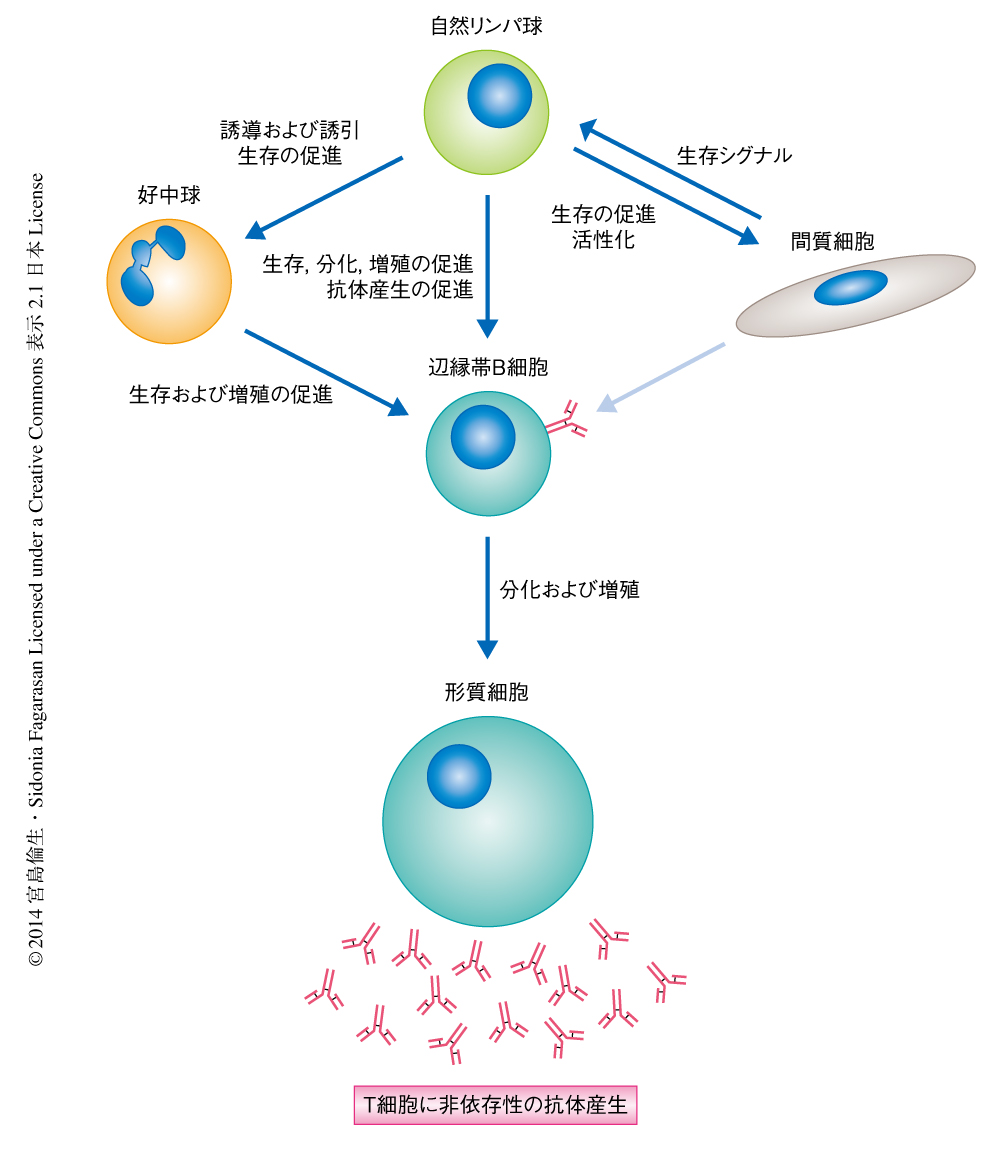
この研究により,自然リンパ球によるT細胞に非依存性の抗体産生について,その機構の一端が明らかになった.自然リンパ球は辺縁帯B細胞からの抗体の産生を直接的に促進するのみならず,間質細胞や好中球などのほかの細胞を介して,間接的にもT細胞に非依存性の抗体の産生を制御していることが示された(図3).
T細胞に非依存性の抗体産生は肺炎双球菌や髄膜炎菌など多糖莢膜をもつ細菌に対する反応であり,莢膜の多糖体はワクチンとしても利用されている10).しかし,多糖莢膜をもつ細菌に対するワクチンには,免疫不全患者に対して効果が薄い,発展途上国における利用には高価すぎる,などの問題点があり,新規のワクチンの開発が望まれていた.この研究により示されたT細胞に非依存性の抗体産生の新たな分子機構が,効率的かつ安価な新規のワクチンの開発の基盤となればうれしいかぎりである.
略歴:2010年 東京大学大学院医学系研究科博士課程 修了,同年 理化学研究所免疫・アレルギー科学総合研究センター 特別研究員を経て,2013年より理化学研究所統合生命医科学研究センター 研究員.
関心事:生物学全般.
Sidonia Fagarasan
理化学研究所統合生命医科学研究センター チームリーダー.
研究室URL:http://web.rcai.riken.jp/mucosal
© 2014 宮島倫生・Sidonia Fagarasan Licensed under CC 表示 2.1 日本
(理化学研究所統合生命医科学研究センター 粘膜免疫研究チーム)
email:宮島倫生
DOI: 10.7875/first.author.2014.039
Innate lymphoid cells integrate stromal and immunological signals to enhance antibody production by splenic marginal zone B cells.
Giuliana Magri, Michio Miyajima, Sabrina Bascones, Arthur Mortha, Irene Puga, Linda Cassis, Carolina M. Barra, Laura Comerma, Aleksey Chudnovskiy, Maurizio Gentile, David Llige, Montserrat Cols, Sergi Serrano, Juan Ignacio Aróstegui, Manel Juan, Jordi Yagüe, Miriam Merad, Sidonia Fagarasan, Andrea Cerutti
Nature Immunology, 15, 354-364 (2014)
要 約
自然リンパ球は上皮細胞や一部の免疫細胞などを制御することが示されていたものの,B細胞に対する影響についてはながらく不明であった.今回,筆者らは,自然リンパ球が脾臓において,自然免疫様のB細胞である辺縁帯B細胞によるT細胞に非依存性の抗体産生を増強していることを見い出した.自然リンパ球は辺縁帯B細胞に近接して局在し,辺縁帯B細胞の生存,分化,増殖および抗体の産生を促進していた.また,自然リンパ球は辺縁帯の間質細胞の生存および活性化を促進する一方で,間質細胞からの生存シグナルを受容するというクロストークにより抗体産生の場を形成していた.さらに,自然リンパ球は好中球を誘引しその生存を促進することにより,好中球による辺縁帯B細胞および形質細胞の補助作用を促進していた.このように,自然リンパ球は脾臓の辺縁帯において間質細胞および免疫細胞からのシグナルを統合し,抗体の産生を直接的かつ間接的に制御していることが示された.
はじめに
これまで,免疫系は自然免疫系と獲得免疫系とに二分されてきた.自然免疫は非特異的な免疫応答であり免疫記憶を欠くのに対し,獲得免疫は特異的な抗原の認識および免疫記憶を特徴とする,というのが一般的な説明である.しかし,このような見解は免疫系の正確な分類ではなくなってきている.というのも,自然免疫系と獲得免疫系という伝統的な境界を不明瞭にするような多くの細胞が同定されてきているからである.すなわち,γδT細胞やナチュラルキラーT細胞などの自然免疫様のT細胞や,B1細胞や辺縁帯B細胞などの自然免疫様のB細胞が知られるところとなった.これらの細胞は限定された抗原受容体のレパトワをもち,迅速な自然免疫応答と一定の時間を要する獲得免疫応答とのあいだをうめ,その橋渡しをすると考えられている細胞である(図1).
このように,自然免疫系と獲得免疫系との境界を不明瞭にする細胞のひとつに,自然リンパ球がある.自然リンパ球は1型から3型までのグループに分けられ,抗菌免疫応答や炎症応答において重要な役割をもつ.また,近年の研究により,自然リンパ球は特異的な抗原受容体を欠くにもかかわらず,ヘルパーT細胞に対応したマスター転写因子を発現し,エフェクターサイトカインを迅速に産生できることが明らかになった1).しかし一方で,これまで自然リンパ球の抗体産生における役割はほとんどわかっていなかった.そこで,筆者らは,自然リンパ球の抗体産生における役割を明らかにすることにした.
抗体の産生は宿主の免疫応答において重要な反応のひとつであり,T細胞に依存性の抗体産生と非依存性の抗体産生の2種類に分けられることが知られている.筆者らのアイデアは単純であった.ヘルパーT細胞サブセットがT細胞に依存性の抗体の産生を制御しているのであれば,それと対応したサイトカインを産生する自然リンパ球サブセットはT細胞に非依存性の抗体の産生を制御しているのではないか,というアイデアである.そこで,“自然リンパ球はT細胞に非依存性の抗体産生を制御しているのか?”,もし,そうであれば“自然リンパ球はどのようにT細胞に非依存性の抗体産生を制御しているのか?”という問いをたて検証することにした(図2).
脾臓は体内で最大の血液フィルターである.とくに,辺縁帯は循環系と免疫系との接点になっており,血液に由来する微生物などに暴露されつづける環境である2).辺縁帯B細胞は自然免疫様のB細胞であり,血液に由来する抗原に対するT細胞に非依存性の抗体の産生により,抗原の迅速な除去に役だっていることが知られている3).一方で,自然リンパ球は粘膜において外界からの異物に対する免疫応答や炎症応答に重要な役割をもつことが知られている1).これまで,ヒトの脾臓において自然リンパ球の存在は報告されていなかったものの,辺縁帯は血液に由来する抗原に暴露されつづける環境であり粘膜との類似性がみられることから,辺縁帯に自然リンパ球が存在しその恒常性の維持を担っている可能性が考えられた.そこで,この研究は,脾臓における自然リンパ球と辺縁帯B細胞との関係に焦点をあてて解析を行い,さきの問いに答えることを試みた.
1.ヒトの脾臓の自然リンパ球は3型自然リンパ球であり辺縁帯に局在する
これまで,ヒトの脾臓における自然リンパ球の報告はなかったことから,ヒトの脾臓に自然リンパ球が存在するかどうか検討した.フローサイトメトリーおよび定量リアルタイムPCR法による解析の結果,脾臓は粘膜細胞に局在する3型自然リンパ球に類似した表面マーカーをもつ細胞を含み,その細胞は3型自然リンパ球に特徴的な遺伝子を発現していた.このことから,脾臓は3型自然リンパ球をもつことが示された.さらに,脾臓の切片の免疫染色により,3型自然リンパ球に特徴的なRORγt陽性の自然リンパ球は辺縁帯に局在することが示唆された.このように,ヒトの脾臓には3型自然リンパ球が存在し,辺縁帯に局在することが明らかになった.
2.ヒトの脾臓における自然リンパ球と間質細胞とのあいだのクロストーク
粘膜において3型自然リンパ球は間質細胞と相互作用していることが知られている4).そこで,ヒトの脾臓の辺縁帯において間質細胞の同定を試みた.脾臓の切片の免疫染色により,辺縁帯の自然リンパ球の近傍において間質細胞のマーカーに陽性の細胞が認められた.さらに,このような間質細胞マーカーを発現する細胞はフローサイトメトリーによっても検出されたことから,ヒトの脾臓の辺縁帯における間質細胞の存在が裏づけられた.また,フローサイトメトリーおよび定量リアルタイムPCR法により,間質細胞はToll様受容体にくわえ,自然リンパ球の生存あるいは誘引にはたらくタンパク質を高く発現していることが明らかになったことから,微生物の構成物により間質細胞を恒常的に活性化する機構の存在が示唆された.さらに,単離培養実験により,自然リンパ球は間質細胞に由来するサイトカインに応答して間質細胞との接着に重要なα4β7インテグリンの発現を誘導することが示された.その一方で,間質細胞は自然リンパ球において高く発現するTNFαなどに応答して,ICAM-1など自然リンパ球との接着分子の発現を誘導することが認められたことから,脾臓における自然リンパ球と間質細胞とのあいだのクロストークの存在が示唆された.
3.ヒトの脾臓において自然リンパ球と間質細胞は協調して辺縁帯B細胞を活性化する
自然リンパ球は脾臓において辺縁帯に局在していたことから,自然リンパ球は辺縁帯B細胞を制御している可能性が考えられた.免疫染色や定量リアルタイムPCR法により,自然リンパ球は辺縁帯B細胞の近傍に局在すること,また,B細胞や形質細胞の補助タンパク質を高く発現していることが明らかになった.また,このような自然リンパ球におけるB細胞や形質細胞の補助タンパク質の発現は,フローサイトメトリーおよび酵素免疫定量法によっても裏づけられた.共培養実験により,脾臓の自然リンパ球は辺縁帯B細胞の生存,増殖,抗体の産生,形質細胞への分化を直接的に促進しうることが示された.さらに,間質細胞および自然リンパ球の両者と共培養した辺縁帯B細胞は,間質細胞あるいは自然リンパ球のどちらかのみと共培養した辺縁帯B細胞と比較して,抗体の産生および形質細胞への分化が促進された.以上の結果から,ヒトの脾臓の自然リンパ球は間質細胞と協調して辺縁帯B細胞を活性化することが示唆された.
4.ヒトの脾臓の自然リンパ球による辺縁帯B細胞の補助活性をもつ好中球の活性化
ヒトの脾臓において辺縁帯B細胞は好中球と相互作用することが知られており,サイトカインの1種であるGM-CSFは好中球の生存および活性化に重要であることが知られている5).一方で,GM-CSFの産生に転写因子RORγtが関与することから6),脾臓の自然リンパ球によるGM-CSFを介した好中球の制御や辺縁帯B細胞の制御の可能性について検討した.
脾臓組織の免疫染色により,自然リンパ球は辺縁帯において好中球と近接して局在することが示された一方,定量リアルタイムPCR法により脾臓の自然リンパ球はGM-CSFを高く発現することが示された.GM-CSFは好中球のB細胞補助活性を増強することから,GM-CSFを産生する自然リンパ球がB細胞補助活性を誘導するかどうか共培養実験により検討した.その結果,脾臓の自然リンパ球の存在のもとで好中球は生存が促進されたほか,CD11bなどの活性化タンパク質の発現の上昇および接着分子の発現の低下といった典型的なB細胞補助活性型の細胞特性を獲得した.これらの好中球の生存の促進および活性化は抗GM-CSF抗体の添加により抑制されたことから,GM-CSFを介した自然リンパ球の好中球の制御が明らかになった.さらに,自然リンパ球との共培養により,好中球は辺縁帯B細胞による抗体産生能を増強させた.このように,ヒトの脾臓において自然リンパ球はGM-CSFの産生をつうじて好中球を刺激し,辺縁帯B細胞の応答を増強している可能性が示唆された.
5.マウスの脾臓の自然リンパ球によるT細胞に非依存性の免疫グロブリンG3の産生増強
生体内における脾臓の自然リンパ球の抗体産生への寄与について明らかにするため,RORγtノックアウトマウスを解析した.RORγtは3型自然リンパ球の分化に不可欠な転写因子であり,RORγtノックアウトマウスは3型自然リンパ球を欠損すること,また,RORγt陽性3型自然リンパ球は脾臓にも存在することが知られている7,8).フローサイトメトリーにより,RORγtノックアウトマウスは野生型マウスと比較して,脾臓における自然リンパ球の数が著しく減少していることが示された.このことから,マウスの脾臓の自然リンパ球についても,3型自然リンパ球が主要であると考えられた.このことは,定量リアルタイムPCR法によりマウスの脾臓の自然リンパ球は3型自然リンパ球に特徴的な遺伝子を高く発現するという結果が得られたことからも裏づけられた.
自然リンパ球のT細胞に非依存性の抗体産生への寄与について明らかにするため,RORγtとCD3とのダブルノックアウトマウスを解析した.マウスにおいては免疫グロブリンMおよび免疫グロブリンG3がT細胞に非依存性に産生される抗体であることが知られているが,RORγt CD3ダブルノックアウトマウスはCD3ノックアウトマウスと比較して,免疫グロブリンG3陽性の形質芽細胞の数および免疫グロブリンG3陽性の形質細胞の数が減少していたと同時に,血清における免疫グロブリンG3の濃度が減少していた.このことから,3型自然リンパ球はT細胞に非依存性の免疫グロブリンG3の産生を制御していることが示された.
生体内における自然リンパ球による辺縁帯B細胞の補助機能をより生理的な条件において詳細に調べるため,近年になり報告された,自然リンパ球除去マウスの系を利用した9).自然リンパ球除去マウスは対照マウスと比較して,自然リンパ球の数の減少にくわえ,免疫グロブリンG3陽性の形質芽細胞の数,免疫グロブリンG3陽性の形質細胞の数,血清における免疫グロブリンG3の濃度の減少が認められた.さらに,自然リンパ球除去マウスは対照マウスと比較して,T細胞に非依存性の抗原であるTNP-FICOLLに対する免疫グロブリンG3抗体の産生が有意に低下していた.このことから,3型自然リンパ球はT細胞に非依存性の免疫グロブリンG3の産生を制御していることが裏づけられた.
さらに,RORγt欠損マウスに自然リンパ球を再構成させたキメラマウスを用いて,脾臓の自然リンパ球のT細胞に非依存性の抗体産生における役割について検討した.自然リンパ球再構成キメラマウスは自然リンパ球が再構成されていない対照マウスと比較して,免疫グロブリンG3陽性の形質芽細胞の数,免疫グロブリンG3陽性の形質細胞の数,血清における免疫グロブリンG3の濃度が増加していた.このことからも,3型自然リンパ球はT細胞に非依存性の免疫グロブリンG3の産生を制御していることが裏づけられた.
これら3つのマウスの系では,血清における免疫グロブリンMの濃度や免疫グロブリンM陽性の形質細胞の数の減少はみられなかったことから,マウスの脾臓の自然リンパ球はおもに辺縁帯B細胞におけるT細胞に非依存性の免疫グロブリンG3の産生に重要であると考えられた.以上の結果から,自然リンパ球は生体内において免疫グロブリンG3陽性の形質芽細胞の数,免疫グロブリンG3陽性の形質細胞の数,血清における免疫グロブリンG3の濃度を適切に維持するのに必要かつ十分であることが示された.
6.マウスの脾臓の自然リンパ球は好中球のホメオスタシスを制御する
自然リンパ球の好中球のホメオスタシスにおける役割について調べた.RORγt CD3ダブルノックアウトマウスは対照となるCD3ノックアウトマウスと比較して好中球の数が減少していたのにくわえ,自然リンパ球再構成キメラマウスは自然リンパ球が再構成されていない対照マウスと比較して好中球の数が増加していたことから,マウスの脾臓の自然リンパ球は好中球の脾臓への局在に必要かつ十分であることが明らかになった.脾臓の好中球の免疫グロブリンG3の産生への寄与について明らかにするため,抗Ly6G抗体により好中球を除去したマウスを解析した.好中球除去マウスは対照マウスと比較して,免疫グロブリンG3陽性の形質細胞の数および血清における免疫グロブリンG3の濃度が有意に減少していた.このように,自然リンパ球とは異なり,好中球はおもに免疫グロブリンG3産生細胞の終末分化を制御することによりT細胞に非依存性の免疫グロブリンG3の産生に寄与していることが示唆された.
生体内における脾臓の自然リンパ球による好中球の制御の分子機構について検討した.定量リアルタイムPCR法により,マウスの脾臓の自然リンパ球はほかの白血球と比較してGM-CSFを高く発現していることが示された.また一方で,自然リンパ球を欠損したRag1 IL2rgダブルノックアウトマウスは自然リンパ球をもつRag1ノックアウトマウスと比較して好中球の数が減少しており,自然リンパ球の養子免疫細胞移入により好中球の数は増加あるいは回復することが示された.さらに,GM-CSFノックアウトマウスに由来する自然リンパ球細胞の養子免疫細胞移入では好中球の数の回復はみられなかった.以上の結果から,脾臓の自然リンパ球はGM-CSFの産生を介して好中球を誘引し,好中球と協調して抗体の産生を増強しているものと考えられた.
おわりに
この研究により,自然リンパ球によるT細胞に非依存性の抗体産生について,その機構の一端が明らかになった.自然リンパ球は辺縁帯B細胞からの抗体の産生を直接的に促進するのみならず,間質細胞や好中球などのほかの細胞を介して,間接的にもT細胞に非依存性の抗体の産生を制御していることが示された(図3).
T細胞に非依存性の抗体産生は肺炎双球菌や髄膜炎菌など多糖莢膜をもつ細菌に対する反応であり,莢膜の多糖体はワクチンとしても利用されている10).しかし,多糖莢膜をもつ細菌に対するワクチンには,免疫不全患者に対して効果が薄い,発展途上国における利用には高価すぎる,などの問題点があり,新規のワクチンの開発が望まれていた.この研究により示されたT細胞に非依存性の抗体産生の新たな分子機構が,効率的かつ安価な新規のワクチンの開発の基盤となればうれしいかぎりである.
文 献
- Walker, J. A., Barlow, J. L. & McKenzie, A. N.: Innate lymphoid cells: how did we miss them? Nat. Rev. Immunol., 13, 75-87 (2013)[PubMed]
- Mebius, R. E. & Kraal, G.: Structure and function of the spleen. Nat. Rev. Immunol., 5, 606-616 (2005)[PubMed]
- Cerutti, A., Cols, M. & Puga, I.: Marginal zone B cells: virtues of innate-like antibody-producing lymphocytes. Nat. Rev. Immunol., 13, 118-132 (2013)[PubMed]
- Tsuji, M., Suzuki, K., Kitamura, H. et al.: Requirement for lymphoid tissue-inducer cells in isolated follicle formation and T cell-independent immunoglobulin A generation in the gut. Immunity, 29, 261-271 (2008)[PubMed]
- Puga, I., Cols, M., Barra, C. M. et al. .: B cell-helper neutrophils stimulate the diversification and production of immunoglobulin in the marginal zone of the spleen. Nat. Immunol., 13, 170-180 (2011)[PubMed]
- Codarri, L., Gyulveszi, G., Tosevski, V. et al.: RORγt drives production of the cytokine GM-CSF in helper T cells, which is essential for the effector phase of autoimmune neuroinflammation. Nat. Immunol., 12, 560-567 (2011)[PubMed]
- Eberl, G. & Littman, D. R.: Thymic origin of intestinal αβ T cells revealed by fate mapping of RORγt+ cells. Science, 305, 248-251 (2004)[PubMed]
- Sawa, S., Cherrier, M., Lochner, M. et al.: Lineage relationship analysis of RORγt+ innate lymphoid cells. Science, 330, 665-669 (2010)[PubMed]
- Sonnenberg, G. F., Monticelli, L. A., Elloso, M. M. et al.: CD4+ lymphoid tissue-inducer cells promote innate immunity in the gut. Immunity, 34, 122-134 (2011)[PubMed]
- Mond, J. J. & Kokai-Kun, J. F.: The multifunctional role of antibodies in the protective response to bacterial T cell-independent antigens. Curr. Top. Microbiol. Immunol., 319, 17-40 (2008)[PubMed]
著者プロフィール
略歴:2010年 東京大学大学院医学系研究科博士課程 修了,同年 理化学研究所免疫・アレルギー科学総合研究センター 特別研究員を経て,2013年より理化学研究所統合生命医科学研究センター 研究員.
関心事:生物学全般.
Sidonia Fagarasan
理化学研究所統合生命医科学研究センター チームリーダー.
研究室URL:http://web.rcai.riken.jp/mucosal
© 2014 宮島倫生・Sidonia Fagarasan Licensed under CC 表示 2.1 日本