生体内における体細胞の不完全な初期化はエピゲノム制御の変化による発がんを惹起する
大西紘太郎・蝉 克憲・山田泰広
(京都大学iPS細胞研究所 初期化機構研究部門)
email:大西紘太郎,山田泰広
DOI: 10.7875/first.author.2014.033
Premature termination of reprogramming in vivo leads to cancer development through altered epigenetic regulation.
Kotaro Ohnishi, Katsunori Semi, Takuya Yamamoto, Masahito Shimizu, Akito Tanaka, Kanae Mitsunaga, Keisuke Okita, Kenji Osafune, Yuko Arioka, Toshiyuki Maeda, Hidenobu Soejima, Hisataka Moriwaki, Shinya Yamanaka, Knut Woltjen, Yasuhiro Yamada
Cell, 156, 663-677 (2014)
がんは遺伝子変異の蓄積により生じると考えられている.iPS細胞の樹立の過程においては,特定の遺伝子配列の変化を必要としないにもかかわらず,がん細胞と同様に無制限の増殖能を獲得する.この研究では,体細胞の初期化と発がんとの関連性を明らかにするため,生体内において初期化因子を誘導性に強制発現させることのできるマウスを作製した.その結果,生体内における初期化因子の強制発現によりiPS細胞を含む奇形腫が多発し,生体内において体細胞が初期化されることがわかった.一方で,生体内における体細胞の初期化を途中で停止すると,さまざまな臓器において未分化な細胞からなる腫瘍の形成が認められた.それらの腫瘍におけるDNAメチル化の状態は,部分的に多能性幹細胞と類似していた.これらの腫瘍のうち,腎臓に生じた腫瘍は代表的な小児の腎腫瘍であるWilms腫瘍と多くの類似点をもつことが判明した.生体内における体細胞の不完全な初期化より腎臓に発生した腫瘍細胞からiPS細胞を作製し,この腫瘍に由来するiPS細胞は正常な腎臓組織に寄与することが示された.これらの結果は,ある種のがんにおいて,iPS細胞の樹立にかかわるエピゲノム制御が,がんの発生や進展に関与している可能性を示唆した.
iPS細胞(induced pluripotent stem cell,人工多能性幹細胞)は分化した体細胞にOct3/4,Klf4,Sox2,c-Mycの4つの初期化因子を一過性に強制発現させることにより樹立することができる1).iPS細胞に関しさまざまな研究が進められているが,体細胞の初期化の詳細に関してはいまだ不明な部分が多い.体細胞の初期化の過程においてiPS細胞とは形態の異なる細胞の集団が出現することがあり,これら初期化に失敗した体細胞に関する研究が報告されている.しかしながら,この不完全な体細胞の初期化に関しては不明な点が多く,また,線維芽細胞以外の組織の細胞からの不完全な初期化に関しては報告がない.
iPS細胞の樹立の過程においては,無限の増殖能の獲得や広範な転写制御の変化など,がん化においても重要なイベントが生じる.筆者らは,これらの類似点から,体細胞の初期化の機構の一部は,がん化において促進的にはたらくのではないかと考えた.不完全な体細胞の初期化とがん化との関連について調べるため,生体内において初期化因子を強制発現させることのできるマウスを作製し,初期化因子を強制発現したのちの生体内における変化を観察した.
まず,ドキシサイクリン誘導性に初期化因子の発現を制御することのできるES細胞を作製した2).このES細胞に由来するキメラマウスは,ドキシサイクリンを投与することにより初期化因子を発現することが確認された.また,このES細胞に由来する胎仔線維芽細胞にドキシサイクリンをくわえて培養することにより,iPS細胞を樹立することができた.このキメラマウスにドキシサイクリンを飲水投与したところ,多くのマウスは数日から10日で衰弱した.投与の開始から28日目まで生存したキメラマウスを解剖したところ,腎臓や膵臓などいくつかの臓器において,ドキシサイクリンを投与しないキメラマウスには出現しない腫瘤の形成が認められた.組織学的な解析の結果,腫瘤は三胚葉のおのおのへの分化の傾向を示す奇形腫であった.この奇形腫を摘出し,ドキシサイクリンの非存在下にて初代培養したところ,キメラマウスに寄与することのできるiPS細胞を樹立することができた.以上,生体内において体細胞を初期化することのできるマウスを作製することができた.
奇形腫が出現するまでの生体内における体細胞の初期化の過程において,どのような変化が起こっているのか観察した.3~9日間のドキシサイクリンの投与ののちキメラマウスの臓器を観察すると,上皮性組織を中心に異型細胞の出現が認められた.これらの異型細胞は非常に強い細胞増殖能を獲得しており,導入した遺伝子の発現が確認された.以上より,初期化因子の強制発現にともない異型細胞の出現することが示された.つぎに,これら異型細胞の初期化因子に対する依存性について検討した.キメラマウスにドキシサイクリンを7日間にわたり投与したのち,投与を中止して初期化因子の発現を停止させ,そののち7日目に組織を観察した.すると,一部のキメラマウスでは異型細胞は消失し,初期化因子の発現していた期間に増生した細胞が正常な組織に組み込まれていた.しかしながら,残りのマウスでは腎臓,肝臓,膵臓といったいくつかの臓器において腫瘍が認められた.これらの腫瘍は体細胞が完全に初期化されたときに観察される奇形腫ではなく,周囲の組織への浸潤の傾向や転移能をもち,また,NOD/SCIDマウスの皮下組織における腫瘍形成能をもっていたことから,がんと同様の性質をもつことが示唆された.
4つの初期化因子のなかにはがん遺伝子産物であるc-Mycが含まれる.そこで,腫瘍の発生におけるc-Mycの役割について検討した.4つの初期化因子からc-Mycを除いたOct3/4,Sox2,Klf4をドキシサイクリン誘導性に強制発現させることのできるマウスを作製し,同様の実験を行った.すると,c-Mycを除いた3つの初期化因子を強制発現した場合にも腫瘍の出現することがわかった.また,Oct3/4を除いたSox2,Klf4,c-Mycの3つの初期化因子を強制発現させることのできるマウスも作製し同様の実験を行ったが,腫瘍は発生しなかった.以上より,初期化因子の発現を停止させたときに生じた腫瘍は,体細胞の初期化に関連して発生したものであると考えた.初期化因子の発現の停止により腎臓に発生した腫瘍における遺伝子発現をマイクロアレイ法により解析したところ,腎臓において特異的に発現する遺伝子はこの腫瘍において発現が低下していた.一方,ES細胞において特異的に発現が上昇している遺伝子はこの腫瘍においても発現の上昇していることが確認された3).これは,初期化因子の発現の停止により生じた腫瘍からNOD/SCIDマウスの皮下に2次的に形成させた腫瘍においても同様であった.ES細胞において特異的に発現が上昇している遺伝子のうち,体細胞の初期化のマーカーであるNanog遺伝子や内在性のOct3/4遺伝子の発現は,多能性幹細胞と比較して初期化因子の発現の停止により生じた腫瘍では低く,この腫瘍細胞は完全に初期化された細胞ではなく不完全に初期化された細胞であることが示唆された.また,正常な腎臓組織および多能性幹細胞においては発現していないLgr5遺伝子が,初期化因子の発現の停止により生じた腫瘍において高く発現していた.実際に,Lgr5-EGFP遺伝子をもつドキシサイクリン誘導性に初期化因子の発現を制御できるマウスを作製したところ,初期化因子の発現の停止により生じた腫瘍においてのみ,GFPのシグナルが検出された4).このLgr5-EGFP陽性の腫瘍細胞はES細胞において発現の高いOct3/4遺伝子およびLin28b遺伝子を発現していた.
ES細胞においてPolycomb抑制複合体の標的となり発現の抑制される遺伝子は,初期化因子の発現の停止により生じた腫瘍においては発現が抑制されていなかった.腫瘍において特異的に発現の上昇するSix2遺伝子やLgr5遺伝子もES細胞においてPolycomb抑制複合体の標的となる遺伝子であり,クロマチン免疫沈降-定量PCR法によっても,これらの遺伝子におけるヒストンH3の27番目のリジン残基のトリメチル化が正常な腎臓細胞と比較して減少していることがわかった.これらのPolycomb抑制複合体の標的となる遺伝子における発現の不完全な抑制は,in vitroにて腎尿細管からの初期化に失敗した細胞においても認められた.
体細胞の初期化においてはDNAメチル化のパターンが広範に変化することが知られている.初期化因子の発現の停止により生じた腫瘍におけるDNAメチル化の状態を解析するため,RRBS(reduced representation bisulfite sequcencing)法により解析を行った5).すると,初期化因子の発現の停止により腎臓に発生した腫瘍においては,正常な腎臓細胞と比較してDNAメチル化が広範に変化していた.とくに,多能性幹細胞において高度にDNAメチル化されている遺伝子は,初期化因子の発現の停止により生じた腫瘍においてもDNAメチル化されていた.一方で,正常な腎臓細胞においてDNAメチル化されている遺伝子については,DNAメチル化は維持される傾向が認められた.また,転写に対し抑制的にはたらく遺伝子プロモーター領域のDNAメチル化の状態と一致して,多能性幹細胞においてDNAメチル化されている遺伝子は,初期化因子の発現の停止により生じた腫瘍においてしばしば発現が抑制されており,腎臓細胞においてDNAメチル化されている遺伝子は,発現が抑制されたままになっていることも確認された.
一般にがん細胞においては,領域特異的に高いDNAメチル化状態が確認される一方,ゲノムワイドには低いDNAメチル化状態を呈することが知られている6).しかしながら,初期化因子の発現の停止により生じた腫瘍においては,CpGアイランドの有無にかかわらず,遺伝子プロモーター領域に高いDNAメチル化状態は認められなかった.くわえて,遺伝子間領域の低いDNAメチル化状態も明らかではなかった.
初期化因子の発現の停止により生じた腫瘍においては,インプリント遺伝子の発現が広範に変化していた.インプリント遺伝子の発現はDNAメチル化により制御されていることから,初期化因子の発現の停止により生じた腫瘍におけるインプリント遺伝子のDNAメチル化の状態をRRBS法およびMassARRAY法により確認した7).その結果,正常な腎臓細胞では約50%のDNAメチル化状態を示す対立遺伝子に特異的なメチル化領域が,多くのインプリント遺伝子において変化していた.
初期化因子の発現の停止により腎臓に発生した腫瘍は,組織学上,小児の腎腫瘍のひとつであるWilms腫瘍に類似していた.初期化因子の発現の停止により生じた腫瘍ではWilms腫瘍においてみられるインプリント遺伝子Igf2遺伝子の発現の亢進およびH19遺伝子の高いDNAメチル化が認められた8).初期化因子の発現の停止により生じた腫瘍において発現が上昇している遺伝子は,Wilms腫瘍においても高頻度に発現の上昇がみられた.一方で,腎細胞がんにおいては,それら遺伝子の発現の亢進は明らかではなかった.さらに,ES細胞において特異的に発現が上昇している遺伝子の発現についてWilms腫瘍にて検討したところ,初期化因子の発現の停止により生じた腫瘍と同様の発現パターンを示すことが確認された.以上より,初期化因子の発現の停止により腎臓に発生した腫瘍は,Wilms腫瘍と多くの類似点をもつことが判明し,体細胞の初期化にかかわるエピゲノム制御および転写制御がWilms腫瘍の発生および維持に関与しているものと考えられた.
初期化因子の発現の停止により腎臓に発生した腫瘍からのiPS細胞の樹立を試みた.Lgr5-EGFP遺伝子をもつドキシサイクリン誘導性に初期化因子の発現を制御できるマウスを用いて,初期化因子の発現の停止により腎臓に発生した腫瘍を摘出し,腫瘍細胞であるLgr5-EGFP陽性の細胞をFACSにより回収した.回収した腫瘍細胞をドキシサイクリンをくわえ培養し初期化因子を発現させたところ,iPS様の細胞を樹立することができた.ドキシサイクリンをくわえて培養をはじめてから7日目にはNanog遺伝子の発現が上昇し,さらに,100個の腫瘍細胞から20個以上のアルカリホスファターゼ陽性のコロニーを得ることができたことから,より短期間に高い効率で腫瘍細胞を初期化できることが明らかになった.
初期化因子の発現の停止により生じた腫瘍における遺伝子異常の有無について検討した.初期化因子の発現の停止により生じた腫瘍からNOD/SCIDマウスの皮下に2次的に形成させた腫瘍において,ヒトのがん関連遺伝子として514の遺伝子を抽出しそのエキソン領域を解析したところ,Wilms腫瘍において異常の報告のあるWt1遺伝子,Wtx遺伝子,Ctnnb1遺伝子,Trp53遺伝子を含む,すべての遺伝子において明らかな異常は検出できなかった.また,CGHアッセイにおいても,腫瘍に特異的な明らかな染色体の異常は認められなかった.
初期化因子の発現の停止により腎臓に生じた腫瘍から樹立したiPS細胞を初期胚へインジェクションし,キメラマウスの作製を試みた.この腫瘍に由来するiPS細胞はキメラマウスに寄与し,腎臓を含む各種の臓器において組織学的に正常な細胞へと分化していた.これら腫瘍に由来するiPS細胞から得られたキメラマウスは加齢によっても腫瘍を形成せず,異常な細胞の増殖は確認されなかった.以上より,初期化因子の発現の停止により生じた腫瘍の発生には遺伝子異常によるトランスフォーメーションは関与せず,エピゲノム制御の変化が重要な役割をはたしていることが示唆された.
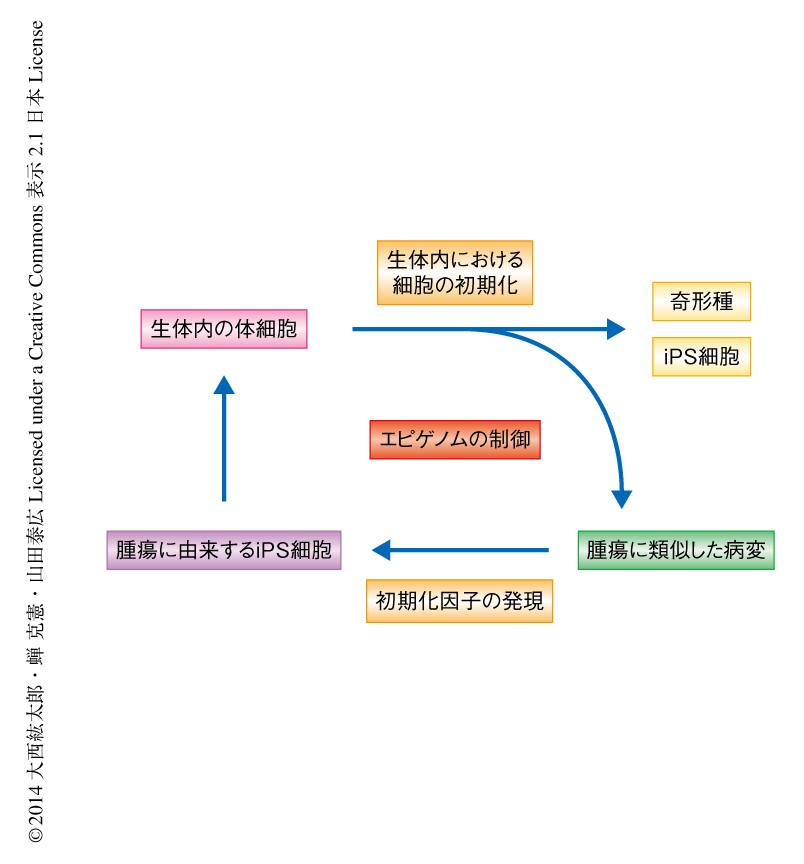
iPS細胞は特定の遺伝子配列の変化なしで樹立される.この研究において,筆者らは,生体内における中途半端な体細胞の初期化によりマウスに腫瘍が形成されることを確認した.これらの腫瘍ではエピゲノムの修飾が広範に変化しており,体細胞の初期化にかかわるエピゲノム制御が腫瘍性の増殖に関与している可能性が示唆された(図1).初期化因子の発現の停止により生じた腫瘍細胞はさらなる初期化因子の発現により容易に完全に初期化され,この腫瘍細胞は正常な体細胞よりもiPS細胞に近い性質をもつことが示唆された.この腫瘍に由来するiPS細胞はキメラマウスに寄与しさまざまな細胞種へと分化していたことから,不完全な初期化にともなうエピゲノムの変化がこの初期化因子の発現の停止により生じた腫瘍の形成において重要であると考えられた.初期化因子の発現の停止により生じた腫瘍には,組織学上,最終分化した領域はほとんど認められなかったことから,この腫瘍細胞は自己複製能をもつ一方で,分化多能性は獲得していないことが示唆された.この腫瘍細胞では多能性幹細胞と同様にES細胞において特異的に発現が上昇している遺伝子の発現が亢進していたが,ES細胞においてPolycomb抑制複合体の標的となる遺伝子の発現は抑制されておらず,この発現の抑制が分化多能性の獲得に関係しているのかもしれない.in vitroにて不完全に初期化された細胞においても,ES細胞においてPolycomb抑制複合体の標的となる遺伝子の発現抑制の不全が確認されており9),この発現の抑制が体細胞の初期化の後期において重要であることが示唆された.同様にして,初期化因子の発現の停止により腎臓に発生した腫瘍には,腎臓細胞に特異的なDNAメチル化が残存しており,体細胞に特異的なDNAメチル化の脱メチル化も,体細胞の初期化の後期の過程において生じることが示唆された.
また,生体内における体細胞の不完全な初期化による腫瘍には,Wilms腫瘍との多くの類似点が観察された.Wilms腫瘍は成人に発生する腎腫瘍とは異なる性質をもつことがよく知られている10).今回の研究結果より,Wilms腫瘍の特徴として,ES細胞において特異的に発現が上昇している遺伝子の発現の亢進,ES細胞においてPolycomb抑制複合体の標的となる遺伝子の発現抑制の不全が明らかになった.この研究において得られたマウスモデルは,Wilms腫瘍の発がん機構および治療戦略を検討するための有用なツールとなることが期待される.
以上より,筆者らは,生体内における体細胞の不完全な初期化がWilms腫瘍に類似した腫瘍の発生につながることを証明した.体細胞の初期化に関与するエピゲノム制御の広範な変化が腫瘍の発生をひき起こすことが示された.遺伝子配列の異常によると考えられてきたがんの発生および進展において,エピゲノム制御の重要性を示唆する結果と考えられる.
岐阜大学大学院医学系研究科博士課程 在学中.
研究テーマ:がんとエピゲノム制御.
蝉 克憲(Katsunori Semi)
京都大学iPS細胞研究所 研究員.
山田 泰広(Yasuhiro Yamada)
京都大学iPS細胞研究所 教授.
研究室URL:http://www.cira.kyoto-u.ac.jp/yamada/index.html
© 2014 大西紘太郎・蝉 克憲・山田泰広 Licensed under CC 表示 2.1 日本
(京都大学iPS細胞研究所 初期化機構研究部門)
email:大西紘太郎,山田泰広
DOI: 10.7875/first.author.2014.033
Premature termination of reprogramming in vivo leads to cancer development through altered epigenetic regulation.
Kotaro Ohnishi, Katsunori Semi, Takuya Yamamoto, Masahito Shimizu, Akito Tanaka, Kanae Mitsunaga, Keisuke Okita, Kenji Osafune, Yuko Arioka, Toshiyuki Maeda, Hidenobu Soejima, Hisataka Moriwaki, Shinya Yamanaka, Knut Woltjen, Yasuhiro Yamada
Cell, 156, 663-677 (2014)
要 約
がんは遺伝子変異の蓄積により生じると考えられている.iPS細胞の樹立の過程においては,特定の遺伝子配列の変化を必要としないにもかかわらず,がん細胞と同様に無制限の増殖能を獲得する.この研究では,体細胞の初期化と発がんとの関連性を明らかにするため,生体内において初期化因子を誘導性に強制発現させることのできるマウスを作製した.その結果,生体内における初期化因子の強制発現によりiPS細胞を含む奇形腫が多発し,生体内において体細胞が初期化されることがわかった.一方で,生体内における体細胞の初期化を途中で停止すると,さまざまな臓器において未分化な細胞からなる腫瘍の形成が認められた.それらの腫瘍におけるDNAメチル化の状態は,部分的に多能性幹細胞と類似していた.これらの腫瘍のうち,腎臓に生じた腫瘍は代表的な小児の腎腫瘍であるWilms腫瘍と多くの類似点をもつことが判明した.生体内における体細胞の不完全な初期化より腎臓に発生した腫瘍細胞からiPS細胞を作製し,この腫瘍に由来するiPS細胞は正常な腎臓組織に寄与することが示された.これらの結果は,ある種のがんにおいて,iPS細胞の樹立にかかわるエピゲノム制御が,がんの発生や進展に関与している可能性を示唆した.
はじめに
iPS細胞(induced pluripotent stem cell,人工多能性幹細胞)は分化した体細胞にOct3/4,Klf4,Sox2,c-Mycの4つの初期化因子を一過性に強制発現させることにより樹立することができる1).iPS細胞に関しさまざまな研究が進められているが,体細胞の初期化の詳細に関してはいまだ不明な部分が多い.体細胞の初期化の過程においてiPS細胞とは形態の異なる細胞の集団が出現することがあり,これら初期化に失敗した体細胞に関する研究が報告されている.しかしながら,この不完全な体細胞の初期化に関しては不明な点が多く,また,線維芽細胞以外の組織の細胞からの不完全な初期化に関しては報告がない.
iPS細胞の樹立の過程においては,無限の増殖能の獲得や広範な転写制御の変化など,がん化においても重要なイベントが生じる.筆者らは,これらの類似点から,体細胞の初期化の機構の一部は,がん化において促進的にはたらくのではないかと考えた.不完全な体細胞の初期化とがん化との関連について調べるため,生体内において初期化因子を強制発現させることのできるマウスを作製し,初期化因子を強制発現したのちの生体内における変化を観察した.
1.生体内において体細胞を初期化することのできるマウスの作製
まず,ドキシサイクリン誘導性に初期化因子の発現を制御することのできるES細胞を作製した2).このES細胞に由来するキメラマウスは,ドキシサイクリンを投与することにより初期化因子を発現することが確認された.また,このES細胞に由来する胎仔線維芽細胞にドキシサイクリンをくわえて培養することにより,iPS細胞を樹立することができた.このキメラマウスにドキシサイクリンを飲水投与したところ,多くのマウスは数日から10日で衰弱した.投与の開始から28日目まで生存したキメラマウスを解剖したところ,腎臓や膵臓などいくつかの臓器において,ドキシサイクリンを投与しないキメラマウスには出現しない腫瘤の形成が認められた.組織学的な解析の結果,腫瘤は三胚葉のおのおのへの分化の傾向を示す奇形腫であった.この奇形腫を摘出し,ドキシサイクリンの非存在下にて初代培養したところ,キメラマウスに寄与することのできるiPS細胞を樹立することができた.以上,生体内において体細胞を初期化することのできるマウスを作製することができた.
2.生体内における体細胞の初期化を停止すると腫瘍が形成される
奇形腫が出現するまでの生体内における体細胞の初期化の過程において,どのような変化が起こっているのか観察した.3~9日間のドキシサイクリンの投与ののちキメラマウスの臓器を観察すると,上皮性組織を中心に異型細胞の出現が認められた.これらの異型細胞は非常に強い細胞増殖能を獲得しており,導入した遺伝子の発現が確認された.以上より,初期化因子の強制発現にともない異型細胞の出現することが示された.つぎに,これら異型細胞の初期化因子に対する依存性について検討した.キメラマウスにドキシサイクリンを7日間にわたり投与したのち,投与を中止して初期化因子の発現を停止させ,そののち7日目に組織を観察した.すると,一部のキメラマウスでは異型細胞は消失し,初期化因子の発現していた期間に増生した細胞が正常な組織に組み込まれていた.しかしながら,残りのマウスでは腎臓,肝臓,膵臓といったいくつかの臓器において腫瘍が認められた.これらの腫瘍は体細胞が完全に初期化されたときに観察される奇形腫ではなく,周囲の組織への浸潤の傾向や転移能をもち,また,NOD/SCIDマウスの皮下組織における腫瘍形成能をもっていたことから,がんと同様の性質をもつことが示唆された.
4つの初期化因子のなかにはがん遺伝子産物であるc-Mycが含まれる.そこで,腫瘍の発生におけるc-Mycの役割について検討した.4つの初期化因子からc-Mycを除いたOct3/4,Sox2,Klf4をドキシサイクリン誘導性に強制発現させることのできるマウスを作製し,同様の実験を行った.すると,c-Mycを除いた3つの初期化因子を強制発現した場合にも腫瘍の出現することがわかった.また,Oct3/4を除いたSox2,Klf4,c-Mycの3つの初期化因子を強制発現させることのできるマウスも作製し同様の実験を行ったが,腫瘍は発生しなかった.以上より,初期化因子の発現を停止させたときに生じた腫瘍は,体細胞の初期化に関連して発生したものであると考えた.初期化因子の発現の停止により腎臓に発生した腫瘍における遺伝子発現をマイクロアレイ法により解析したところ,腎臓において特異的に発現する遺伝子はこの腫瘍において発現が低下していた.一方,ES細胞において特異的に発現が上昇している遺伝子はこの腫瘍においても発現の上昇していることが確認された3).これは,初期化因子の発現の停止により生じた腫瘍からNOD/SCIDマウスの皮下に2次的に形成させた腫瘍においても同様であった.ES細胞において特異的に発現が上昇している遺伝子のうち,体細胞の初期化のマーカーであるNanog遺伝子や内在性のOct3/4遺伝子の発現は,多能性幹細胞と比較して初期化因子の発現の停止により生じた腫瘍では低く,この腫瘍細胞は完全に初期化された細胞ではなく不完全に初期化された細胞であることが示唆された.また,正常な腎臓組織および多能性幹細胞においては発現していないLgr5遺伝子が,初期化因子の発現の停止により生じた腫瘍において高く発現していた.実際に,Lgr5-EGFP遺伝子をもつドキシサイクリン誘導性に初期化因子の発現を制御できるマウスを作製したところ,初期化因子の発現の停止により生じた腫瘍においてのみ,GFPのシグナルが検出された4).このLgr5-EGFP陽性の腫瘍細胞はES細胞において発現の高いOct3/4遺伝子およびLin28b遺伝子を発現していた.
3.初期化因子の発現の停止により生じた腫瘍においてはエピゲノムの状態が広範に変化している
ES細胞においてPolycomb抑制複合体の標的となり発現の抑制される遺伝子は,初期化因子の発現の停止により生じた腫瘍においては発現が抑制されていなかった.腫瘍において特異的に発現の上昇するSix2遺伝子やLgr5遺伝子もES細胞においてPolycomb抑制複合体の標的となる遺伝子であり,クロマチン免疫沈降-定量PCR法によっても,これらの遺伝子におけるヒストンH3の27番目のリジン残基のトリメチル化が正常な腎臓細胞と比較して減少していることがわかった.これらのPolycomb抑制複合体の標的となる遺伝子における発現の不完全な抑制は,in vitroにて腎尿細管からの初期化に失敗した細胞においても認められた.
体細胞の初期化においてはDNAメチル化のパターンが広範に変化することが知られている.初期化因子の発現の停止により生じた腫瘍におけるDNAメチル化の状態を解析するため,RRBS(reduced representation bisulfite sequcencing)法により解析を行った5).すると,初期化因子の発現の停止により腎臓に発生した腫瘍においては,正常な腎臓細胞と比較してDNAメチル化が広範に変化していた.とくに,多能性幹細胞において高度にDNAメチル化されている遺伝子は,初期化因子の発現の停止により生じた腫瘍においてもDNAメチル化されていた.一方で,正常な腎臓細胞においてDNAメチル化されている遺伝子については,DNAメチル化は維持される傾向が認められた.また,転写に対し抑制的にはたらく遺伝子プロモーター領域のDNAメチル化の状態と一致して,多能性幹細胞においてDNAメチル化されている遺伝子は,初期化因子の発現の停止により生じた腫瘍においてしばしば発現が抑制されており,腎臓細胞においてDNAメチル化されている遺伝子は,発現が抑制されたままになっていることも確認された.
一般にがん細胞においては,領域特異的に高いDNAメチル化状態が確認される一方,ゲノムワイドには低いDNAメチル化状態を呈することが知られている6).しかしながら,初期化因子の発現の停止により生じた腫瘍においては,CpGアイランドの有無にかかわらず,遺伝子プロモーター領域に高いDNAメチル化状態は認められなかった.くわえて,遺伝子間領域の低いDNAメチル化状態も明らかではなかった.
初期化因子の発現の停止により生じた腫瘍においては,インプリント遺伝子の発現が広範に変化していた.インプリント遺伝子の発現はDNAメチル化により制御されていることから,初期化因子の発現の停止により生じた腫瘍におけるインプリント遺伝子のDNAメチル化の状態をRRBS法およびMassARRAY法により確認した7).その結果,正常な腎臓細胞では約50%のDNAメチル化状態を示す対立遺伝子に特異的なメチル化領域が,多くのインプリント遺伝子において変化していた.
4.初期化因子の発現の停止により腎臓に発生した腫瘍はWilms腫瘍に類似している
初期化因子の発現の停止により腎臓に発生した腫瘍は,組織学上,小児の腎腫瘍のひとつであるWilms腫瘍に類似していた.初期化因子の発現の停止により生じた腫瘍ではWilms腫瘍においてみられるインプリント遺伝子Igf2遺伝子の発現の亢進およびH19遺伝子の高いDNAメチル化が認められた8).初期化因子の発現の停止により生じた腫瘍において発現が上昇している遺伝子は,Wilms腫瘍においても高頻度に発現の上昇がみられた.一方で,腎細胞がんにおいては,それら遺伝子の発現の亢進は明らかではなかった.さらに,ES細胞において特異的に発現が上昇している遺伝子の発現についてWilms腫瘍にて検討したところ,初期化因子の発現の停止により生じた腫瘍と同様の発現パターンを示すことが確認された.以上より,初期化因子の発現の停止により腎臓に発生した腫瘍は,Wilms腫瘍と多くの類似点をもつことが判明し,体細胞の初期化にかかわるエピゲノム制御および転写制御がWilms腫瘍の発生および維持に関与しているものと考えられた.
5.初期化因子の発現の停止により生じた腫瘍から樹立したiPS細胞は正常な組織細胞への分化が可能である
初期化因子の発現の停止により腎臓に発生した腫瘍からのiPS細胞の樹立を試みた.Lgr5-EGFP遺伝子をもつドキシサイクリン誘導性に初期化因子の発現を制御できるマウスを用いて,初期化因子の発現の停止により腎臓に発生した腫瘍を摘出し,腫瘍細胞であるLgr5-EGFP陽性の細胞をFACSにより回収した.回収した腫瘍細胞をドキシサイクリンをくわえ培養し初期化因子を発現させたところ,iPS様の細胞を樹立することができた.ドキシサイクリンをくわえて培養をはじめてから7日目にはNanog遺伝子の発現が上昇し,さらに,100個の腫瘍細胞から20個以上のアルカリホスファターゼ陽性のコロニーを得ることができたことから,より短期間に高い効率で腫瘍細胞を初期化できることが明らかになった.
初期化因子の発現の停止により生じた腫瘍における遺伝子異常の有無について検討した.初期化因子の発現の停止により生じた腫瘍からNOD/SCIDマウスの皮下に2次的に形成させた腫瘍において,ヒトのがん関連遺伝子として514の遺伝子を抽出しそのエキソン領域を解析したところ,Wilms腫瘍において異常の報告のあるWt1遺伝子,Wtx遺伝子,Ctnnb1遺伝子,Trp53遺伝子を含む,すべての遺伝子において明らかな異常は検出できなかった.また,CGHアッセイにおいても,腫瘍に特異的な明らかな染色体の異常は認められなかった.
初期化因子の発現の停止により腎臓に生じた腫瘍から樹立したiPS細胞を初期胚へインジェクションし,キメラマウスの作製を試みた.この腫瘍に由来するiPS細胞はキメラマウスに寄与し,腎臓を含む各種の臓器において組織学的に正常な細胞へと分化していた.これら腫瘍に由来するiPS細胞から得られたキメラマウスは加齢によっても腫瘍を形成せず,異常な細胞の増殖は確認されなかった.以上より,初期化因子の発現の停止により生じた腫瘍の発生には遺伝子異常によるトランスフォーメーションは関与せず,エピゲノム制御の変化が重要な役割をはたしていることが示唆された.
おわりに
iPS細胞は特定の遺伝子配列の変化なしで樹立される.この研究において,筆者らは,生体内における中途半端な体細胞の初期化によりマウスに腫瘍が形成されることを確認した.これらの腫瘍ではエピゲノムの修飾が広範に変化しており,体細胞の初期化にかかわるエピゲノム制御が腫瘍性の増殖に関与している可能性が示唆された(図1).初期化因子の発現の停止により生じた腫瘍細胞はさらなる初期化因子の発現により容易に完全に初期化され,この腫瘍細胞は正常な体細胞よりもiPS細胞に近い性質をもつことが示唆された.この腫瘍に由来するiPS細胞はキメラマウスに寄与しさまざまな細胞種へと分化していたことから,不完全な初期化にともなうエピゲノムの変化がこの初期化因子の発現の停止により生じた腫瘍の形成において重要であると考えられた.初期化因子の発現の停止により生じた腫瘍には,組織学上,最終分化した領域はほとんど認められなかったことから,この腫瘍細胞は自己複製能をもつ一方で,分化多能性は獲得していないことが示唆された.この腫瘍細胞では多能性幹細胞と同様にES細胞において特異的に発現が上昇している遺伝子の発現が亢進していたが,ES細胞においてPolycomb抑制複合体の標的となる遺伝子の発現は抑制されておらず,この発現の抑制が分化多能性の獲得に関係しているのかもしれない.in vitroにて不完全に初期化された細胞においても,ES細胞においてPolycomb抑制複合体の標的となる遺伝子の発現抑制の不全が確認されており9),この発現の抑制が体細胞の初期化の後期において重要であることが示唆された.同様にして,初期化因子の発現の停止により腎臓に発生した腫瘍には,腎臓細胞に特異的なDNAメチル化が残存しており,体細胞に特異的なDNAメチル化の脱メチル化も,体細胞の初期化の後期の過程において生じることが示唆された.
また,生体内における体細胞の不完全な初期化による腫瘍には,Wilms腫瘍との多くの類似点が観察された.Wilms腫瘍は成人に発生する腎腫瘍とは異なる性質をもつことがよく知られている10).今回の研究結果より,Wilms腫瘍の特徴として,ES細胞において特異的に発現が上昇している遺伝子の発現の亢進,ES細胞においてPolycomb抑制複合体の標的となる遺伝子の発現抑制の不全が明らかになった.この研究において得られたマウスモデルは,Wilms腫瘍の発がん機構および治療戦略を検討するための有用なツールとなることが期待される.
以上より,筆者らは,生体内における体細胞の不完全な初期化がWilms腫瘍に類似した腫瘍の発生につながることを証明した.体細胞の初期化に関与するエピゲノム制御の広範な変化が腫瘍の発生をひき起こすことが示された.遺伝子配列の異常によると考えられてきたがんの発生および進展において,エピゲノム制御の重要性を示唆する結果と考えられる.
文 献
- Takahashi, K. & Yamanaka, S.: Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126, 663-676 (2006)[PubMed]
- Stadtfeld, M., Maherali, N., Breault, D. T. et al.: Defining molecular cornerstones during fibroblast to iPS cell reprogramming in mouse. Cell Stem Cell, 2, 230-240 (2008)[PubMed]
- Kim, J., Woo, A. J., Chu, J. et al.: A Myc network accounts for similarities between embryonic stem and cancer cell transcription programs. Cell, 143, 313-324 (2010)[PubMed]
- Barker, N., van Es, J. H., Kuipers, J. et al.: Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature, 449, 1003-1007 (2007)[PubMed]
- Meissner, A., Gnirke, A., Bell, G. W. et al.: Reduced representation bisulfite sequencing for comparative high-resolution DNA methylation analysis. Nucleic Acids Res., 33, 5868-5877 (2005)[PubMed]
- Jones, P. A. & Baylin, S. B.: The fundamental role of epigenetic events in cancer. Nat. Rev. Genet., 3, 415-428 (2002)[PubMed]
- Ehrich, M., Nelson, M. R., Stanssens, P. et al.: Quantitative high-throughput analysis of DNA methylation patterns by base-specific cleavage and mass spectrometry. Proc. Natl. Acad. Sci. USA, 102, 15785-15790 (2005)[PubMed]
- Ogawa, O., Eccles, M. R., Szeto, J. et al.: Relaxation of insulin-like growth factor II gene imprinting implicated in Wilms' tumour. Nature, 362, 749-751 (1993)[PubMed]
- Polo, J. M., Anderssen, E., Walsh, R. M. et al.: A molecular roadmap of reprogramming somatic cells into iPS cells. Cell, 151, 1617-1632 (2012)[PubMed]
- Ben-Porath, I., Thomson, M. W., Carey, V. J. et al.: An embryonic stem cell-like gene expression signature in poorly differentiated aggressive human tumors. Nat. Genet., 40, 499-507 (2008)[PubMed]
著者プロフィール
岐阜大学大学院医学系研究科博士課程 在学中.
研究テーマ:がんとエピゲノム制御.
蝉 克憲(Katsunori Semi)
京都大学iPS細胞研究所 研究員.
山田 泰広(Yasuhiro Yamada)
京都大学iPS細胞研究所 教授.
研究室URL:http://www.cira.kyoto-u.ac.jp/yamada/index.html
© 2014 大西紘太郎・蝉 克憲・山田泰広 Licensed under CC 表示 2.1 日本