パイオニア軸索との接触がニューロンの極性化を制御する
難波隆志・貝淵弘三
(名古屋大学大学院医学系研究科 神経情報薬理学講座)
email:難波隆志,貝淵弘三
DOI: 10.7875/first.author.2014.032
Pioneering axons regulate neuronal polarization in the developing cerebral cortex.
Takashi Namba, Yuji Kibe, Yasuhiro Funahashi, Shinichi Nakamuta, Tetsuya Takano, Takuji Ueno, Akiko Shimada, Sachi Kozawa, Mayumi Okamoto, Yasushi Shimoda, Kanako Oda, Yoshino Wada, Tomoyuki Masuda, Akira Sakakibara, Michihiro Igarashi, Takaki Miyata, Catherine Faivre-Sarrailh, Kosei Takeuchi, Kozo Kaibuchi
Neuron, 81, 814-829 (2014)
ニューロンは高度に極性化した細胞のひとつであり,通常は1本の軸索と複数の樹状突起をもつ.現在までに,ニューロンの極性化,なかでも,軸索の形成を制御するさまざまな細胞内シグナルタンパク質が,おもに培養ニューロンを用いた実験系により同定されてきた.しかしながら,生体においてニューロンがどのように軸索を形成し極性化するのかに関しては未解明な点が多い.今回,筆者らは,胎生期の大脳新皮質の興奮性ニューロンをモデルとして用い,生体においてどのようなタンパク質がニューロンの極性化を制御しているのかについて解析した.その結果,未熟なニューロンとすでに成熟したニューロンの軸索であるパイオニア軸索とのあいだに免疫グロブリン様の細胞接着分子であるTAG-1を介した密接な細胞間相互作用があり,これが軸索の形成において重要な役割をはたしていることを見い出した.さらに,TAG-1の下流においてSrcファミリーキナーゼLynがはたらき,ニューロンの極性化を制御していることも明らかにした.この研究は,これまでの培養ニューロンを用いた極性化の研究においては明らかにすることのできなかった,生体でのニューロンの極性化におけるニューロンどうしの相互作用による制御機構をはじめて解明したものといえる.
われわれの身体のなかでもっとも複雑かつ高度に極性化した細胞のひとつがニューロンである1,2).通常,ニューロンは1本の軸索と複数の樹状突起という2種類の異なった突起をもつ.ニューロンは極性化することにより,樹状突起より入力をうけ軸索を介し出力するという,一方向の情報伝達を行うことが可能になっている.現在までに,さまざまなニューロンの極性化の機構が,おもに培養ニューロンを用いた研究から明らかにされてきている.しかし,それらの研究結果をそのまま“生体内”におけるニューロンの極性化の機構にあてはめることはできない.なぜならば,細胞どうしの直接的な接触のない培養ニューロンとは違い,生体においてニューロンは多種多様な細胞にかこまれ,これらと接しながら極性化すると考えられるからである.この研究において,筆者らは,生体においてニューロンの極性化を制御する微小環境とその下流のシグナルの実態を明らかにするため,胎生期の大脳新皮質の興奮性ニューロンをモデルとして用い解析を行った.
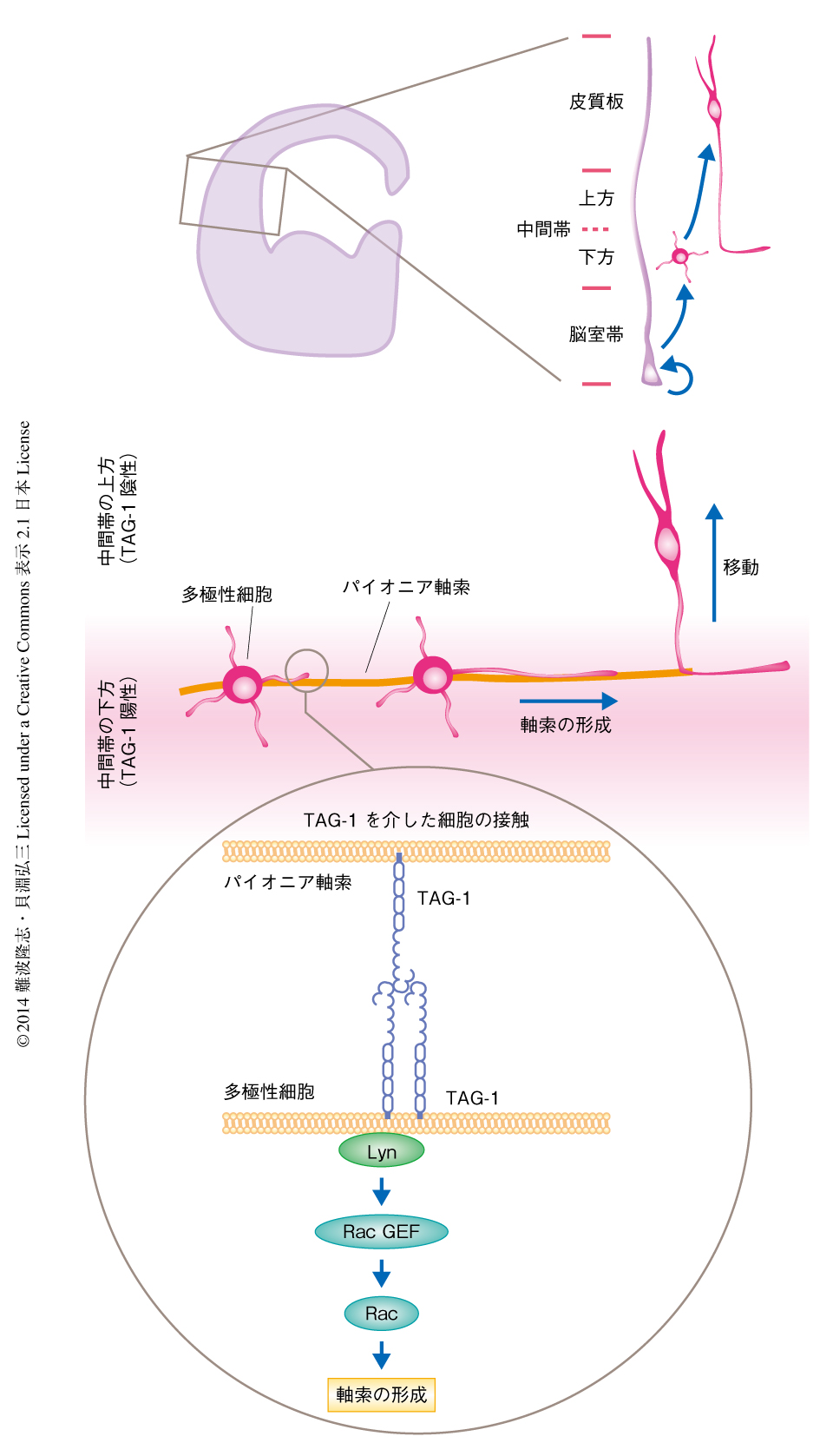
胎生期のマウスの大脳新皮質の興奮性ニューロンは,以下の過程をへて極性化すると考えられている3-5)(図1).脳室帯に位置する神経幹細胞である放射状グリア細胞は,中間型神経前駆細胞を生み出す.そののち,脳室下帯に存在する中間型神経前駆細胞は,ニューロンを生み出す.未熟なニューロンはまず中間帯において複数の短い突起をもつ多極性の形態をとる多極性細胞となり,そののち,先導突起および後方突起を伸ばした双極性の形態をとる双極性細胞となる.そして,双極性細胞は皮質板へと移動し,最終的に,樹状突起および軸索をもつニューロンへと成熟する.このとき,先導突起は樹状突起に,後方突起は軸索になると考えられている.この研究では,多極性細胞から双極性細胞への形態の変化および未熟な軸索の形成に着目し解析を行った.
ニューロンの経時的な形態変化について詳細に解析するため,子宮内電気穿孔法を用いて胎生13日目の大脳新皮質のニューロンを標識した.そののち,胎生15日目に培養切片を作製し,共焦点顕微鏡によりタイムラプスイメージングを行った.その結果,過半数の多極性細胞はまず軸索を伸ばし,そののち,先導突起を伸ばして双極性細胞へと変化することがわかった.この結果は,生体においても培養ニューロンと同様に,軸索の形成がニューロンの極性化の最初の段階であることを示唆した.つづいて,ニューロンの極性化の空間的な解析を行った.胎生13日目に標識されたニューロンの大部分は,胎生15日目には中間帯に存在していた.中間帯の上方では過半数のニューロンが軸索をもつ双極性細胞であったが,中間帯の下方では軸索をもつ双極性細胞と軸索をもつ多極性細胞との割合はほぼ同じであった.以上の結果より,中間帯の下方において多極性細胞は軸索を伸ばし極性化し,そののち,双極性細胞へと形態を変化させ皮質板へむかい移動することが判明した.
ニューロンの極性化の起こる領域である中間帯の下方には,早生まれのニューロンに由来するパイオニア軸索が走行していることが知られている.そこで,多極性細胞とパイオニア軸索とのあいだの関係を組織学的に解析した.1回目の子宮内電気穿孔法によりパイオニア軸索を標識し,2回目の電気穿孔法により多極性細胞を標識した.その結果,多極性細胞のもつ複数の突起のうちの1本がパイオニア軸索と接触し,最終的にその突起が軸索へと分化することが確認された.
ニューロンどうしの接触にはさまざまな細胞接着分子の関与が知られ,なかでも,免疫グロブリン様の細胞接着分子がよく知られる6).さまざまな免疫グロブリン様細胞接着分子のなかで,多極性細胞が極性を獲得する“場”である中間帯の下方に非常に強く局在している細胞接着分子としてTAG-1を同定した.また,TAG-1は多極性細胞にも強く発現していることが確認された.これらの結果は,TAG-1を介した多極性細胞とパイオニア軸索とのあいだの接触が軸索の形成を制御している可能性を示唆した.そこで,軸索の形成におけるTAG-1の機能について解析した.子宮内電気穿孔法およびRNAi法を用いてTAG-1の発現を抑制したところ,軸索の形成が有意に阻害された.また,この表現型は野生型TAG-1の強制発現により救済されたが,細胞接着能を欠失したTAG-1変異体の強制発現では救済されなかった.以上のことから,TAG-1を介した細胞間相互作用が多極性細胞における軸索の形成を制御していることが示唆された.
これまでの研究から,TAG-1は脂質ラフトを介してSrcファミリーキナーゼLynを活性化することが知られていた7).実際に,胎生期15日目の大脳新皮質に対し抗TAG-1抗体を用いて免疫沈降を行うとLynが共沈降すること,また,抗TAG-1抗体による架橋によりLynが活性化することが確認された.さらに,TAG-1の発現抑制による軸索の形成異常の表現型は,Lynの強制発現により部分的に救済されることも確認された.また,Lynが低分子量Gタンパク質であるRac1を間接的に活性化することも見い出した.以上の結果から,TAG-1を介した細胞接着はLynを活性化し,それにひきつづきRac1を活性化することにより,ニューロンにおける軸索の形成および極性化を制御していることが示唆された.
この研究より,生体におけるニューロンの極性化においては,すでに存在しているパイオニア軸索との接触が重要な役割をはたすことが明らかになった.これまでの研究から,生体において神経栄養因子やTGFβなどの液性因子がニューロンの極性化を制御している可能性が提示されている.しかしながら,これらの液性因子では,どのようにして複数の突起のうちの1本が軸索として選択されるのかという問題を解決することはできない.筆者らは,今回の結果をもとに,パイオニア軸索との細胞間相互作用により,多極性細胞の特定の突起が効率よく軸索へと分化することが可能になっていると考えている(図1).
一方で,今回の研究結果は新たな疑問を生み出した.ニューロンが軸索を伸ばすためにすでに存在する軸索を使用するならば,“最初”の軸索の形成はどのような分子機構により制御されているのであろうか8)(図2).神経発生の過程を丹念にながめると,この問いに対する回答がみえてくる.胎生中期のニューロンは神経幹細胞である神経上皮細胞から直接に生み出されると考えられている.神経上皮細胞は名前のとおり上皮様の極性をもつ.そのため,神経上皮細胞から直接に生み出されたニューロンは母細胞の極性をうけつぐことができると考えられる.一方で,胎生後期のニューロンは神経幹細胞である放射状グリア細胞から直接には産生されず,中間型前駆細胞をへて産生されることが知られている.放射状グリア細胞は基底膜と接した上皮様の極性をもつが,中間型前駆細胞はそのような明確な極性をもたない.そのため,中間型前駆細胞より生じたニューロンは母細胞の極性をうけつぐことができず,極性を再獲得する必要がある.そのような状況において,パイオニア軸索はニューロンが極性化するための微小環境因子として多極性細胞にはたらきかけ,効率のよい軸索の形成および極性化を可能にしていると推測される.
この研究は,生体においてニューロンが極性化するのに必要な“微小環境”にはじめて着目し解析したものである.今後,このような視点のみならず,さらなる新しい観点からニューロンの極性化の研究が進められていくことを願っている.
略歴:2007年 早稲田大学大学院理工学研究科 修了,同年 国立精神・神経センター神経研究所 流動研究員を経て,2009年より名古屋大学大学院医学系研究科 特任助教.
抱負:目に見えるもの(発生や進化)を,目に見えないもの(分子)により説明したい.
貝淵 弘三(Kozo Kaibuchi)
名古屋大学大学院医学系研究科 教授.
研究室URL:http://www.med.nagoya-u.ac.jp/Yakuri/
© 2014 難波隆志・貝淵弘三 Licensed under CC 表示 2.1 日本
(名古屋大学大学院医学系研究科 神経情報薬理学講座)
email:難波隆志,貝淵弘三
DOI: 10.7875/first.author.2014.032
Pioneering axons regulate neuronal polarization in the developing cerebral cortex.
Takashi Namba, Yuji Kibe, Yasuhiro Funahashi, Shinichi Nakamuta, Tetsuya Takano, Takuji Ueno, Akiko Shimada, Sachi Kozawa, Mayumi Okamoto, Yasushi Shimoda, Kanako Oda, Yoshino Wada, Tomoyuki Masuda, Akira Sakakibara, Michihiro Igarashi, Takaki Miyata, Catherine Faivre-Sarrailh, Kosei Takeuchi, Kozo Kaibuchi
Neuron, 81, 814-829 (2014)
要 約
ニューロンは高度に極性化した細胞のひとつであり,通常は1本の軸索と複数の樹状突起をもつ.現在までに,ニューロンの極性化,なかでも,軸索の形成を制御するさまざまな細胞内シグナルタンパク質が,おもに培養ニューロンを用いた実験系により同定されてきた.しかしながら,生体においてニューロンがどのように軸索を形成し極性化するのかに関しては未解明な点が多い.今回,筆者らは,胎生期の大脳新皮質の興奮性ニューロンをモデルとして用い,生体においてどのようなタンパク質がニューロンの極性化を制御しているのかについて解析した.その結果,未熟なニューロンとすでに成熟したニューロンの軸索であるパイオニア軸索とのあいだに免疫グロブリン様の細胞接着分子であるTAG-1を介した密接な細胞間相互作用があり,これが軸索の形成において重要な役割をはたしていることを見い出した.さらに,TAG-1の下流においてSrcファミリーキナーゼLynがはたらき,ニューロンの極性化を制御していることも明らかにした.この研究は,これまでの培養ニューロンを用いた極性化の研究においては明らかにすることのできなかった,生体でのニューロンの極性化におけるニューロンどうしの相互作用による制御機構をはじめて解明したものといえる.
はじめに
われわれの身体のなかでもっとも複雑かつ高度に極性化した細胞のひとつがニューロンである1,2).通常,ニューロンは1本の軸索と複数の樹状突起という2種類の異なった突起をもつ.ニューロンは極性化することにより,樹状突起より入力をうけ軸索を介し出力するという,一方向の情報伝達を行うことが可能になっている.現在までに,さまざまなニューロンの極性化の機構が,おもに培養ニューロンを用いた研究から明らかにされてきている.しかし,それらの研究結果をそのまま“生体内”におけるニューロンの極性化の機構にあてはめることはできない.なぜならば,細胞どうしの直接的な接触のない培養ニューロンとは違い,生体においてニューロンは多種多様な細胞にかこまれ,これらと接しながら極性化すると考えられるからである.この研究において,筆者らは,生体においてニューロンの極性化を制御する微小環境とその下流のシグナルの実態を明らかにするため,胎生期の大脳新皮質の興奮性ニューロンをモデルとして用い解析を行った.
胎生期のマウスの大脳新皮質の興奮性ニューロンは,以下の過程をへて極性化すると考えられている3-5)(図1).脳室帯に位置する神経幹細胞である放射状グリア細胞は,中間型神経前駆細胞を生み出す.そののち,脳室下帯に存在する中間型神経前駆細胞は,ニューロンを生み出す.未熟なニューロンはまず中間帯において複数の短い突起をもつ多極性の形態をとる多極性細胞となり,そののち,先導突起および後方突起を伸ばした双極性の形態をとる双極性細胞となる.そして,双極性細胞は皮質板へと移動し,最終的に,樹状突起および軸索をもつニューロンへと成熟する.このとき,先導突起は樹状突起に,後方突起は軸索になると考えられている.この研究では,多極性細胞から双極性細胞への形態の変化および未熟な軸索の形成に着目し解析を行った.
1.多極性細胞は中間帯の下方において極性化する
ニューロンの経時的な形態変化について詳細に解析するため,子宮内電気穿孔法を用いて胎生13日目の大脳新皮質のニューロンを標識した.そののち,胎生15日目に培養切片を作製し,共焦点顕微鏡によりタイムラプスイメージングを行った.その結果,過半数の多極性細胞はまず軸索を伸ばし,そののち,先導突起を伸ばして双極性細胞へと変化することがわかった.この結果は,生体においても培養ニューロンと同様に,軸索の形成がニューロンの極性化の最初の段階であることを示唆した.つづいて,ニューロンの極性化の空間的な解析を行った.胎生13日目に標識されたニューロンの大部分は,胎生15日目には中間帯に存在していた.中間帯の上方では過半数のニューロンが軸索をもつ双極性細胞であったが,中間帯の下方では軸索をもつ双極性細胞と軸索をもつ多極性細胞との割合はほぼ同じであった.以上の結果より,中間帯の下方において多極性細胞は軸索を伸ばし極性化し,そののち,双極性細胞へと形態を変化させ皮質板へむかい移動することが判明した.
2.多極性細胞のもつ未熟な突起はパイオニア軸索と密に接触し軸索へと分化する
ニューロンの極性化の起こる領域である中間帯の下方には,早生まれのニューロンに由来するパイオニア軸索が走行していることが知られている.そこで,多極性細胞とパイオニア軸索とのあいだの関係を組織学的に解析した.1回目の子宮内電気穿孔法によりパイオニア軸索を標識し,2回目の電気穿孔法により多極性細胞を標識した.その結果,多極性細胞のもつ複数の突起のうちの1本がパイオニア軸索と接触し,最終的にその突起が軸索へと分化することが確認された.
3.軸索の形成には細胞接着分子TAG-1が必要である
ニューロンどうしの接触にはさまざまな細胞接着分子の関与が知られ,なかでも,免疫グロブリン様の細胞接着分子がよく知られる6).さまざまな免疫グロブリン様細胞接着分子のなかで,多極性細胞が極性を獲得する“場”である中間帯の下方に非常に強く局在している細胞接着分子としてTAG-1を同定した.また,TAG-1は多極性細胞にも強く発現していることが確認された.これらの結果は,TAG-1を介した多極性細胞とパイオニア軸索とのあいだの接触が軸索の形成を制御している可能性を示唆した.そこで,軸索の形成におけるTAG-1の機能について解析した.子宮内電気穿孔法およびRNAi法を用いてTAG-1の発現を抑制したところ,軸索の形成が有意に阻害された.また,この表現型は野生型TAG-1の強制発現により救済されたが,細胞接着能を欠失したTAG-1変異体の強制発現では救済されなかった.以上のことから,TAG-1を介した細胞間相互作用が多極性細胞における軸索の形成を制御していることが示唆された.
4.TAG-1はSrcファミリーキナーゼLynを活性化し軸索の形成を制御する
これまでの研究から,TAG-1は脂質ラフトを介してSrcファミリーキナーゼLynを活性化することが知られていた7).実際に,胎生期15日目の大脳新皮質に対し抗TAG-1抗体を用いて免疫沈降を行うとLynが共沈降すること,また,抗TAG-1抗体による架橋によりLynが活性化することが確認された.さらに,TAG-1の発現抑制による軸索の形成異常の表現型は,Lynの強制発現により部分的に救済されることも確認された.また,Lynが低分子量Gタンパク質であるRac1を間接的に活性化することも見い出した.以上の結果から,TAG-1を介した細胞接着はLynを活性化し,それにひきつづきRac1を活性化することにより,ニューロンにおける軸索の形成および極性化を制御していることが示唆された.
おわりに
この研究より,生体におけるニューロンの極性化においては,すでに存在しているパイオニア軸索との接触が重要な役割をはたすことが明らかになった.これまでの研究から,生体において神経栄養因子やTGFβなどの液性因子がニューロンの極性化を制御している可能性が提示されている.しかしながら,これらの液性因子では,どのようにして複数の突起のうちの1本が軸索として選択されるのかという問題を解決することはできない.筆者らは,今回の結果をもとに,パイオニア軸索との細胞間相互作用により,多極性細胞の特定の突起が効率よく軸索へと分化することが可能になっていると考えている(図1).
一方で,今回の研究結果は新たな疑問を生み出した.ニューロンが軸索を伸ばすためにすでに存在する軸索を使用するならば,“最初”の軸索の形成はどのような分子機構により制御されているのであろうか8)(図2).神経発生の過程を丹念にながめると,この問いに対する回答がみえてくる.胎生中期のニューロンは神経幹細胞である神経上皮細胞から直接に生み出されると考えられている.神経上皮細胞は名前のとおり上皮様の極性をもつ.そのため,神経上皮細胞から直接に生み出されたニューロンは母細胞の極性をうけつぐことができると考えられる.一方で,胎生後期のニューロンは神経幹細胞である放射状グリア細胞から直接には産生されず,中間型前駆細胞をへて産生されることが知られている.放射状グリア細胞は基底膜と接した上皮様の極性をもつが,中間型前駆細胞はそのような明確な極性をもたない.そのため,中間型前駆細胞より生じたニューロンは母細胞の極性をうけつぐことができず,極性を再獲得する必要がある.そのような状況において,パイオニア軸索はニューロンが極性化するための微小環境因子として多極性細胞にはたらきかけ,効率のよい軸索の形成および極性化を可能にしていると推測される.
この研究は,生体においてニューロンが極性化するのに必要な“微小環境”にはじめて着目し解析したものである.今後,このような視点のみならず,さらなる新しい観点からニューロンの極性化の研究が進められていくことを願っている.
文 献
- Arimura, N. & Kaibuchi, K.: Neuronal polarity: from extracellular signals to intracellular mechanisms. Nat. Rev. Neurosci., 8, 194-205 (2007)[PubMed]
- Barnes, A. P. & Polleux, F.: Establishment of axon-dendrite polarity in developing neurons. Annu. Rev. Neurosci., 32, 347-381 (2009)[PubMed]
- Kriegstein, A. R. & Noctor, S. C.: Patterns of neuronal migration in the embryonic cortex. Trends Neurosci., 27, 392-399 (2004)[PubMed]
- Nakamuta, S., Funahashi, Y., Namba, T. et al.: Local application of neurotrophins specifies axons through inositol 1,4,5-trisphosphate, calcium, and Ca2+/calmodulin-dependent protein kinases. Sci. Signal., 4, ra76 (2011)[PubMed]
- Hatanaka, Y. & Yamauchi, K.: Excitatory cortical neurons with multipolar shape establish neuronal polarity by forming a tangentially oriented axon in the intermediate zone. Cereb. Cortex, 23, 105-113 (2013)[PubMed]
- Shimoda, Y. & Watanabe, K.: Contactins: emerging key roles in the development and function of the nervous system. Cell Adh. Migr., 3, 64-70 (2009)[PubMed]
- Kasahara, K., Watanabe, K., Takeuchi, K. et al.: Involvement of gangliosides in glycosylphosphatidylinositol-anchored neuronal cell adhesion molecule TAG-1 signaling in lipid rafts. J. Biol. Chem., 275, 34701-34709 (2000)[PubMed]
- Kriegstein, A. & Alvarez-Buylla, A.: The glial nature of embryonic and adult neural stem cells. Annu. Rev. Neurosci., 32, 149-184 (2009)[PubMed]
著者プロフィール
略歴:2007年 早稲田大学大学院理工学研究科 修了,同年 国立精神・神経センター神経研究所 流動研究員を経て,2009年より名古屋大学大学院医学系研究科 特任助教.
抱負:目に見えるもの(発生や進化)を,目に見えないもの(分子)により説明したい.
貝淵 弘三(Kozo Kaibuchi)
名古屋大学大学院医学系研究科 教授.
研究室URL:http://www.med.nagoya-u.ac.jp/Yakuri/
© 2014 難波隆志・貝淵弘三 Licensed under CC 表示 2.1 日本