卵子に蓄えられたヒストンバリアントはiPS細胞へのリプログラミングを促進する
品川敏恵・石井俊輔
(理化学研究所 石井分子遺伝学研究室)
email:品川敏恵
DOI: 10.7875/first.author.2014.030
Histone variants enriched in oocytes enhance reprogramming to induced pluripotent stem cells.
Toshie Shinagawa, Tsuyoshi Takagi, Daisuke Tsukamoto, Chinatsu Tomaru, Linh My Huynh, Padavattan Sivaraman, Thirumananseri Kumarevel, Kimiko Inoue, Ryuichiro Nakato, Yuki Katou, Takashi Sado, Satoru Takahashi, Atsuo Ogura, Katsuhiko Shirahige, Shunsuke Ishii
Cell Stem Cell, 14, 217-227 (2014)
ES細胞の主要な4つの転写因子Oct3/4,Sox2,Klf4,c-Mycを発現させることにより体細胞からiPS細胞を作製することができる.一方,体細胞の核を卵子に移植することにより受精卵の状態へともどすことが可能で,卵子にはリプログラミング因子の存在することが示唆されていた.筆者らは,ヒストンH2AおよびヒストンH2BのヒストンバリアントであるTH2AおよびTH2Bが,卵子に大量に発現し受精ののちの父親に由来するゲノムの活性化に寄与していること,および,4つの転写因子の発現によるiPS細胞の作製を促進することを明らかにした.TH2AおよびTH2Bを発現させた細胞ではDNase Iに対する感受性が上昇しており,転写の起こりやすい開いたクロマチン構造が形成されていると考えられた.リプログラミングの過程において,TH2AおよびTH2BはX染色体に優先的に結合していた.X染色体は体細胞の核移植の際にXist RNAにより異常な不活性化をうけるため,Xist遺伝子を欠損した細胞の核を使用するとクローンマウスの作製の効率が上昇すると報告されている.TH2AおよびTH2Bをくわえた場合のiPS細胞の作製効率はXist遺伝子を欠損させることによりさらに上昇したが,4つの転写因子の発現のみによるiPS細胞の作製において影響はなかった.これらの結果は,ヒストンバリアントであるTH2AおよびTH2Bは,通常の受精卵の発生の過程や体細胞の核移植の過程を誘導することによりリプログラミングを促進している可能性を示唆した.
体細胞にOct3/4,Sox2,Klf4,c-Myc(山中4因子)を人工的に強制発現させことによりiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)を作製することができる1).これら4つの因子はES細胞において高発現している転写因子であり,この方法はES細胞における主要な転写因子を用いて多能性幹細胞としての転写ネットワークを構築することにより体細胞をリプログラミングしていると考えられる.体細胞をリプログラミングする方法はほかにもあり,体細胞の核移植はその代表である.体細胞核移植では体細胞の核を卵子に移植することによりリプログラミングを誘導し,分化した核を受精卵の状態へともどすことができる.体細胞核移植は,カエル2),ヒツジ3),マウス4) において成功している.体細胞核移植の際のリプログラミング因子は卵子に存在すると考えられているが,どの因子がその役割をはたしているのかはよくわかっていない.
ヒストンは糸状のDNAを巻きとる糸巻きのようなタンパク質で,ヒストンの翻訳後修飾はエピゲノム制御の中核をなしている.クロマチンの構造とかかわりの深いヒストンバリアントもいくつか報告されている5).筆者らは,卵子や受精卵に大量に発現しているヒストンバリアントTH2AおよびTH2Bにin vivoおよびin vitroにおいてリプログラミングを促進する効果があるかどうかを調べた.
TH2AおよびTH2BはヒストンH2AおよびヒストンH2Bの精巣に特異的なヒストンバリアントとしてみつかったもので6),ヒストンH2AおよびヒストンH2Bとはそれぞれ15アミノ酸残基および16アミノ酸残基の違いがある.TH2AおよびTH2BをコードするmRNAの発現を調べたところ,精巣だけでなく,卵子および受精卵でも高い発現が認められ,細胞が分裂するにつれ減少した.
TH2AおよびTH2Bが受精のときのリプログラミングにおいてどのような役割をはたしているのかを調べるため,それらのノックアウトマウスを作製した.TH2AおよびTH2Bをコードする遺伝子はゲノムにおいて隣接しており,それらのあいだにある共通の遺伝子プロモーターにより発現が制御されているので,この両方の遺伝子を欠損したダブルノックアウトマウスを作製した.TH2A TH2Bヘテロダブルノックアウトマウスの雄と雌を交配したとき,仔マウスの遺伝子型は1:2:1という正常なメンデル比を示した.雄のTH2A TH2Bホモダブルノックアウトマウスは不妊であった.TH2A TH2Bヘテロダブルノックアウトマウスの雄と交配したときの雌のTH2A TH2Bホモダブルノックアウトマウス1腹あたりの産仔の数は,雌の野生型マウスの場合の半分以下に減少していた.野生型マウスの雄と交配しても産仔の数は増加しなかった.父親からTH2AあるいはTH2Bの遺伝子が供給されても表現型は回復しなかったことから,母親に由来するTH2AおよびTH2Bが胚の初期発生において重要であると推察された.
雌のTH2A TH2Bホモダブルノックアウトマウスにおいて卵巣の形態や過排卵処理ののちに得られた卵子の数は正常であったが,受精卵は野生型マウスの半分しか胚盤胞の段階にまで達しなかった.したがって,TH2AおよびTH2Bは初期胚の発生にかかわる母性効果因子であると考えられた.母性効果因子の多くは2細胞期の接合子遺伝子の活性化に重要な役割をはたしており,母親に由来する遺伝子を欠損させると接合子ゲノムからの新たな転写は起こらない.新規に合成されたRNAの量を指標に接合子遺伝子の活性化について調べたところ,母親に由来するTH2AおよびTH2Bを欠損した胚では野生型の胚の59%になっていた.これらのことから,TH2AおよびTH2Bが母性効果因子であることが確認された.
卵子の単為発生能に違いがみられなかったことから,母親に由来するゲノムからの転写はTH2AおよびTH2Bがなくても正常に起こると推察された.そこで,父親に由来するゲノムからの遺伝子発現と母親に由来するゲノムからの遺伝子発現のどちらが母親に由来するTH2AおよびTH2Bの影響をうけるのかをはっきりさせるため,父親に由来するゲノムあるいは母親に由来するゲノムにNanog-GFPレポーター遺伝子をもつ胚を使い,それぞれのゲノムからのGFPの発現を調べた.その結果,母親に由来するゲノムからのGFPの発現に差はみられなかったが,母親に由来するTH2AおよびTH2Bを欠損した胚において,父親に由来するゲノムからの発現は低下していた.これらの結果から,TH2AおよびTH2Bは父親に由来するゲノムの活性化に必要な母性効果因子であることが明らかになった.
TH2AおよびTH2Bが受精ののちの父親に由来するゲノムの活性化に役立っていたことから,これらがiPS細胞を作製する際のリプログラミングに対しても促進効果を示すのではないかと考えた.そこで,iPS細胞の作製におけるTH2AおよびTH2Bの効果についてNanog-GFPトランスジェニックマウスの胎仔線維芽細胞を用いて調べた.その結果,TH2AあるいはTH2Bを単独で山中4因子の発現と組み合わせた場合にはあまり効果はみられなかったが,TH2AとTH2Bの両方をくわえるとiPS細胞の作製効率は9倍になった.
ヌクレオプラスミンは卵子で高く発現しているヒストンシャペロンで,精子のクロマチンの脱凝集にかかわることが知られている7).ヌクレオプラスミンは受精の際にリン酸化され活性を示すようになることから8),アミノ酸の置換によりリン酸化を模倣したヌクレオプラスミン変異体を作製した.リン酸化模倣ヌクレオプラスミン変異体をTH2AおよびTH2Bとともに山中4因子の発現によるiPS細胞の作製系にくわえると,iPS細胞の作製効率は18倍に上昇した.このことにより,山中4因子だけのときと比べGFP陽性のコロニーが出現するまでにかかる期間も短縮された.また,TH2AおよびTH2B,リン酸化模倣ヌクレオプラスミン変異体と,山中4因子のうちOct4およびKlf4の組合せによってもiPS細胞を作製することができた.
TH2AおよびTH2Bがリプログラミングを促進する分子機構について調べるため,TH2AおよびTH2Bがゲノムのどこに結合しているかネイティブクロマチン免疫沈降-シークエンシング法により解析した.山中4因子,TH2AおよびTH2B,リン酸化模倣ヌクレオプラスミン変異体によるiPS細胞の作製の途中の線維芽細胞において,TH2AおよびTH2Bはプロモーターや転写開始点のような遺伝子制御配列にかたよった分布を示さず,ゲノムの全体に分布していた.染色体のあいだで分布を比較したところ,TH2AおよびTH2BはX染色体に濃縮していた.
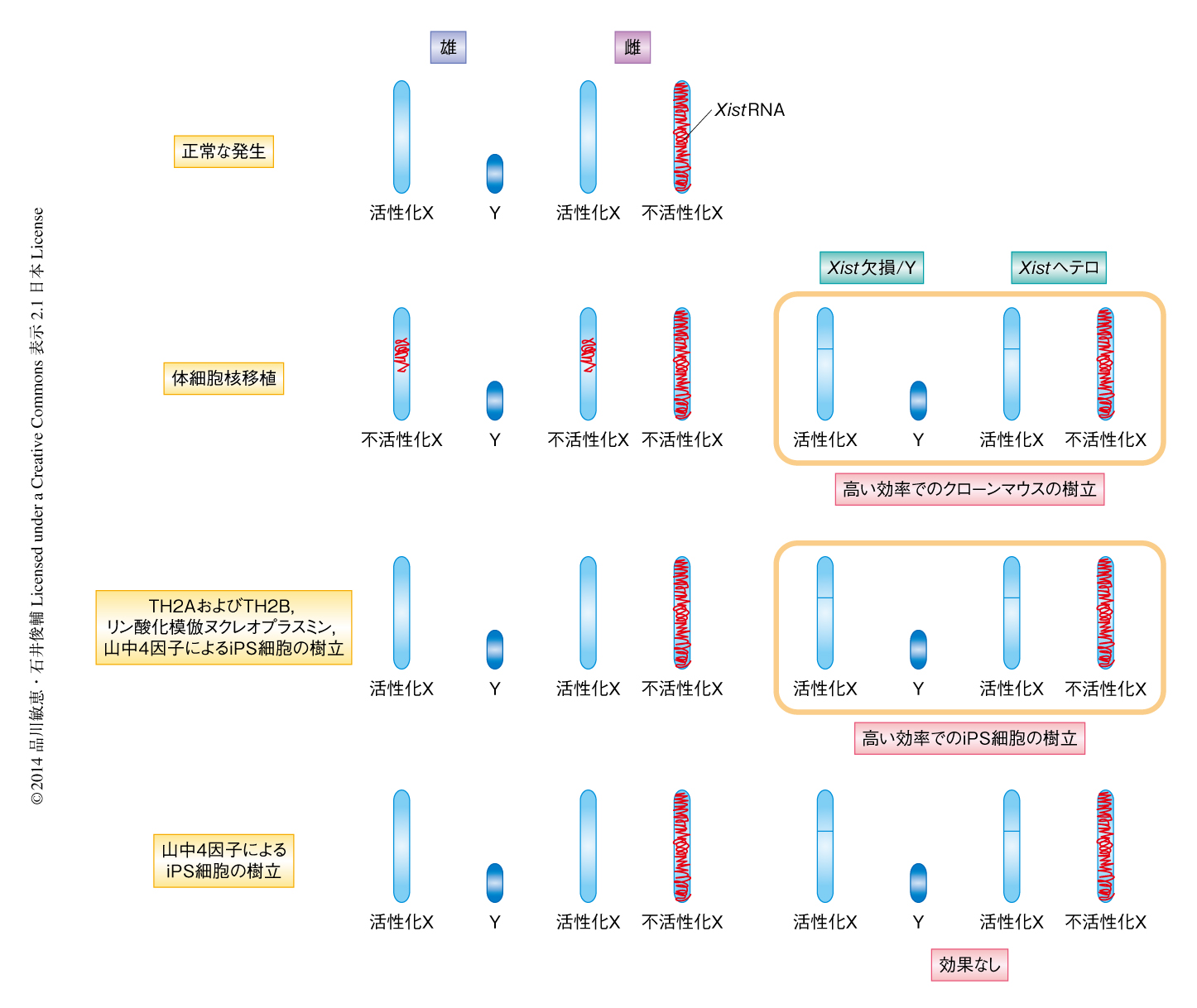
X染色体の数の違いによりリプログラミングの効率に違いがあるかどうかを調べたが,雄と雌とで差はなかった.X染色体は体細胞核移植の際にXist RNAにより異常な不活性化をうけるため,Xist遺伝子を欠損した細胞の核を使用するとクローンマウスの作製効率が上昇すると報告されている9).そこで,Xist遺伝子を欠損した細胞を用いてiPS細胞を作製した.その結果,TH2AおよびTH2Bをくわえた場合のiPS細胞の作製効率はXist遺伝子を欠損させることによりさらに上昇したが,山中4因子のみによるiPS細胞の作製において影響はなかった(図1).体細胞のリプログラミング系にTH2AおよびTH2Bをくわえると卵子で起こるリプログラミングや体細胞核移植に似たプロセスが誘導されるのかもしれない.
TH2AおよびTH2Bがクロマチンの構造に影響をあたえるかどうかを調べるため,H2AおよびヒストンH2Bを含むヌクレオソームとTH2AおよびTH2Bを含むヌクレオソームについて,その構造の特徴を比較した.すると,TH2AおよびTH2Bを含むヌクレオソームでは強い水素結合の数が少なくなっており,転写が起こりやすい,より開いたクロマチン構造をとっていることが示唆された.TH2AおよびTH2Bの発現により開いたクロマチン構造が誘導されることを確認するため,核に存在するDNAのDNase Iに対する感受性について調べた.TH2AおよびTH2Bとリン酸化模倣ヌクレオプラスミン変異体を強制発現させたNIH3T3細胞では,ヒストンH2AおよびヒストンH2Bとリン酸化模倣ヌクレオプラスミン変異体を発現させた細胞よりDNase Iに対する感受性が高くなっていた.これらの結果から,TH2AおよびTH2Bが発現している細胞では,より開いたクロマチン構造の誘導されることが示唆された.
卵子に大量に蓄積しているヒストンバリアントTH2AおよびTH2Bは初期胚における接合子遺伝子の活性化にかかわる母性効果因子であり,父親に由来するゲノムの活性化,および,山中4因子によるリプログラミングの促進の両方に効果のあることが明らかになった.TH2AおよびTH2Bに依存したリプログラミングに対し促進作用を示したヌクレオプラスミンも母性効果因子であり,接合子遺伝子の活性化において重要な役割をはたしている10).よって,母性効果因子の全般がリプログラミングを促進する因子のよい候補になるとも考えられる.母性効果因子を調べることにより,iPS細胞の作製を思いどおりに制御できる因子がみつかるかもしれない.
略歴:1998年 岐阜大学大学院連合獣医学研究科 修了,同年より理化学研究所 ポスドク研究員(現 専任研究員).
研究テーマ:核の初期化の分子機構.
関心事:卵のなかのリプログラミング因子.
石井 俊輔(Shunsuke Ishii)
理化学研究所 上席研究員.
研究室URL:http://rtcweb.rtc.riken.jp/lab/mg/mg.html
© 2014 品川敏恵・石井俊輔 Licensed under CC 表示 2.1 日本
(理化学研究所 石井分子遺伝学研究室)
email:品川敏恵
DOI: 10.7875/first.author.2014.030
Histone variants enriched in oocytes enhance reprogramming to induced pluripotent stem cells.
Toshie Shinagawa, Tsuyoshi Takagi, Daisuke Tsukamoto, Chinatsu Tomaru, Linh My Huynh, Padavattan Sivaraman, Thirumananseri Kumarevel, Kimiko Inoue, Ryuichiro Nakato, Yuki Katou, Takashi Sado, Satoru Takahashi, Atsuo Ogura, Katsuhiko Shirahige, Shunsuke Ishii
Cell Stem Cell, 14, 217-227 (2014)
要 約
ES細胞の主要な4つの転写因子Oct3/4,Sox2,Klf4,c-Mycを発現させることにより体細胞からiPS細胞を作製することができる.一方,体細胞の核を卵子に移植することにより受精卵の状態へともどすことが可能で,卵子にはリプログラミング因子の存在することが示唆されていた.筆者らは,ヒストンH2AおよびヒストンH2BのヒストンバリアントであるTH2AおよびTH2Bが,卵子に大量に発現し受精ののちの父親に由来するゲノムの活性化に寄与していること,および,4つの転写因子の発現によるiPS細胞の作製を促進することを明らかにした.TH2AおよびTH2Bを発現させた細胞ではDNase Iに対する感受性が上昇しており,転写の起こりやすい開いたクロマチン構造が形成されていると考えられた.リプログラミングの過程において,TH2AおよびTH2BはX染色体に優先的に結合していた.X染色体は体細胞の核移植の際にXist RNAにより異常な不活性化をうけるため,Xist遺伝子を欠損した細胞の核を使用するとクローンマウスの作製の効率が上昇すると報告されている.TH2AおよびTH2Bをくわえた場合のiPS細胞の作製効率はXist遺伝子を欠損させることによりさらに上昇したが,4つの転写因子の発現のみによるiPS細胞の作製において影響はなかった.これらの結果は,ヒストンバリアントであるTH2AおよびTH2Bは,通常の受精卵の発生の過程や体細胞の核移植の過程を誘導することによりリプログラミングを促進している可能性を示唆した.
はじめに
体細胞にOct3/4,Sox2,Klf4,c-Myc(山中4因子)を人工的に強制発現させことによりiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)を作製することができる1).これら4つの因子はES細胞において高発現している転写因子であり,この方法はES細胞における主要な転写因子を用いて多能性幹細胞としての転写ネットワークを構築することにより体細胞をリプログラミングしていると考えられる.体細胞をリプログラミングする方法はほかにもあり,体細胞の核移植はその代表である.体細胞核移植では体細胞の核を卵子に移植することによりリプログラミングを誘導し,分化した核を受精卵の状態へともどすことができる.体細胞核移植は,カエル2),ヒツジ3),マウス4) において成功している.体細胞核移植の際のリプログラミング因子は卵子に存在すると考えられているが,どの因子がその役割をはたしているのかはよくわかっていない.
ヒストンは糸状のDNAを巻きとる糸巻きのようなタンパク質で,ヒストンの翻訳後修飾はエピゲノム制御の中核をなしている.クロマチンの構造とかかわりの深いヒストンバリアントもいくつか報告されている5).筆者らは,卵子や受精卵に大量に発現しているヒストンバリアントTH2AおよびTH2Bにin vivoおよびin vitroにおいてリプログラミングを促進する効果があるかどうかを調べた.
1.TH2AおよびTH2Bは父親に由来するゲノムの活性化にかかわる母性効果因子である
TH2AおよびTH2BはヒストンH2AおよびヒストンH2Bの精巣に特異的なヒストンバリアントとしてみつかったもので6),ヒストンH2AおよびヒストンH2Bとはそれぞれ15アミノ酸残基および16アミノ酸残基の違いがある.TH2AおよびTH2BをコードするmRNAの発現を調べたところ,精巣だけでなく,卵子および受精卵でも高い発現が認められ,細胞が分裂するにつれ減少した.
TH2AおよびTH2Bが受精のときのリプログラミングにおいてどのような役割をはたしているのかを調べるため,それらのノックアウトマウスを作製した.TH2AおよびTH2Bをコードする遺伝子はゲノムにおいて隣接しており,それらのあいだにある共通の遺伝子プロモーターにより発現が制御されているので,この両方の遺伝子を欠損したダブルノックアウトマウスを作製した.TH2A TH2Bヘテロダブルノックアウトマウスの雄と雌を交配したとき,仔マウスの遺伝子型は1:2:1という正常なメンデル比を示した.雄のTH2A TH2Bホモダブルノックアウトマウスは不妊であった.TH2A TH2Bヘテロダブルノックアウトマウスの雄と交配したときの雌のTH2A TH2Bホモダブルノックアウトマウス1腹あたりの産仔の数は,雌の野生型マウスの場合の半分以下に減少していた.野生型マウスの雄と交配しても産仔の数は増加しなかった.父親からTH2AあるいはTH2Bの遺伝子が供給されても表現型は回復しなかったことから,母親に由来するTH2AおよびTH2Bが胚の初期発生において重要であると推察された.
雌のTH2A TH2Bホモダブルノックアウトマウスにおいて卵巣の形態や過排卵処理ののちに得られた卵子の数は正常であったが,受精卵は野生型マウスの半分しか胚盤胞の段階にまで達しなかった.したがって,TH2AおよびTH2Bは初期胚の発生にかかわる母性効果因子であると考えられた.母性効果因子の多くは2細胞期の接合子遺伝子の活性化に重要な役割をはたしており,母親に由来する遺伝子を欠損させると接合子ゲノムからの新たな転写は起こらない.新規に合成されたRNAの量を指標に接合子遺伝子の活性化について調べたところ,母親に由来するTH2AおよびTH2Bを欠損した胚では野生型の胚の59%になっていた.これらのことから,TH2AおよびTH2Bが母性効果因子であることが確認された.
卵子の単為発生能に違いがみられなかったことから,母親に由来するゲノムからの転写はTH2AおよびTH2Bがなくても正常に起こると推察された.そこで,父親に由来するゲノムからの遺伝子発現と母親に由来するゲノムからの遺伝子発現のどちらが母親に由来するTH2AおよびTH2Bの影響をうけるのかをはっきりさせるため,父親に由来するゲノムあるいは母親に由来するゲノムにNanog-GFPレポーター遺伝子をもつ胚を使い,それぞれのゲノムからのGFPの発現を調べた.その結果,母親に由来するゲノムからのGFPの発現に差はみられなかったが,母親に由来するTH2AおよびTH2Bを欠損した胚において,父親に由来するゲノムからの発現は低下していた.これらの結果から,TH2AおよびTH2Bは父親に由来するゲノムの活性化に必要な母性効果因子であることが明らかになった.
2.TH2AおよびTH2BはiPS細胞の作製効率を上昇させる
TH2AおよびTH2Bが受精ののちの父親に由来するゲノムの活性化に役立っていたことから,これらがiPS細胞を作製する際のリプログラミングに対しても促進効果を示すのではないかと考えた.そこで,iPS細胞の作製におけるTH2AおよびTH2Bの効果についてNanog-GFPトランスジェニックマウスの胎仔線維芽細胞を用いて調べた.その結果,TH2AあるいはTH2Bを単独で山中4因子の発現と組み合わせた場合にはあまり効果はみられなかったが,TH2AとTH2Bの両方をくわえるとiPS細胞の作製効率は9倍になった.
ヌクレオプラスミンは卵子で高く発現しているヒストンシャペロンで,精子のクロマチンの脱凝集にかかわることが知られている7).ヌクレオプラスミンは受精の際にリン酸化され活性を示すようになることから8),アミノ酸の置換によりリン酸化を模倣したヌクレオプラスミン変異体を作製した.リン酸化模倣ヌクレオプラスミン変異体をTH2AおよびTH2Bとともに山中4因子の発現によるiPS細胞の作製系にくわえると,iPS細胞の作製効率は18倍に上昇した.このことにより,山中4因子だけのときと比べGFP陽性のコロニーが出現するまでにかかる期間も短縮された.また,TH2AおよびTH2B,リン酸化模倣ヌクレオプラスミン変異体と,山中4因子のうちOct4およびKlf4の組合せによってもiPS細胞を作製することができた.
3.TH2AおよびTH2BはX染色体において濃縮されている
TH2AおよびTH2Bがリプログラミングを促進する分子機構について調べるため,TH2AおよびTH2Bがゲノムのどこに結合しているかネイティブクロマチン免疫沈降-シークエンシング法により解析した.山中4因子,TH2AおよびTH2B,リン酸化模倣ヌクレオプラスミン変異体によるiPS細胞の作製の途中の線維芽細胞において,TH2AおよびTH2Bはプロモーターや転写開始点のような遺伝子制御配列にかたよった分布を示さず,ゲノムの全体に分布していた.染色体のあいだで分布を比較したところ,TH2AおよびTH2BはX染色体に濃縮していた.
X染色体の数の違いによりリプログラミングの効率に違いがあるかどうかを調べたが,雄と雌とで差はなかった.X染色体は体細胞核移植の際にXist RNAにより異常な不活性化をうけるため,Xist遺伝子を欠損した細胞の核を使用するとクローンマウスの作製効率が上昇すると報告されている9).そこで,Xist遺伝子を欠損した細胞を用いてiPS細胞を作製した.その結果,TH2AおよびTH2Bをくわえた場合のiPS細胞の作製効率はXist遺伝子を欠損させることによりさらに上昇したが,山中4因子のみによるiPS細胞の作製において影響はなかった(図1).体細胞のリプログラミング系にTH2AおよびTH2Bをくわえると卵子で起こるリプログラミングや体細胞核移植に似たプロセスが誘導されるのかもしれない.
4.TH2AおよびTH2Bは開いたクロマチン構造の形成に役立つ
TH2AおよびTH2Bがクロマチンの構造に影響をあたえるかどうかを調べるため,H2AおよびヒストンH2Bを含むヌクレオソームとTH2AおよびTH2Bを含むヌクレオソームについて,その構造の特徴を比較した.すると,TH2AおよびTH2Bを含むヌクレオソームでは強い水素結合の数が少なくなっており,転写が起こりやすい,より開いたクロマチン構造をとっていることが示唆された.TH2AおよびTH2Bの発現により開いたクロマチン構造が誘導されることを確認するため,核に存在するDNAのDNase Iに対する感受性について調べた.TH2AおよびTH2Bとリン酸化模倣ヌクレオプラスミン変異体を強制発現させたNIH3T3細胞では,ヒストンH2AおよびヒストンH2Bとリン酸化模倣ヌクレオプラスミン変異体を発現させた細胞よりDNase Iに対する感受性が高くなっていた.これらの結果から,TH2AおよびTH2Bが発現している細胞では,より開いたクロマチン構造の誘導されることが示唆された.
おわりに
卵子に大量に蓄積しているヒストンバリアントTH2AおよびTH2Bは初期胚における接合子遺伝子の活性化にかかわる母性効果因子であり,父親に由来するゲノムの活性化,および,山中4因子によるリプログラミングの促進の両方に効果のあることが明らかになった.TH2AおよびTH2Bに依存したリプログラミングに対し促進作用を示したヌクレオプラスミンも母性効果因子であり,接合子遺伝子の活性化において重要な役割をはたしている10).よって,母性効果因子の全般がリプログラミングを促進する因子のよい候補になるとも考えられる.母性効果因子を調べることにより,iPS細胞の作製を思いどおりに制御できる因子がみつかるかもしれない.
文 献
- Takahashi, K. & Yamanaka, S.: Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126, 663-676 (2006)[PubMed]
- Gurdon, J. B., Elsdale, T. R. & Fishberg, M.: Sexually mature individuals of Xenopus laevis from the transplantation of single somatic nuclei. Nature, 182, 64-65 (1958)[PubMed]
- Campbell, K. H., McWhir, J., Ritchie W. A. et al.: Sheep cloned by nuclear transfer from a cultured cell line. Nature, 380, 64-66 (1996)[PubMed]
- Wakayama, T., Perry, A. C., Zuccotti, M. et al.: Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature, 394, 369-374 (1998)[PubMed]
- Banaszynski, L. A., Allis, C. D. & Lewis, P. W.: Histone variants in metazoan development. Dev. Cell, 19, 662-674 (2010)[PubMed]
- Shires, A., Carpenter, M. P. & Chalkley, R.: A cysteine-containing H2B-like histone found in mature mammalian testis. J. Biol. Chem., 251, 4155-4158 (1976)[PubMed]
- Philpott, A., Leno, G. H. & Laskey, R. A.: Sperm decondensation in Xenopus egg cytoplasm is mediated by nucleoplasmin. Cell, 65, 569-578 (1991)[PubMed]
- Banuelos, S., Omaetxebarria, M. J., Ramos, I. et al.: Phosphorylation of both nucleoplasmin domains is required for activation of its chromatin decondensation activity. J. Biol. Chem., 282, 21213-21221 (2007)[PubMed]
- Inoue, K., Kohda, T., Sugimoto, M. et al.: Impeding Xist expression from the active X chromosome improves mouse somatic cell nuclear transfer. Science, 330, 496-499 (2010)[PubMed] [新着論文レビュー]
- Burns, K. H., Viveiros, M. M., Ren, Y. et al.: Roles of NPM2 in chromatin and nucleolar organization in oocytes and embryos. Science, 300, 633-636 (2003)[PubMed]
著者プロフィール
略歴:1998年 岐阜大学大学院連合獣医学研究科 修了,同年より理化学研究所 ポスドク研究員(現 専任研究員).
研究テーマ:核の初期化の分子機構.
関心事:卵のなかのリプログラミング因子.
石井 俊輔(Shunsuke Ishii)
理化学研究所 上席研究員.
研究室URL:http://rtcweb.rtc.riken.jp/lab/mg/mg.html
© 2014 品川敏恵・石井俊輔 Licensed under CC 表示 2.1 日本