ウイルスの感染における長鎖非コードRNAによる転写抑制因子を介したサイトカインの産生の制御
今村亮俊・秋光信佳
(東京大学アイソトープ総合センター 研究開発部門)
email:今村亮俊,秋光信佳
DOI: 10.7875/first.author.2014.024
Long noncoding RNA NEAT1-dependent SFPQ relocation from promoter region to paraspeckle mediates IL8 expression upon immune stimuli.
Katsutoshi Imamura, Naoto Imamachi, Gen Akizuki, Michiko Kumakura, Atsushi Kawaguchi, Kyosuke Nagata, Akihisa Kato, Yasushi Kawaguchi, Hiroki Sato, Misako Yoneda, Chieko Kai, Tetsushi Yada, Yutaka Suzuki, Toshimichi Yamada, Takeaki Ozawa, Kiyomi Kaneki, Tsuyoshi Inoue, Mika Kobayashi, Tatsuhiko Kodama, Youichiro Wada, Kazuhisa Sekimizu, Nobuyoshi Akimitsu
Molecular Cell, 53, 393-406 (2014)
核に存在する長鎖非コードRNAであるNEAT1v2は転写制御などに関与するSFPQと結合し核内構造体であるパラスペックルを形成することは知られていたが,その機能についてはよくわかっていなかった.筆者らは,ウイルスの感染を模擬する2本鎖RNAの添加,および,インフルエンザウイルスあるいはヘルペスウイルスの感染により,転写の段階における制御によりNEAT1v2の発現が上昇しパラスペックルが肥大化することを見い出した.さらに,NEAT1v2がインターロイキン8を含むサイトカインの産生の制御に関与していることがわかった.また,NEAT1v2と結合しパラスペックルの形成に関与するSFPQは,インターロイキン8をコードする遺伝子のプロモーター領域に結合し転写抑制因子としてはたらいており,NEAT1v2の発現の上昇にともないこの領域からはずれ,パラスペックルへと移行することにより転写の抑制が解除されることを見い出した.以上の結果は,長鎖非コードRNAであるNEAT1v2が転写抑制因子SFPQを介してサイトカインの産生の制御に関与していることを示唆した.
この10年間でヒトやマウスにおける大規模なゲノム解析が進み,タンパク質をコードしない非コードRNAの存在が明らかになった1).なかでも,核に存在する200塩基以上の長さをもつ核内長鎖非コードRNAががんなどの疾患に関与し,また,遺伝子の発現制御に直接に関与していることなどが明らかになりつつある2).核内長鎖非コードRNAは進化的に新しいことから,免疫応答などのストレスの刺激のもとでの遺伝子制御にはたらいていることが予想されたが,免疫応答における核内長鎖非コードRNAの関与についてはほとんど知見がなかった.
核内長鎖非コードRNAのひとつNEAT1(nuclear enriched abundant transcript 1)は,転写制御などに関与するSFPQやNONOと結合し,核内構造体であるパラスペックルを形成することが知られている3-5).筆者らは,さまざまなストレスの刺激のもとでの核内長鎖非コードRNAの発現について調べていくなかで,2本鎖RNAであるポリI:C 6) の投与によりウイルスの感染を模擬したとき,NEAT1の分子種のひとつNEAT1v2の発現の上昇がひき起こされることを見い出した.長鎖非コードRNAはさまざまなタンパク質と相互作用することにより複雑なゲノム情報発現ネットワークを形成すると考えられることから,長鎖非コードRNAによるサイトカインの産生の制御がウイルスに感染したときのサイトカインの発現を制御しているのではないかとの仮説をたてた.
ウイルスの感染を模擬するものとして,2本鎖RNAでありToll様受容体のひとつTLR3のリガンドとして知られるポリI:CによりHeLa細胞を刺激したところ,NEAT1およびNEAT1v2の発現の上昇がみられた.一方で,ポリIあるいはポリCによる刺激ではこの反応はみられず,また,ポリI:Cによる刺激ののちのサイトカインによる2次的な応答であるかどうかを調べる目的で,HeLa細胞にインターフェロンを添加してみたが,NEAT1v2の発現の上昇はみられなかった.さらに,ポリI:Cの刺激によるNEAT1v2の発現の上昇が転写の段階における制御なのかどうかを検討する目的で,NEAT1v2をコードする遺伝子のプロモーター領域をクローニングしてルシフェラーゼアッセイを行ったところ,ポリI:Cの添加に依存してNEAT1v2の遺伝子の転写活性が上昇した.さらに,ノックダウン実験および阻害剤を用いた実験から,ポリI:Cの刺激によるNEAT1v2の発現の上昇にはTLR3-p38リン酸化経路が関与することが明らかになった.
ポリI:Cの刺激によるNEAT1v2の発現の上昇は核内構造体であるパラスペックルにどのような影響をあたえているのか,蛍光in situハイブリダイゼーション法および免疫染色法によりNEAT1v2,および,パラスペックルの構成タンパク質であるSFPQおよびNONOについて観察したところ,ポリI:Cの添加に依存してパラスペックルが肥大化していることがわかった.一方で,ポリI:Cを添加してもSFPQおよびNONOの発現量には変化がなかったことから,核質に存在しているSFPQおよびNONOがポリI:Cに依存してパラスペックルに集合していると考えられた.以上の結果は,ポリI:Cの刺激によりTLR3-p38リン酸化経路を介してNEAT1v2の遺伝子の転写が誘導され,その結果,パラスペックルの肥大化がひき起こされたことを示唆した.
パラスペックルの構成タンパク質には転写制御にあずかるものが多く存在していることから,ポリI:Cによる刺激に依存してひき起こされるNEAT1v2の発現の上昇による,パラスペックルの肥大化にともなうパラスペックルの構成タンパク質の局在の変化は,細胞における転写プログラムを変化させていると考えた.そこで,ポリI:Cにより誘導されるNEAT1v2の発現の上昇の意義について検討するため,ノックダウン実験および過剰発現実験においてマイクロアレイを用い遺伝子発現を網羅的に解析した.その結果,NEAT1v2により発現の制御される遺伝子には,インターロイキン8をはじめとしたサイトカインの遺伝子,および,ウイルスセンサータンパク質であるRIG-IやMDA5などの遺伝子が含まれることがわかった.
NEAT1v2によるサイトカインの産生の制御機構について,パラスペックルの構成タンパク質のうちSFPQ,NONO,PSPC1は転写制御に関与することがわかっていたことから,これらタンパク質の局在が変化することにより細胞における転写プログラムが変化することが考えられた.そこで,これらタンパク質をノックダウンすることによりインターロイキン8をコードするmRNAの発現量が変化するかどうか調べた結果,SFPQおよびNONOのノックダウンによりインターロイキン8のmRNAの発現の上昇がみられた.さらに,SFPQおよびNONOのノックダウンによりインターロイキン8をコードする遺伝子の転写活性が上昇することがわかった.以上の結果から,SFPQおよびNONOはインターロイキン8の遺伝子の転写抑制因子としてはたらいているのではないかと考えた.
SFPQがインターロイキン8の遺伝子のプロモーター領域に結合しているかどうかを検討した.まず,TRANSFACによりSFPQの結合部位がインターロイキン8の遺伝子のプロモーター領域にあるかどうかを確認したところ,5’側非翻訳領域にSFPQ結合部位配列と非常によく似た配列を見い出すことができた.この配列がSFPQあるいはNONOと結合するかどうかをin vitroのゲルシフトアッセイおよびクロマチン免疫沈降法を用いて検討した.通常の細胞ではインターロイキン8の遺伝子の5’側非翻訳領域の予想された結合部位にSFPQが結合していること,さらに,この結合はポリI:Cによる刺激やNEAT1v2の過剰発現により低下することがわかった.また,RNA免疫沈降法によりポリI:Cにより刺激したときにはNEAT1v2およびSFPQの結合量が増加することが明らかになった.
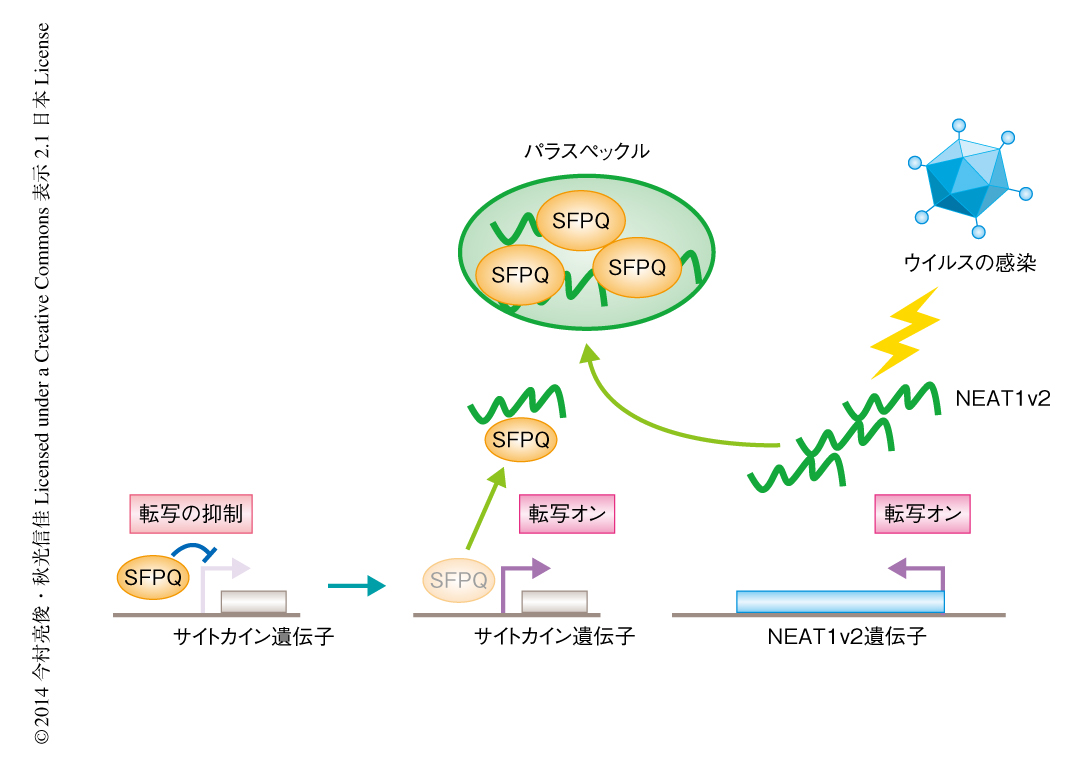
以上の結果は,通常,SFPQはインターロイキン8の遺伝子の5’側非翻訳領域に結合してその転写を抑制しているが,ポリI:Cの刺激によりNEAT1v2の発現が上昇するとそこからはずれ,NEAT1v2と結合することによりパラスペックルを肥大化し,転写の抑制を解除することを示唆した(図1).
ポリI:Cの刺激によりみられた現象がウイルスに感染したときにもみられるかどうかを検討する目的で,単純ヘルペスウイルス,インフルエンザウイルス,麻疹ウイルスを培養細胞に感染させた結果,単純ヘルペスウイルスおよびインフルエンザウイルスが感染したときNEAT1v2の発現は上昇することを見い出した.またこのとき,パラスペックルの肥大,および,パラスペックルの構成タンパク質の量的な変動のないこともわかった.これらの結果は,ポリI:Cにより刺激したときと同様の結果であった.さらに,NEAT1v2をノックダウンした細胞にインフルエンザウイルスを感染させたところ,インターロイキン8のmRNAおよびインターロイキン8について,その発現の抑制がみられた.また,このインフルエンザウイルスを感染させた細胞の培養上清を用いて,好中球に分化させたHL60細胞の遊走性を検討したところ低下していた.以上の結果は,ウイルスの感染のときにNEAT1v2はサイトカインの産生制御を担う重要なタンパク質であることを示唆した.
筆者らは,この研究により,長鎖非コードRNAであるNEAT1v2が転写抑制因子SFPQを介して免疫応答の制御に関与するという新しい知見を得た.NEAT1v2は核内構造体であるパラスペックルの形成において必須であることはわかっていたが,哺乳類がなぜパラスペックルおよびNEAT1v2をもつのか,また,その機能は不明であった.この研究により,NEAT1v2およびパラスペックルがウイルスに感染したときの免疫応答の制御に重要な役割をはたしていることが明らかにされた.さらに,その分子機構の解析において,NEAT1v2がパラスペックルを介し転写抑制因子の時空間的な制御を行っているという新たな概念を提唱した.この論文の改訂中に,プロテオソーム活性の阻害に依存したNEAT1とSFPQとの相互作用がADARB2遺伝子の発現制御を担うことが報告された7).この結果は,筆者らの提案するNEAT1とSFPQとの相互作用が自然免疫応答のほかの局面でも重要な役割をはたす可能性を示しており,たいへん興味深い.
ウイルスは宿主の細胞の翻訳系を乗っ取り自身の複製および増殖を行うため,ウイルスが感染すると宿主の翻訳は阻害される.そのため,宿主の翻訳系を介さない遺伝子の発現制御には利点があると考えられる.筆者らの実験では,翻訳阻害剤を添加したときにも,ポリI:Cの刺激によりNEAT1v2の発現の上昇がみられた.この結果は,なぜ生物はタンパク質をコードしない長鎖非コードRNAをもつのかという疑問に対して理解を進めるものと考えられる.
略歴:東京大学大学院薬学系研究科博士課程 在学中.
研究テーマ:免疫応答における長鎖非コードRNAの機能.
抱負:免疫応答の複雑なしくみと,なぜ高等動物は長鎖非コードRNAをもつのかという疑問に答えていきたい.今後は,自己免疫疾患についても解析したい.
秋光 信佳(Nobuyoshi Akimitsu)
東京大学アイソトープ総合センター 准教授.
研究室URL:http://www.ric.u-tokyo.ac.jp/akimitsu/
© 2014 今村亮俊・秋光信佳 Licensed under CC 表示 2.1 日本
(東京大学アイソトープ総合センター 研究開発部門)
email:今村亮俊,秋光信佳
DOI: 10.7875/first.author.2014.024
Long noncoding RNA NEAT1-dependent SFPQ relocation from promoter region to paraspeckle mediates IL8 expression upon immune stimuli.
Katsutoshi Imamura, Naoto Imamachi, Gen Akizuki, Michiko Kumakura, Atsushi Kawaguchi, Kyosuke Nagata, Akihisa Kato, Yasushi Kawaguchi, Hiroki Sato, Misako Yoneda, Chieko Kai, Tetsushi Yada, Yutaka Suzuki, Toshimichi Yamada, Takeaki Ozawa, Kiyomi Kaneki, Tsuyoshi Inoue, Mika Kobayashi, Tatsuhiko Kodama, Youichiro Wada, Kazuhisa Sekimizu, Nobuyoshi Akimitsu
Molecular Cell, 53, 393-406 (2014)
要 約
核に存在する長鎖非コードRNAであるNEAT1v2は転写制御などに関与するSFPQと結合し核内構造体であるパラスペックルを形成することは知られていたが,その機能についてはよくわかっていなかった.筆者らは,ウイルスの感染を模擬する2本鎖RNAの添加,および,インフルエンザウイルスあるいはヘルペスウイルスの感染により,転写の段階における制御によりNEAT1v2の発現が上昇しパラスペックルが肥大化することを見い出した.さらに,NEAT1v2がインターロイキン8を含むサイトカインの産生の制御に関与していることがわかった.また,NEAT1v2と結合しパラスペックルの形成に関与するSFPQは,インターロイキン8をコードする遺伝子のプロモーター領域に結合し転写抑制因子としてはたらいており,NEAT1v2の発現の上昇にともないこの領域からはずれ,パラスペックルへと移行することにより転写の抑制が解除されることを見い出した.以上の結果は,長鎖非コードRNAであるNEAT1v2が転写抑制因子SFPQを介してサイトカインの産生の制御に関与していることを示唆した.
はじめに
この10年間でヒトやマウスにおける大規模なゲノム解析が進み,タンパク質をコードしない非コードRNAの存在が明らかになった1).なかでも,核に存在する200塩基以上の長さをもつ核内長鎖非コードRNAががんなどの疾患に関与し,また,遺伝子の発現制御に直接に関与していることなどが明らかになりつつある2).核内長鎖非コードRNAは進化的に新しいことから,免疫応答などのストレスの刺激のもとでの遺伝子制御にはたらいていることが予想されたが,免疫応答における核内長鎖非コードRNAの関与についてはほとんど知見がなかった.
核内長鎖非コードRNAのひとつNEAT1(nuclear enriched abundant transcript 1)は,転写制御などに関与するSFPQやNONOと結合し,核内構造体であるパラスペックルを形成することが知られている3-5).筆者らは,さまざまなストレスの刺激のもとでの核内長鎖非コードRNAの発現について調べていくなかで,2本鎖RNAであるポリI:C 6) の投与によりウイルスの感染を模擬したとき,NEAT1の分子種のひとつNEAT1v2の発現の上昇がひき起こされることを見い出した.長鎖非コードRNAはさまざまなタンパク質と相互作用することにより複雑なゲノム情報発現ネットワークを形成すると考えられることから,長鎖非コードRNAによるサイトカインの産生の制御がウイルスに感染したときのサイトカインの発現を制御しているのではないかとの仮説をたてた.
1.2本鎖RNAの刺激によるNEAT1の発現の上昇およびパラスペックルの肥大化
ウイルスの感染を模擬するものとして,2本鎖RNAでありToll様受容体のひとつTLR3のリガンドとして知られるポリI:CによりHeLa細胞を刺激したところ,NEAT1およびNEAT1v2の発現の上昇がみられた.一方で,ポリIあるいはポリCによる刺激ではこの反応はみられず,また,ポリI:Cによる刺激ののちのサイトカインによる2次的な応答であるかどうかを調べる目的で,HeLa細胞にインターフェロンを添加してみたが,NEAT1v2の発現の上昇はみられなかった.さらに,ポリI:Cの刺激によるNEAT1v2の発現の上昇が転写の段階における制御なのかどうかを検討する目的で,NEAT1v2をコードする遺伝子のプロモーター領域をクローニングしてルシフェラーゼアッセイを行ったところ,ポリI:Cの添加に依存してNEAT1v2の遺伝子の転写活性が上昇した.さらに,ノックダウン実験および阻害剤を用いた実験から,ポリI:Cの刺激によるNEAT1v2の発現の上昇にはTLR3-p38リン酸化経路が関与することが明らかになった.
ポリI:Cの刺激によるNEAT1v2の発現の上昇は核内構造体であるパラスペックルにどのような影響をあたえているのか,蛍光in situハイブリダイゼーション法および免疫染色法によりNEAT1v2,および,パラスペックルの構成タンパク質であるSFPQおよびNONOについて観察したところ,ポリI:Cの添加に依存してパラスペックルが肥大化していることがわかった.一方で,ポリI:Cを添加してもSFPQおよびNONOの発現量には変化がなかったことから,核質に存在しているSFPQおよびNONOがポリI:Cに依存してパラスペックルに集合していると考えられた.以上の結果は,ポリI:Cの刺激によりTLR3-p38リン酸化経路を介してNEAT1v2の遺伝子の転写が誘導され,その結果,パラスペックルの肥大化がひき起こされたことを示唆した.
2.NEAT1により発現の制御されるサイトカインの発見
パラスペックルの構成タンパク質には転写制御にあずかるものが多く存在していることから,ポリI:Cによる刺激に依存してひき起こされるNEAT1v2の発現の上昇による,パラスペックルの肥大化にともなうパラスペックルの構成タンパク質の局在の変化は,細胞における転写プログラムを変化させていると考えた.そこで,ポリI:Cにより誘導されるNEAT1v2の発現の上昇の意義について検討するため,ノックダウン実験および過剰発現実験においてマイクロアレイを用い遺伝子発現を網羅的に解析した.その結果,NEAT1v2により発現の制御される遺伝子には,インターロイキン8をはじめとしたサイトカインの遺伝子,および,ウイルスセンサータンパク質であるRIG-IやMDA5などの遺伝子が含まれることがわかった.
3.NEAT1に依存的なサイトカインの産生の制御における転写抑制因子SFPQの関与
NEAT1v2によるサイトカインの産生の制御機構について,パラスペックルの構成タンパク質のうちSFPQ,NONO,PSPC1は転写制御に関与することがわかっていたことから,これらタンパク質の局在が変化することにより細胞における転写プログラムが変化することが考えられた.そこで,これらタンパク質をノックダウンすることによりインターロイキン8をコードするmRNAの発現量が変化するかどうか調べた結果,SFPQおよびNONOのノックダウンによりインターロイキン8のmRNAの発現の上昇がみられた.さらに,SFPQおよびNONOのノックダウンによりインターロイキン8をコードする遺伝子の転写活性が上昇することがわかった.以上の結果から,SFPQおよびNONOはインターロイキン8の遺伝子の転写抑制因子としてはたらいているのではないかと考えた.
SFPQがインターロイキン8の遺伝子のプロモーター領域に結合しているかどうかを検討した.まず,TRANSFACによりSFPQの結合部位がインターロイキン8の遺伝子のプロモーター領域にあるかどうかを確認したところ,5’側非翻訳領域にSFPQ結合部位配列と非常によく似た配列を見い出すことができた.この配列がSFPQあるいはNONOと結合するかどうかをin vitroのゲルシフトアッセイおよびクロマチン免疫沈降法を用いて検討した.通常の細胞ではインターロイキン8の遺伝子の5’側非翻訳領域の予想された結合部位にSFPQが結合していること,さらに,この結合はポリI:Cによる刺激やNEAT1v2の過剰発現により低下することがわかった.また,RNA免疫沈降法によりポリI:Cにより刺激したときにはNEAT1v2およびSFPQの結合量が増加することが明らかになった.
以上の結果は,通常,SFPQはインターロイキン8の遺伝子の5’側非翻訳領域に結合してその転写を抑制しているが,ポリI:Cの刺激によりNEAT1v2の発現が上昇するとそこからはずれ,NEAT1v2と結合することによりパラスペックルを肥大化し,転写の抑制を解除することを示唆した(図1).
4.ウイルスの感染による自然免疫応答へのNEAT1の寄与
ポリI:Cの刺激によりみられた現象がウイルスに感染したときにもみられるかどうかを検討する目的で,単純ヘルペスウイルス,インフルエンザウイルス,麻疹ウイルスを培養細胞に感染させた結果,単純ヘルペスウイルスおよびインフルエンザウイルスが感染したときNEAT1v2の発現は上昇することを見い出した.またこのとき,パラスペックルの肥大,および,パラスペックルの構成タンパク質の量的な変動のないこともわかった.これらの結果は,ポリI:Cにより刺激したときと同様の結果であった.さらに,NEAT1v2をノックダウンした細胞にインフルエンザウイルスを感染させたところ,インターロイキン8のmRNAおよびインターロイキン8について,その発現の抑制がみられた.また,このインフルエンザウイルスを感染させた細胞の培養上清を用いて,好中球に分化させたHL60細胞の遊走性を検討したところ低下していた.以上の結果は,ウイルスの感染のときにNEAT1v2はサイトカインの産生制御を担う重要なタンパク質であることを示唆した.
おわりに
筆者らは,この研究により,長鎖非コードRNAであるNEAT1v2が転写抑制因子SFPQを介して免疫応答の制御に関与するという新しい知見を得た.NEAT1v2は核内構造体であるパラスペックルの形成において必須であることはわかっていたが,哺乳類がなぜパラスペックルおよびNEAT1v2をもつのか,また,その機能は不明であった.この研究により,NEAT1v2およびパラスペックルがウイルスに感染したときの免疫応答の制御に重要な役割をはたしていることが明らかにされた.さらに,その分子機構の解析において,NEAT1v2がパラスペックルを介し転写抑制因子の時空間的な制御を行っているという新たな概念を提唱した.この論文の改訂中に,プロテオソーム活性の阻害に依存したNEAT1とSFPQとの相互作用がADARB2遺伝子の発現制御を担うことが報告された7).この結果は,筆者らの提案するNEAT1とSFPQとの相互作用が自然免疫応答のほかの局面でも重要な役割をはたす可能性を示しており,たいへん興味深い.
ウイルスは宿主の細胞の翻訳系を乗っ取り自身の複製および増殖を行うため,ウイルスが感染すると宿主の翻訳は阻害される.そのため,宿主の翻訳系を介さない遺伝子の発現制御には利点があると考えられる.筆者らの実験では,翻訳阻害剤を添加したときにも,ポリI:Cの刺激によりNEAT1v2の発現の上昇がみられた.この結果は,なぜ生物はタンパク質をコードしない長鎖非コードRNAをもつのかという疑問に対して理解を進めるものと考えられる.
文 献
- Kapranov, P., Willingham, A. T. & Gingeras, T. R.: Genome-wide transcription and the implications for genomic organization. Nat. Rev. Genet., 8, 413-423 (2007)[PubMed]
- Yoon, J. H., Abdelmohsen, K. & Gorospe, M.: Posttranscriptional gene regulation by long noncoding RNA. J. Mol. Biol., 425, 3723-3730 (2013)[PubMed]
- Sasaki, Y. T., Ideue, T., Sano, M. et al.: MENε/β noncoding RNAs are essential for structural integrity of nuclear paraspeckles. Proc. Natl. Acad. Sci. USA, 106, 2525-2530 (2009)[PubMed]
- Chen, L. L. & Carmichael, G. G.: Altered nuclear retention of mRNAs containing inverted repeats in human embryonic stem cells: functional role of a nuclear noncoding RNA. Mol. Cell., 35, 467-478 (2009)[PubMed]
- Naganuma, T., Nakagawa, S., Tanigawa, A. et al.: Alternative 3'-end processing of long noncoding RNA initiates construction of nuclear paraspeckles. EMBO J., 31, 4020-4034 (2012)[PubMed]
- Kawai, T. & Akira, S.: The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors. Nat. Immunol., 11, 373-384 (2010)[PubMed]
- Hirose, T., Virnicchi, G., Tanigawa, A. et al.: NEAT1 long noncoding RNA regulates transcription via protein sequestration within subnuclear bodies. Mol. Biol. Cell, 25, 169-183 (2014)[PubMed]
著者プロフィール
略歴:東京大学大学院薬学系研究科博士課程 在学中.
研究テーマ:免疫応答における長鎖非コードRNAの機能.
抱負:免疫応答の複雑なしくみと,なぜ高等動物は長鎖非コードRNAをもつのかという疑問に答えていきたい.今後は,自己免疫疾患についても解析したい.
秋光 信佳(Nobuyoshi Akimitsu)
東京大学アイソトープ総合センター 准教授.
研究室URL:http://www.ric.u-tokyo.ac.jp/akimitsu/
© 2014 今村亮俊・秋光信佳 Licensed under CC 表示 2.1 日本