2本鎖DNA切断修復機構においてその経路はMRE11のもつヌクレアーゼ活性により決定される
柴田 淳史
(英国Sussex大学Genome Damage and Stability Centre)
email:柴田淳史
DOI: 10.7875/first.author.2014.015
DNA double-strand break repair pathway choice is directed by distinct MRE11 nuclease activities.
Atsushi Shibata, Davide Moiani, Andrew S. Arvai, Jefferson Perry, Shane M. Harding, Marie-Michelle Genois, Ranjan Maity, Sari van Rossum-Fikkert, Aryandi Kertokalio, Filippo Romoli, Amani Ismail, Ermal Ismalaj, Elena Petricci, Matthew J. Neale, Robert G. Bristow, Jean-Yves Masson, Claire Wyman, Penny A. Jeggo, John A. Tainer
Molecular Cell, 53, 7-18 (2014)
MRN複合体の構成タンパク質のひとつであるMRE11は,2本鎖DNA切断修復機構において損傷部位の発見,修復,シグナルの増強にはたらく.一方で,MRE11のもつエンドヌクレアーゼ活性およびエキソヌクレアーゼ活性が,2本鎖DNA切断修復機構における2つの異なる経路,すなわち,非相同末端結合経路および相同組換え経路においてどのように関与しているかについては,いまだ多くは明らかになっていない.筆者らは,X線構造解析をもとにした化合物スクリーニングにより,MRE11のエンドヌクレアーゼ活性あるいはエキソヌクレアーゼ活性に対し特異的な阻害剤を発見した.これらの阻害剤を用い,非相同末端結合経路および相同組換え経路の機能するG2期における2本鎖DNA切断修復機構の経路決定の機序に着目して研究を行った.エンドヌクレアーゼ活性あるいはエキソヌクレアーゼ活性のどちらの活性に特異的な阻害剤を処理した場合にも,相同組換え経路の最初のステップである2本鎖DNA末端の削り込みの低下にともなう相同組換え効率の低下が認められた.一方で,非常に興味深いことに,エンドヌクレアーゼ活性を阻害したときのみ,2本鎖DNA切断修復機構は相同組換え経路から非相同末端結合経路へと移行することが見い出された.以上の研究結果から,MRE11のもつエンドヌクレアーゼ活性が2本鎖DNA切断修復機構を相同組換え経路へと進行させ,その下流において,MRE11のもつエキソヌクレアーゼ活性がEXO1-BLM複合体のエキソヌクレアーゼ活性と協調して,相同組換え経路への移行を決定づけていることが明らかになった.
放射線の照射や化学療法剤の処理により誘発される2本鎖DNA切断は,細胞の生死を決定しうる重篤なDNA損傷のひとつである.また,2本鎖DNA切断は免疫の成熟過程のひとつであるV(D)J組換えのときにも生じ,さらには,減数分裂期に遺伝子組換えを誘導する際にも生じる.MRE11はMRE11-RAD50-NBS1(MRN)複合体を形成し,2本鎖DNA切断が生じたのちの修復や損傷シグナルの増強にかかわることが報告されている1).しかしながら,MRE11のもつヌクレアーゼ活性がどのように2本鎖DNA切断修復機構にかかわるかについて多くは明らかになっていない2).その理由として,MRE11は異なる2つのヌクレアーゼ活性をもつことがあげられる.酵母を用いた実験系から,MRE11のもつエキソヌクレアーゼ活性のみを欠失した変異体,および,エキソヌクレアーゼ活性とエンドヌクレアーゼ活性の両方を欠失した変異体は見い出されているが,エンドヌクレアーゼ活性のみを欠失した変異体はみつかっていない2).また,そのほかの要因として,遺伝子操作などによりMRE11を欠損させるとMRN複合体が不安定化するため,単体のMRE11の役割について証明することが困難であったこともあげられる3).
筆者らは,X線構造解析をもとにした化合物スクリーニングにより,MRE11のもつエンドヌクレアーゼ活性あるいはエキソヌクレアーゼ活性に対し特異的な阻害剤を開発した.これらの阻害剤を用いることにより,これまで明らかされていなかったエンドヌクレアーゼ活性およびエキソヌクレアーゼ活性のそれぞれの役割を解析することが可能になった.今回,筆者らは,2本鎖DNA切断が生じてから細胞が死にいたる過程においてもっとも重要とされる,2本鎖DNA切断修復機構における最適な経路決定の機序に着目し研究を行った.その結果,MRE11のもつエンドヌクレアーゼ活性が相同組換えを開始することにより2本鎖DNA切断修復機構を相同組換え経路へと決定づけ,そののち,MRE11のもつエキソヌクレアーゼ活性およびEXO1-BLM複合体のエキソヌクレアーゼ活性が相同組換え経路を促進することを見い出した.
2008年,MRE11と複合体を形成してMRE11のもつエキソヌクレアーゼ活性を阻害する化合物mirinが発見された4).しかしながら,その阻害の機序は明らかになっていなかった.そこで,ヒトのMRE11と高い相同性もつ超好熱性の真正細菌Thermotoga maritimaのMre11とmirinとの複合体の構造をX線構造解析により明らかにした.mirinはMRE11のエキソヌクレアーゼ活性の活性中心であるHis61(ヒトでは,His63)の近傍に結合していた.また,mirinの水酸基をアミノ基に置換することにより,活性中心により特異的に結合しエキソヌクレアーゼ活性を阻害する化合物PFM39を開発した.また一方で,mirinのN-アルキル化誘導体を作製することにより,MRE11の構造を変化させMRE11がエンドヌクレアーゼ活性を発揮するのに必要な1本鎖DNAの接近を阻害する化合物PFM01および化合物PFM03を開発した.これら阻害剤のエンドヌクレアーゼ活性およびエキソヌクレアーゼ活性に対する特異的な阻害効果をヒトの精製MRE11を用いて検討した結果,X線構造解析の結果と一致し,mirinとPFM39が特異的にMRE11のエキソヌクレアーゼ活性を阻害し,PFM01とPFM03が特異的にMRE11のエンドヌクレアーゼ活性を阻害することが確認された.これらの阻害剤は細胞のレベルでも阻害効果を示すこと,MRN複合体としての機能には影響を及ぼさないこと,さらに,これら阻害剤により相同組換え経路の効率が低下することも確認された.
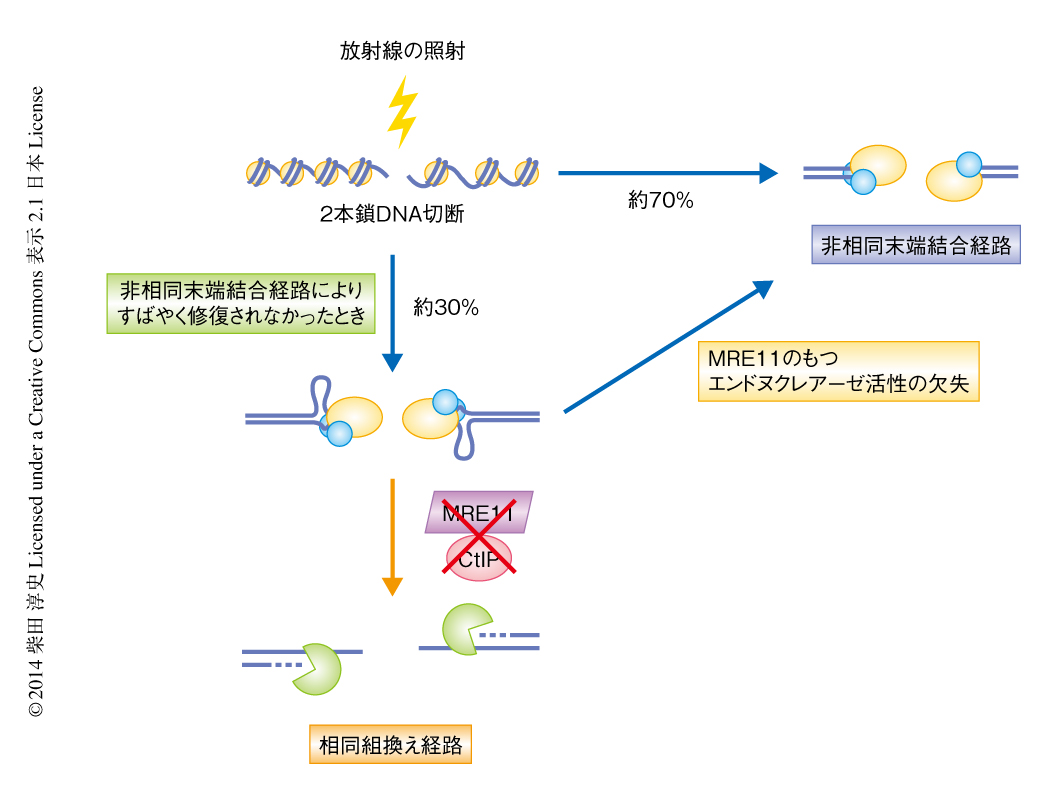
ヒトの細胞において生じた2本鎖DNA切断は,おもに非相同末端結合(nonhomologous end-joining:NHEJ)経路あるいは相同組換え(homologous recombination:HR)経路のいずれかにより修復される.2本鎖DNA切断修復機構は細胞周期により制御されている.G1期では非相同末端結合経路が優位にはたらき,S期およびG2期では非相同末端結合経路および相同組換え経路の両方がはたらく5).筆者らを含めたこれまでの研究により,放射線の照射により生じた2本鎖DNA切断に対しては非相同末端結合経路が第1の選択としてはたらき,2本鎖DNA切断をすみやかに修復することがわかっている6).2本鎖DNA切断の末端の構造の複雑性やクロマチン構造の影響により非相同末端結合経路が停滞した場合には,CtIPに依存的な2本鎖DNA末端の削り込みが開始され,2本鎖DNA切断修復機構は非相同末端結合経路から相同組換え経路へと移行する7).
MRE11のもつエキソヌクレアーゼ活性を阻害すると,相同組換え経路の停滞にともなう2本鎖DNA切断修復機構の欠損が認められた.一方で,非常に興味深いことに,MRE11のもつエンドヌクレアーゼ活性を阻害したときには,相同組換え経路は遮断されているにもかかわらず2本鎖DNA切断修復機構の欠損は認められなかった.CtIPはMRE11のもつヌクレアーゼ活性を活性化することが知られている8).また,筆者らは,CtIPを欠損すると2本鎖DNA切断修復機構は相同組換え経路から非相同末端結合経路へと移行することを見い出している7).そこで,CtIPを欠損したときと同様に,MRE11のもつエンドヌクレアーゼ活性を阻害したときも2本鎖DNA切断修復機構は相同組換え経路から非相同末端結合経路へ移行するとの仮説をたて実験を行った結果,このことが証明された(図1).
相同組換え経路はCtIPに依存的な2本鎖DNA末端の削り込みにより開始される.ここまでの結果から,CtIPおよびMRE11のもつエンドヌクレアーゼ活性により相同組換え経路が開始していたことから,MRE11のエンドヌクレアーゼ活性はエキソヌクレアーゼ活性の機能的な上流においてはたらいているとの仮説をたてた.MRE11のエンドヌクレアーゼ活性およびエキソヌクレアーゼ活性をともに阻害したところ,エンドヌクレアーゼ活性のみを阻害したときと同様に,2本鎖DNA切断修復機構は相同組換え経路から非相同末端結合経路へと移行した.また,同様な結果はMRE11を欠損したATLD細胞においても認められたことから,MRE11のもつエンドヌクレアーゼ活性はエキソヌクレアーゼ活性の上流ではたらくという機能的なヒエラルキーが証明された.
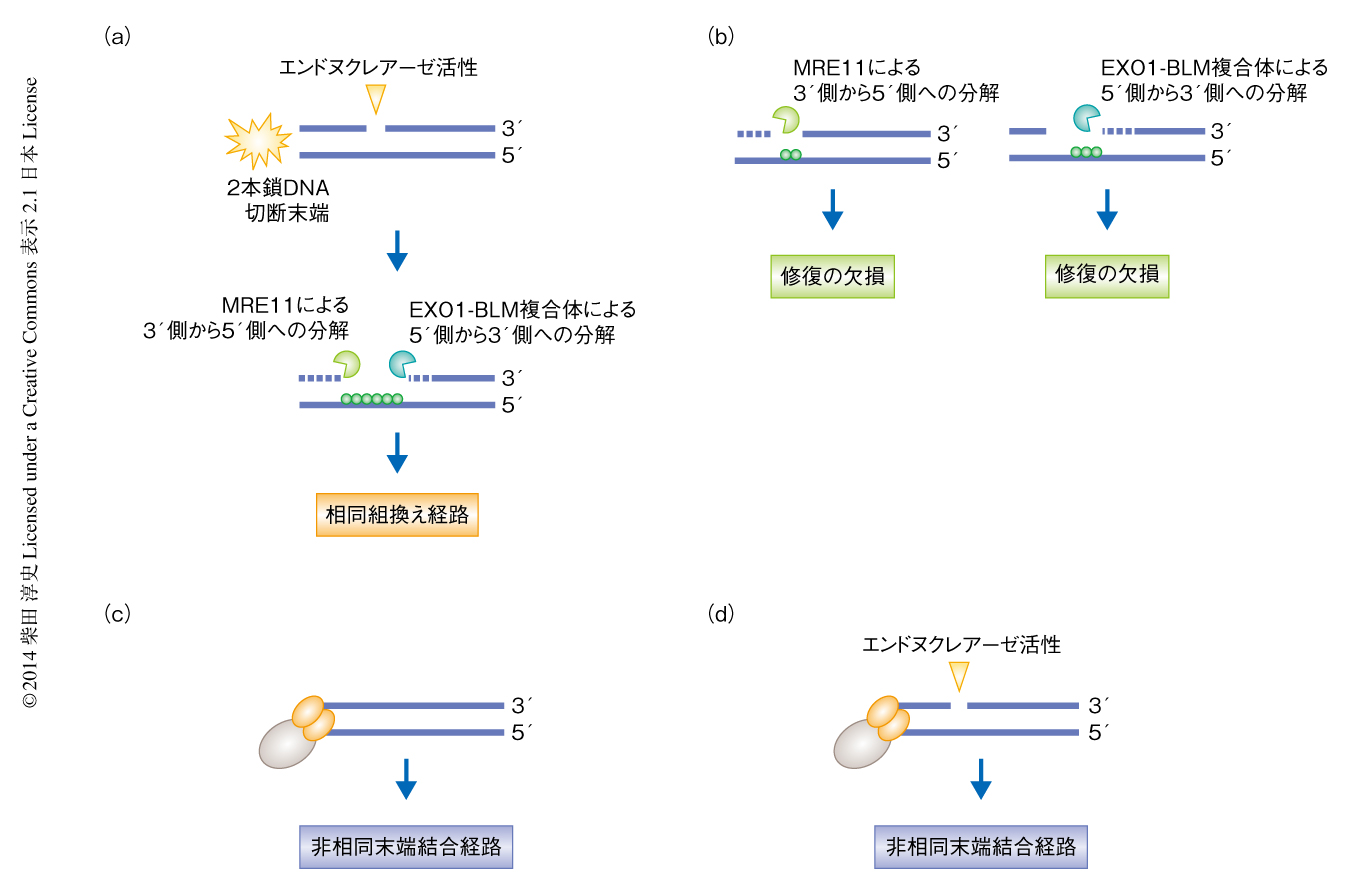
酵母の減数分裂細胞を用いた実験系から,MRE11のもつ3’-5’エキソヌクレアーゼ活性は2本鎖DNA切断の末端の方向へDNAを分解することが報告されている9).一方で,EXO1-BLM複合体はエキソヌクレアーゼ活性により5’側から3’側の方向へDNAを分解する.そこで,MRE11のもつエンドヌクレアーゼ活性が2本鎖DNA切断の近傍にニックを生成したのちに,MRE11のもつエキソヌクレアーゼ活性とEXO1-BLM複合体のエキソヌクレアーゼ活性がともに失われた場合の2本鎖DNA切断修復機構への影響について検討した.その結果,MRE11のエンドヌクレアーゼ活性によりニックが生成したのちにもかかわらず,これら2つのエキソヌクレアーゼ活性が阻害された場合には2本鎖DNA切断修復機構は非相同末端結合経路への移行が可能であることを発見した.相同組換え経路の開始のためMRE11のもつエンドヌクレアーゼ活性により生じたニックは,おそらく,2本鎖DNA切断修復ののち,1本鎖DNA切断修復機構により修復されていると考えられた.
この研究では,2本鎖DNA切断修復機構において,その経路の決定におけるMRE11のもつヌクレアーゼ活性の役割を,新規の特異的な阻害剤の開発およびその活用により明らかにした.これまで,2本鎖DNA末端の削り込みが相同組換え経路の最初のステップであることは示唆されてきたが,2本鎖DNA末端の削り込みの開始機構について多くは明らかになっていなかった.この研究により,2本鎖DNA末端の削り込み反応を開始するMRE11のもつエンドヌクレアーゼ活性によるニックの生成が,2本鎖DNA切断修復機構において非相同末端結合経路から相同組換え経路へと移行させるターニングポイントであることが明らかになった(図2).
2本鎖DNA切断は,放射線,化学療法剤,酸化ストレスなど,さまざまな外来性の要因により生じる.また一方で,免疫の成熟過程のひとつであるV(D)J組換えや減数分裂のときにも生じ,その両方においてMRE11は重要な役割をはたすことが知られている.さらに,MRE11遺伝子は毛細血管拡張性運動失調様疾患の原因遺伝子であることも知られており,MRE11のもつ役割の包括的な理解はこの疾患における原因と症状の因果関係の究明および治療法の開発にも役だつものと考えられる.この研究では,新規のMRE11阻害剤を2本鎖DNA切断修復機構における経路決定の機序の解明のため用いたが,この阻害剤はそのほかの研究領域にも応用が可能であり,2本鎖DNA切断に関連する研究を大きく推進するものと考えている.
略歴:2006年 東京医科歯科大学大学大学院医歯学総合研究科 修了,同年 英国Sussex大学 博士研究員を経て,2013年より群馬大学先端科学研究指導者育成ユニット 助教.
研究テーマ:2本鎖DNA切断修復機構の包括的な理解と生体に対する影響.
抱負:DNA修復研究をリードすることにより医療の発展をめざす.
© 2014 柴田 淳史 Licensed under CC 表示 2.1 日本
(英国Sussex大学Genome Damage and Stability Centre)
email:柴田淳史
DOI: 10.7875/first.author.2014.015
DNA double-strand break repair pathway choice is directed by distinct MRE11 nuclease activities.
Atsushi Shibata, Davide Moiani, Andrew S. Arvai, Jefferson Perry, Shane M. Harding, Marie-Michelle Genois, Ranjan Maity, Sari van Rossum-Fikkert, Aryandi Kertokalio, Filippo Romoli, Amani Ismail, Ermal Ismalaj, Elena Petricci, Matthew J. Neale, Robert G. Bristow, Jean-Yves Masson, Claire Wyman, Penny A. Jeggo, John A. Tainer
Molecular Cell, 53, 7-18 (2014)
この論文に出現する遺伝子・タンパク質のUniprot ID
MRE11(P49959), MRN複合体, EXO1(Q9UQ84), BLM(P54132), RAD50(Q92878), NBS1(O60934), MRN, Mre11(Q9X1X0), CtIP(Q99708)
要 約
MRN複合体の構成タンパク質のひとつであるMRE11は,2本鎖DNA切断修復機構において損傷部位の発見,修復,シグナルの増強にはたらく.一方で,MRE11のもつエンドヌクレアーゼ活性およびエキソヌクレアーゼ活性が,2本鎖DNA切断修復機構における2つの異なる経路,すなわち,非相同末端結合経路および相同組換え経路においてどのように関与しているかについては,いまだ多くは明らかになっていない.筆者らは,X線構造解析をもとにした化合物スクリーニングにより,MRE11のエンドヌクレアーゼ活性あるいはエキソヌクレアーゼ活性に対し特異的な阻害剤を発見した.これらの阻害剤を用い,非相同末端結合経路および相同組換え経路の機能するG2期における2本鎖DNA切断修復機構の経路決定の機序に着目して研究を行った.エンドヌクレアーゼ活性あるいはエキソヌクレアーゼ活性のどちらの活性に特異的な阻害剤を処理した場合にも,相同組換え経路の最初のステップである2本鎖DNA末端の削り込みの低下にともなう相同組換え効率の低下が認められた.一方で,非常に興味深いことに,エンドヌクレアーゼ活性を阻害したときのみ,2本鎖DNA切断修復機構は相同組換え経路から非相同末端結合経路へと移行することが見い出された.以上の研究結果から,MRE11のもつエンドヌクレアーゼ活性が2本鎖DNA切断修復機構を相同組換え経路へと進行させ,その下流において,MRE11のもつエキソヌクレアーゼ活性がEXO1-BLM複合体のエキソヌクレアーゼ活性と協調して,相同組換え経路への移行を決定づけていることが明らかになった.
はじめに
放射線の照射や化学療法剤の処理により誘発される2本鎖DNA切断は,細胞の生死を決定しうる重篤なDNA損傷のひとつである.また,2本鎖DNA切断は免疫の成熟過程のひとつであるV(D)J組換えのときにも生じ,さらには,減数分裂期に遺伝子組換えを誘導する際にも生じる.MRE11はMRE11-RAD50-NBS1(MRN)複合体を形成し,2本鎖DNA切断が生じたのちの修復や損傷シグナルの増強にかかわることが報告されている1).しかしながら,MRE11のもつヌクレアーゼ活性がどのように2本鎖DNA切断修復機構にかかわるかについて多くは明らかになっていない2).その理由として,MRE11は異なる2つのヌクレアーゼ活性をもつことがあげられる.酵母を用いた実験系から,MRE11のもつエキソヌクレアーゼ活性のみを欠失した変異体,および,エキソヌクレアーゼ活性とエンドヌクレアーゼ活性の両方を欠失した変異体は見い出されているが,エンドヌクレアーゼ活性のみを欠失した変異体はみつかっていない2).また,そのほかの要因として,遺伝子操作などによりMRE11を欠損させるとMRN複合体が不安定化するため,単体のMRE11の役割について証明することが困難であったこともあげられる3).
筆者らは,X線構造解析をもとにした化合物スクリーニングにより,MRE11のもつエンドヌクレアーゼ活性あるいはエキソヌクレアーゼ活性に対し特異的な阻害剤を開発した.これらの阻害剤を用いることにより,これまで明らかされていなかったエンドヌクレアーゼ活性およびエキソヌクレアーゼ活性のそれぞれの役割を解析することが可能になった.今回,筆者らは,2本鎖DNA切断が生じてから細胞が死にいたる過程においてもっとも重要とされる,2本鎖DNA切断修復機構における最適な経路決定の機序に着目し研究を行った.その結果,MRE11のもつエンドヌクレアーゼ活性が相同組換えを開始することにより2本鎖DNA切断修復機構を相同組換え経路へと決定づけ,そののち,MRE11のもつエキソヌクレアーゼ活性およびEXO1-BLM複合体のエキソヌクレアーゼ活性が相同組換え経路を促進することを見い出した.
1.MRE11のもつエンドヌクレアーゼ活性あるいはエキソヌクレアーゼ活性に特異的な阻害剤の開発
2008年,MRE11と複合体を形成してMRE11のもつエキソヌクレアーゼ活性を阻害する化合物mirinが発見された4).しかしながら,その阻害の機序は明らかになっていなかった.そこで,ヒトのMRE11と高い相同性もつ超好熱性の真正細菌Thermotoga maritimaのMre11とmirinとの複合体の構造をX線構造解析により明らかにした.mirinはMRE11のエキソヌクレアーゼ活性の活性中心であるHis61(ヒトでは,His63)の近傍に結合していた.また,mirinの水酸基をアミノ基に置換することにより,活性中心により特異的に結合しエキソヌクレアーゼ活性を阻害する化合物PFM39を開発した.また一方で,mirinのN-アルキル化誘導体を作製することにより,MRE11の構造を変化させMRE11がエンドヌクレアーゼ活性を発揮するのに必要な1本鎖DNAの接近を阻害する化合物PFM01および化合物PFM03を開発した.これら阻害剤のエンドヌクレアーゼ活性およびエキソヌクレアーゼ活性に対する特異的な阻害効果をヒトの精製MRE11を用いて検討した結果,X線構造解析の結果と一致し,mirinとPFM39が特異的にMRE11のエキソヌクレアーゼ活性を阻害し,PFM01とPFM03が特異的にMRE11のエンドヌクレアーゼ活性を阻害することが確認された.これらの阻害剤は細胞のレベルでも阻害効果を示すこと,MRN複合体としての機能には影響を及ぼさないこと,さらに,これら阻害剤により相同組換え経路の効率が低下することも確認された.
2.MRE11のエキソヌクレアーゼ活性に対する阻害剤により2本鎖DNA切断修復機構は欠損する
ヒトの細胞において生じた2本鎖DNA切断は,おもに非相同末端結合(nonhomologous end-joining:NHEJ)経路あるいは相同組換え(homologous recombination:HR)経路のいずれかにより修復される.2本鎖DNA切断修復機構は細胞周期により制御されている.G1期では非相同末端結合経路が優位にはたらき,S期およびG2期では非相同末端結合経路および相同組換え経路の両方がはたらく5).筆者らを含めたこれまでの研究により,放射線の照射により生じた2本鎖DNA切断に対しては非相同末端結合経路が第1の選択としてはたらき,2本鎖DNA切断をすみやかに修復することがわかっている6).2本鎖DNA切断の末端の構造の複雑性やクロマチン構造の影響により非相同末端結合経路が停滞した場合には,CtIPに依存的な2本鎖DNA末端の削り込みが開始され,2本鎖DNA切断修復機構は非相同末端結合経路から相同組換え経路へと移行する7).
MRE11のもつエキソヌクレアーゼ活性を阻害すると,相同組換え経路の停滞にともなう2本鎖DNA切断修復機構の欠損が認められた.一方で,非常に興味深いことに,MRE11のもつエンドヌクレアーゼ活性を阻害したときには,相同組換え経路は遮断されているにもかかわらず2本鎖DNA切断修復機構の欠損は認められなかった.CtIPはMRE11のもつヌクレアーゼ活性を活性化することが知られている8).また,筆者らは,CtIPを欠損すると2本鎖DNA切断修復機構は相同組換え経路から非相同末端結合経路へと移行することを見い出している7).そこで,CtIPを欠損したときと同様に,MRE11のもつエンドヌクレアーゼ活性を阻害したときも2本鎖DNA切断修復機構は相同組換え経路から非相同末端結合経路へ移行するとの仮説をたて実験を行った結果,このことが証明された(図1).
3.MRE11のもつエンドヌクレアーゼ活性が2本鎖DNA末端の削り込みを開始することが2本鎖DNA切断修復機構を相同組換え経路へと方向づける
相同組換え経路はCtIPに依存的な2本鎖DNA末端の削り込みにより開始される.ここまでの結果から,CtIPおよびMRE11のもつエンドヌクレアーゼ活性により相同組換え経路が開始していたことから,MRE11のエンドヌクレアーゼ活性はエキソヌクレアーゼ活性の機能的な上流においてはたらいているとの仮説をたてた.MRE11のエンドヌクレアーゼ活性およびエキソヌクレアーゼ活性をともに阻害したところ,エンドヌクレアーゼ活性のみを阻害したときと同様に,2本鎖DNA切断修復機構は相同組換え経路から非相同末端結合経路へと移行した.また,同様な結果はMRE11を欠損したATLD細胞においても認められたことから,MRE11のもつエンドヌクレアーゼ活性はエキソヌクレアーゼ活性の上流ではたらくという機能的なヒエラルキーが証明された.
4.MRE11のもつエキソヌクレアーゼ活性とEXO1-BLM複合体のエキソヌクレアーゼ活性をともに失活させると2本鎖DNA切断修復機構は非相同末端結合経路へと移行する
酵母の減数分裂細胞を用いた実験系から,MRE11のもつ3’-5’エキソヌクレアーゼ活性は2本鎖DNA切断の末端の方向へDNAを分解することが報告されている9).一方で,EXO1-BLM複合体はエキソヌクレアーゼ活性により5’側から3’側の方向へDNAを分解する.そこで,MRE11のもつエンドヌクレアーゼ活性が2本鎖DNA切断の近傍にニックを生成したのちに,MRE11のもつエキソヌクレアーゼ活性とEXO1-BLM複合体のエキソヌクレアーゼ活性がともに失われた場合の2本鎖DNA切断修復機構への影響について検討した.その結果,MRE11のエンドヌクレアーゼ活性によりニックが生成したのちにもかかわらず,これら2つのエキソヌクレアーゼ活性が阻害された場合には2本鎖DNA切断修復機構は非相同末端結合経路への移行が可能であることを発見した.相同組換え経路の開始のためMRE11のもつエンドヌクレアーゼ活性により生じたニックは,おそらく,2本鎖DNA切断修復ののち,1本鎖DNA切断修復機構により修復されていると考えられた.
おわりに
この研究では,2本鎖DNA切断修復機構において,その経路の決定におけるMRE11のもつヌクレアーゼ活性の役割を,新規の特異的な阻害剤の開発およびその活用により明らかにした.これまで,2本鎖DNA末端の削り込みが相同組換え経路の最初のステップであることは示唆されてきたが,2本鎖DNA末端の削り込みの開始機構について多くは明らかになっていなかった.この研究により,2本鎖DNA末端の削り込み反応を開始するMRE11のもつエンドヌクレアーゼ活性によるニックの生成が,2本鎖DNA切断修復機構において非相同末端結合経路から相同組換え経路へと移行させるターニングポイントであることが明らかになった(図2).
2本鎖DNA切断は,放射線,化学療法剤,酸化ストレスなど,さまざまな外来性の要因により生じる.また一方で,免疫の成熟過程のひとつであるV(D)J組換えや減数分裂のときにも生じ,その両方においてMRE11は重要な役割をはたすことが知られている.さらに,MRE11遺伝子は毛細血管拡張性運動失調様疾患の原因遺伝子であることも知られており,MRE11のもつ役割の包括的な理解はこの疾患における原因と症状の因果関係の究明および治療法の開発にも役だつものと考えられる.この研究では,新規のMRE11阻害剤を2本鎖DNA切断修復機構における経路決定の機序の解明のため用いたが,この阻害剤はそのほかの研究領域にも応用が可能であり,2本鎖DNA切断に関連する研究を大きく推進するものと考えている.
文 献
- Stracker, T. H. & Petrini, J. H.: The MRE11 complex: starting from the ends. Nat. Rev. Mol. Cell Biol., 12, 90-103 (2011)[PubMed]
- Symington, L. S. & Gautier, J.: Double-strand break end resection and repair pathway choice. Annu. Rev. Genet., 45, 247-271 (2011)[PubMed]
- Uziel, T., Lerenthal, Y., Moyal, L. et al.: Requirement of the MRN complex for ATM activation by DNA damage. EMBO J., 22, 5612-5621 (2003)[PubMed]
- Dupre, A., Boyer-Chatenet, L., Sattler, R. M. et al.: A forward chemical genetic screen reveals an inhibitor of the Mre11-Rad50-Nbs1 complex. Nat. Chem. Biol., 4, 119-125 (2008)[PubMed]
- Rothkamm, K., Kruger, I., Thompson, L. H. et al.: Pathways of DNA double-strand break repair during the mammalian cell cycle. Mol. Cell. Biol., 23, 5706-5715 (2003)[PubMed]
- Beucher, A., Birraux, J., Tchouandong, L. et al.: ATM and Artemis promote homologous recombination of radiation-induced DNA double-strand breaks in G2. EMBO J., 28, 3413-3427 (2009)[PubMed]
- Shibata, A., Conrad, S., Birraux, J. et al.: Factors determining DNA double-strand break repair pathway choice in G2 phase. EMBO J., 30, 1079-1092 (2011)[PubMed]
- Huertas, P. & Jackson, S. P.: Human CtIP mediates cell cycle control of DNA end resection and double strand break repair. J. Biol. Chem., 284, 9558-9565 (2009)[PubMed]
- Garcia, V., Phelps, S. E., Gray, S. et al.: Bidirectional resection of DNA double-strand breaks by Mre11 and Exo1. Nature, 479, 241-244 (2011)[PubMed]
著者プロフィール
略歴:2006年 東京医科歯科大学大学大学院医歯学総合研究科 修了,同年 英国Sussex大学 博士研究員を経て,2013年より群馬大学先端科学研究指導者育成ユニット 助教.
研究テーマ:2本鎖DNA切断修復機構の包括的な理解と生体に対する影響.
抱負:DNA修復研究をリードすることにより医療の発展をめざす.
© 2014 柴田 淳史 Licensed under CC 表示 2.1 日本