関節リウマチに対する新たなゲノム創薬の手法
岡田 随象
(東京医科歯科大学大学院医歯学総合研究科 疾患多様性遺伝学分野)
email:岡田随象
DOI: 10.7875/first.author.2014.014
Genetics of rheumatoid arthritis contributes to biology and drug discovery.
Yukinori Okada, Di Wu, Gosia Trynka, Towfique Raj, Chikashi Terao, Katsunori Ikari, Yuta Kochi, Koichiro Ohmura, Akari Suzuki, Shinji Yoshida, Robert R. Graham, Arun Manoharan, Ward Ortmann, Tushar Bhangale, Joshua C. Denny, Robert J. Carroll, Anne E. Eyler, Jeffrey D. Greenberg, Joel M. Kremer, Dimitrios A. Pappas, Lei Jiang, Jian Yin, Lingying Ye, Ding-Feng Su, Jian Yang, Gang Xie, Ed Keystone, Harm-Jan Westra, Tõnu Esko, Andres Metspalu, Xuezhong Zhou, Namrata Gupta, Daniel Mirel, Eli A. Stahl, Dorothée Diogo, Jing Cui, Katherine Liao, Michael H. Guo, Keiko Myouzen, Takahisa Kawaguchi, Marieke J. H. Coenen, Piet L. C. M. van Riel, Mart A. F. J. van de Laar, Henk-Jan Guchelaar, Tom W. J. Huizinga, Philippe Dieudé, Xavier Mariette, S. Louis Bridges Jr, Alexandra Zhernakova, Rene E. M. Toes, Paul P. Tak, Corinne Miceli-Richard, So-Young Bang, Hye-Soon Lee, Javier Martin, Miguel A. Gonzalez-Gay, Luis Rodriguez-Rodriguez, Solbritt Rantapää-Dahlqvist, Lisbeth Ärlestig, Hyon K. Choi, Yoichiro Kamatani, Pilar Galan, Mark Lathrop, Steve Eyre, John Bowes, Anne Barton, Niek de Vries, Larry W. Moreland, Lindsey A. Criswell, Elizabeth W. Karlson, Atsuo Taniguchi, Ryo Yamada, Michiaki Kubo, Jun S. Liu, Sang-Cheol Bae, Jane Worthington, Leonid Padyukov, Lars Klareskog, Peter K. Gregersen, Soumya Raychaudhuri, Barbara E. Stranger, Philip L. De Jager, Lude Franke, Peter M. Visscher, Matthew A. Brown, Hisashi Yamanaka, Tsuneyo Mimori, Atsushi Takahashi, Huji Xu, Timothy W. Behrens, Katherine A. Siminovitch, Shigeki Momohara, Fumihiko Matsuda, Kazuhiko Yamamoto, Robert M. Plenge
Nature, 506, 376-381 (2014)
ゲノムワイド関連解析はヒトの疾患において感受性遺伝子を同定する代表的な手法である.しかしながら,得られた感受性遺伝子を疾患病態の解明や新規の創薬にどう結びつければよいのか,答えは得られていなかった.筆者らは,関節リウマチに対しアジア人および欧米人を含む10万人以上を対象とした大規模なゲノムワイド関連解析を実施し,新たに発見した42の領域を含む,計101の感受性遺伝子の領域を同定した.さまざまなデータベースとの統合を網羅的に行う遺伝統計解析により,これらの領域が遺伝子発現量の制御能や細胞に特異的なヒストン修飾能をもつこと,原発性免疫不全症候群および血液細胞に由来する悪性腫瘍に対する感受性遺伝子と有意に重複することが明らかになった.さらに,関節リウマチ感受性遺伝子と既存の関節リウマチ治療薬の標的遺伝子とがネットワークを形成していることが判明した.また,ほかの疾患に対する既存の薬物の標的遺伝子が関節リウマチ感受性遺伝子と重複している場合,その治療薬を関節リウマチの治療に対し適応できる可能性が示唆された.これらの知見は,ゲノム解析の活用が病態解明や新規の創薬の実現において有用であることを示すと考えられた.
ゲノムワイド関連解析(genome-wide association study:GWAS)は,ヒトの疾患において感受性遺伝子を同定する代表的な手法である.ヒトのゲノムを網羅した数百万~1000万の1塩基多型(single nucleotide polymorphism:SNP)を対象として,数百人~数万人の対象群における疾患との因果関係を統計解析により評価する.GWASは2002年に世界ではじめて,わが国の理化学研究所において実施され1),以後,世界中で精力的に実施されている.2012年までに,300以上のヒトの形質に対し1000以上のGWASの実施例が報告されている2).
関節リウマチは関節の炎症と破壊をもたらす自己免疫疾患で,わが国における患者数は約70~80万人と推定されている.関節リウマチの発症リスクの約半分は遺伝的な背景の影響によるものと考えられており,これまでに実施されたGWASにより関節リウマチの発症に関与する多数の感受性遺伝子の領域が同定されてきた3,4).筆者らは,これらGWASの結果を横断的に比較することにより,関節リウマチの遺伝的なリスクは異なる人種のあいだで共有されていることを見い出し,複数の人種を対象としたGWASにより,さらに多くの感受性遺伝子の領域が同定されると提唱していた3).
しかし,このようにGWASにより多数の疾患感受性遺伝子が同定される一方,得られた感受性遺伝子から疾患の病態解明や新規の創薬に役だつ情報をどうひき出せばよいのかという根本的な課題については,具体的な成果が得られない状態がつづいていた.
これまで別個に実施されていたGWASを統合するため,米国Harvard大学およびわが国のGARNETコンソーシアム(理化学研究所,東京大学,京都大学,東京女子医科大学)が中心となり国際共同研究グループを結成した.欧米人の集団およびアジア人の集団を対象として,世界中から関節リウマチに対する22のGWASのデータを集め,10万人以上を対象とした大規模なGWASを実施した.1000 Genomes Project 5) により同定された約1000万のSNPに対する関連解析を実施した結果,新たに発見された42の領域を含む,計101の感受性遺伝子の領域を同定した.これらの領域に含まれる関節リウマチ感受性SNPは,アレル頻度およびオッズ比において欧米人集団およびアジア人集団のあいだで有意な正の相関関係を示し,関節リウマチの発症の遺伝的な背景が人種間で共有されているという筆者らの仮説を裏づける結果となった.
同定された101個の関節リウマチ感受性SNPにつき,近傍に位置する遺伝子にあたえる影響について機能的な分類を行ったところ,16%のSNPはタンパク質のアミノ酸配列を変化させるミスセンスSNPであることが判明した.欧米人の一般の集団から得られた,末梢血液に由来する単核球,CD4陽性T細胞,CD14陽性CD16陰性単核球におけるmRNAの発現データ6) と照合した結果,44%のSNPは近傍に位置する遺伝子のmRNAの発現量に影響をあたえるSNP(expression quantitative trait locus SNP:eQTL SNP)であることが判明した.以上より,関節リウマチ感受性SNPはタンパク質の配列の変化や遺伝子の発現量の変化を介して関節リウマチの発症に寄与している可能性が示された.
細胞の機能を制御する機構のひとつとして,ヒストン修飾などのエピゲノム修飾機構がある.エピゲノム修飾の状態は細胞や組織により異なるため,細胞あるいは組織の特異性の理解において重要と考えられている.関節リウマチ感受性SNPと,National Institutes of Health Roadmap Epigenetics Mapping Project 7) により得られた34の細胞種におけるヒストン修飾能との重なりについて検討した結果,制御性T細胞において遺伝子のプロモーター領域への転写因子の結合を制御するヒストンH3の4番目のLysのトリメチル化能ともっとも強い重複が認められた.制御性T細胞は抑制的な制御(免疫寛容)をつかさどり,関節リウマチをはじめとする自己免疫疾患の発症に関与していることが示唆されてきたが,これまでの報告はマウスのモデルにもとづくものが多かった.今回の結果は,ヒトの自己免疫疾患の病態に対する制御性T細胞の関与を客観的に裏づけるものと考えられた.
ひとつの遺伝子多型が複数の形質に影響をあたえることを多面的関連(pleiotropy)といい,実際に,GWASにより同定された感受性遺伝子の領域の多くが異なる疾患のあいだで共有されていることが知られていた2).今回,得られた結果と既存のGWASの結果とを照合した結果,約2/3の関節リウマチ感受性SNPは多面的関連を示すことが明らかになった.1型糖尿病,炎症性腸疾患,全身性エリテマトーデスなどほかの自己免疫疾患にくわえ,ぜんそく,円形脱毛症,尋常性白斑,原発性胆汁性肝硬変といった疾患,臨床検査の項目である白血球分画(好中球,好塩基球)や炎症マーカー(C反応性タンパク質,フィブリノーゲン)の個人差との多面的関連が明らかになった.
原発性免疫不全症候群(human primary immunodeficiency disease:PID)は,遺伝的な要因により先天的に免疫機構が正常にはたらかないため生じる免疫疾患の総称である.おもに家系例の解析により,これまでに多数の感受性遺伝子が同定されている.原発性免疫不全症候群の感受性遺伝子についてのデータベースと照合した結果,関節リウマチと原発性免疫不全症候群とで感受性遺伝子の一部が重複していることが明らかになった.原発性免疫不全症候群における疾患分類との層別化解析を行った結果,獲得免疫に関連した原発性免疫不全症候群においては関節リウマチと重複した感受性遺伝子が認められた一方,自然免疫に関連したものにおいては認められず,これは,関節リウマチの病態における獲得免疫および自然免疫の相対的な役割を示唆する結果とも考えられた.
同様に,各種の悪性腫瘍細胞において同定された体細胞遺伝子変異についてのデータベースとの照合を行った.興味深いことに,白血病やリンパ腫など血液細胞に由来する悪性腫瘍において関節リウマチとの有意な感受性遺伝子の重複が認められた一方で,固形がんあるいは臓器がんなど血液細胞に由来しない悪性腫瘍においては有意な重複が認められなかった.血液細胞に由来する悪性腫瘍のなかでは,とくにリンパ腫との重複がもっとも多く認められた.関節リウマチとリンパ腫は,ほかの疾患との組合せと比較して,疫学的な合併率が高いことや有効な治療薬が共通していることが知られており.この結果は,関節リウマチとリンパ腫とのあいだに共通した病態が存在することを示唆するものと考えられた.
ノックアウトマウスは特定の遺伝子の機能を欠失させたマウスであり,ノックアウトマウスにおける表現型を観察することにより,その遺伝子の生物学的な機能を評価することができる.関節リウマチの感受性遺伝子をノックアウトしたマウスにおいて認められる表現型をデータベースから網羅的に検索した結果,血液細胞や免疫細胞に関与した表現型が認められた.一方で,体の大きさ,感覚系,神経系に対応した表現型との関連は見い出されなかった.
GWASの結果からどの生物学的なパスウェイに属する遺伝子においてより有意な疾患感受性が認められるかを評価する手法があり,パスウェイ解析とよばれている8).今回,得られた結果を対象にパスウェイ解析を実施したところ,関節リウマチの病態においてもっとも重要なT細胞パスウェイにくわえ,B細胞パスウェイ,インターロイキン10,インターフェロン,顆粒球単球コロニー刺激因子など複数のサイトカインシグナルのパスウェイが同定された.同様の解析を,以前に報告された関節リウマチに対する対象数の少ないGWASの結果4) に対し実施したところ,T細胞パスウェイのみが同定された.このことは,今後,GWASの対象数が増加しより多くの疾患感受性遺伝子が同定されるにともない,より多くの生物学的なパスウェイが明らかになることを示すと考えられた.
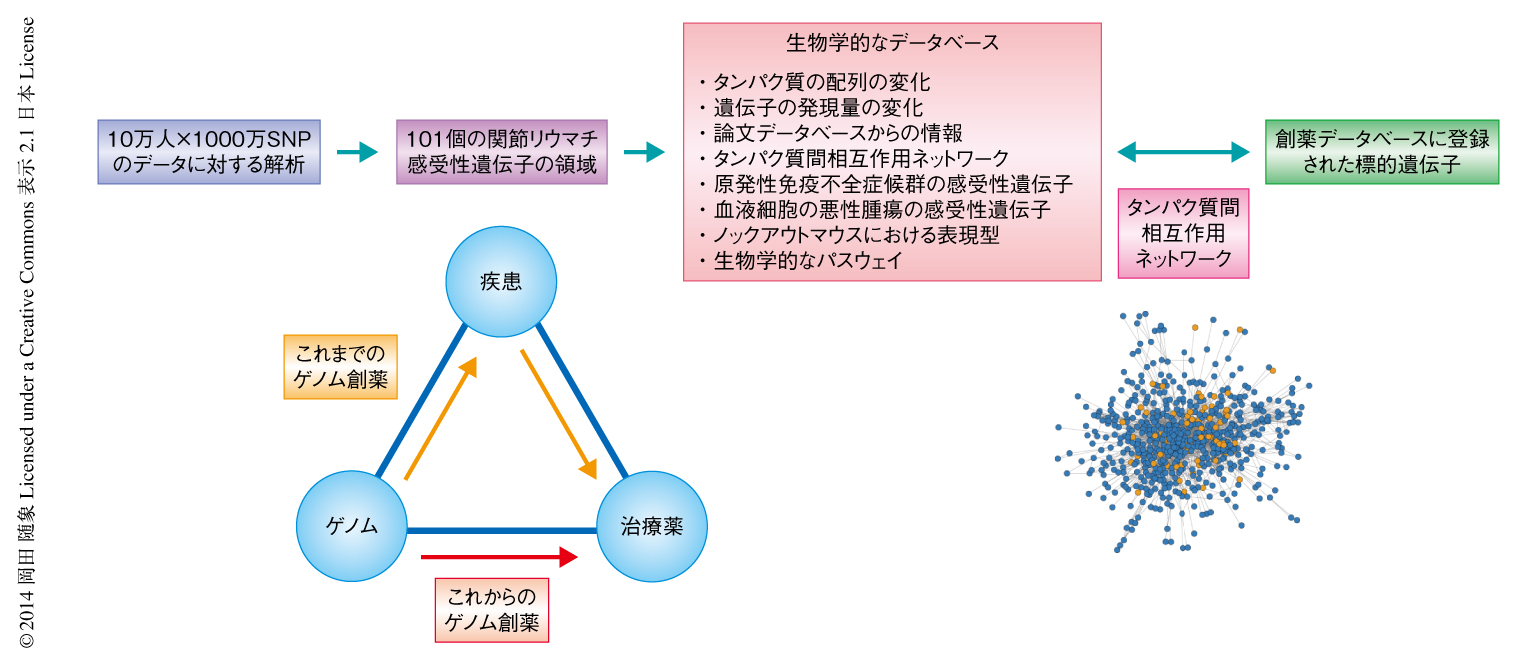
今回の研究により得られた関節リウマチ感受性遺伝子と,そこから見い出された疾患病態を用いて,新しいゲノム創薬の手法を開発した(図1).まず,101の関節リウマチ感受性遺伝子の領域に含まれる377の遺伝子から,つぎの8つの基準を用いて疾患病態に寄与すると考えられる98の遺伝子を絞り込んだ.1)タンパク質の配列の変化,2)遺伝子の発現量の変化,3)論文データベースからの情報9),4)タンパク質間相互作用ネットワーク10),5)原発性免疫不全症候群の感受性遺伝子,6)血液細胞に由来する悪性腫瘍の感受性遺伝子,7)ノックアウトマウスにおいて有意な関連が認められた表現型,8)同定された生物学的なパスウェイ.つぎに,創薬データベースに登録されている,ヒトのさまざまな疾患に対する既存(もしくは,臨床治験中)の治療薬とその標的遺伝子の情報を整理し,GWASにより得られた疾患の感受性遺伝子とのつながりについて検討した.
その結果,関節リウマチの感受性遺伝子はタンパク質間相互作用を介して関節リウマチ治療薬の標的遺伝子とネットワークを形成していることが明らかになった(図2).このネットワークには,エタネルセプト,トシリズマブなど生物学的製剤,スルファサラジン,イグラチモドなど疾患修飾性抗リウマチ薬,経口ステロイド,という関節リウマチ治療薬の3つの重要なカテゴリーがすべて含まれていた.疾患に対する感受性遺伝子と治療薬とのつながりを網羅的に示したのは,この研究がはじめての報告となった.
関節リウマチの感受性遺伝子と既存の関節リウマチ治療薬の標的遺伝子とのあいだにつながりが認められたことは,逆に,ほかの疾患に対する既存の治療薬のなかで関節リウマチの感受性遺伝子を標的としているものを,関節リウマチの治療に適応できる可能性を示すと考えられた.そして実際に,現在,乳がんなどの治療に用いられているCDK4/CDK6阻害薬が,関節リウマチの感受性遺伝子であるCDK4遺伝子およびCDK6遺伝子を標的としていることを見い出した(図2).CDK4/CDK6阻害薬は関節リウマチのマウスモデルにおいて関節炎の改善に有効であることが報告されており11),新たな関節リウマチ治療薬の候補として有力であると考えられた.
GWASがはじめて実施されてから10年たち,科学者の夢であった疾患感受性遺伝子の同定が現実のものとなった反面,得られた結果の活用については課題が残されたままであった.この研究は,大規模なGWASの結果を,さまざまなデータベースと統合した遺伝統計解析により,疾患病態の解明や新規の創薬に役だてることが可能であることを明らかにした.とくに,ゲノム情報を創薬に活用する“ゲノム創薬”においてもGWASの結果の活用が有用であることが示されたのは,今後の創薬において大きな意義をもつものと考えられる.
この研究の対象となった関節リウマチについては,近年,治療法の飛躍的な進歩をとげている一方で,既存の治療薬では十分な効果の得られない場合や重篤な副作用を生じる場合が知られている.この研究により同定された感受性遺伝子を検討することにより,より効果的で副作用の少ない新たな治療薬の開発が期待される.また,今回,開発されたゲノム創薬の手法をほかの疾患にも適用することにより,さまざまな疾患に対する創薬が加速することも期待される.
略歴:2011年 東京大学大学院医学系研究科 修了,同年 同 研究員,2012年 米国Harvard大学 研究員を経て,2013年より東京医科歯科大学大学院医歯学総合研究科 講師.
研究テーマ:遺伝統計解析をつうじたヒトの疾患の病態解明やゲノム創薬への貢献.
抱負:遺伝統計学の楽しさを日本中に広めたい.
© 2014 岡田 随象 Licensed under CC 表示 2.1 日本
(東京医科歯科大学大学院医歯学総合研究科 疾患多様性遺伝学分野)
email:岡田随象
DOI: 10.7875/first.author.2014.014
Genetics of rheumatoid arthritis contributes to biology and drug discovery.
Yukinori Okada, Di Wu, Gosia Trynka, Towfique Raj, Chikashi Terao, Katsunori Ikari, Yuta Kochi, Koichiro Ohmura, Akari Suzuki, Shinji Yoshida, Robert R. Graham, Arun Manoharan, Ward Ortmann, Tushar Bhangale, Joshua C. Denny, Robert J. Carroll, Anne E. Eyler, Jeffrey D. Greenberg, Joel M. Kremer, Dimitrios A. Pappas, Lei Jiang, Jian Yin, Lingying Ye, Ding-Feng Su, Jian Yang, Gang Xie, Ed Keystone, Harm-Jan Westra, Tõnu Esko, Andres Metspalu, Xuezhong Zhou, Namrata Gupta, Daniel Mirel, Eli A. Stahl, Dorothée Diogo, Jing Cui, Katherine Liao, Michael H. Guo, Keiko Myouzen, Takahisa Kawaguchi, Marieke J. H. Coenen, Piet L. C. M. van Riel, Mart A. F. J. van de Laar, Henk-Jan Guchelaar, Tom W. J. Huizinga, Philippe Dieudé, Xavier Mariette, S. Louis Bridges Jr, Alexandra Zhernakova, Rene E. M. Toes, Paul P. Tak, Corinne Miceli-Richard, So-Young Bang, Hye-Soon Lee, Javier Martin, Miguel A. Gonzalez-Gay, Luis Rodriguez-Rodriguez, Solbritt Rantapää-Dahlqvist, Lisbeth Ärlestig, Hyon K. Choi, Yoichiro Kamatani, Pilar Galan, Mark Lathrop, Steve Eyre, John Bowes, Anne Barton, Niek de Vries, Larry W. Moreland, Lindsey A. Criswell, Elizabeth W. Karlson, Atsuo Taniguchi, Ryo Yamada, Michiaki Kubo, Jun S. Liu, Sang-Cheol Bae, Jane Worthington, Leonid Padyukov, Lars Klareskog, Peter K. Gregersen, Soumya Raychaudhuri, Barbara E. Stranger, Philip L. De Jager, Lude Franke, Peter M. Visscher, Matthew A. Brown, Hisashi Yamanaka, Tsuneyo Mimori, Atsushi Takahashi, Huji Xu, Timothy W. Behrens, Katherine A. Siminovitch, Shigeki Momohara, Fumihiko Matsuda, Kazuhiko Yamamoto, Robert M. Plenge
Nature, 506, 376-381 (2014)
要 約
ゲノムワイド関連解析はヒトの疾患において感受性遺伝子を同定する代表的な手法である.しかしながら,得られた感受性遺伝子を疾患病態の解明や新規の創薬にどう結びつければよいのか,答えは得られていなかった.筆者らは,関節リウマチに対しアジア人および欧米人を含む10万人以上を対象とした大規模なゲノムワイド関連解析を実施し,新たに発見した42の領域を含む,計101の感受性遺伝子の領域を同定した.さまざまなデータベースとの統合を網羅的に行う遺伝統計解析により,これらの領域が遺伝子発現量の制御能や細胞に特異的なヒストン修飾能をもつこと,原発性免疫不全症候群および血液細胞に由来する悪性腫瘍に対する感受性遺伝子と有意に重複することが明らかになった.さらに,関節リウマチ感受性遺伝子と既存の関節リウマチ治療薬の標的遺伝子とがネットワークを形成していることが判明した.また,ほかの疾患に対する既存の薬物の標的遺伝子が関節リウマチ感受性遺伝子と重複している場合,その治療薬を関節リウマチの治療に対し適応できる可能性が示唆された.これらの知見は,ゲノム解析の活用が病態解明や新規の創薬の実現において有用であることを示すと考えられた.
はじめに
ゲノムワイド関連解析(genome-wide association study:GWAS)は,ヒトの疾患において感受性遺伝子を同定する代表的な手法である.ヒトのゲノムを網羅した数百万~1000万の1塩基多型(single nucleotide polymorphism:SNP)を対象として,数百人~数万人の対象群における疾患との因果関係を統計解析により評価する.GWASは2002年に世界ではじめて,わが国の理化学研究所において実施され1),以後,世界中で精力的に実施されている.2012年までに,300以上のヒトの形質に対し1000以上のGWASの実施例が報告されている2).
関節リウマチは関節の炎症と破壊をもたらす自己免疫疾患で,わが国における患者数は約70~80万人と推定されている.関節リウマチの発症リスクの約半分は遺伝的な背景の影響によるものと考えられており,これまでに実施されたGWASにより関節リウマチの発症に関与する多数の感受性遺伝子の領域が同定されてきた3,4).筆者らは,これらGWASの結果を横断的に比較することにより,関節リウマチの遺伝的なリスクは異なる人種のあいだで共有されていることを見い出し,複数の人種を対象としたGWASにより,さらに多くの感受性遺伝子の領域が同定されると提唱していた3).
しかし,このようにGWASにより多数の疾患感受性遺伝子が同定される一方,得られた感受性遺伝子から疾患の病態解明や新規の創薬に役だつ情報をどうひき出せばよいのかという根本的な課題については,具体的な成果が得られない状態がつづいていた.
1.国際共同研究グループによる関節リウマチに対する大規模なゲノムワイド関連解析の実施
これまで別個に実施されていたGWASを統合するため,米国Harvard大学およびわが国のGARNETコンソーシアム(理化学研究所,東京大学,京都大学,東京女子医科大学)が中心となり国際共同研究グループを結成した.欧米人の集団およびアジア人の集団を対象として,世界中から関節リウマチに対する22のGWASのデータを集め,10万人以上を対象とした大規模なGWASを実施した.1000 Genomes Project 5) により同定された約1000万のSNPに対する関連解析を実施した結果,新たに発見された42の領域を含む,計101の感受性遺伝子の領域を同定した.これらの領域に含まれる関節リウマチ感受性SNPは,アレル頻度およびオッズ比において欧米人集団およびアジア人集団のあいだで有意な正の相関関係を示し,関節リウマチの発症の遺伝的な背景が人種間で共有されているという筆者らの仮説を裏づける結果となった.
2.関節リウマチ感受性SNPのタンパク質の配列および遺伝子の発現量への影響
同定された101個の関節リウマチ感受性SNPにつき,近傍に位置する遺伝子にあたえる影響について機能的な分類を行ったところ,16%のSNPはタンパク質のアミノ酸配列を変化させるミスセンスSNPであることが判明した.欧米人の一般の集団から得られた,末梢血液に由来する単核球,CD4陽性T細胞,CD14陽性CD16陰性単核球におけるmRNAの発現データ6) と照合した結果,44%のSNPは近傍に位置する遺伝子のmRNAの発現量に影響をあたえるSNP(expression quantitative trait locus SNP:eQTL SNP)であることが判明した.以上より,関節リウマチ感受性SNPはタンパク質の配列の変化や遺伝子の発現量の変化を介して関節リウマチの発症に寄与している可能性が示された.
3.関節リウマチ感受性SNPと細胞に特異的なヒストン修飾能との重複
細胞の機能を制御する機構のひとつとして,ヒストン修飾などのエピゲノム修飾機構がある.エピゲノム修飾の状態は細胞や組織により異なるため,細胞あるいは組織の特異性の理解において重要と考えられている.関節リウマチ感受性SNPと,National Institutes of Health Roadmap Epigenetics Mapping Project 7) により得られた34の細胞種におけるヒストン修飾能との重なりについて検討した結果,制御性T細胞において遺伝子のプロモーター領域への転写因子の結合を制御するヒストンH3の4番目のLysのトリメチル化能ともっとも強い重複が認められた.制御性T細胞は抑制的な制御(免疫寛容)をつかさどり,関節リウマチをはじめとする自己免疫疾患の発症に関与していることが示唆されてきたが,これまでの報告はマウスのモデルにもとづくものが多かった.今回の結果は,ヒトの自己免疫疾患の病態に対する制御性T細胞の関与を客観的に裏づけるものと考えられた.
4.関節リウマチ感受性SNPはほかの疾患とも関連する
ひとつの遺伝子多型が複数の形質に影響をあたえることを多面的関連(pleiotropy)といい,実際に,GWASにより同定された感受性遺伝子の領域の多くが異なる疾患のあいだで共有されていることが知られていた2).今回,得られた結果と既存のGWASの結果とを照合した結果,約2/3の関節リウマチ感受性SNPは多面的関連を示すことが明らかになった.1型糖尿病,炎症性腸疾患,全身性エリテマトーデスなどほかの自己免疫疾患にくわえ,ぜんそく,円形脱毛症,尋常性白斑,原発性胆汁性肝硬変といった疾患,臨床検査の項目である白血球分画(好中球,好塩基球)や炎症マーカー(C反応性タンパク質,フィブリノーゲン)の個人差との多面的関連が明らかになった.
5.関節リウマチと原発性免疫不全症候群とで感受性遺伝子が共通する
原発性免疫不全症候群(human primary immunodeficiency disease:PID)は,遺伝的な要因により先天的に免疫機構が正常にはたらかないため生じる免疫疾患の総称である.おもに家系例の解析により,これまでに多数の感受性遺伝子が同定されている.原発性免疫不全症候群の感受性遺伝子についてのデータベースと照合した結果,関節リウマチと原発性免疫不全症候群とで感受性遺伝子の一部が重複していることが明らかになった.原発性免疫不全症候群における疾患分類との層別化解析を行った結果,獲得免疫に関連した原発性免疫不全症候群においては関節リウマチと重複した感受性遺伝子が認められた一方,自然免疫に関連したものにおいては認められず,これは,関節リウマチの病態における獲得免疫および自然免疫の相対的な役割を示唆する結果とも考えられた.
6.関節リウマチと血液細胞に由来する悪性腫瘍とで感受性遺伝子が共通する
同様に,各種の悪性腫瘍細胞において同定された体細胞遺伝子変異についてのデータベースとの照合を行った.興味深いことに,白血病やリンパ腫など血液細胞に由来する悪性腫瘍において関節リウマチとの有意な感受性遺伝子の重複が認められた一方で,固形がんあるいは臓器がんなど血液細胞に由来しない悪性腫瘍においては有意な重複が認められなかった.血液細胞に由来する悪性腫瘍のなかでは,とくにリンパ腫との重複がもっとも多く認められた.関節リウマチとリンパ腫は,ほかの疾患との組合せと比較して,疫学的な合併率が高いことや有効な治療薬が共通していることが知られており.この結果は,関節リウマチとリンパ腫とのあいだに共通した病態が存在することを示唆するものと考えられた.
7.関節リウマチ感受性遺伝子にみられるノックアウトマウスの表現型
ノックアウトマウスは特定の遺伝子の機能を欠失させたマウスであり,ノックアウトマウスにおける表現型を観察することにより,その遺伝子の生物学的な機能を評価することができる.関節リウマチの感受性遺伝子をノックアウトしたマウスにおいて認められる表現型をデータベースから網羅的に検索した結果,血液細胞や免疫細胞に関与した表現型が認められた.一方で,体の大きさ,感覚系,神経系に対応した表現型との関連は見い出されなかった.
8.関節リウマチに対するゲノムワイド関連解析より得られた生物学的なパスウェイ
GWASの結果からどの生物学的なパスウェイに属する遺伝子においてより有意な疾患感受性が認められるかを評価する手法があり,パスウェイ解析とよばれている8).今回,得られた結果を対象にパスウェイ解析を実施したところ,関節リウマチの病態においてもっとも重要なT細胞パスウェイにくわえ,B細胞パスウェイ,インターロイキン10,インターフェロン,顆粒球単球コロニー刺激因子など複数のサイトカインシグナルのパスウェイが同定された.同様の解析を,以前に報告された関節リウマチに対する対象数の少ないGWASの結果4) に対し実施したところ,T細胞パスウェイのみが同定された.このことは,今後,GWASの対象数が増加しより多くの疾患感受性遺伝子が同定されるにともない,より多くの生物学的なパスウェイが明らかになることを示すと考えられた.
9.関節リウマチ感受性遺伝子と関節リウマチ治療薬の標的遺伝子とのつながり
今回の研究により得られた関節リウマチ感受性遺伝子と,そこから見い出された疾患病態を用いて,新しいゲノム創薬の手法を開発した(図1).まず,101の関節リウマチ感受性遺伝子の領域に含まれる377の遺伝子から,つぎの8つの基準を用いて疾患病態に寄与すると考えられる98の遺伝子を絞り込んだ.1)タンパク質の配列の変化,2)遺伝子の発現量の変化,3)論文データベースからの情報9),4)タンパク質間相互作用ネットワーク10),5)原発性免疫不全症候群の感受性遺伝子,6)血液細胞に由来する悪性腫瘍の感受性遺伝子,7)ノックアウトマウスにおいて有意な関連が認められた表現型,8)同定された生物学的なパスウェイ.つぎに,創薬データベースに登録されている,ヒトのさまざまな疾患に対する既存(もしくは,臨床治験中)の治療薬とその標的遺伝子の情報を整理し,GWASにより得られた疾患の感受性遺伝子とのつながりについて検討した.
その結果,関節リウマチの感受性遺伝子はタンパク質間相互作用を介して関節リウマチ治療薬の標的遺伝子とネットワークを形成していることが明らかになった(図2).このネットワークには,エタネルセプト,トシリズマブなど生物学的製剤,スルファサラジン,イグラチモドなど疾患修飾性抗リウマチ薬,経口ステロイド,という関節リウマチ治療薬の3つの重要なカテゴリーがすべて含まれていた.疾患に対する感受性遺伝子と治療薬とのつながりを網羅的に示したのは,この研究がはじめての報告となった.
10.関節リウマチに対する新たな治療薬の候補の同定
関節リウマチの感受性遺伝子と既存の関節リウマチ治療薬の標的遺伝子とのあいだにつながりが認められたことは,逆に,ほかの疾患に対する既存の治療薬のなかで関節リウマチの感受性遺伝子を標的としているものを,関節リウマチの治療に適応できる可能性を示すと考えられた.そして実際に,現在,乳がんなどの治療に用いられているCDK4/CDK6阻害薬が,関節リウマチの感受性遺伝子であるCDK4遺伝子およびCDK6遺伝子を標的としていることを見い出した(図2).CDK4/CDK6阻害薬は関節リウマチのマウスモデルにおいて関節炎の改善に有効であることが報告されており11),新たな関節リウマチ治療薬の候補として有力であると考えられた.
おわりに
GWASがはじめて実施されてから10年たち,科学者の夢であった疾患感受性遺伝子の同定が現実のものとなった反面,得られた結果の活用については課題が残されたままであった.この研究は,大規模なGWASの結果を,さまざまなデータベースと統合した遺伝統計解析により,疾患病態の解明や新規の創薬に役だてることが可能であることを明らかにした.とくに,ゲノム情報を創薬に活用する“ゲノム創薬”においてもGWASの結果の活用が有用であることが示されたのは,今後の創薬において大きな意義をもつものと考えられる.
この研究の対象となった関節リウマチについては,近年,治療法の飛躍的な進歩をとげている一方で,既存の治療薬では十分な効果の得られない場合や重篤な副作用を生じる場合が知られている.この研究により同定された感受性遺伝子を検討することにより,より効果的で副作用の少ない新たな治療薬の開発が期待される.また,今回,開発されたゲノム創薬の手法をほかの疾患にも適用することにより,さまざまな疾患に対する創薬が加速することも期待される.
文 献
- Ozaki, K., Ohnishi, Y., Iida, A. et al.: Functional SNPs in the lymphotoxin-α gene that are associated with susceptibility to myocardial infarction. Nat. Genet., 32, 650-654 (2002)[PubMed]
- Hindorff, L. A., Sethupathy, P., Junkins, H. A. et al.: Potential etiologic and functional implications of genome-wide association loci for human diseases and traits. Proc. Natl. Acad. Sci. USA, 106, 9362-9367 (2009)[PubMed]
- Okada, Y., Terao, C., Ikari, K. et al.: Meta-analysis identifies nine new loci associated with rheumatoid arthritis in the Japanese population. Nat. Genet., 44, 511-516 (2012)[PubMed]
- Stahl, E. A., Raychaudhuri, S., Remmers, E. F. et al.: Genome-wide association study meta-analysis identifies seven new rheumatoid arthritis risk loci. Nat. Genet., 42, 508-514 (2010)[PubMed]
- 1000 Genomes Project Consortium: An integrated map of genetic variation from 1,092 human genomes. Nature, 491, 56-65 (2012)[PubMed]
- Westra, H. J., Peters, M. J., Esko, T. et al.: Systematic identification of trans eQTLs as putative drivers of known disease associations. Nat. Genet., 45, 1238-1243 (2013)[PubMed]
- Trynka, G., Sandor, C., Han, B. et al.: Chromatin marks identify critical cell types for fine mapping complex trait variants. Nat. Genet., 45, 124-130 (2013)[PubMed]
- Segre, A. V., Groop, L., Mootha, V. K. et al.: Common inherited variation in mitochondrial genes is not enriched for associations with type 2 diabetes or related glycemic traits. PLoS Genet., 6, e1001058 (2010)[PubMed]
- Raychaudhuri, S., Plenge, R. M., Rossin, E. J. et al.: Identifying relationships among genomic disease regions: predicting genes at pathogenic SNP associations and rare deletions. PLoS Genet., 5, e1000534 (2009)[PubMed]
- Rossin, E. J., Lage, K., Raychaudhuri, S. et al.: Proteins encoded in genomic regions associated with immune-mediated disease physically interact and suggest underlying biology. PLoS Genet., 7, e1001273 (2011)[PubMed]
- Sekine, C., Sugihara, T., Miyake, S. et al.: Successful treatment of animal models of rheumatoid arthritis with small-molecule cyclin-dependent kinase inhibitors. J. Immunol., 180, 1954-1961 (2008)[PubMed]
著者プロフィール
略歴:2011年 東京大学大学院医学系研究科 修了,同年 同 研究員,2012年 米国Harvard大学 研究員を経て,2013年より東京医科歯科大学大学院医歯学総合研究科 講師.
研究テーマ:遺伝統計解析をつうじたヒトの疾患の病態解明やゲノム創薬への貢献.
抱負:遺伝統計学の楽しさを日本中に広めたい.
© 2014 岡田 随象 Licensed under CC 表示 2.1 日本