腎臓の初期発生の新たなモデルと多能性幹細胞からの腎臓の組織の構築
太口敦博・西中村隆一
(熊本大学発生医学研究所 腎臓発生分野)
email:太口敦博,西中村隆一
DOI: 10.7875/first.author.2014.008
Redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells.
Atsuhiro Taguchi, Yusuke Kaku, Tomoko Ohmori, Sazia Sharmin, Minetaro Ogawa, Hiroshi Sasaki, Ryuichi Nishinakamura
Cell Stem Cell, 14, 53-67 (2014)
ES細胞やiPS細胞などの多能性幹細胞から腎臓の細胞を誘導する試みが多くなされてきたが,腎臓の発生の過程は明らかではなく,腎臓に特有の構造であるネフロンを構築できるようなネフロン前駆細胞の作製についてはこれまで報告されていない.腎臓の発生の過程では,中胚葉に由来する前腎,中腎,後腎の3つの原基が前後軸にそって形成され,後腎のみが成体の腎臓へと成長する.しかし,中胚葉組織からの腎臓の細胞系譜の選択や,その前後軸の形成のしくみについてはほとんど明らかにされていない.今回,筆者らは,細胞系譜の追跡実験により,ネフロン前駆細胞である後腎間葉の起源は,これまで信じられてきた初期の中間中胚葉ではなく,下半身のもとになる未分化な後方中胚葉であることを見い出した.さらに,この細胞を胚から分取してin vitroにおいて培養することにより,前後軸の形成,そののちの腎臓の細胞系譜への分化,さらに,後腎間葉への成熟に必要な成長因子の組合せを同定した.この培養条件を用いてマウスのES細胞およびヒトのiPS細胞から後腎間葉への分化誘導法を確立し,これを器官培養することにより,糸球体と近位尿細管および遠位尿細管をともなう3次元での腎臓の組織の形成に成功した.
ニューロン,心筋細胞,膵臓β細胞など,多くの臓器の細胞の多能性幹細胞からの分化誘導法の確立が報告されて久しいが,腎臓においては,特有の3次元構造であり糸球体および尿細管からなるネフロンを構築しうるようなネフロン前駆細胞の分化誘導法は確立されていなかった.その理由としては,そもそも胎児期の腎臓の原基において初期の発生過程が明らかにされていないことが大きい.その背景として,腎臓はほかの臓器とは異なり,発生期において前腎および中腎という2つの一時的な原基が前方から順に形成され,最終的な成体の腎臓のもととなる胎児の後腎は体幹の最後部に生じるという複雑な発生過程をへることがあげられる1).したがって,腎臓の細胞の分化の誘導に際しては,胎児の後腎がどのような細胞系譜を選択するタンパク質,および,前後軸のパターンを決定するタンパク質により形成されるのかという発生学的な知見を明らかにする必要があった.さらに,腎臓は血液をろ過して尿のもとをつくる糸球体とそれに接続して栄養分の再吸収を担う尿細管からなる,ネフロンとよばれる構造をとってはじめて機能する.したがって,将来的に誘導した腎臓の細胞に機能を付与するためには,この糸球体と尿細管の両方を含む3次元構造の構築が必須であるという点で,細胞の単位で機能しうる内分泌系細胞および外分泌系細胞やニューロンなどにはないむずかしさが存在する.
マウスの胚において,胎仔の後腎は受精後10.5日目ごろに明らかになる後腎間葉と尿管芽という2つの前駆細胞の集団の相互作用により形成される.これらの前駆細胞はともに,受精後8.5日目ごろに明らかになる初期の中間中胚葉という腎臓の細胞系譜に運命づけられた中胚葉組織に由来するとされてきた.さらに,胎仔の後腎における後腎間葉のなかに,ネフロンのもとになるネフロン前駆細胞の存在することが明らかになっている2).しかしながら,初期の発生過程において,時空間に特異的などのようなシグナルによりこの後腎間葉が形成されるのかはほとんど明らかにされていなかった.一方で,ES細胞やiPS細胞などに代表される多能性幹細胞を用いたネフロン前駆細胞の分化の誘導の試みは,古くはカエル卵のアニマルキャップとよばれる多能性組織を用いた実験にさかのぼる.この系では,アニマルキャップをレチノイン酸とアクチビンの存在のもとで培養することにより,オタマジャクシの原始的な前腎構造の分化を誘導できることが報告されている3).また,マウスおよびヒトの多能性幹細胞を用いた研究においては,Bmpシグナルがネフロン前駆細胞に関連する遺伝子の発現を誘導できることが報告されていた4).しかしながら,糸球体および尿細管の両方を構築しうるネフロン前駆細胞の分化を誘導したという報告はなく,ネフロン前駆細胞の真の作製法の確立が待望されていた.
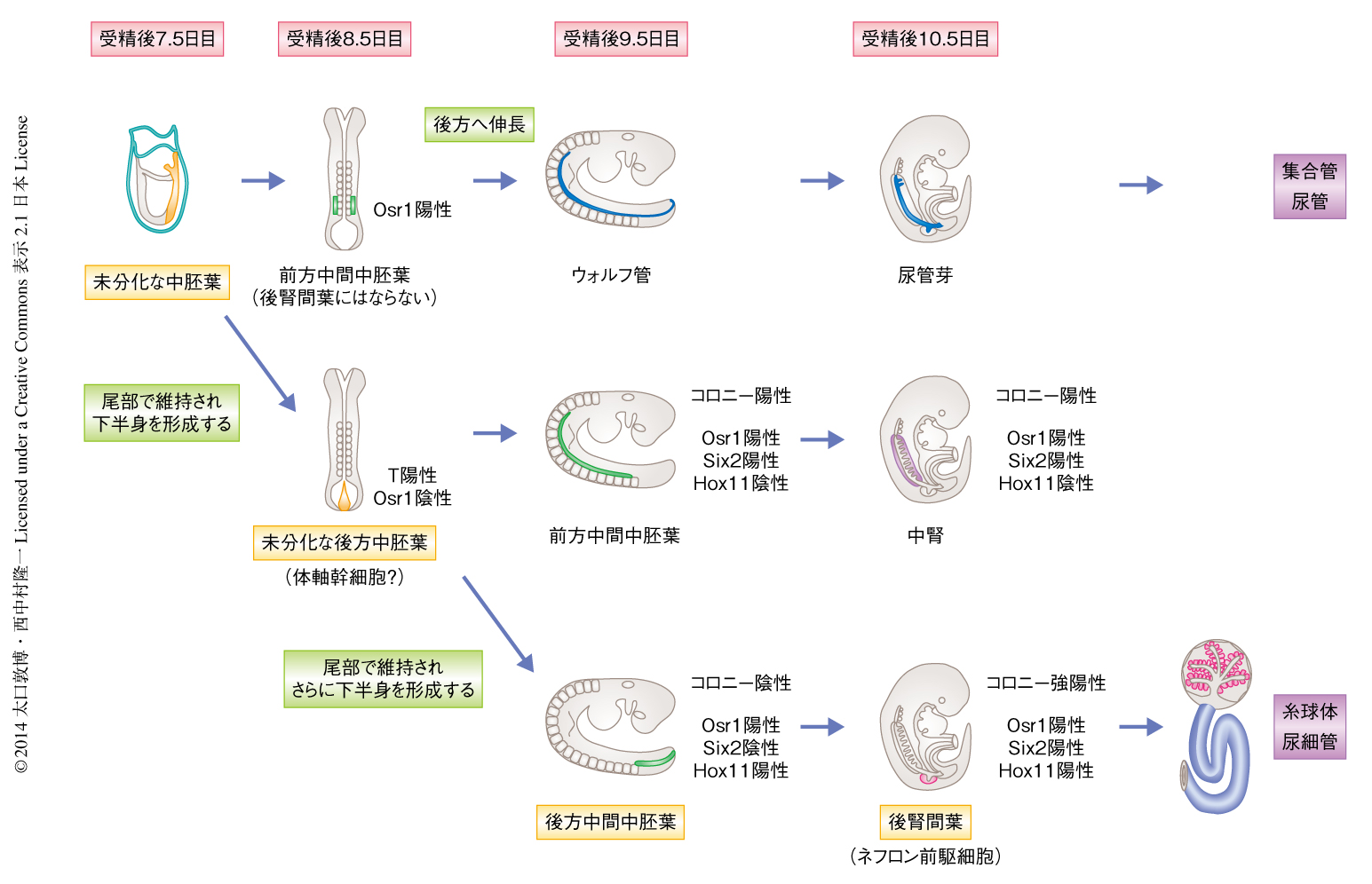
受精後10.5日目以降の後腎間葉には糸球体と尿細管の両方に分化するネフロン前駆細胞の存在することが知られており,筆者らの研究室では,このネフロン前駆細胞を検出しうるコロニー形成アッセイ法を樹立し報告している5).また,これまでに,受精後8.5日目の中間中胚葉とそれ以降の腎臓の細胞系譜においてOsr1という転写因子が持続的に発現することが報告されている.そこで,このOsr1遺伝子座に緑色蛍光タンパク質EGFPを導入した遺伝子改変マウスを作製し,これを用いて初期の発生段階の胎仔に同様のコロニー形成性のネフロン前駆細胞が存在するのかどうか検討した.その結果,後腎の形成よりまえの受精後9.5日目の胚の中間中胚葉において,ごく少数ながらコロニーを形成する細胞の存在することが判明した.さらに,このコロニー形成性の細胞は受精後9.5日目の胚において,前方のOsr1陽性を示す中間中胚葉のみに存在し,後方のOsr1陽性細胞には含まれないことが明らかになった(図1).しかし,この受精後9.5日目の胚において,前方中間中胚葉において特異的にSix2の発現する遺伝子改変マウスを用いて細胞系譜を追跡したところ,この細胞の集団は中腎のみに寄与し後腎にはならないことが示唆された(図1).一方,後腎は中腎に対しより後方の体幹部に形成され,予定される後腎の領域は体幹尾部を規定するHox11ファミリー遺伝子の発現により決定されると報告されていたことから6),このOsr1陽性かつHox11陽性のコロニーを形成しない後方中間中胚葉が,受精後9.5日目の胚における後腎間葉の起源ではないかと考えた(図1).そこで,実際にこの後方中間中胚葉の細胞を胚からセルソーターを用いて分取し,in vitroにおいて分化を誘導した.その結果,この細胞は低濃度のWntアゴニスト,さらには,Fgf9の添加により,効果的にコロニー形成性の後腎間葉へと分化を誘導できることが明らかになった.
受精後9.5日目の胚における中間中胚葉の起源と考えられてきた,受精後8.5日目の胚のOsr1陽性を示す中間中胚葉を分取し,同様にさまざまな成長因子の存在のもとで分化の誘導を試みたがコロニー形成性のネフロン前駆細胞は得られなかった.しかしながら意外なことに,Osr1陰性を示す細胞を用いたところ,そのなかからわずかにコロニー形成性の細胞の分化を誘導しうる条件がみつかった.このことから,後腎間葉はこの受精後8.5日目胚においてこれまで教科書的に後腎の起源とされてきたOsr1陽性を示す中間中胚葉ではなく,Osr1陰性を示す未分化な後方中胚葉に由来するのではないかと考えた.そこで,未分化な中胚葉において特異的に発現する転写因子T(Brachyury)の遺伝子改変マウスを用いて,T陽性を示す細胞を時期特異的に標識し細胞系譜を追跡した.一般に,受精後6.5日目から受精後7.5日目にかけて胚葉が形成され,この時期にT陽性を示す未分化な中胚葉が全身の中胚葉組織のもとになると考えられてきた.実際に細胞系譜を追跡した結果,この時期のT陽性細胞はからだのほとんどの中胚葉組織に寄与していた.一方で,胚葉の形成がすでに終了していると考えられてきた受精後8.5日目の胚においても尾部にわずかにT陽性を示す細胞が存在し,これを標識すると後腎間葉を含む下半身の中胚葉組織に寄与していることが明らかになった.
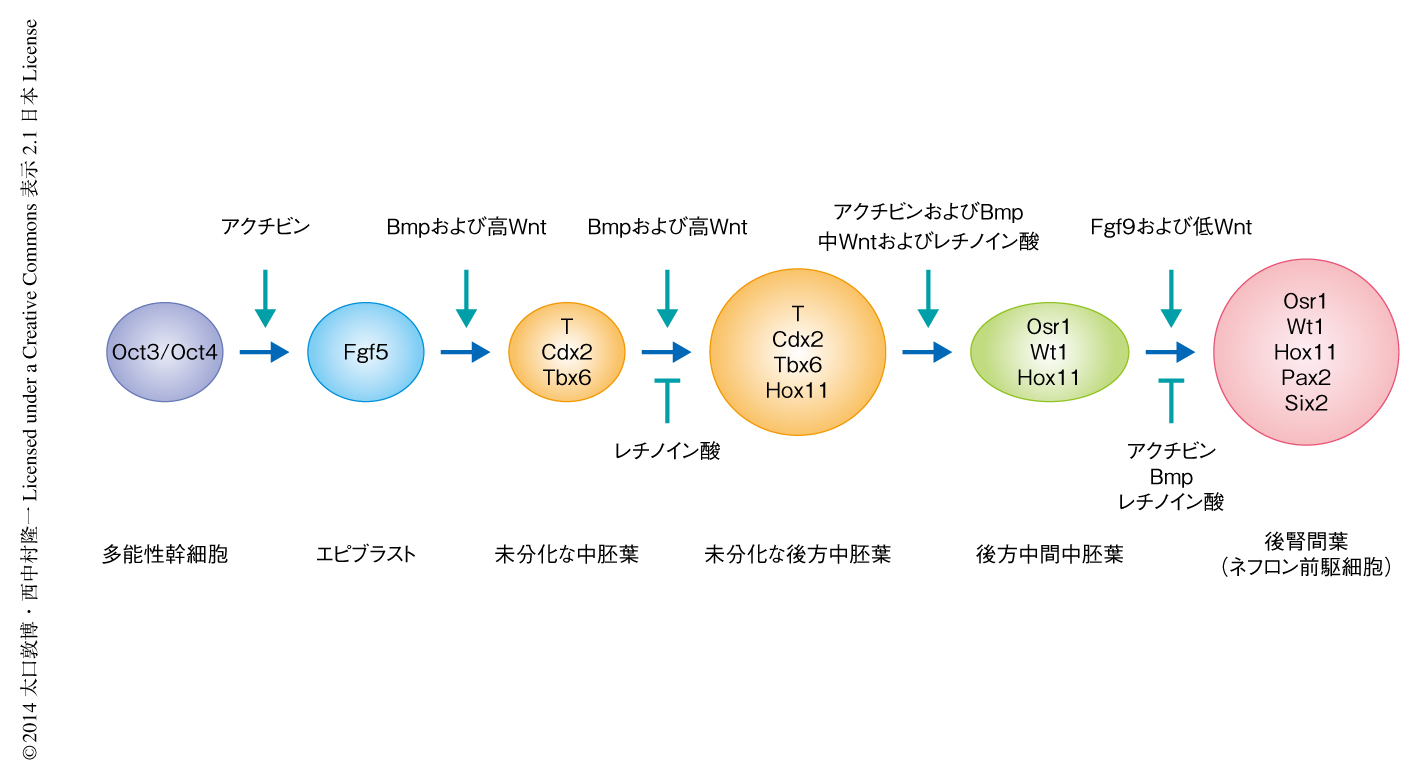
さらに意外なことに,この時期のT陽性細胞は後腎におけるもうひとつの前駆細胞である尿管芽には寄与しないことが明らかになった(図1).すなわち,尿管芽は受精後8.5日目の胚において,すでに前方に形成されているT陰性を示す前方中間中胚葉に由来することが示唆された.このことは,ニワトリの胚を用いた細胞系譜の追跡実験の報告とも合致した.前方の領域の中間中胚葉を標識すると,それらが前方から後方へと伸長し体幹の後部に到達して尿管芽が発生するというものである.すなわち,これまで教科書的に後腎間葉も尿管芽もともに前方中間中胚葉から後進して後腎を形成するとされてきたが,そうではなく,後腎間葉のみは体尾部の未分化な中胚葉として後方に維持されたのち,受精後9.5日目の胚において後方中間中胚葉をへて,受精後10.5日目の胚において後腎間葉へと分化するという新規の発生モデルが構築された.実際に,受精後8.5日目の胚から分取したT陽性を示す未分化な中胚葉の細胞は,高濃度のWntアゴニストおよびBmp4により後方化したのち,腎臓を形成すると報告されてきた成長因子を含む,アクチビン,Bmp4,レチノイン酸,中濃度のWntアゴニストの存在のもとで培養すると後方中間中胚葉のマーカーを発現し,さらに,さきのとおりFgf9と低濃度のWntアゴニストを添加して培養するとコロニー形成性のネフロン前駆細胞へと分化を誘導することができた.
マウスの胚を用いて確立した分化誘導の条件を用いて,マウスのES細胞からのネフロン前駆細胞の分化の誘導を試みた.これまでに,中胚葉組織の分化の誘導においては初期のアクチビンシグナルが重要であると報告されていたことから7),まず,ES細胞をアクチビンにより処理し,さらに,未分化な後方中胚葉の分化を誘導しうる高濃度のWntアゴニストとBmp4の存在のもとで培養し,T陽性を示す未分化な中胚葉の分化を誘導した.この細胞をさらに受精後8.5日目の胚の未分化な中胚葉からの後腎間葉の分化の誘導において確立した条件において培養したところ,90%以上の細胞がOsr1陽性となり,さらに,その60%程度の細胞がコロニー形成性のネフロン前駆細胞へと分化したことが確認された.さらには,このプロトコールをヒトのiPS細胞にも応用したところ,初期の中胚葉の分化の誘導の過程においてFgf2をくわえることと,ヒトの胎児の発生過程にあわせておのおのの培養期間を延長することにより,ほとんどマウスと同様のプロトコールによりネフロン前駆細胞のマーカーに陽性を示す細胞の分化が誘導された(図2).
マウスの後腎間葉はWnt4を発現するフィーダー細胞あるいは胎仔の脊髄と共培養すると単独で間葉-上皮転換を起こして自己組織化し,糸球体および尿細管を形成することが知られている8).そこで,分化を誘導したマウスのES細胞およびヒトのiPS細胞に由来するネフロン前駆細胞を同様にWnt4発現細胞および胎仔の脊髄と共培養したところ,どちらの細胞も間葉-上皮転換を起こすとともに,尿細管および糸球体の両方の構造が構築された.重要なことに,これらの尿細管は生体におけるそれと同様に近位側および遠位側を形成しており,近位尿細管あるいは遠位尿細管に特有のタンパク質を発現するとともに,完全な管腔の構造を形成していた.さらに,形成された糸球体は糸球体上皮細胞に特異的なタンパク質で糸球体のろ過の機能を保障するネフリンやポドシン,さらには,糸球体において血管の分化を誘導するVegfaを発現し,真の糸球体上皮細胞が形成されていることが明らかになった.さらに,この共培養組織を免疫不全マウスの腎臓の被膜下に移植すると,糸球体に血管が侵入し赤血球の流入が認められたことから,移植されたマウスの血流にも接続されうることが示された.
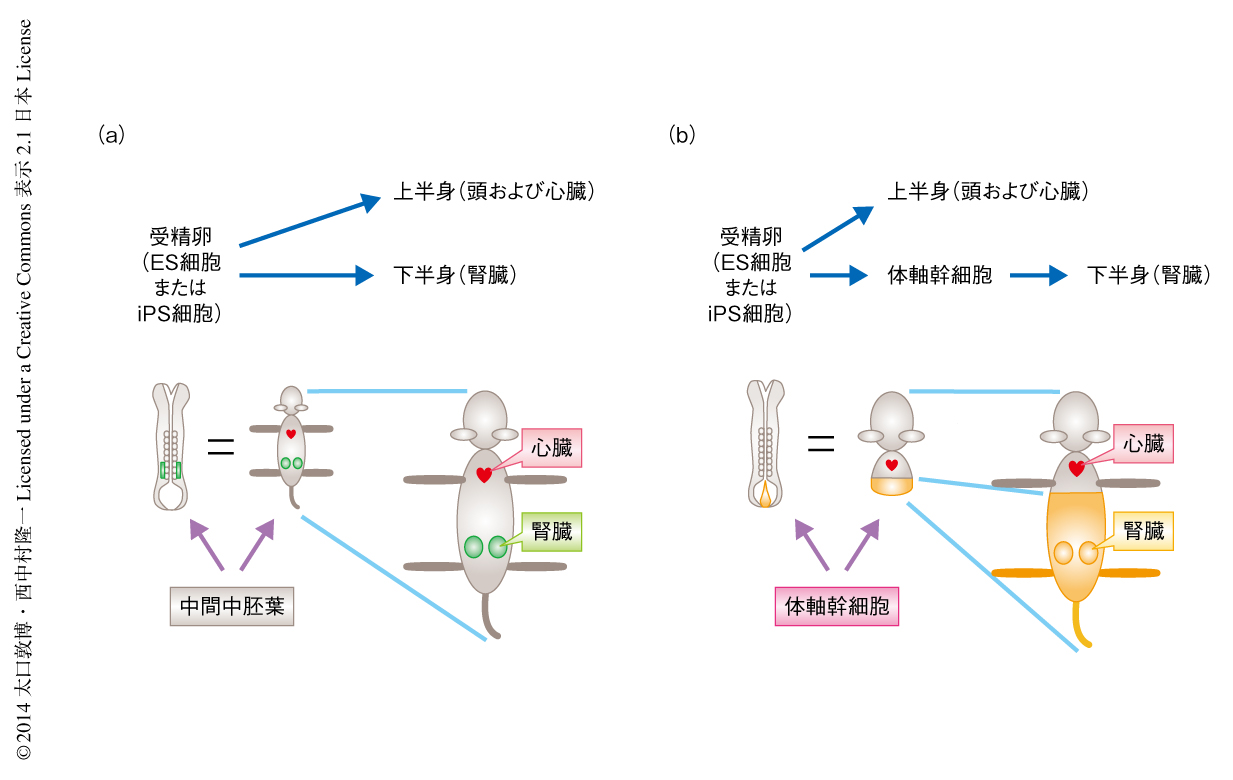
今回,筆者らは,これまでの通説であった腎臓の起源,すなわち,受精後8.5日目の胚における初期の中間中胚葉が後進することにより後腎が形成されるという概念に対し,後腎間葉のみは未分化な後方中胚葉として維持され,後方中間中胚葉をへたのち形成されるという新たな発生モデルを構築し,ネフロン前駆細胞のin vitroにおける分化の誘導に成功した.このモデルは,近年になり提唱されている体軸幹細胞の概念にも適合すると考えられた9,10).すなわち,受精後8.5日目ごろの胚において形成されている体幹部の大部分は上半身の組織であり,下半身の前駆細胞は胎児の後方の体軸幹細胞として維持されているというものである(図3).今回,筆者らは,多能性幹細胞からのネフロン前駆細胞の分化の誘導において5つのステップにおける成長因子の最適な組合せを決定したが,この体軸幹細胞の維持にはWntシグナルが重要であるとされていることや10),その減弱が細胞分化を誘引するとの報告11) とも合致しており,体軸幹細胞の分化における細胞系譜に依存しない共通の分子機構のはたらいていることが示唆された.さらには,腎臓の細胞系譜に特化した細胞である後方中間中胚葉の分化の誘導の段階において,カエルにおける前腎の分化の誘導において見い出されたアクチビンやレチノイン酸3) が共通して含まれたことは,種をこえて保存された分子機構の存在を示唆しており興味深い.
今回の成果は,今後,疾患に特異的なiPS細胞を用いた疾患モデルの構築や,それを応用した創薬の研究にもつながる可能性がある.また,発生過程の詳細な解析およびモデルの形成がin vitroにおける腎臓の組織の構築において非常に有用であったことから,これらはさらに機能的な腎臓の作製をめざす際にもやはり有効であると考えられ,発生学的な解析と多能性幹細胞の利用の両輪により腎臓の再生への道が拓かれるものと期待される.
略歴:熊本大学大学院医学研究科博士課程 在学中.
研究テーマ:腎臓の再生.
抱負:いつか“昔,透析というたいへんな治療もあったね”といってみたい.
西中村 隆一(Ryuichi Nishinakamura)
熊本大学発生医学研究所 教授.
研究室URL:http://www.imeg.kumamoto-u.ac.jp/divisions/integrative_cell_biology
© 2014 太口敦博・西中村隆一 Licensed under CC 表示 2.1 日本
(熊本大学発生医学研究所 腎臓発生分野)
email:太口敦博,西中村隆一
DOI: 10.7875/first.author.2014.008
Redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells.
Atsuhiro Taguchi, Yusuke Kaku, Tomoko Ohmori, Sazia Sharmin, Minetaro Ogawa, Hiroshi Sasaki, Ryuichi Nishinakamura
Cell Stem Cell, 14, 53-67 (2014)
要 約
ES細胞やiPS細胞などの多能性幹細胞から腎臓の細胞を誘導する試みが多くなされてきたが,腎臓の発生の過程は明らかではなく,腎臓に特有の構造であるネフロンを構築できるようなネフロン前駆細胞の作製についてはこれまで報告されていない.腎臓の発生の過程では,中胚葉に由来する前腎,中腎,後腎の3つの原基が前後軸にそって形成され,後腎のみが成体の腎臓へと成長する.しかし,中胚葉組織からの腎臓の細胞系譜の選択や,その前後軸の形成のしくみについてはほとんど明らかにされていない.今回,筆者らは,細胞系譜の追跡実験により,ネフロン前駆細胞である後腎間葉の起源は,これまで信じられてきた初期の中間中胚葉ではなく,下半身のもとになる未分化な後方中胚葉であることを見い出した.さらに,この細胞を胚から分取してin vitroにおいて培養することにより,前後軸の形成,そののちの腎臓の細胞系譜への分化,さらに,後腎間葉への成熟に必要な成長因子の組合せを同定した.この培養条件を用いてマウスのES細胞およびヒトのiPS細胞から後腎間葉への分化誘導法を確立し,これを器官培養することにより,糸球体と近位尿細管および遠位尿細管をともなう3次元での腎臓の組織の形成に成功した.
はじめに
ニューロン,心筋細胞,膵臓β細胞など,多くの臓器の細胞の多能性幹細胞からの分化誘導法の確立が報告されて久しいが,腎臓においては,特有の3次元構造であり糸球体および尿細管からなるネフロンを構築しうるようなネフロン前駆細胞の分化誘導法は確立されていなかった.その理由としては,そもそも胎児期の腎臓の原基において初期の発生過程が明らかにされていないことが大きい.その背景として,腎臓はほかの臓器とは異なり,発生期において前腎および中腎という2つの一時的な原基が前方から順に形成され,最終的な成体の腎臓のもととなる胎児の後腎は体幹の最後部に生じるという複雑な発生過程をへることがあげられる1).したがって,腎臓の細胞の分化の誘導に際しては,胎児の後腎がどのような細胞系譜を選択するタンパク質,および,前後軸のパターンを決定するタンパク質により形成されるのかという発生学的な知見を明らかにする必要があった.さらに,腎臓は血液をろ過して尿のもとをつくる糸球体とそれに接続して栄養分の再吸収を担う尿細管からなる,ネフロンとよばれる構造をとってはじめて機能する.したがって,将来的に誘導した腎臓の細胞に機能を付与するためには,この糸球体と尿細管の両方を含む3次元構造の構築が必須であるという点で,細胞の単位で機能しうる内分泌系細胞および外分泌系細胞やニューロンなどにはないむずかしさが存在する.
マウスの胚において,胎仔の後腎は受精後10.5日目ごろに明らかになる後腎間葉と尿管芽という2つの前駆細胞の集団の相互作用により形成される.これらの前駆細胞はともに,受精後8.5日目ごろに明らかになる初期の中間中胚葉という腎臓の細胞系譜に運命づけられた中胚葉組織に由来するとされてきた.さらに,胎仔の後腎における後腎間葉のなかに,ネフロンのもとになるネフロン前駆細胞の存在することが明らかになっている2).しかしながら,初期の発生過程において,時空間に特異的などのようなシグナルによりこの後腎間葉が形成されるのかはほとんど明らかにされていなかった.一方で,ES細胞やiPS細胞などに代表される多能性幹細胞を用いたネフロン前駆細胞の分化の誘導の試みは,古くはカエル卵のアニマルキャップとよばれる多能性組織を用いた実験にさかのぼる.この系では,アニマルキャップをレチノイン酸とアクチビンの存在のもとで培養することにより,オタマジャクシの原始的な前腎構造の分化を誘導できることが報告されている3).また,マウスおよびヒトの多能性幹細胞を用いた研究においては,Bmpシグナルがネフロン前駆細胞に関連する遺伝子の発現を誘導できることが報告されていた4).しかしながら,糸球体および尿細管の両方を構築しうるネフロン前駆細胞の分化を誘導したという報告はなく,ネフロン前駆細胞の真の作製法の確立が待望されていた.
1.受精後9.5日目の胚において中腎と後腎の細胞系譜は前後軸にそって分かれている
受精後10.5日目以降の後腎間葉には糸球体と尿細管の両方に分化するネフロン前駆細胞の存在することが知られており,筆者らの研究室では,このネフロン前駆細胞を検出しうるコロニー形成アッセイ法を樹立し報告している5).また,これまでに,受精後8.5日目の中間中胚葉とそれ以降の腎臓の細胞系譜においてOsr1という転写因子が持続的に発現することが報告されている.そこで,このOsr1遺伝子座に緑色蛍光タンパク質EGFPを導入した遺伝子改変マウスを作製し,これを用いて初期の発生段階の胎仔に同様のコロニー形成性のネフロン前駆細胞が存在するのかどうか検討した.その結果,後腎の形成よりまえの受精後9.5日目の胚の中間中胚葉において,ごく少数ながらコロニーを形成する細胞の存在することが判明した.さらに,このコロニー形成性の細胞は受精後9.5日目の胚において,前方のOsr1陽性を示す中間中胚葉のみに存在し,後方のOsr1陽性細胞には含まれないことが明らかになった(図1).しかし,この受精後9.5日目の胚において,前方中間中胚葉において特異的にSix2の発現する遺伝子改変マウスを用いて細胞系譜を追跡したところ,この細胞の集団は中腎のみに寄与し後腎にはならないことが示唆された(図1).一方,後腎は中腎に対しより後方の体幹部に形成され,予定される後腎の領域は体幹尾部を規定するHox11ファミリー遺伝子の発現により決定されると報告されていたことから6),このOsr1陽性かつHox11陽性のコロニーを形成しない後方中間中胚葉が,受精後9.5日目の胚における後腎間葉の起源ではないかと考えた(図1).そこで,実際にこの後方中間中胚葉の細胞を胚からセルソーターを用いて分取し,in vitroにおいて分化を誘導した.その結果,この細胞は低濃度のWntアゴニスト,さらには,Fgf9の添加により,効果的にコロニー形成性の後腎間葉へと分化を誘導できることが明らかになった.
2.受精後8.5日目の胚において尿管芽と後腎間葉の細胞系譜は前後軸にそって分かれている
受精後9.5日目の胚における中間中胚葉の起源と考えられてきた,受精後8.5日目の胚のOsr1陽性を示す中間中胚葉を分取し,同様にさまざまな成長因子の存在のもとで分化の誘導を試みたがコロニー形成性のネフロン前駆細胞は得られなかった.しかしながら意外なことに,Osr1陰性を示す細胞を用いたところ,そのなかからわずかにコロニー形成性の細胞の分化を誘導しうる条件がみつかった.このことから,後腎間葉はこの受精後8.5日目胚においてこれまで教科書的に後腎の起源とされてきたOsr1陽性を示す中間中胚葉ではなく,Osr1陰性を示す未分化な後方中胚葉に由来するのではないかと考えた.そこで,未分化な中胚葉において特異的に発現する転写因子T(Brachyury)の遺伝子改変マウスを用いて,T陽性を示す細胞を時期特異的に標識し細胞系譜を追跡した.一般に,受精後6.5日目から受精後7.5日目にかけて胚葉が形成され,この時期にT陽性を示す未分化な中胚葉が全身の中胚葉組織のもとになると考えられてきた.実際に細胞系譜を追跡した結果,この時期のT陽性細胞はからだのほとんどの中胚葉組織に寄与していた.一方で,胚葉の形成がすでに終了していると考えられてきた受精後8.5日目の胚においても尾部にわずかにT陽性を示す細胞が存在し,これを標識すると後腎間葉を含む下半身の中胚葉組織に寄与していることが明らかになった.
さらに意外なことに,この時期のT陽性細胞は後腎におけるもうひとつの前駆細胞である尿管芽には寄与しないことが明らかになった(図1).すなわち,尿管芽は受精後8.5日目の胚において,すでに前方に形成されているT陰性を示す前方中間中胚葉に由来することが示唆された.このことは,ニワトリの胚を用いた細胞系譜の追跡実験の報告とも合致した.前方の領域の中間中胚葉を標識すると,それらが前方から後方へと伸長し体幹の後部に到達して尿管芽が発生するというものである.すなわち,これまで教科書的に後腎間葉も尿管芽もともに前方中間中胚葉から後進して後腎を形成するとされてきたが,そうではなく,後腎間葉のみは体尾部の未分化な中胚葉として後方に維持されたのち,受精後9.5日目の胚において後方中間中胚葉をへて,受精後10.5日目の胚において後腎間葉へと分化するという新規の発生モデルが構築された.実際に,受精後8.5日目の胚から分取したT陽性を示す未分化な中胚葉の細胞は,高濃度のWntアゴニストおよびBmp4により後方化したのち,腎臓を形成すると報告されてきた成長因子を含む,アクチビン,Bmp4,レチノイン酸,中濃度のWntアゴニストの存在のもとで培養すると後方中間中胚葉のマーカーを発現し,さらに,さきのとおりFgf9と低濃度のWntアゴニストを添加して培養するとコロニー形成性のネフロン前駆細胞へと分化を誘導することができた.
3.マウスのES細胞およびヒトのiPS細胞からの後腎間葉の分化誘導法の確立
マウスの胚を用いて確立した分化誘導の条件を用いて,マウスのES細胞からのネフロン前駆細胞の分化の誘導を試みた.これまでに,中胚葉組織の分化の誘導においては初期のアクチビンシグナルが重要であると報告されていたことから7),まず,ES細胞をアクチビンにより処理し,さらに,未分化な後方中胚葉の分化を誘導しうる高濃度のWntアゴニストとBmp4の存在のもとで培養し,T陽性を示す未分化な中胚葉の分化を誘導した.この細胞をさらに受精後8.5日目の胚の未分化な中胚葉からの後腎間葉の分化の誘導において確立した条件において培養したところ,90%以上の細胞がOsr1陽性となり,さらに,その60%程度の細胞がコロニー形成性のネフロン前駆細胞へと分化したことが確認された.さらには,このプロトコールをヒトのiPS細胞にも応用したところ,初期の中胚葉の分化の誘導の過程においてFgf2をくわえることと,ヒトの胎児の発生過程にあわせておのおのの培養期間を延長することにより,ほとんどマウスと同様のプロトコールによりネフロン前駆細胞のマーカーに陽性を示す細胞の分化が誘導された(図2).
4.マウスのES細胞およびヒトのiPS細胞から誘導した後腎間葉は糸球体および尿細管の構造を構築する
マウスの後腎間葉はWnt4を発現するフィーダー細胞あるいは胎仔の脊髄と共培養すると単独で間葉-上皮転換を起こして自己組織化し,糸球体および尿細管を形成することが知られている8).そこで,分化を誘導したマウスのES細胞およびヒトのiPS細胞に由来するネフロン前駆細胞を同様にWnt4発現細胞および胎仔の脊髄と共培養したところ,どちらの細胞も間葉-上皮転換を起こすとともに,尿細管および糸球体の両方の構造が構築された.重要なことに,これらの尿細管は生体におけるそれと同様に近位側および遠位側を形成しており,近位尿細管あるいは遠位尿細管に特有のタンパク質を発現するとともに,完全な管腔の構造を形成していた.さらに,形成された糸球体は糸球体上皮細胞に特異的なタンパク質で糸球体のろ過の機能を保障するネフリンやポドシン,さらには,糸球体において血管の分化を誘導するVegfaを発現し,真の糸球体上皮細胞が形成されていることが明らかになった.さらに,この共培養組織を免疫不全マウスの腎臓の被膜下に移植すると,糸球体に血管が侵入し赤血球の流入が認められたことから,移植されたマウスの血流にも接続されうることが示された.
おわりに
今回,筆者らは,これまでの通説であった腎臓の起源,すなわち,受精後8.5日目の胚における初期の中間中胚葉が後進することにより後腎が形成されるという概念に対し,後腎間葉のみは未分化な後方中胚葉として維持され,後方中間中胚葉をへたのち形成されるという新たな発生モデルを構築し,ネフロン前駆細胞のin vitroにおける分化の誘導に成功した.このモデルは,近年になり提唱されている体軸幹細胞の概念にも適合すると考えられた9,10).すなわち,受精後8.5日目ごろの胚において形成されている体幹部の大部分は上半身の組織であり,下半身の前駆細胞は胎児の後方の体軸幹細胞として維持されているというものである(図3).今回,筆者らは,多能性幹細胞からのネフロン前駆細胞の分化の誘導において5つのステップにおける成長因子の最適な組合せを決定したが,この体軸幹細胞の維持にはWntシグナルが重要であるとされていることや10),その減弱が細胞分化を誘引するとの報告11) とも合致しており,体軸幹細胞の分化における細胞系譜に依存しない共通の分子機構のはたらいていることが示唆された.さらには,腎臓の細胞系譜に特化した細胞である後方中間中胚葉の分化の誘導の段階において,カエルにおける前腎の分化の誘導において見い出されたアクチビンやレチノイン酸3) が共通して含まれたことは,種をこえて保存された分子機構の存在を示唆しており興味深い.
今回の成果は,今後,疾患に特異的なiPS細胞を用いた疾患モデルの構築や,それを応用した創薬の研究にもつながる可能性がある.また,発生過程の詳細な解析およびモデルの形成がin vitroにおける腎臓の組織の構築において非常に有用であったことから,これらはさらに機能的な腎臓の作製をめざす際にもやはり有効であると考えられ,発生学的な解析と多能性幹細胞の利用の両輪により腎臓の再生への道が拓かれるものと期待される.
文 献
- Costantini, F. & Kopan, R.: Patterning a complex organ: branching morphogenesis and nephron segmentation in kidney development. Dev. Cell, 18, 698-712 (2010)[PubMed]
- Kobayashi, A., Valerius, M. T., Mugford, J. W. et al.: Six2 defines and regulates a multipotent self-renewing nephron progenitor population throughout mammalian kidney development. Cell Stem Cell, 3, 169-181 (2008)[PubMed]
- Moriya, N., Uchiyama, H. & Asashima, M.: Induction of pronephric tubules by activin and retinoic acid in presumptive ectoderm of Xenopus laevis. Dev. Growth Differ., 35, 123-128 (1993)
- Kim, D. & Dressler, G. R.: Nephrogenic factors promote differentiation of mouse embryonic stem cells into renal epithelia. J. Am. Soc. Nephrol., 16, 3527-3534 (2005)[PubMed]
- Osafune, K., Takasato, M., Kispert, A. et al.: Identification of multipotent progenitors in the embryonic mouse kidney by a novel colony-forming assay. Development, 133, 151-161 (2006)[PubMed]
- Wellik, D. M., Hawkes, P. J. & Capecchi, M. R.: Hox11 paralogous genes are essential for metanephric kidney induction. Genes Dev., 16, 1423-1432 (2002)[PubMed]
- Kattman, S. J., Witty, A. D., Gagliardi, M. et al.: Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell Stem Cell, 8, 228-240 (2011)[PubMed]
- Kispert, A., Vainio, S. & McMahon, A. P.: Wnt-4 is a mesenchymal signal for epithelial transformation of metanephric mesenchyme in the developing kidney. Development, 125, 4225-4534 (1998)[PubMed]
- Takemoto, T., Uchikawa, M., Yoshida, M. et al.: Tbx6-dependent Sox2 regulation determines neural or mesodermal fate in axial stem cells. Nature, 470, 394-398 (2011)[PubMed] [新着論文レビュー]
- Wilson, V., Olivera-Martinez, I. & Storey, K. G.: Stem cells, signals and vertebrate body axis extension. Development, 136, 1591-1604 (2009)[PubMed]
- Aulehla, A. & Pourquie, O.: Signaling gradients during paraxial mesoderm development. Cold Spring Harb. Perspect. Biol., 2, a000869 (2010)[PubMed]
著者プロフィール
略歴:熊本大学大学院医学研究科博士課程 在学中.
研究テーマ:腎臓の再生.
抱負:いつか“昔,透析というたいへんな治療もあったね”といってみたい.
西中村 隆一(Ryuichi Nishinakamura)
熊本大学発生医学研究所 教授.
研究室URL:http://www.imeg.kumamoto-u.ac.jp/divisions/integrative_cell_biology
© 2014 太口敦博・西中村隆一 Licensed under CC 表示 2.1 日本