RNAポリメラーゼIIのC末端ドメインはLCドメインにより形成された可逆性のポリマー線維と結合しリン酸化により解離する
加藤 昌人
(米国Texas大学Southwestern Medical Center,Department of Biochemistry)
email:加藤昌人
DOI: 10.7875/first.author.2013.163
Phosphorylation-regulated binding of RNA polymerase II to fibrous polymers of low-complexity domains.
Ilmin Kwon, Masato Kato, Siheng Xiang, Leeju Wu, Pano Theodoropoulos, Hamid Mirzaei, Tina Han, Shanhai Xie, Jeffry L. Corden, Steven L. McKnight
Cell, 155, 1049-1060 (2013)
FUS,EWS,TAF15はN末端側の領域にLCドメインをもち,C末端側の領域にRNA結合ドメインをもつというよく似たドメイン構造から,FETファミリータンパク質とよばれている.白血病や肉腫などのがん遺伝子の産物として,これら3つのタンパク質のLCドメインが遺伝子の転座によりいくつかの転写因子のDNA結合ドメインと融合した転座産物が同定されている.そして,LCドメインがこの融合転写因子の強力な活性化ドメインとしてはたらくことがわかっている.筆者らは,これらLCドメインが可逆性のアミロイド様のポリマー線維を形成し,RNAポリメラーゼIIのC末端ドメインと結合することを発見した.この結合はC末端ドメインのリン酸化により阻害されることも見い出した.また,LCドメインに変異を導入する実験により,ポリマー線維とC末端ドメインとの結合の強さは,LCドメインによる転写の活性化能と相関することもわかった.これらの結果より,RNAポリメラーゼIIの転写開始複合体への結合はC末端ドメインのポリマー線維との結合を介して起こり,さらに,C末端ドメインのリン酸化によりポリマー線維から解離して転写伸長の過程へと移行するというモデルを提唱した.
LC(low-complexity)ドメインは20種類あるアミノ酸残基のうちかぎられた種類のアミノ酸残基から構成された配列よりなり,多くの場合,決まった構造をもたずフレキシブルな状態をとっている.また,溶解度の低いこと,プロテアーゼにより分解されやすいことから,これまで生化学的な研究の対象とはなりづらかった.そのため,多くのRNA結合タンパク質やDNA結合タンパク質などにLCドメインが含まれることはわかっていたものの,その生物学的な機能はよくわかっていなかった1).筆者らは,RNA粒子に含まれるRNA結合タンパク質であるFUS(fused in sarcoma)やhnRNPA2のもつLCドメインが,濃度に依存して可逆性のポリマー線維を形成することを発見した2,3)(文献3) は,新着論文レビュー でも掲載).高い濃度の状態ではこれらのポリマー線維は互いに相互結合しヒドロゲル状態へと相転移し,あたかもRNA粒子のように,RNA粒子に含まれるほかのタンパク質のLCドメインをその内部に蓄積した.これらの結果は,これまで長らく解明できなかった2つの問題,すなわち,もともとLCドメインのもつ生理学的な機能と,RNA粒子をはじめCajal体や核スペックルなど膜をもたない細胞内の構造体の形成の機構について,はじめて分子レベルでの具体的な知見をあたえた.
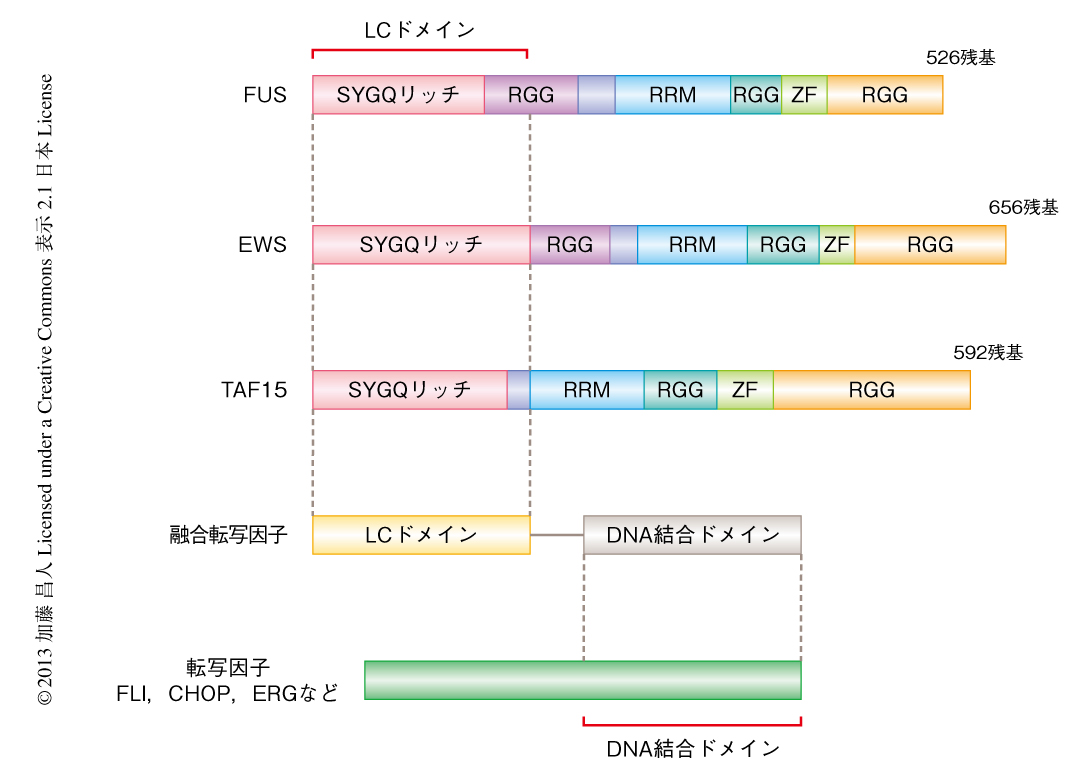
FUS,EWS(ewing sarcoma),TAF15(TATA-binding protein associated factor 2N)はよく似たドメイン構造をもつことからFETファミリータンパク質とよばれ,N末端側の領域にLCドメインをもち,C末端側の領域にはRNA結合ドメインをもつ(図1).FETファミリータンパク質のLCドメインがCHOPやFLIなどの転写因子のDNA結合ドメインと融合した転座産物は,がんをひき起こすことが知られている4)(図1).EWS-FLI融合タンパク質の研究より,もとのFLIと比較して,この融合タンパク質のLCドメインは転写活性化能を1000倍以上も高めることがわかっている5).転写因子のもつ転写活性に活性化ドメインが必須であることは周知の事実である.ところが,大半の活性化ドメインはLCドメインから構成されており,それによる活性化の分子機構はまったくといっていいほどわかっていない.筆者らは,LCドメインによる可逆性のポリマー繊維の形成がこの融合転写因子における転写活性化の分子機構ではないかと推察し研究を進めた.
FUSのもつLCドメインのアミノ酸配列には27個の (GlySer)Tyr(GlySer) モチーフがくり返し出現する.筆者らは,このモチーフのTyrがポリマー線維の形成において重要であることを示している3).今回,ランダムに選択した1個から9個のTyrをSerに変換した43種類のLCドメイン変異体を作製し,それらのポリマー線維の形成能および転写活性化能を,ヒドロゲル結合実験およびGAL4-ルシフェラーゼレポーター実験により測定した.その結果,どちらの実験においても,Serに変換したTyrの数が増えるにつれ,ポリマー線維の形成能および転写活性化能は低下し,この2つの機能には強い相関性がみられた.よって,LCドメインによる転写活性化の分子機構にはそのポリマー線維の形成が関与していると結論づけた.
イソオキサゾール化合物はマウスのES細胞の心筋細胞への分化を誘導する化合物としてスクリーニングされた6).筆者らは,イソオキサゾール化合物の微結晶がヒトの全細胞の溶解液においてLCドメインをもつタンパク質を特異的に吸着し共沈殿させることを報告した3).今回,LCドメインが転写活性化にも関与していることが示されたことから,転写の起こっている核のタンパク質にしぼってイソオキサゾール化合物による沈殿実験を行った.その結果,全細胞の溶解液を使ったときにはみられなかったTAF15およびRNAポリメラーゼIIが,核の抽出液においては共沈殿するタンパク質のリストの上位にくることがわかった.RNAポリメラーゼIIは出芽酵母の細胞の溶解液からもイソオキサゾール化合物によりすみやかに沈殿された.
RNAポリメラーゼIIのC末端側の領域には7つのアミノ酸残基からなる配列Tyr-Ser-Pro-Thr-Ser-Pro-Serが52回くり返し出現するC末端ドメインが存在する7).このC末端ドメインはRNAポリメラーゼIIの活性において不可欠であり,2番目,5番目,7番目のSerのリン酸化によりRNAポリメラーゼIIの活性は制御されている8).これまでの研究からおおまかに,非リン酸化状態のC末端ドメインをもつRNAポリメラーゼIIが転写開始のとき転写開始複合体へとリクルートされ,そののち,Serが順次リン酸化されることで転写開始複合体から遊離し,転写伸長の過程へと移行することがわかっている.C末端ドメインはいわばLCドメインであり,イソオキサゾールの微結晶によるRNAポリメラーゼIIの沈殿においてもC末端ドメインは必須で,かつ,非リン酸化状態のC末端ドメインだけがイソオキサゾールの微結晶に結合し,リン酸化状態のC末端ドメインは結合しないことが確かめられた.
RNAポリメラーゼIIのC末端ドメインはLCドメインであることから,C末端ドメインがFETファミリータンパク質のLCドメインからなるヒドロゲルに結合できるかどうかを調べた.その結果,C末端ドメインはTAF15からなるヒドロゲルに強く結合し,FUSあるいはEWSからなるヒドロゲルにも弱く結合した.しかし,hnRNPA2あるいはCIRBPからなるヒドロゲルにはまったく結合しなかった.全長のFUSはRNAポリメラーゼIIと結合することが報告されており9),この結果はそれと一致した.筆者らは,ヒドロゲルの結合の分子機構は,ヒドロゲルを形成するポリマー線維が外部から浸透してきたRNA粒子に含まれるタンパク質のもつLCドメインと共重合することによることを明らかにしている3).しかしながら,蛍光顕微鏡による観察からC末端ドメインの場合はポリマー線維との共重合ではなく,ポリマー線維の側面に結合していることがわかった.また,ポリマー線維の形成能をいちじるしく低下させたTAF15の変異体を用いた実験により,C末端ドメインとの結合にはTAF15のポリマー線維の形成が不可欠であり,モノマーのLCドメインどうしでは結合しないことも確かめられた.
さらに,C末端ドメインのリン酸化がヒドロゲルとの結合にどのように影響するかを調べたところ,イソオキサゾールの微結晶の場合と同様に,リン酸化されたC末端ドメインはヒドロゲルとは結合しなかった.また,非リン酸化C末端ドメインをTAF15のヒドロゲルに結合させたのち,リン酸化酵素とATPをくわえると,C末端ドメインがリン酸化されゲルの外部へと遊離してくることも観察された.この現象は,まさに細胞において転写開始のとき起こっていることと類似していた.
FUSのLCドメインにおいてTyrをSerに変換した43種類の変異体のうち,27個ある (GlySer)Tyr(GlySer) モチーフの16番目と20番目のTyrをSerに変換した変異体の転写活性化能は,野生型のFUSと比べ,ほかの変異体では同等かそれ以下なのと対照的に約2倍も高かった.そこで,この変異体のヒドロゲルを作製し,C末端ドメインとの結合について野生型のFUSのヒドロゲルと比較した.すると,この変異体のヒドロゲルはC末端ドメインと野生型のFUSのヒドロゲルより約2倍も強く結合した.このことから,ポリマー線維のC末端ドメインへの結合の強さと転写活性化能とが直接的に関係することが示唆された.この変異体では27個ある (GlySer)Tyr(GlySer) モチーフのうち16番目と20番目のTyrがSerに変換されている.さきに述べたように,Tyrはポリマー線維の形成に重要なはたらきをしていることから,この2個のTyrの変異によりポリマー線維の側面の構造がC末端ドメインとの結合に有利なよう変化したのかもしれない.おもしろいことに,FUSのアミノ酸配列をC末端ドメインと強く結合するTAF15のアミノ配列と比較すると,FUSにおいて16番目から20番目に相当するTAF15の (GlySer)Tyr(GlySer) モチーフでは,Tyrのどちらかとなりの残基が6個連続してGlyあるいはSerではなくAspに置換されていた.Aspは擬似リン酸化残基としてしばしば用いられる.つまり,TAF15ではAspがTyrのすぐとなりに位置することにより,この領域のポリマー線維の構造をC末端ドメインとの結合に有利なようにしているのかもしれない.
in vitroにおけるLCドメインによるポリマー線維の形成には,10 mg/ml以上という高いタンパク質濃度が必要である.しかし,細胞において実際にそのような高い濃度となっているのだろうか? ひとつの答えは,DNAやRNAにおいて局所的に多数のタンパク質が結合することにより高い濃度になっているというものである.マイクロサテライトDNAにはGGAAという4塩基の配列がくり返し出現する領域がある.このGGAA配列は転写因子FLIのもつDNA結合ドメインの結合に最適な配列である.このマイクロサテライトDNAが遺伝子プロモーターの上流に位置すると,EWSとFLIとが融合した転写因子は標的となる遺伝子プロモーターを格段に活性化することが知られている10).そこで,FUSのLCドメインとFLIのDNA結合ドメインとを融合させたタンパク質を精製し,GGAA配列の25回のくり返しをもつマイクロサテライトDNAがその融合タンパク質のポリマー線維の形成を促進するかどうか調べた.ゲルシフトアッセイでは複数個のFUS-FLI融合タンパク質がマイクロサテライトDNAに結合することが確認できた.また,電子顕微鏡ではFUS-FLI融合タンパク質にマイクロサテライトDNAを混ぜたときに長いポリマー線維のからまった“毛玉”が観察されたが,FUS-FLI融合タンパク質だけでは自然に発生した少量の短いポリマー線維がところどころに観察されただけであった.この論文と同時に発表された論文においても,全長のFUSがRNAにより線維を形成する(全長のFUSはC末端側の領域にRNA結合ドメインをもつ)ことが報告されている11).これらの結果より,細胞においてもポリマー線維の形成は起こりうることが証明された.
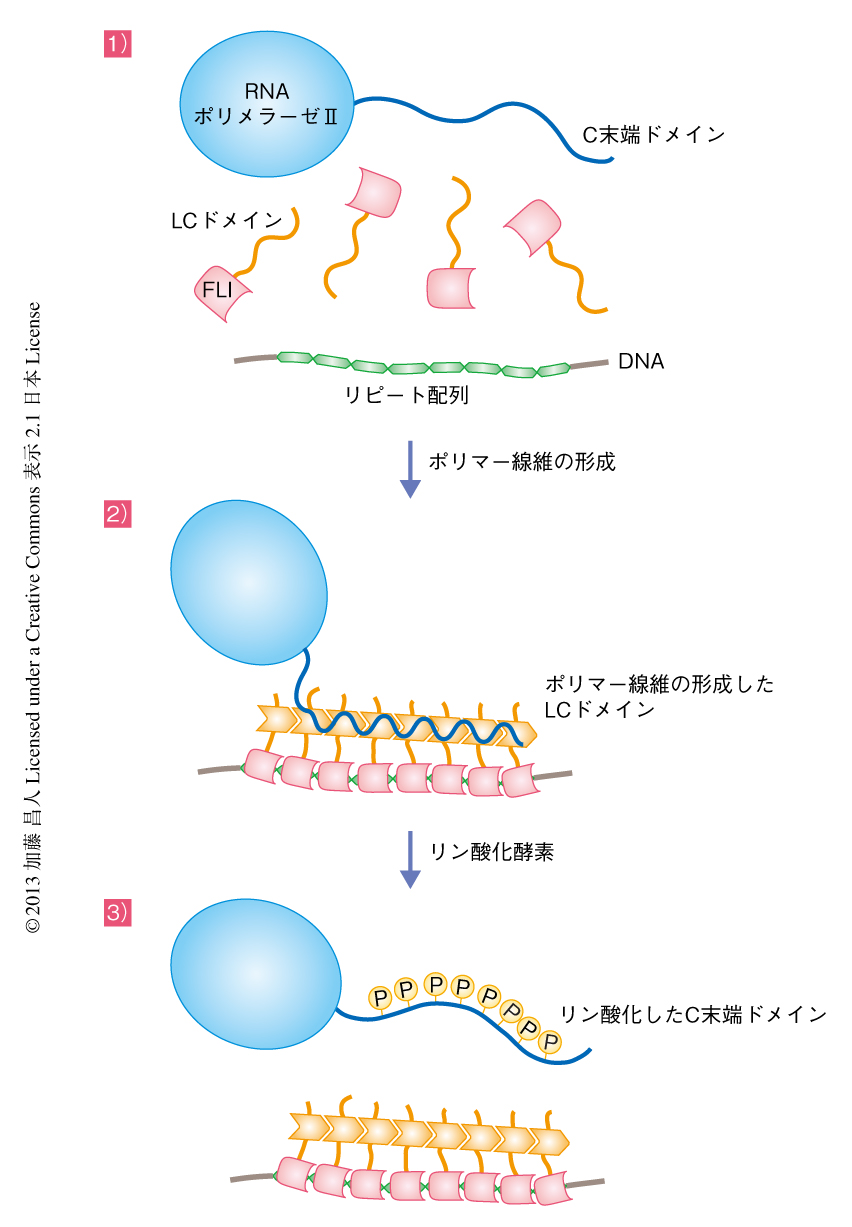
筆者らは,以上の結果より,FETファミリータンパク質のLCドメインと転写因子のDNA結合ドメインとが融合した転座産物による転写活性化の分子機構のモデルを提唱した(図2).まず,複数の融合転写因子がマイクロサテライトDNAのようなリピート配列に結合して局所的な濃度を高め,LCドメインからなるポリマー線維が形成される.そのポリマー線維にRNAポリメラーゼIIのC末端ドメインが結合し,転写開始複合体へとリクルートする.そののち,CDK7やCDK9などのリン酸化酵素がC末端ドメインをリン酸化し,ポリマー線維からの遊離を促進してRNAポリメラーゼIIを転写伸長の過程へと移行させる.
多くのRNA結合タンパク質およびDNA結合タンパク質がLCドメインをもつ.LCドメインからなる可逆性のポリマー線維の形成が細胞においても本当に起こっており,転写(RNAポリメラーゼIIのC末端ドメインとの結合)から翻訳(RNA粒子の形成)にいたるまで遺伝子発現の制御にかかわっているのならば,その制御機構は非常に複雑なものになっていると考えられる.なぜなら,異なるLCドメインは比較的容易に混合してポリマー線維を形成することができるし,ほとんどのLCドメインは複数の翻訳後修飾をうけることがわかっているからである.よって,LCドメインの混合のパターンや線維の形成能の変化にはほぼ際限がない.筆者らは,それを解き明かす道へと開く扉をみつけたところである.
略歴:1998年 奈良先端科学技術大学院大学バイオサイエンス研究科にて博士号取得,米国Harvard Medical School博士研究員を経て,米国Texas大学Southwestern Medical CenterにてAssistant Professor.
研究テーマ:可逆性のポリマー線維の生物学的な機能と構造.
© 2013 加藤 昌人 Licensed under CC 表示 2.1 日本
(米国Texas大学Southwestern Medical Center,Department of Biochemistry)
email:加藤昌人
DOI: 10.7875/first.author.2013.163
Phosphorylation-regulated binding of RNA polymerase II to fibrous polymers of low-complexity domains.
Ilmin Kwon, Masato Kato, Siheng Xiang, Leeju Wu, Pano Theodoropoulos, Hamid Mirzaei, Tina Han, Shanhai Xie, Jeffry L. Corden, Steven L. McKnight
Cell, 155, 1049-1060 (2013)
要 約
FUS,EWS,TAF15はN末端側の領域にLCドメインをもち,C末端側の領域にRNA結合ドメインをもつというよく似たドメイン構造から,FETファミリータンパク質とよばれている.白血病や肉腫などのがん遺伝子の産物として,これら3つのタンパク質のLCドメインが遺伝子の転座によりいくつかの転写因子のDNA結合ドメインと融合した転座産物が同定されている.そして,LCドメインがこの融合転写因子の強力な活性化ドメインとしてはたらくことがわかっている.筆者らは,これらLCドメインが可逆性のアミロイド様のポリマー線維を形成し,RNAポリメラーゼIIのC末端ドメインと結合することを発見した.この結合はC末端ドメインのリン酸化により阻害されることも見い出した.また,LCドメインに変異を導入する実験により,ポリマー線維とC末端ドメインとの結合の強さは,LCドメインによる転写の活性化能と相関することもわかった.これらの結果より,RNAポリメラーゼIIの転写開始複合体への結合はC末端ドメインのポリマー線維との結合を介して起こり,さらに,C末端ドメインのリン酸化によりポリマー線維から解離して転写伸長の過程へと移行するというモデルを提唱した.
はじめに
LC(low-complexity)ドメインは20種類あるアミノ酸残基のうちかぎられた種類のアミノ酸残基から構成された配列よりなり,多くの場合,決まった構造をもたずフレキシブルな状態をとっている.また,溶解度の低いこと,プロテアーゼにより分解されやすいことから,これまで生化学的な研究の対象とはなりづらかった.そのため,多くのRNA結合タンパク質やDNA結合タンパク質などにLCドメインが含まれることはわかっていたものの,その生物学的な機能はよくわかっていなかった1).筆者らは,RNA粒子に含まれるRNA結合タンパク質であるFUS(fused in sarcoma)やhnRNPA2のもつLCドメインが,濃度に依存して可逆性のポリマー線維を形成することを発見した2,3)(文献3) は,新着論文レビュー でも掲載).高い濃度の状態ではこれらのポリマー線維は互いに相互結合しヒドロゲル状態へと相転移し,あたかもRNA粒子のように,RNA粒子に含まれるほかのタンパク質のLCドメインをその内部に蓄積した.これらの結果は,これまで長らく解明できなかった2つの問題,すなわち,もともとLCドメインのもつ生理学的な機能と,RNA粒子をはじめCajal体や核スペックルなど膜をもたない細胞内の構造体の形成の機構について,はじめて分子レベルでの具体的な知見をあたえた.
FUS,EWS(ewing sarcoma),TAF15(TATA-binding protein associated factor 2N)はよく似たドメイン構造をもつことからFETファミリータンパク質とよばれ,N末端側の領域にLCドメインをもち,C末端側の領域にはRNA結合ドメインをもつ(図1).FETファミリータンパク質のLCドメインがCHOPやFLIなどの転写因子のDNA結合ドメインと融合した転座産物は,がんをひき起こすことが知られている4)(図1).EWS-FLI融合タンパク質の研究より,もとのFLIと比較して,この融合タンパク質のLCドメインは転写活性化能を1000倍以上も高めることがわかっている5).転写因子のもつ転写活性に活性化ドメインが必須であることは周知の事実である.ところが,大半の活性化ドメインはLCドメインから構成されており,それによる活性化の分子機構はまったくといっていいほどわかっていない.筆者らは,LCドメインによる可逆性のポリマー繊維の形成がこの融合転写因子における転写活性化の分子機構ではないかと推察し研究を進めた.
1.LCドメインのポリマー線維の形成能と転写活性化能は相関する
FUSのもつLCドメインのアミノ酸配列には27個の (GlySer)Tyr(GlySer) モチーフがくり返し出現する.筆者らは,このモチーフのTyrがポリマー線維の形成において重要であることを示している3).今回,ランダムに選択した1個から9個のTyrをSerに変換した43種類のLCドメイン変異体を作製し,それらのポリマー線維の形成能および転写活性化能を,ヒドロゲル結合実験およびGAL4-ルシフェラーゼレポーター実験により測定した.その結果,どちらの実験においても,Serに変換したTyrの数が増えるにつれ,ポリマー線維の形成能および転写活性化能は低下し,この2つの機能には強い相関性がみられた.よって,LCドメインによる転写活性化の分子機構にはそのポリマー線維の形成が関与していると結論づけた.
2.イソオキサゾール化合物は核の抽出液からRNAポリメラーゼIIを沈殿させる
イソオキサゾール化合物はマウスのES細胞の心筋細胞への分化を誘導する化合物としてスクリーニングされた6).筆者らは,イソオキサゾール化合物の微結晶がヒトの全細胞の溶解液においてLCドメインをもつタンパク質を特異的に吸着し共沈殿させることを報告した3).今回,LCドメインが転写活性化にも関与していることが示されたことから,転写の起こっている核のタンパク質にしぼってイソオキサゾール化合物による沈殿実験を行った.その結果,全細胞の溶解液を使ったときにはみられなかったTAF15およびRNAポリメラーゼIIが,核の抽出液においては共沈殿するタンパク質のリストの上位にくることがわかった.RNAポリメラーゼIIは出芽酵母の細胞の溶解液からもイソオキサゾール化合物によりすみやかに沈殿された.
RNAポリメラーゼIIのC末端側の領域には7つのアミノ酸残基からなる配列Tyr-Ser-Pro-Thr-Ser-Pro-Serが52回くり返し出現するC末端ドメインが存在する7).このC末端ドメインはRNAポリメラーゼIIの活性において不可欠であり,2番目,5番目,7番目のSerのリン酸化によりRNAポリメラーゼIIの活性は制御されている8).これまでの研究からおおまかに,非リン酸化状態のC末端ドメインをもつRNAポリメラーゼIIが転写開始のとき転写開始複合体へとリクルートされ,そののち,Serが順次リン酸化されることで転写開始複合体から遊離し,転写伸長の過程へと移行することがわかっている.C末端ドメインはいわばLCドメインであり,イソオキサゾールの微結晶によるRNAポリメラーゼIIの沈殿においてもC末端ドメインは必須で,かつ,非リン酸化状態のC末端ドメインだけがイソオキサゾールの微結晶に結合し,リン酸化状態のC末端ドメインは結合しないことが確かめられた.
3.RNAポリメラーゼIIのC末端ドメインはFETファミリータンパク質のLCドメインからなるヒドロゲルと結合する
RNAポリメラーゼIIのC末端ドメインはLCドメインであることから,C末端ドメインがFETファミリータンパク質のLCドメインからなるヒドロゲルに結合できるかどうかを調べた.その結果,C末端ドメインはTAF15からなるヒドロゲルに強く結合し,FUSあるいはEWSからなるヒドロゲルにも弱く結合した.しかし,hnRNPA2あるいはCIRBPからなるヒドロゲルにはまったく結合しなかった.全長のFUSはRNAポリメラーゼIIと結合することが報告されており9),この結果はそれと一致した.筆者らは,ヒドロゲルの結合の分子機構は,ヒドロゲルを形成するポリマー線維が外部から浸透してきたRNA粒子に含まれるタンパク質のもつLCドメインと共重合することによることを明らかにしている3).しかしながら,蛍光顕微鏡による観察からC末端ドメインの場合はポリマー線維との共重合ではなく,ポリマー線維の側面に結合していることがわかった.また,ポリマー線維の形成能をいちじるしく低下させたTAF15の変異体を用いた実験により,C末端ドメインとの結合にはTAF15のポリマー線維の形成が不可欠であり,モノマーのLCドメインどうしでは結合しないことも確かめられた.
さらに,C末端ドメインのリン酸化がヒドロゲルとの結合にどのように影響するかを調べたところ,イソオキサゾールの微結晶の場合と同様に,リン酸化されたC末端ドメインはヒドロゲルとは結合しなかった.また,非リン酸化C末端ドメインをTAF15のヒドロゲルに結合させたのち,リン酸化酵素とATPをくわえると,C末端ドメインがリン酸化されゲルの外部へと遊離してくることも観察された.この現象は,まさに細胞において転写開始のとき起こっていることと類似していた.
4.FUSのLCドメインにおける変異体はC末端ドメインに強く結合し高い転写活性能をもつ
FUSのLCドメインにおいてTyrをSerに変換した43種類の変異体のうち,27個ある (GlySer)Tyr(GlySer) モチーフの16番目と20番目のTyrをSerに変換した変異体の転写活性化能は,野生型のFUSと比べ,ほかの変異体では同等かそれ以下なのと対照的に約2倍も高かった.そこで,この変異体のヒドロゲルを作製し,C末端ドメインとの結合について野生型のFUSのヒドロゲルと比較した.すると,この変異体のヒドロゲルはC末端ドメインと野生型のFUSのヒドロゲルより約2倍も強く結合した.このことから,ポリマー線維のC末端ドメインへの結合の強さと転写活性化能とが直接的に関係することが示唆された.この変異体では27個ある (GlySer)Tyr(GlySer) モチーフのうち16番目と20番目のTyrがSerに変換されている.さきに述べたように,Tyrはポリマー線維の形成に重要なはたらきをしていることから,この2個のTyrの変異によりポリマー線維の側面の構造がC末端ドメインとの結合に有利なよう変化したのかもしれない.おもしろいことに,FUSのアミノ酸配列をC末端ドメインと強く結合するTAF15のアミノ配列と比較すると,FUSにおいて16番目から20番目に相当するTAF15の (GlySer)Tyr(GlySer) モチーフでは,Tyrのどちらかとなりの残基が6個連続してGlyあるいはSerではなくAspに置換されていた.Aspは擬似リン酸化残基としてしばしば用いられる.つまり,TAF15ではAspがTyrのすぐとなりに位置することにより,この領域のポリマー線維の構造をC末端ドメインとの結合に有利なようにしているのかもしれない.
5.FUSのLCドメインとFLIのDNA結合ドメインとの融合タンパク質におけるポリマー線維の形成はDNAとの結合により促進される
in vitroにおけるLCドメインによるポリマー線維の形成には,10 mg/ml以上という高いタンパク質濃度が必要である.しかし,細胞において実際にそのような高い濃度となっているのだろうか? ひとつの答えは,DNAやRNAにおいて局所的に多数のタンパク質が結合することにより高い濃度になっているというものである.マイクロサテライトDNAにはGGAAという4塩基の配列がくり返し出現する領域がある.このGGAA配列は転写因子FLIのもつDNA結合ドメインの結合に最適な配列である.このマイクロサテライトDNAが遺伝子プロモーターの上流に位置すると,EWSとFLIとが融合した転写因子は標的となる遺伝子プロモーターを格段に活性化することが知られている10).そこで,FUSのLCドメインとFLIのDNA結合ドメインとを融合させたタンパク質を精製し,GGAA配列の25回のくり返しをもつマイクロサテライトDNAがその融合タンパク質のポリマー線維の形成を促進するかどうか調べた.ゲルシフトアッセイでは複数個のFUS-FLI融合タンパク質がマイクロサテライトDNAに結合することが確認できた.また,電子顕微鏡ではFUS-FLI融合タンパク質にマイクロサテライトDNAを混ぜたときに長いポリマー線維のからまった“毛玉”が観察されたが,FUS-FLI融合タンパク質だけでは自然に発生した少量の短いポリマー線維がところどころに観察されただけであった.この論文と同時に発表された論文においても,全長のFUSがRNAにより線維を形成する(全長のFUSはC末端側の領域にRNA結合ドメインをもつ)ことが報告されている11).これらの結果より,細胞においてもポリマー線維の形成は起こりうることが証明された.
おわりに
筆者らは,以上の結果より,FETファミリータンパク質のLCドメインと転写因子のDNA結合ドメインとが融合した転座産物による転写活性化の分子機構のモデルを提唱した(図2).まず,複数の融合転写因子がマイクロサテライトDNAのようなリピート配列に結合して局所的な濃度を高め,LCドメインからなるポリマー線維が形成される.そのポリマー線維にRNAポリメラーゼIIのC末端ドメインが結合し,転写開始複合体へとリクルートする.そののち,CDK7やCDK9などのリン酸化酵素がC末端ドメインをリン酸化し,ポリマー線維からの遊離を促進してRNAポリメラーゼIIを転写伸長の過程へと移行させる.
多くのRNA結合タンパク質およびDNA結合タンパク質がLCドメインをもつ.LCドメインからなる可逆性のポリマー線維の形成が細胞においても本当に起こっており,転写(RNAポリメラーゼIIのC末端ドメインとの結合)から翻訳(RNA粒子の形成)にいたるまで遺伝子発現の制御にかかわっているのならば,その制御機構は非常に複雑なものになっていると考えられる.なぜなら,異なるLCドメインは比較的容易に混合してポリマー線維を形成することができるし,ほとんどのLCドメインは複数の翻訳後修飾をうけることがわかっているからである.よって,LCドメインの混合のパターンや線維の形成能の変化にはほぼ際限がない.筆者らは,それを解き明かす道へと開く扉をみつけたところである.
文 献
- Michelitsch, M. D. & Weissman, J. S.: A census of glutamine/asparagine-rich regions: implications for their conserved function and the prediction of novel prions. Proc. Natl. Acad. Sci. USA, 97, 11910-11915 (2000)[PubMed]
- Han, T. W., Kato, M., Xie, S. et al.: Cell-free formation of RNA granules: bound RNAs identify features and components of cellular assemblies. Cell, 149, 768-779 (2012)[PubMed]
- Kato, M., Han, T. W., Xie, S. et al.: Cell-free formation of RNA granules: low complexity sequence domains form dynamic fibers within hydrogels. Cell, 149, 753-767 (2012)[PubMed] [新着論文レビュー]
- Guipaud, O., Guillonneau, F., Labas, V. et al.: An in vitro enzymatic assay coupled to proteomics analysis reveals a new DNA processing activity for Ewing sarcoma and TAF(II)68 proteins. Proteomics, 6, 5962-5972 (2006)[PubMed]
- Bailly, R. A., Bosselut, R., Zucman, J. et al.: DNA-binding and transcriptional activation properties of the EWS-FLI-1 fusion protein resulting from the t(11;22) translocation in Ewing sarcoma. Mol. Cell. Biol., 14, 3230-3241 (1994)[PubMed]
- Sadek, H., Hannack, B., Choe, E. et al.: Cardiogenic small molecules that enhance myocardial repair by stem cells. Proc. Natl. Acad. Sci. USA, 105, 6063-6068 (2008)[PubMed]
- Corden, J. L., Cadena, D. L., Ahearn, J. M. Jr. et al.: A unique structure at the carboxyl terminus of the largest subunit of eukaryotic RNA polymerase II. Proc. Natl. Acad. Sci. USA, 82, 7934-7938 (1985)[PubMed]
- Egloff, S., Dienstbier, M. & Murphy, S.: Updating the RNA polymerase CTD code: adding gene-specific layers. Trends Genet., 28, 333-341 (2012)[PubMed]
- Schwartz, J. C., Ebmeier, C. C., Podell, E. R. et al.: FUS binds the CTD of RNA polymerase II and regulates its phosphorylation at Ser2. Genes Dev., 26, 2690-2695 (2012)[PubMed]
- Gangwal, K., Sankar, S., Hollenhorst, P. C. et al.: Microsatellites as EWS/FLI response elements in Ewing's sarcoma. Proc. Natl. Acad. Sci. USA, 105, 10149-10154 (2008)[PubMed]
- Schwartz, J. C., Wang, X., Podell, E. R. et al.: RNA seeds higher-order assembly of FUS protein. Cell Rep., 5, 918-925 (2013)[PubMed]
著者プロフィール
略歴:1998年 奈良先端科学技術大学院大学バイオサイエンス研究科にて博士号取得,米国Harvard Medical School博士研究員を経て,米国Texas大学Southwestern Medical CenterにてAssistant Professor.
研究テーマ:可逆性のポリマー線維の生物学的な機能と構造.
© 2013 加藤 昌人 Licensed under CC 表示 2.1 日本