骨細胞はB細胞およびT細胞の分化と脂質の代謝を制御する
佐藤真理・片山義雄
(神戸大学大学院医学研究科 血液内科学分野)
email:佐藤真理,片山義雄
DOI: 10.7875/first.author.2013.140
Osteocytes regulate primary lymphoid organs and fat metabolism.
Mari Sato, Noboru Asada, Yuko Kawano, Kanako Wakahashi, Kentaro Minagawa, Hiroki Kawano, Akiko Sada, Kyoji Ikeda, Toshimitsu Matsui, Yoshio Katayama
Cell Metabolism, 18, 749-758 (2013)
骨の細胞のひとつである骨細胞は,重力や運動の刺激を感知するメカノセンサーであり,骨形成や骨吸収に関与していると考えられている.しかし,骨から遠く離れた臓器に対する役割についてはほとんどわかっていない.筆者らは,骨細胞にダメージをあたえたマウスを用いて,全身に対する骨細胞の役割について調べた.このマウスでは骨髄細胞および胸腺ストローマ細胞の欠失によりB細胞およびT細胞が著しく減少しており,全身の白色脂肪組織が消失していた.これらの表現型は分化した新しい骨細胞が骨に埋め込まれるにしたがい,きれいに回復した.一方,野生型マウスとの伴体結合術による細胞成分および液性因子の供給,あるいは,脳の視床下部の部分的な破壊では,骨細胞にダメージをあたえたマウスに表現型の回復はみられなかった.さらに,骨細胞にダメージをあたえたマウスの脳の視床下部を破壊すると激烈な脂肪肝を呈し,これは野生型マウスとの伴体結合術により回復した.これらのことから,骨細胞はB細胞およびT細胞の分化と脂質の代謝に重要な役割をもち,全身の恒常性の維持において中枢的な役割をはたしていることが明らかになった.
骨は骨細胞や骨芽細胞を埋め込んだ感覚臓器である.骨の細胞の90%以上をしめる骨細胞は,骨組織のなかで互いに長い細胞突起を伸ばしあって構成する網目のようなネットワーク構造を骨の隅々にまではりめぐらせている.このネットワーク構造により骨細胞の感知する重力や運動の刺激といった機械的なストレスは生物学的なシグナルに変換され,骨の表面に存在する骨芽細胞や破骨細胞を制御することにより骨の恒常性を保っている1,2).骨に重力の刺激の入らない宇宙飛行士や長期臥床者には骨量の急激な減少がみられるだけでなく,興味深いことに,免疫の低下も観察される3-6).しかしながら,骨細胞が感知する機械的なストレスが免疫および全身の恒常性に及ぼす影響は明らかになっていない.これを明らかにするため,筆者らは,メカノセンサーである骨細胞にダメージをあたえたマウスを用いて全身の解析を行った.
尾部懸垂にてマウスの後肢を地面につかないようにし微小重力環境にすると,後肢の骨量が減少するのみならず7),骨細胞のつくるネットワーク構造が乱れ骨髄のなかのB細胞の数の減少がみられた.B細胞の減少は微小重力環境である後肢の骨髄においてのみみられ,全身を循環する血液においては正常であった.骨細胞の全身への影響をより明確にするため,骨細胞において特異的に発現するDMP-1遺伝子プロモーターのもとジフテリア毒素受容体を発現させたトランスジェニックマウス8) を用い解析を行った.15週齢のジフテリア毒素受容体トランスジェニックマウスにジフテリア毒素を投与し,3週間後に骨細胞がダメージをうけ全身の骨組織において骨細胞のネットワーク構造が切断されたマウスを得た.この骨細胞にダメージをあたえたマウスでは,末梢血におけるミエロイド細胞の数は正常だったが,B細胞およびT細胞の数が減少し,リンパ組織である胸腺および脾臓の萎縮がみられた.ジフテリア毒素の投与から100日後には,無傷の骨芽細胞から分化した新たな骨細胞が骨組織に埋め込まれるとともに骨細胞のネットワーク構造も回復し,それにともないB細胞およびT細胞の減少とリンパ組織の萎縮も回復した.
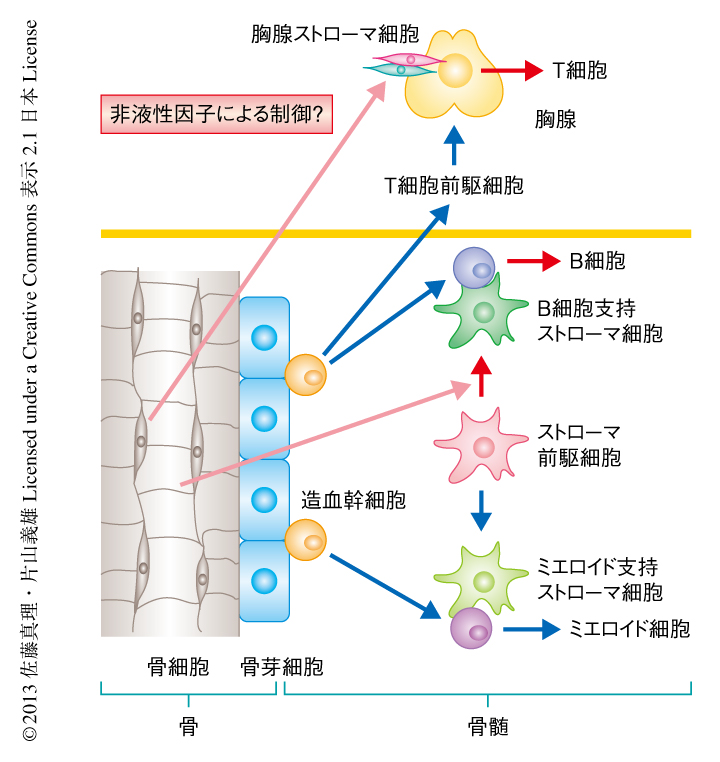
フローサイトメトリー法およびコロニーアッセイ法により,骨細胞にダメージをあたえたマウスの骨髄に存在するリンパ球について調べたところ,造血幹細胞には異常がなく,ミエロイド細胞への分化にも問題はないが,B細胞への分化のみが阻害されていることがわかった.マウスの骨髄を用いた長期骨髄培養法では,培養皿にはりついた骨髄ストローマ細胞の支持による培養上清へのリンパ球の産生が観察される.骨細胞にダメージをあたえたマウスの骨髄を用いた長期骨髄培養法では,ミエロイド細胞の培養条件においてミエロイド細胞は正常に分化したが,B細胞の培養条件においてB細胞はまったく分化しなかった.培養皿にはりついた骨髄ストローマ細胞をフローサイトメトリーにより解析したところ,骨細胞にダメージをあたえたマウスの骨髄ではB細胞を特異的に支持する骨髄ストローマ細胞が消失していた.さらに,コロニーアッセイ法により,骨髄ストローマ前駆細胞は正常であること,長期骨髄培養法においてミエロイド細胞の培養条件から途中でB細胞の培養条件に切り変えるとB細胞は問題なく分化してきたことから,骨細胞にダメージをあたえたマウスでは骨髄ストローマ細胞がB細胞を特異的に支持する骨髄ストローマ細胞にだけ分化できないことが示唆された.これらのことから,骨細胞がダメージをうけると骨髄においてB細胞を特異的に支持する骨髄ストローマ細胞が欠失し,それによりB細胞の分化が阻害されることが明らかになった(図1).
骨細胞にダメージをあたえたマウスの胸腺は激しく萎縮し,すべての分化段階のT細胞が激減していた.T細胞前駆細胞も同様に激減していたが,骨髄におけるリンパ球前駆細胞の減少は約1/3にすぎなかったため,T細胞前駆細胞は骨髄から胸腺に供給されているが,骨細胞にダメージをあたえたマウスの胸腺の環境では生育ができていない可能性が考えられた.実際に,T細胞の分化に大切な胸腺の微小環境を構成する胸腺ストローマ細胞のうち,皮質ストローマ細胞の減少が骨細胞にダメージをあたえたマウスの胸腺において確認された.骨細胞にダメージをあたえたマウスの胸腺における微小環境の異常を調べるため,9~10週齢の野生型マウスとジフテリア毒を投与するまえのジフテリア毒素受容体トランスジェニックマウスとを伴体結合術により結合させ,両者の血流が十分に混ざりあったのを確認してから,15週齢においてジフテリア毒素を投与することにより骨細胞にダメージをあたえ,3週間後に解析した.骨細胞にダメージをあたえたマウスのT細胞前駆細胞は野生型マウスの胸腺においては正常に生育した一方,野生型マウスのT細胞前駆細胞は骨細胞にダメージをあたえたマウスの胸腺では生育できず,予想どおり,骨細胞にダメージをあたえたマウスの胸腺では胸腺ストローマ細胞の減少によりT細胞の分化が阻害されていることが明らかになった.重要なことに,伴体結合術では細胞成分のみならず血液中のホルモンなどの液性因子も野生型マウスから骨細胞にダメージをあたえたマウスへと持続的に供給される.しかし,伴体結合術では骨細胞にダメージをあたえたマウスの胸腺の萎縮はまったく回復しなかったことから,骨細胞は遠隔臓器である胸腺の微小環境を構成する胸腺ストローマ細胞を,液性因子を介すことなく制御していることが明らかになった(図1).
骨細胞にダメージをあたえたマウスはジフテリア毒素の投与ののち3週間でみるみる体重が減少し,骨細胞の新生にともない体重はゆるやかに回復する.これは白色脂肪組織の消失に起因し,骨細胞にダメージをあたえたマウスの皮下脂肪組織,腸管膜脂肪組織,精巣上体周囲脂肪塊は消失していた.これはヒトの疾患である全身性リポジストロフィーと類似しており,実際に,骨細胞にダメージをあたえたマウスの血中のレプチン濃度は低下していた.しかし,リポジストロフィーの原因遺伝子と報告されており脂質合成関連遺伝子でもあるAGPAT2遺伝子やseipin遺伝子などの発現は骨細胞にダメージをあたえたマウスの脳および脂肪組織においてはむしろ上昇しており,脂肪細胞の分化に関与するPPARγ遺伝子の発現も上昇していた.さらに,ヒトのリポジストロフィーとは対照的に,骨細胞にダメージをあたえたマウスにおいて糖尿病の傾向はみられなかった.酸素の消費量,二酸化炭素の排出量,熱の産生を測定したところ,骨細胞にダメージをあたえたマウスにおいて全身のエネルギー代謝は低下していた.すなわち,骨細胞にダメージをあたえたマウスにおいて消失した脂肪組織は,エネルギーとして消費されたのではなく,たんに失われているだけであった.実際に,骨細胞にダメージをあたえたマウスの血中からは遊離脂肪酸やトリアシルグリセロールといった脂質が著しく減少していた.骨細胞にダメージをあたえたマウスでは摂食量がわずかながら減少していたため,高脂肪食にて飼育したが脂肪組織の消失は防げなかった.この脂肪組織の消失の原因については,下痢や血便がみられないことから消化管の異常による吸収の障害による可能性は低く,心拍数の増加や頻脈がみられないことから甲状腺機能亢進症やカテコラミン過剰症といった内分泌の異常によるものでもないと考えられた.また,伴体結合術によっても脂肪組織の消失は改善されなかったことから,骨細胞からの血中へと産生される液性因子が原因であるとも考えにくかった.
これらの結果から,骨細胞が脳を介し脂質の代謝を制御しているとの仮説をたて,骨量の制御に重要である脳の視床下部の一部,腹内側核あるいは弓状核を破壊することにより,骨細胞にダメージをあたえたマウスにおいて脂肪組織の消失が回復するかどうか検討した.脳のこれらの部位は摂食の中枢でもあるため,その破壊ののちには摂食量が増加してマウスは肥満を呈するが,骨細胞にダメージをあたえると,同様に脂肪組織は消失した.しかしながら驚くべきことに,脳の視床下部の一部を破壊したマウスの骨細胞にダメージをあたえると激烈な脂肪肝を呈した.この脂肪肝は野生型マウスとの伴体結合術により回復したため,脳の視床下部の一部を破壊したマウスの骨細胞にダメージをあたえると,肝臓において脂質を排出する能力が低下すると推測された.実際に,脳の視床下部の一部を破壊したマウスの骨細胞にダメージをあたえると,肝臓において脂質合成系の遺伝子は正常に発現していたが,脂質排出系の遺伝子の発現は抑制されていた.さらに,血中の遊離脂肪酸やトリアシルグリセロールの量は野生型のマウスと同じ程度に回復していた.これらの結果から,骨細胞は全身における脂質の代謝を制御し,一部分では脳と協調して肝臓における脂質の代謝機能を制御していることが明らかになった.
骨細胞にダメージをあたえたマウスにおけるダイナミックな表現型が,急速な骨リモデリング,あるいは,骨細胞がダメージをうけたことにより産生された炎症性サイトカインによるものかどうかを検討するため,骨の環境について調べた.骨細胞にダメージをあたえたマウスの骨では破骨細胞の数が増加しており急速な骨リモデリングが生じていると考えられたが,カルセイン標識実験の結果では骨リモデリングは正常なマウスと同じ程度であった.また,骨リモデリングの遅延している48~54週齢の老齢マウスにおいて骨細胞にダメージをあたえても,同様の表現型がみられた.骨細胞にダメージをあたえたマウスの血中および骨髄細胞外液において炎症性サイトカインを測定したところ,正常なマウスと差はなかった.これらのことから,骨細胞にダメージをあたえたマウスの表現型は,骨細胞の機能の喪失そのものが原因であることが明らかになった.
今回,筆者らは,骨細胞が液性因子を介さずにB細胞およびT細胞の分化のための環境を整備し,脳と協調して全身における脂質の代謝を制御していることを明らかにした(図2).これにより,骨に存在する骨細胞が日々感じとっている重力や運動の刺激が,これら遠隔臓器の恒常性の維持において重要であることが示唆された.神経ミエリン鞘の主要な糖脂質成分の合成酵素を欠失したマウスでは骨細胞にダメージをあたえたマウスと非常によく似た表現型が観察されることから9),筆者らは,骨細胞による液性因子を介さない胸腺や脂肪組織の制御機構として神経系の関与を疑った.そして,種々の神経を除去する方法により骨細胞にダメージをあたえたマウスにおいて表現型が回復するかどうか検討したが,いずれも回復はみられなかった.今後は,骨と神経系の詳細な解析にくわえ,伴体結合術では供給されない液性因子の関与をも含めた,さらなる解析が必要である.
全身における恒常性の維持においては脳が中枢的な役割を担うと一般的に理解されているが,筆者らは,骨もまるで第2の脳であるかのように,複数の臓器を制御する中枢的な役割を担っていることを衝撃をもって実感した.骨に対する概念を新たにし,骨を頂点としたあらゆる臓器とのネットワークの制御機構のさらなる解明と理解が,生体を深く知るうえで今後も重要であろう.
略歴:2009年 北海道大学大学院歯学研究科博士課程 修了,2010年 神戸大学大学院医学研究科 研究員を経て,2013年より北海道大学大学院歯学研究科 助教.
研究テーマ:骨代謝学.
関心事:飲み会.
片山 義雄(Yoshio Katayama)
神戸大学大学院医学研究科 講師.科学技術振興機構 さきがけ研究者 兼任.
© 2013 佐藤真理・片山義雄 Licensed under CC 表示 2.1 日本
(神戸大学大学院医学研究科 血液内科学分野)
email:佐藤真理,片山義雄
DOI: 10.7875/first.author.2013.140
Osteocytes regulate primary lymphoid organs and fat metabolism.
Mari Sato, Noboru Asada, Yuko Kawano, Kanako Wakahashi, Kentaro Minagawa, Hiroki Kawano, Akiko Sada, Kyoji Ikeda, Toshimitsu Matsui, Yoshio Katayama
Cell Metabolism, 18, 749-758 (2013)
要 約
骨の細胞のひとつである骨細胞は,重力や運動の刺激を感知するメカノセンサーであり,骨形成や骨吸収に関与していると考えられている.しかし,骨から遠く離れた臓器に対する役割についてはほとんどわかっていない.筆者らは,骨細胞にダメージをあたえたマウスを用いて,全身に対する骨細胞の役割について調べた.このマウスでは骨髄細胞および胸腺ストローマ細胞の欠失によりB細胞およびT細胞が著しく減少しており,全身の白色脂肪組織が消失していた.これらの表現型は分化した新しい骨細胞が骨に埋め込まれるにしたがい,きれいに回復した.一方,野生型マウスとの伴体結合術による細胞成分および液性因子の供給,あるいは,脳の視床下部の部分的な破壊では,骨細胞にダメージをあたえたマウスに表現型の回復はみられなかった.さらに,骨細胞にダメージをあたえたマウスの脳の視床下部を破壊すると激烈な脂肪肝を呈し,これは野生型マウスとの伴体結合術により回復した.これらのことから,骨細胞はB細胞およびT細胞の分化と脂質の代謝に重要な役割をもち,全身の恒常性の維持において中枢的な役割をはたしていることが明らかになった.
はじめに
骨は骨細胞や骨芽細胞を埋め込んだ感覚臓器である.骨の細胞の90%以上をしめる骨細胞は,骨組織のなかで互いに長い細胞突起を伸ばしあって構成する網目のようなネットワーク構造を骨の隅々にまではりめぐらせている.このネットワーク構造により骨細胞の感知する重力や運動の刺激といった機械的なストレスは生物学的なシグナルに変換され,骨の表面に存在する骨芽細胞や破骨細胞を制御することにより骨の恒常性を保っている1,2).骨に重力の刺激の入らない宇宙飛行士や長期臥床者には骨量の急激な減少がみられるだけでなく,興味深いことに,免疫の低下も観察される3-6).しかしながら,骨細胞が感知する機械的なストレスが免疫および全身の恒常性に及ぼす影響は明らかになっていない.これを明らかにするため,筆者らは,メカノセンサーである骨細胞にダメージをあたえたマウスを用いて全身の解析を行った.
1.骨細胞がダメージをうけると可逆的なB細胞およびT細胞の減少とリンパ組織の萎縮が生じる
尾部懸垂にてマウスの後肢を地面につかないようにし微小重力環境にすると,後肢の骨量が減少するのみならず7),骨細胞のつくるネットワーク構造が乱れ骨髄のなかのB細胞の数の減少がみられた.B細胞の減少は微小重力環境である後肢の骨髄においてのみみられ,全身を循環する血液においては正常であった.骨細胞の全身への影響をより明確にするため,骨細胞において特異的に発現するDMP-1遺伝子プロモーターのもとジフテリア毒素受容体を発現させたトランスジェニックマウス8) を用い解析を行った.15週齢のジフテリア毒素受容体トランスジェニックマウスにジフテリア毒素を投与し,3週間後に骨細胞がダメージをうけ全身の骨組織において骨細胞のネットワーク構造が切断されたマウスを得た.この骨細胞にダメージをあたえたマウスでは,末梢血におけるミエロイド細胞の数は正常だったが,B細胞およびT細胞の数が減少し,リンパ組織である胸腺および脾臓の萎縮がみられた.ジフテリア毒素の投与から100日後には,無傷の骨芽細胞から分化した新たな骨細胞が骨組織に埋め込まれるとともに骨細胞のネットワーク構造も回復し,それにともないB細胞およびT細胞の減少とリンパ組織の萎縮も回復した.
2.骨細胞がダメージをうけると骨髄においてB細胞の分化が起こらない
フローサイトメトリー法およびコロニーアッセイ法により,骨細胞にダメージをあたえたマウスの骨髄に存在するリンパ球について調べたところ,造血幹細胞には異常がなく,ミエロイド細胞への分化にも問題はないが,B細胞への分化のみが阻害されていることがわかった.マウスの骨髄を用いた長期骨髄培養法では,培養皿にはりついた骨髄ストローマ細胞の支持による培養上清へのリンパ球の産生が観察される.骨細胞にダメージをあたえたマウスの骨髄を用いた長期骨髄培養法では,ミエロイド細胞の培養条件においてミエロイド細胞は正常に分化したが,B細胞の培養条件においてB細胞はまったく分化しなかった.培養皿にはりついた骨髄ストローマ細胞をフローサイトメトリーにより解析したところ,骨細胞にダメージをあたえたマウスの骨髄ではB細胞を特異的に支持する骨髄ストローマ細胞が消失していた.さらに,コロニーアッセイ法により,骨髄ストローマ前駆細胞は正常であること,長期骨髄培養法においてミエロイド細胞の培養条件から途中でB細胞の培養条件に切り変えるとB細胞は問題なく分化してきたことから,骨細胞にダメージをあたえたマウスでは骨髄ストローマ細胞がB細胞を特異的に支持する骨髄ストローマ細胞にだけ分化できないことが示唆された.これらのことから,骨細胞がダメージをうけると骨髄においてB細胞を特異的に支持する骨髄ストローマ細胞が欠失し,それによりB細胞の分化が阻害されることが明らかになった(図1).
3.骨細胞がダメージをうけると胸腺の微小環境の傷害によりT細胞が欠失する
骨細胞にダメージをあたえたマウスの胸腺は激しく萎縮し,すべての分化段階のT細胞が激減していた.T細胞前駆細胞も同様に激減していたが,骨髄におけるリンパ球前駆細胞の減少は約1/3にすぎなかったため,T細胞前駆細胞は骨髄から胸腺に供給されているが,骨細胞にダメージをあたえたマウスの胸腺の環境では生育ができていない可能性が考えられた.実際に,T細胞の分化に大切な胸腺の微小環境を構成する胸腺ストローマ細胞のうち,皮質ストローマ細胞の減少が骨細胞にダメージをあたえたマウスの胸腺において確認された.骨細胞にダメージをあたえたマウスの胸腺における微小環境の異常を調べるため,9~10週齢の野生型マウスとジフテリア毒を投与するまえのジフテリア毒素受容体トランスジェニックマウスとを伴体結合術により結合させ,両者の血流が十分に混ざりあったのを確認してから,15週齢においてジフテリア毒素を投与することにより骨細胞にダメージをあたえ,3週間後に解析した.骨細胞にダメージをあたえたマウスのT細胞前駆細胞は野生型マウスの胸腺においては正常に生育した一方,野生型マウスのT細胞前駆細胞は骨細胞にダメージをあたえたマウスの胸腺では生育できず,予想どおり,骨細胞にダメージをあたえたマウスの胸腺では胸腺ストローマ細胞の減少によりT細胞の分化が阻害されていることが明らかになった.重要なことに,伴体結合術では細胞成分のみならず血液中のホルモンなどの液性因子も野生型マウスから骨細胞にダメージをあたえたマウスへと持続的に供給される.しかし,伴体結合術では骨細胞にダメージをあたえたマウスの胸腺の萎縮はまったく回復しなかったことから,骨細胞は遠隔臓器である胸腺の微小環境を構成する胸腺ストローマ細胞を,液性因子を介すことなく制御していることが明らかになった(図1).
4.骨細胞は全身における脂質の代謝を制御する
骨細胞にダメージをあたえたマウスはジフテリア毒素の投与ののち3週間でみるみる体重が減少し,骨細胞の新生にともない体重はゆるやかに回復する.これは白色脂肪組織の消失に起因し,骨細胞にダメージをあたえたマウスの皮下脂肪組織,腸管膜脂肪組織,精巣上体周囲脂肪塊は消失していた.これはヒトの疾患である全身性リポジストロフィーと類似しており,実際に,骨細胞にダメージをあたえたマウスの血中のレプチン濃度は低下していた.しかし,リポジストロフィーの原因遺伝子と報告されており脂質合成関連遺伝子でもあるAGPAT2遺伝子やseipin遺伝子などの発現は骨細胞にダメージをあたえたマウスの脳および脂肪組織においてはむしろ上昇しており,脂肪細胞の分化に関与するPPARγ遺伝子の発現も上昇していた.さらに,ヒトのリポジストロフィーとは対照的に,骨細胞にダメージをあたえたマウスにおいて糖尿病の傾向はみられなかった.酸素の消費量,二酸化炭素の排出量,熱の産生を測定したところ,骨細胞にダメージをあたえたマウスにおいて全身のエネルギー代謝は低下していた.すなわち,骨細胞にダメージをあたえたマウスにおいて消失した脂肪組織は,エネルギーとして消費されたのではなく,たんに失われているだけであった.実際に,骨細胞にダメージをあたえたマウスの血中からは遊離脂肪酸やトリアシルグリセロールといった脂質が著しく減少していた.骨細胞にダメージをあたえたマウスでは摂食量がわずかながら減少していたため,高脂肪食にて飼育したが脂肪組織の消失は防げなかった.この脂肪組織の消失の原因については,下痢や血便がみられないことから消化管の異常による吸収の障害による可能性は低く,心拍数の増加や頻脈がみられないことから甲状腺機能亢進症やカテコラミン過剰症といった内分泌の異常によるものでもないと考えられた.また,伴体結合術によっても脂肪組織の消失は改善されなかったことから,骨細胞からの血中へと産生される液性因子が原因であるとも考えにくかった.
これらの結果から,骨細胞が脳を介し脂質の代謝を制御しているとの仮説をたて,骨量の制御に重要である脳の視床下部の一部,腹内側核あるいは弓状核を破壊することにより,骨細胞にダメージをあたえたマウスにおいて脂肪組織の消失が回復するかどうか検討した.脳のこれらの部位は摂食の中枢でもあるため,その破壊ののちには摂食量が増加してマウスは肥満を呈するが,骨細胞にダメージをあたえると,同様に脂肪組織は消失した.しかしながら驚くべきことに,脳の視床下部の一部を破壊したマウスの骨細胞にダメージをあたえると激烈な脂肪肝を呈した.この脂肪肝は野生型マウスとの伴体結合術により回復したため,脳の視床下部の一部を破壊したマウスの骨細胞にダメージをあたえると,肝臓において脂質を排出する能力が低下すると推測された.実際に,脳の視床下部の一部を破壊したマウスの骨細胞にダメージをあたえると,肝臓において脂質合成系の遺伝子は正常に発現していたが,脂質排出系の遺伝子の発現は抑制されていた.さらに,血中の遊離脂肪酸やトリアシルグリセロールの量は野生型のマウスと同じ程度に回復していた.これらの結果から,骨細胞は全身における脂質の代謝を制御し,一部分では脳と協調して肝臓における脂質の代謝機能を制御していることが明らかになった.
5.骨細胞がダメージをうけたあとの骨の環境
骨細胞にダメージをあたえたマウスにおけるダイナミックな表現型が,急速な骨リモデリング,あるいは,骨細胞がダメージをうけたことにより産生された炎症性サイトカインによるものかどうかを検討するため,骨の環境について調べた.骨細胞にダメージをあたえたマウスの骨では破骨細胞の数が増加しており急速な骨リモデリングが生じていると考えられたが,カルセイン標識実験の結果では骨リモデリングは正常なマウスと同じ程度であった.また,骨リモデリングの遅延している48~54週齢の老齢マウスにおいて骨細胞にダメージをあたえても,同様の表現型がみられた.骨細胞にダメージをあたえたマウスの血中および骨髄細胞外液において炎症性サイトカインを測定したところ,正常なマウスと差はなかった.これらのことから,骨細胞にダメージをあたえたマウスの表現型は,骨細胞の機能の喪失そのものが原因であることが明らかになった.
おわりに
今回,筆者らは,骨細胞が液性因子を介さずにB細胞およびT細胞の分化のための環境を整備し,脳と協調して全身における脂質の代謝を制御していることを明らかにした(図2).これにより,骨に存在する骨細胞が日々感じとっている重力や運動の刺激が,これら遠隔臓器の恒常性の維持において重要であることが示唆された.神経ミエリン鞘の主要な糖脂質成分の合成酵素を欠失したマウスでは骨細胞にダメージをあたえたマウスと非常によく似た表現型が観察されることから9),筆者らは,骨細胞による液性因子を介さない胸腺や脂肪組織の制御機構として神経系の関与を疑った.そして,種々の神経を除去する方法により骨細胞にダメージをあたえたマウスにおいて表現型が回復するかどうか検討したが,いずれも回復はみられなかった.今後は,骨と神経系の詳細な解析にくわえ,伴体結合術では供給されない液性因子の関与をも含めた,さらなる解析が必要である.
全身における恒常性の維持においては脳が中枢的な役割を担うと一般的に理解されているが,筆者らは,骨もまるで第2の脳であるかのように,複数の臓器を制御する中枢的な役割を担っていることを衝撃をもって実感した.骨に対する概念を新たにし,骨を頂点としたあらゆる臓器とのネットワークの制御機構のさらなる解明と理解が,生体を深く知るうえで今後も重要であろう.
文 献
- Bonewald, L. F.: The amazing osteocyte. J. Bone Miner. Res., 26, 229-238 (2011)[PubMed]
- Klein-Nulend, J., Bakker, A. D., Bacabac, R. G. et al.: Mechanosensation and transduction in osteocytes. Bone, 54, 182-190 (2013)[PubMed]
- Belavy, D. L., Beller, G., Armbrecht, G. et al.: Evidence for an additional effect of whole-body vibration above resistive exercise alone in preventing bone loss during prolonged bed rest. Osteoporos. Int., 22, 1581-1591 (2011)[PubMed]
- Crucian, B. & Sams, C.: Immune system dysregulation during spaceflight: clinical risk for exploration-class missions. J. Leukoc. Biol., 86, 1017-1018 (2009)[PubMed]
- Gueguinou, N., Huin-Schohn, C., Bascove, M. et al.: Could spaceflight-associated immune system weakening preclude the expansion of human presence beyond Earth's orbit? J. Leukoc. Biol., 86, 1027-1038 (2009)[PubMed]
- Lang, T., LeBlanc, A., Evans, H. et al.: Cortical and trabecular bone mineral loss from the spine and hip in long-duration spaceflight. J. Bone Miner. Res., 19, 1006-1012 (2004)[PubMed]
- Globus, R. K., Bikle, D. D. & Morey-Holton, E.: Effects of simulated weightlessness on bone mineral metabolism. Endocrinology, 114, 2264-2270 (1984)[PubMed]
- Tatsumi, S., Ishii, K., Amizuka, N. et al.: Targeted ablation of osteocytes induces osteoporosis with defective mechanotransduction. Cell Metab., 5, 464-475 (2007)[PubMed]
- Katayama, Y. & Frenette, P. S.: Galactocerebrosides are required postnatally for stromal-dependent bone marrow lymphopoiesis. Immunity, 18, 789-800 (2003)[PubMed]
著者プロフィール
略歴:2009年 北海道大学大学院歯学研究科博士課程 修了,2010年 神戸大学大学院医学研究科 研究員を経て,2013年より北海道大学大学院歯学研究科 助教.
研究テーマ:骨代謝学.
関心事:飲み会.
片山 義雄(Yoshio Katayama)
神戸大学大学院医学研究科 講師.科学技術振興機構 さきがけ研究者 兼任.
© 2013 佐藤真理・片山義雄 Licensed under CC 表示 2.1 日本