ノイズと細胞間の伝搬により駆動されるMAPキナーゼERKの確率的な活性化と細胞の増殖速度の制御
青木一洋・松田道行
(京都大学生命動態システム科学推進拠点事業 生命動態制御研究室)
email:青木一洋
DOI: 10.7875/first.author.2013.136
Stochastic ERK activation induced by noise and cell-to-cell propagation regulates cell density-dependent proliferation.
Kazuhiro Aoki, Yuka Kumagai, Atsuro Sakurai, Naoki Komatsu, Yoshihisa Fujita, Clara Shionyu, Michiyuki Matsuda
Molecular Cell, 52, 529-540 (2013)
MAPキナーゼに属するERKは細胞の増殖を制御する中心的なシグナル伝達タンパク質である.今回,筆者らは,ERKは確率的に活性化することにより細胞の増殖を制御していることを見い出した.バイオセンサーを用いたイメージングにより,ERKの確率的な活性化はノイズによる自発的な発火現象,および,隣接する細胞からの伝搬によりひき起こされていることがわかった.また,細胞の増殖速度はERKの活性化の振幅ではなく,活性化の頻度と相関していたことから,ERKの活性化の周波数が細胞の増殖を制御していることが示唆された.これを直接的に検証するため,光の刺激によりERKを活性化させる実験系を構築し細胞の増殖を測定したところ,持続的な刺激ではなく,間歇的な刺激によってのみ細胞の増殖は促進された.また,ERKの間歇的な活性化により特異的に発現の上昇する遺伝子を同定したところ,それらの遺伝子プロモーター領域には転写因子SRFの結合配列が有意に濃縮していることを発見した.これらの結果から,細胞の増殖はERKの活性化の振幅ではなく,活性化の時間パターンにより制御されていることが明らかになった.
日本人の死因の第1位は悪性新生物(がん)であり,この疾患の征圧は喫緊の課題である.がんはゲノムの遺伝子に変異が導入されることによりひき起こされる1).なかでも,Ras-Raf-MEK-ERKシグナル伝達系を構成する遺伝子には多くのがんにおいて変異のみられることが知られている.すでにこのシグナル伝達系を構成するタンパク質を標的とした抗がん剤は治療に使われ,また,新たな抗がん剤も開発されつつある.しかしながら,薬剤耐性の問題からがんの根治にはいたらないのが現状である.
MAPキナーゼに属するERK(extracellular signal-regulated kinase)は成長因子などの刺激により活性化ループのスレオニン残基とチロシン残基がリン酸化されることにより,それ自体のもつキナーゼ活性が上昇する.そののち,転写因子など下流の基質タンパク質をリン酸化することにより,細胞の増殖や分化といったさまざまな現象を制御する2).ERKがこのような多様な表現型を制御する分子機構としては,ERKの活性化の持続時間による制御が提唱されてきた.たとえば,ラット褐色細胞種PC12細胞では上皮細胞成長因子EGFを処理するとERKが一過的に活性化され細胞の増殖が誘導されるが,神経成長因子NGFを処理するとERKが持続的に活性化されニューロンへの分化がひき起こされる3).しかしながら,このようなERKの時間的な変化がどのようにして細胞の機能へと変換されるのかについては議論の余地が残っていた.また,これまでの多くの研究は,生化学的な手法により数百万個の細胞を使いERKの活性の平均値を測定するものであったが,ひとつの細胞のなかでERKの活性がどのように変動するのか,また,その機能的な役割についても不明であった.
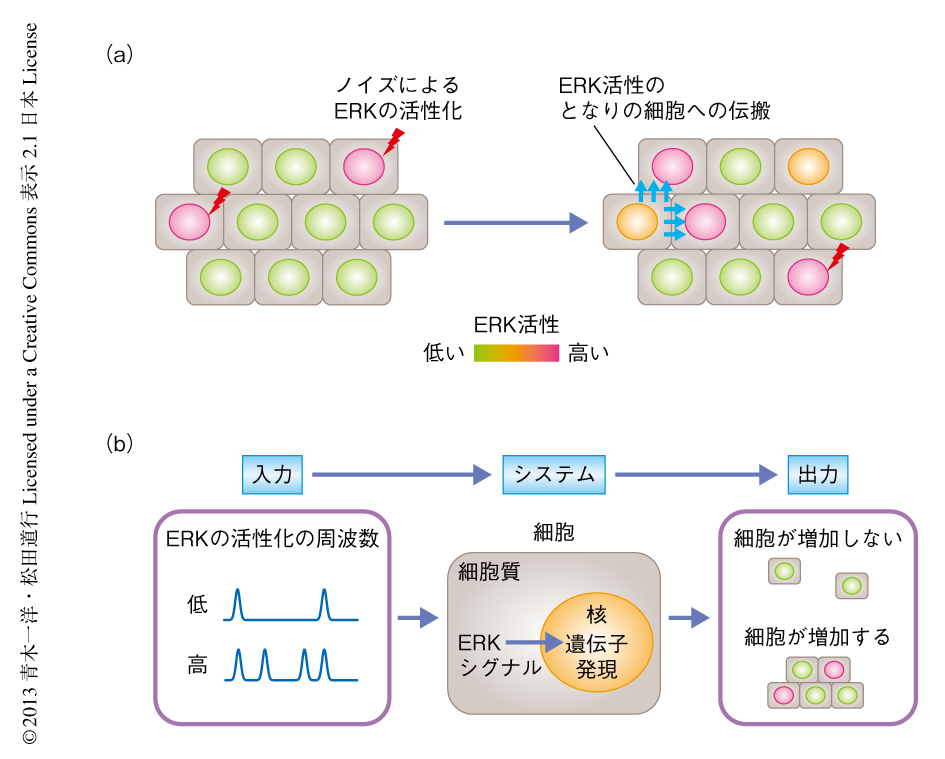
まず,蛍光共鳴エネルギー移動(fluorescence resonance energy transfer:FRET)の原理にもとづくERKのバイオセンサーを用いて4),生細胞におけるERKの活性を長期間にわたり観察する実験系を構築した.その結果,増殖している細胞においてERKは1時間から数時間におきに不規則かつ一過性に活性化すること,そして,ひとつの細胞においてERKが活性化すると数分後に隣接する細胞においてERKの活性化がひき起こされる“ERKの活性化の伝搬現象”を発見した.このようなERKの確率的な活性化は,さまざまな細胞種や生きたマウスの乳腺上皮細胞においても観察されたことから,一般的な現象であることが示された.
ERKの確率的な活性化の生理的な意義を調べるため,ラットの正常な腎臓上皮に由来するNRK-52E細胞を用いて,ERKの活性化のダイナミクスと細胞の増殖速度を測定した.さまざまな細胞密度においてERKの活性化のダイナミクスを定量した結果,ERKの活性化の平均的な度合いは細胞の密度が上昇するにつれ単調に減少したのに対し,ERKの活性化の頻度は低い細胞密度および高い細胞密度においては低く,中程度の細胞密度においてもっとも高いという二相性の応答を示す結果が得られた.細胞の増殖速度を測定したところ,低い細胞密度および高い細胞密度において増殖の速度は低く,中程度の細胞密度においてもっとも高いことがわかった.これらの結果は,ERKの活性化の強度(すなわち,振幅)ではなく,ERKの活性化の頻度(すなわち,周波数)と細胞の増殖速度とが相関することを示していた.
ERKが自発的に活性化する分子機構について検討した.Ras-Raf-MEK-ERKシグナル伝達系において上流に位置するRasの活性をFRETの原理にもとづくRasのバイオセンサーにより可視化したところ5),Rasの活性はERKとは異なりつねにほぼ一定であった.ただし,細胞にRasの優性劣性変異体を発現させるとERKの確率的な活性化はまったく起こらなくなったことから,Rasの活性はERKの活性化には必要であるが,Rasそれ自体がERKの自発的な活性化をひき起こしているわけはないことがわかった.
RafあるいはMEKの阻害剤を処理したときのERKの活性化のダイナミクスを調べた.数理モデルによる解析から,ERKの活性にパルスを発生するタンパク質であれば,その阻害剤を処理したときERKの自発的な活性化においてパルスの振幅が変化することが予測された.期待どおり,Rafの阻害剤を処理したときにはパルスの振幅の延長が観察された.一方,MEKの阻害剤を処理すると,ERKの活性化の頻度は変化したがパルスの振幅には変化がみられなかった.これらの結果から,RafがERKの確率的な活性化をひき起こすタンパク質であることが示された.これを支持する証拠として,BRaf遺伝子に変異をもつがん細胞株においてはERKの確率的な活性化は観察されないこと,1細胞におけるRafのタンパク質数はRas,MEK,ERKと比べ2桁くらい少なく6),なんらかのノイズに脆弱であると予想されること,の2つがあげられた.興味深いことに,ERKのパルスの間隔を定量化しヒストグラムを描くと指数分布を示すことがわかった.白色ノイズがある閾値をこえたときの時間間隔をヒストグラムで示すと指数分布をとることが解析的に示されており,おそらく,ERKの確率的な活性化も,ある周期的なノイズにより誘導されているのではなく,ランダムなノイズにより誘導されていると考えられた.
ERKに確率的な活性化が起こると,活性化が隣接する細胞に伝搬することがしばしば観察されていた.ERKの活性化の細胞間の伝搬は,細胞の密度によるERKの活性化の頻度に影響すると考えられたことから,その伝搬の機構について調べることにした.まず,光の刺激によりEKRを活性化する実験系を構築した.これは,シロイズナズナに由来するCRY2とRafとを融合したCRY2-Raf融合タンパク質,および,CRY2の結合タンパク質であるCIBに膜局在化シグナルであるKRasのC末端にある脂質修飾部位を付加したタンパク質を作製し,これらを細胞に共発現させ,青色の光を細胞に露光させることによりCRY2-Raf融合タンパク質を細胞膜へと移行させRafの下流のMEKおよびERKを活性化させるという実験系である7).この光の刺激によりERKの活性化する細胞株を樹立し,ERKのバイオセンサーを発現する細胞株との共培養について,蛍光顕微鏡のもとで青色の光を露光させた.その結果,光の刺激によりERKが活性化した3~6分後に隣接する細胞においてERKの活性化が認められた.したがって,ERKが活性化すると,数分後に隣接する細胞においてERKの活性化がひき起こされることが直接的に示された.
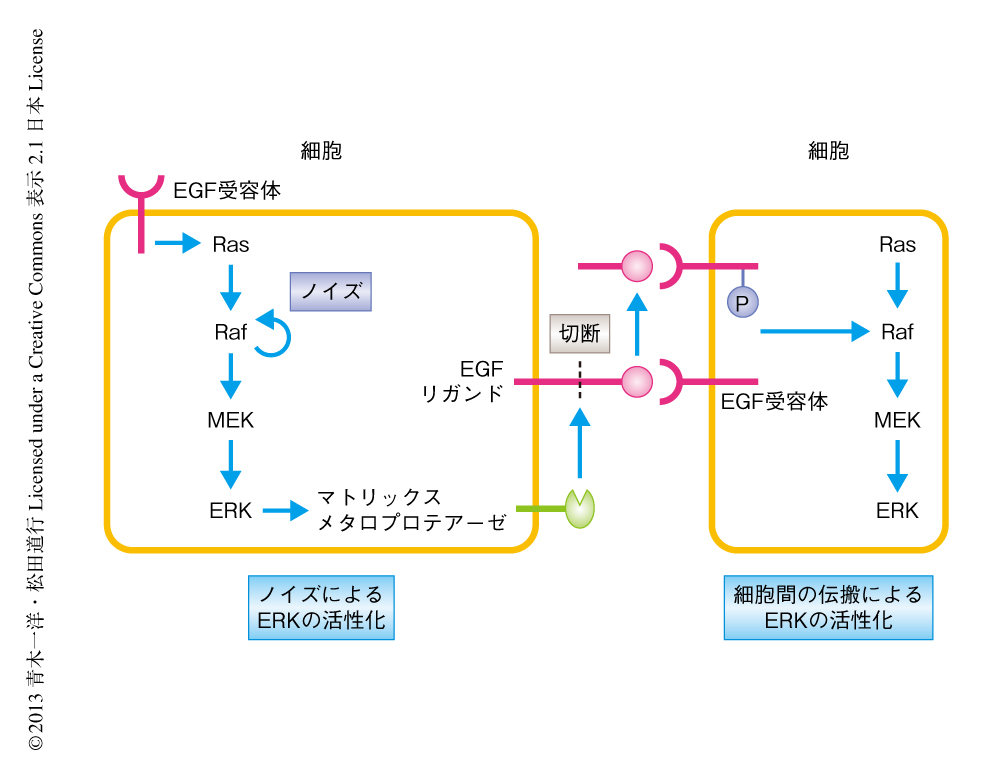
この実験系を用いて,さらにERKの活性化の伝搬機構の解明を試みた.種々の阻害剤を処理したときのERKの活性化の細胞間の伝搬を観察したところ,EGF受容体の阻害剤,さらに,マトリックスメタロプロテアーゼの阻害剤により,伝搬はほぼ完全に抑制されることがわかった.これらの結果をまとめると,1)ERKがノイズにより自発的に活性化する,2)ERKがマトリックスメタロプロテアーゼを活性化し膜結合型のEGFリガンド前駆体を切断する,3)切断により生じたEGFリガンドが隣接する細胞のEGF受容体を活性化しその下流のERKが活性化する,というモデルが考えられた(図1).
ERKの活性化の強度(振幅)ではなく,活性化の頻度(周波数)と細胞の増殖速度とが相関することが示されたが,これはあくまで相関関係であった.そこで,光の刺激によりERKの活性化する細胞株を,暗条件,明条件,間歇的な光条件(10分間の明条件-50分間の暗条件)において培養したときの,細胞の増殖速度を測定した.その結果,明条件では対照となる暗条件と比較して細胞の増殖速度は変化しなかったのに対し,間歇的な光条件では暗条件と比較して細胞の増殖速度は有意に亢進していた.したがって,ERKの活性化の振幅ではなく,活性化の周波数が細胞の増殖速度を制御していることが直接的に示された.
光の刺激によりERKの活性化する細胞株を用いて,ERKの活性化の頻度に依存して発現の制御されている遺伝子をRNAシークエンス法により解析した.暗条件,明条件,間歇的な光条件のもとで培養した細胞において,有意に発現の変動が認められる遺伝子を同定したところ,間歇的な光条件において発現の上昇する遺伝子には,それらの遺伝子プロモーター領域に転写因子SRFの結合領域が有意に存在することがわかった.一方,明条件において発現の上昇する遺伝子の遺伝子プロモーター領域には転写因子AP1の結合領域が有意に濃縮していた.これらの結果から,ERKの頻度の情報は転写因子SRPへと伝達されて,下流の遺伝子の発現を誘導していることが示唆された.
この研究により,ERKの活性化の頻度が細胞の増殖速度を制御していること,すなわち,細胞はERKの入力情報をAM(振幅の変調)システムではなくFM(周波数の変調)システムにより処理し,細胞の増殖速度という表現型として出力していることを示すことができた(図2).これまで,Ras-Raf-MEK-ERKシグナル伝達系にかぎらず,多くのシグナル伝達系は活性化の振幅により制御されていると考えられてきたが,NF-κBやp53,また,インスリンの刺激によるAktシグナル伝達系なども,活性化の時間パターンが情報の実態であるという“時間情報コード”を利用していることが示されてきており,こういった概念は,より広範な現象に適用できる可能性がある8-10).
略歴:2007年 大阪大学大学院医学系研究科 修了,2008年 京都大学大学院生命科学研究科 助教,2010年 同 講師を経て,2013年より京都大学大学院医学研究科 特定准教授.
研究テーマ:がん遺伝子のシグナル伝達系の定量的な解析.
関心事:分子標的薬の併用療法の最適化.がん細胞を一匹残らず駆逐すること.
松田 道行(Michiyuki Matsuda)
京都大学大学院生命科学研究科 教授.
© 2013 青木一洋・松田道行 Licensed under CC 表示 2.1 日本
(京都大学生命動態システム科学推進拠点事業 生命動態制御研究室)
email:青木一洋
DOI: 10.7875/first.author.2013.136
Stochastic ERK activation induced by noise and cell-to-cell propagation regulates cell density-dependent proliferation.
Kazuhiro Aoki, Yuka Kumagai, Atsuro Sakurai, Naoki Komatsu, Yoshihisa Fujita, Clara Shionyu, Michiyuki Matsuda
Molecular Cell, 52, 529-540 (2013)
要 約
MAPキナーゼに属するERKは細胞の増殖を制御する中心的なシグナル伝達タンパク質である.今回,筆者らは,ERKは確率的に活性化することにより細胞の増殖を制御していることを見い出した.バイオセンサーを用いたイメージングにより,ERKの確率的な活性化はノイズによる自発的な発火現象,および,隣接する細胞からの伝搬によりひき起こされていることがわかった.また,細胞の増殖速度はERKの活性化の振幅ではなく,活性化の頻度と相関していたことから,ERKの活性化の周波数が細胞の増殖を制御していることが示唆された.これを直接的に検証するため,光の刺激によりERKを活性化させる実験系を構築し細胞の増殖を測定したところ,持続的な刺激ではなく,間歇的な刺激によってのみ細胞の増殖は促進された.また,ERKの間歇的な活性化により特異的に発現の上昇する遺伝子を同定したところ,それらの遺伝子プロモーター領域には転写因子SRFの結合配列が有意に濃縮していることを発見した.これらの結果から,細胞の増殖はERKの活性化の振幅ではなく,活性化の時間パターンにより制御されていることが明らかになった.
はじめに
日本人の死因の第1位は悪性新生物(がん)であり,この疾患の征圧は喫緊の課題である.がんはゲノムの遺伝子に変異が導入されることによりひき起こされる1).なかでも,Ras-Raf-MEK-ERKシグナル伝達系を構成する遺伝子には多くのがんにおいて変異のみられることが知られている.すでにこのシグナル伝達系を構成するタンパク質を標的とした抗がん剤は治療に使われ,また,新たな抗がん剤も開発されつつある.しかしながら,薬剤耐性の問題からがんの根治にはいたらないのが現状である.
MAPキナーゼに属するERK(extracellular signal-regulated kinase)は成長因子などの刺激により活性化ループのスレオニン残基とチロシン残基がリン酸化されることにより,それ自体のもつキナーゼ活性が上昇する.そののち,転写因子など下流の基質タンパク質をリン酸化することにより,細胞の増殖や分化といったさまざまな現象を制御する2).ERKがこのような多様な表現型を制御する分子機構としては,ERKの活性化の持続時間による制御が提唱されてきた.たとえば,ラット褐色細胞種PC12細胞では上皮細胞成長因子EGFを処理するとERKが一過的に活性化され細胞の増殖が誘導されるが,神経成長因子NGFを処理するとERKが持続的に活性化されニューロンへの分化がひき起こされる3).しかしながら,このようなERKの時間的な変化がどのようにして細胞の機能へと変換されるのかについては議論の余地が残っていた.また,これまでの多くの研究は,生化学的な手法により数百万個の細胞を使いERKの活性の平均値を測定するものであったが,ひとつの細胞のなかでERKの活性がどのように変動するのか,また,その機能的な役割についても不明であった.
1.バイオセンサーを用いたイメージングによるERKの活性化の可視化
まず,蛍光共鳴エネルギー移動(fluorescence resonance energy transfer:FRET)の原理にもとづくERKのバイオセンサーを用いて4),生細胞におけるERKの活性を長期間にわたり観察する実験系を構築した.その結果,増殖している細胞においてERKは1時間から数時間におきに不規則かつ一過性に活性化すること,そして,ひとつの細胞においてERKが活性化すると数分後に隣接する細胞においてERKの活性化がひき起こされる“ERKの活性化の伝搬現象”を発見した.このようなERKの確率的な活性化は,さまざまな細胞種や生きたマウスの乳腺上皮細胞においても観察されたことから,一般的な現象であることが示された.
2.ERKの活性化の頻度と細胞の増殖速度
ERKの確率的な活性化の生理的な意義を調べるため,ラットの正常な腎臓上皮に由来するNRK-52E細胞を用いて,ERKの活性化のダイナミクスと細胞の増殖速度を測定した.さまざまな細胞密度においてERKの活性化のダイナミクスを定量した結果,ERKの活性化の平均的な度合いは細胞の密度が上昇するにつれ単調に減少したのに対し,ERKの活性化の頻度は低い細胞密度および高い細胞密度においては低く,中程度の細胞密度においてもっとも高いという二相性の応答を示す結果が得られた.細胞の増殖速度を測定したところ,低い細胞密度および高い細胞密度において増殖の速度は低く,中程度の細胞密度においてもっとも高いことがわかった.これらの結果は,ERKの活性化の強度(すなわち,振幅)ではなく,ERKの活性化の頻度(すなわち,周波数)と細胞の増殖速度とが相関することを示していた.
3.ERKの自発的な活性化の機構
ERKが自発的に活性化する分子機構について検討した.Ras-Raf-MEK-ERKシグナル伝達系において上流に位置するRasの活性をFRETの原理にもとづくRasのバイオセンサーにより可視化したところ5),Rasの活性はERKとは異なりつねにほぼ一定であった.ただし,細胞にRasの優性劣性変異体を発現させるとERKの確率的な活性化はまったく起こらなくなったことから,Rasの活性はERKの活性化には必要であるが,Rasそれ自体がERKの自発的な活性化をひき起こしているわけはないことがわかった.
RafあるいはMEKの阻害剤を処理したときのERKの活性化のダイナミクスを調べた.数理モデルによる解析から,ERKの活性にパルスを発生するタンパク質であれば,その阻害剤を処理したときERKの自発的な活性化においてパルスの振幅が変化することが予測された.期待どおり,Rafの阻害剤を処理したときにはパルスの振幅の延長が観察された.一方,MEKの阻害剤を処理すると,ERKの活性化の頻度は変化したがパルスの振幅には変化がみられなかった.これらの結果から,RafがERKの確率的な活性化をひき起こすタンパク質であることが示された.これを支持する証拠として,BRaf遺伝子に変異をもつがん細胞株においてはERKの確率的な活性化は観察されないこと,1細胞におけるRafのタンパク質数はRas,MEK,ERKと比べ2桁くらい少なく6),なんらかのノイズに脆弱であると予想されること,の2つがあげられた.興味深いことに,ERKのパルスの間隔を定量化しヒストグラムを描くと指数分布を示すことがわかった.白色ノイズがある閾値をこえたときの時間間隔をヒストグラムで示すと指数分布をとることが解析的に示されており,おそらく,ERKの確率的な活性化も,ある周期的なノイズにより誘導されているのではなく,ランダムなノイズにより誘導されていると考えられた.
4.ERKの活性化の細胞間の伝搬の機構
ERKに確率的な活性化が起こると,活性化が隣接する細胞に伝搬することがしばしば観察されていた.ERKの活性化の細胞間の伝搬は,細胞の密度によるERKの活性化の頻度に影響すると考えられたことから,その伝搬の機構について調べることにした.まず,光の刺激によりEKRを活性化する実験系を構築した.これは,シロイズナズナに由来するCRY2とRafとを融合したCRY2-Raf融合タンパク質,および,CRY2の結合タンパク質であるCIBに膜局在化シグナルであるKRasのC末端にある脂質修飾部位を付加したタンパク質を作製し,これらを細胞に共発現させ,青色の光を細胞に露光させることによりCRY2-Raf融合タンパク質を細胞膜へと移行させRafの下流のMEKおよびERKを活性化させるという実験系である7).この光の刺激によりERKの活性化する細胞株を樹立し,ERKのバイオセンサーを発現する細胞株との共培養について,蛍光顕微鏡のもとで青色の光を露光させた.その結果,光の刺激によりERKが活性化した3~6分後に隣接する細胞においてERKの活性化が認められた.したがって,ERKが活性化すると,数分後に隣接する細胞においてERKの活性化がひき起こされることが直接的に示された.
この実験系を用いて,さらにERKの活性化の伝搬機構の解明を試みた.種々の阻害剤を処理したときのERKの活性化の細胞間の伝搬を観察したところ,EGF受容体の阻害剤,さらに,マトリックスメタロプロテアーゼの阻害剤により,伝搬はほぼ完全に抑制されることがわかった.これらの結果をまとめると,1)ERKがノイズにより自発的に活性化する,2)ERKがマトリックスメタロプロテアーゼを活性化し膜結合型のEGFリガンド前駆体を切断する,3)切断により生じたEGFリガンドが隣接する細胞のEGF受容体を活性化しその下流のERKが活性化する,というモデルが考えられた(図1).
5.ERKの活性化の周波数と細胞の増殖との関係
ERKの活性化の強度(振幅)ではなく,活性化の頻度(周波数)と細胞の増殖速度とが相関することが示されたが,これはあくまで相関関係であった.そこで,光の刺激によりERKの活性化する細胞株を,暗条件,明条件,間歇的な光条件(10分間の明条件-50分間の暗条件)において培養したときの,細胞の増殖速度を測定した.その結果,明条件では対照となる暗条件と比較して細胞の増殖速度は変化しなかったのに対し,間歇的な光条件では暗条件と比較して細胞の増殖速度は有意に亢進していた.したがって,ERKの活性化の振幅ではなく,活性化の周波数が細胞の増殖速度を制御していることが直接的に示された.
6.ERKの活性化のダイナミクスに依存して発現する遺伝子の解析
光の刺激によりERKの活性化する細胞株を用いて,ERKの活性化の頻度に依存して発現の制御されている遺伝子をRNAシークエンス法により解析した.暗条件,明条件,間歇的な光条件のもとで培養した細胞において,有意に発現の変動が認められる遺伝子を同定したところ,間歇的な光条件において発現の上昇する遺伝子には,それらの遺伝子プロモーター領域に転写因子SRFの結合領域が有意に存在することがわかった.一方,明条件において発現の上昇する遺伝子の遺伝子プロモーター領域には転写因子AP1の結合領域が有意に濃縮していた.これらの結果から,ERKの頻度の情報は転写因子SRPへと伝達されて,下流の遺伝子の発現を誘導していることが示唆された.
おわりに
この研究により,ERKの活性化の頻度が細胞の増殖速度を制御していること,すなわち,細胞はERKの入力情報をAM(振幅の変調)システムではなくFM(周波数の変調)システムにより処理し,細胞の増殖速度という表現型として出力していることを示すことができた(図2).これまで,Ras-Raf-MEK-ERKシグナル伝達系にかぎらず,多くのシグナル伝達系は活性化の振幅により制御されていると考えられてきたが,NF-κBやp53,また,インスリンの刺激によるAktシグナル伝達系なども,活性化の時間パターンが情報の実態であるという“時間情報コード”を利用していることが示されてきており,こういった概念は,より広範な現象に適用できる可能性がある8-10).
文 献
- Hanahan, D. & Weinberg, R. A.: Hallmarks of cancer: the next generation. Cell, 144, 646-674 (2011)[PubMed]
- Nishida, E. & Gotoh, Y.: The MAP kinase cascade is essential for diverse signal transduction pathways. Trends Biochem. Sci., 18, 128-131 (1993)[PubMed]
- Sasagawa, S., Ozaki, Y., Fujita, K. et al.: Prediction and validation of the distinct dynamics of transient and sustained ERK activation. Nat. Cell Biol., 7, 365-373 (2005)[PubMed]
- Komatsu, N., Aoki, K., Yamada, M. et al.: Development of an optimized backbone of FRET biosensors for kinases and GTPases. Mol. Biol. Cell, 22, 4647-4656 (2011)[PubMed]
- Mochizuki, N., Yamashita, S., Kurokawa, K. et al.: Spatio-temporal images of growth-factor-induced activation of Ras and Rap1. Nature, 411, 1065-1068 (2001)[PubMed]
- Fujioka, A., Terai, K., Itoh, R. E. et al.: Dynamics of the Ras/ERK MAPK cascade as monitored by fluorescent probes. J. Biol. Chem., 281, 8917-8926 (2006)[PubMed]
- Kennedy, M. J., Hughes, R. M., Peteya, L. A. et al.: Rapid blue-light-mediated induction of protein interactions in living cells. Nat. Methods, 7, 973-975 (2010)[PubMed]
- Kubota, H., Noguchi, R., Toyoshima, Y. et al.: Temporal coding of insulin action through multiplexing of the AKT pathway. Mol. Cell, 46, 820-832 (2012)[PubMed] [新着論文レビュー]
- Lahav, G., Rosenfeld, N., Sigal, A. et al.: Dynamics of the p53-Mdm2 feedback loop in individual cells. Nat. Genet., 36, 147-150 (2004)[PubMed]
- Tay, S., Hughey, J. J., Lee, T. K. et al.: Single-cell NF-κB dynamics reveal digital activation and analogue information processing. Nature, 466, 267-271 (2010)[PubMed]
著者プロフィール
略歴:2007年 大阪大学大学院医学系研究科 修了,2008年 京都大学大学院生命科学研究科 助教,2010年 同 講師を経て,2013年より京都大学大学院医学研究科 特定准教授.
研究テーマ:がん遺伝子のシグナル伝達系の定量的な解析.
関心事:分子標的薬の併用療法の最適化.がん細胞を一匹残らず駆逐すること.
松田 道行(Michiyuki Matsuda)
京都大学大学院生命科学研究科 教授.
© 2013 青木一洋・松田道行 Licensed under CC 表示 2.1 日本