高度好熱菌Thermus thermophilus HB8株のCRISPR-Cas系を構成するCmr複合体の構造と機能
新海 暁男
(理化学研究所 横山構造生物学研究室)
email:新海暁男
DOI: 10.7875/first.author.2013.131
Structure and activity of the RNA-targeting type III-B CRISPR-Cas complex of Thermus thermophilus.
Raymond H. J. Staals, Yoshihiro Agari, Saori Maki-Yonekura, Yifan Zhu, David W. Taylor, Esther van Duijn, Arjan Barendregt, Marnix Vlot, Jasper J. Koehorst, Keiko Sakamoto, Akiko Masuda, Naoshi Dohmae, Peter J. Schaap, Jennifer A. Doudna, Albert J.R. Heck, Koji Yonekura, John van der Oost, Akeo Shinkai
Molecular Cell, 52, 135-145 (2013)
CRISPR-Cas系は,細胞に侵入したファージのDNAやプラスミドなどの核酸に対する細菌に特有の獲得免疫系である.筆者らは,高度好熱菌Thermus thermophilus HB8株のもつ多種類のCRISPR-Cas系の役割や作用機作の全貌を明らかにすることをめざしている.今回,タイプIII-Bに分類されるCmr複合体の構造および機能を解析した.Cmr複合体は6種類のタンパク質Cmr1~Cmr6と小分子RNAであるcrRNAからなるが,解析の結果,1分子のCmr1,1分子のCmr2,1分子のCmr3,4分子のCmr4,3分子のCmr5,1分子のCmr6,1分子のcrRNAから構成されることが明らかになった.Cmr複合体はcrRNAとの相補的な配列を含む一本鎖RNAに対して特異的に,5箇所を6塩基の間隔で切断した.電子顕微鏡法による解析の結果,Cmr複合体は細長い形状をしており,中央部には4分子のCmr4と3分子のCmr5がらせん状に位置していた.Cmr4の間隔はRNAの6~7塩基に相当したことから,RNA分解の活性中心はCmr4にあると推察された.侵入したDNAの切断に関与する,大腸菌に由来するCascade複合体も同様のらせん構造をしていることから,Cmr複合体とCascade複合体は同じ起源から派生したと考えられた.
CRISPR-Cas系は,ゲノム解析のなされている真正細菌の約40%,古細菌の約90%のもつ,真核生物におけるRNAi系に類似した,細菌に特有の獲得免疫系である1,2).この系は,25~50 bpのパリンドローム様の配列が25~50 bpの間隔のスペーサー配列を隔てリピート部位として存在するDNA領域であるCRISPR領域と,CRISPR領域の近傍に存在するcas遺伝子にコードされるタンパク質から構成されている.CRISPR領域のスペーサー配列がファージのDNAやプラスミドなど細胞へ侵入した核酸の配列の一部と同一である場合,細菌はそれらのDNA,あるいは,DNAから転写されたRNAを認識し切断する.CRISPR-Cas系による獲得免疫は,つぎの3段階からなる.1)侵入した核酸の一部分を切り出し新たなスペーサー配列としてCRISPR領域に挿入する.2)CRISPR領域の転写産物であるCRISPR RNA前駆体がCasの作用によりリピート部位において切断され,スペーサー配列を単位とする小分子RNAであるcrRNAが生成される.3)CasとcrRNAとの複合体が形成され,侵入したDNAの一部と相補的な配列をもつcrRNAを含む複合体が侵入したDNA(あるいは,RNA)に結合しこれを分解する.CRISPR-Cas系は,2)および3)の分子機構の違いによりタイプI~タイプIIIの3つに分類され,それぞれのタイプはさらにいくつかのサブタイプに分類される3).タイプI,タイプII,タイプIII-AではDNAを分解し,タイプIII-BではRNAを分解する.
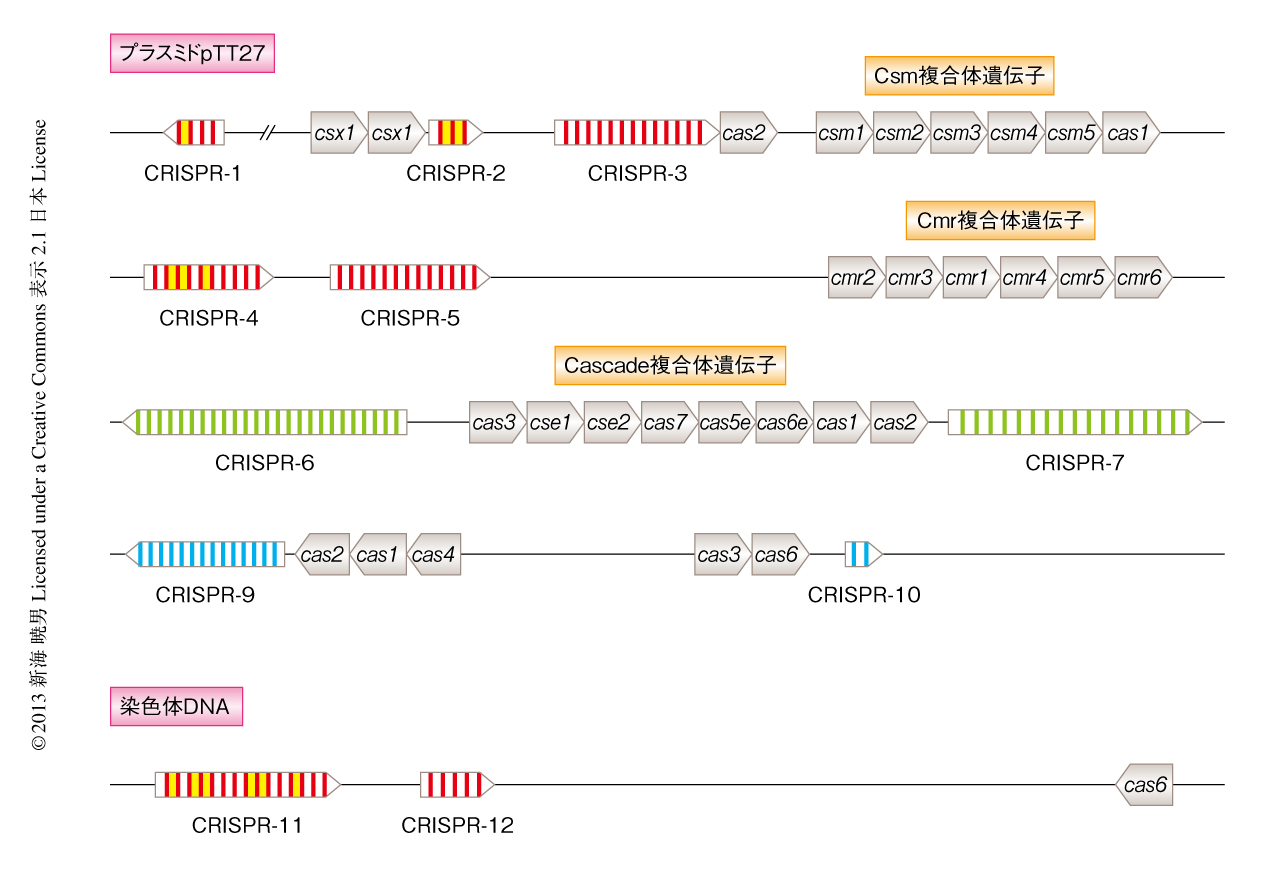
高度好熱菌Thermus thermophilus HB8株は生命の起源に近いと考えられている細菌の一種で,比較的多くのCRISPR領域とCasをもつ4,5).CRISPR領域は,プラスミドpTT27に9箇所,染色体に2箇所のあわせて11箇所が存在し,これらのCRISPR領域はリピート部位の塩基配列の違いによりカテゴリーI~カテゴリーIIIの3つに分類される.さらに,T. thermophilus HB8株は,タイプI-E(Cascade複合体),タイプIII-A(Csm複合体),タイプIII-B(Cmr複合体)を含む,合計で約30種類のCasをもつ(図1).
筆者らは,T. thermophilus HB8株のもつCRISPR-Cas系の全容を解明しひとつの細菌における獲得免疫系を体系的に理解すること,さらに,CRISPR-Cas系の進化を考察することをめざしている.今回,タイプIII-Bに分類されるCmr複合体の構造と機能について解析した.
T. thermophilus HB8株からCmr複合体を単離するため,cmr6遺伝子の3’末端側にHisタグをコードするDNAを組み込み,Cmr6-Hisタグ融合タンパク質を発現させた.Niレジンを用いてタンパク質を精製したところ,6種類のタンパク質Cmr1~Cmr6と小分子RNAから構成されるCmr複合体を精製することができた.
これまでに研究されていたCmr複合体は,古細菌Pyrococcus furiosusに由来するものと同じく古細菌Sulfolobus solfataricusに由来するもので,それぞれ,6種類のタンパク質からなるCmr-αと7種類のタンパク質からなるCmr-βに分類されている.真正細菌T. thermophilus HB8株に由来するCmr複合体は,Cmr-αに分類された.
T. thermophilus HB8株のCmr複合体に含まれるRNAを同定するため,Cmr複合体からRNAを抽出しディープシークエンシング法により解析した.その結果,ほとんどすべてのRNAはCRISPR領域のスペーサー配列に由来する小分子RNAであるcrRNAであったが,いずれのスペーサー配列も一様に見い出されたのではなく,カテゴリーIのCRISPR領域のスペーサー配列にかたよっていた(図1).これらのcrRNAにコンセンサス配列はなく,とりうる2次構造にも共通性はなかった.crRNAの選択性における分子機構の解明は今後の研究課題のひとつである.一方,これまでに報告されているcrRNAと同様に,Cmr複合体に含まれるほとんどのcrRNAにも,5’末端に共通の8塩基の配列(T. thermophilus HB8株のCmr複合体の場合は5’-ATTGCGAC-3’)が見い出された.この配列はCRISPR領域のリピート部位に由来する5’タグ配列とよばれ,これまでに報告されているほかのcrRNAの場合と同様に,Cmr複合体と結合するため必要な配列と考えられた.また,crRNAの長さは一様ではなく,46塩基と40塩基のものが大半をしめており,3’末端はふぞろいであった.これらは,P. furiosusに由来するCmr複合体よりも1塩基だけ長かった.タイプIII CRISPRではCas6がcrRNA前駆体を分解することでcrRNAが生成される.crRNAの3’末端がふぞろいであったことは,Cas6の作用により生成したcrRNAの3’末端側は,未知のヌクレアーゼによりさらに切断されていることを示唆した.
T. thermophilus HB8株のCmr複合体の分子量をネイティブ質量分析法により解析したところ,おもなピークとして364.6 kDaおよび319.0 kDaに相当する2つが検出され,衝突解離実験では319.0 kDaのピークのみが見い出された.2つのピークの差45.6 kDaはCmr1に相当するため,Cmr複合体には1分子のCmr1が含まれ,このCmr1はCmr複合体から解離しやすいことが示唆された.ほかのサブユニットはCmr複合体から解離しづらいのか,分子数を解析できなかったため,大腸菌において発現させたそれぞれの組換えタンパク質を精製し,6種類のサブユニットすべてを混合して再構成した複合体,および,一部のサブユニットを欠いた複合体を調製して同様に解析した.その結果,Cmr複合体は1分子のCmr1,1分子のCmr2,1分子のCmr3,4分子のCmr4,3分子のCmr5,1分子のCmr6,1分子のcrRNAからなることが強く示唆された.
T. thermophilus HB8株のCmr複合体はMg2+に依存してcrRNAと相補的な配列を含む一本鎖RNAを特異的に切断した.すなわち,Cmr複合体は細胞に侵入したRNA,あるいは,侵入したDNAから転写されたRNAを分解することが強く示唆された(図2).標的となるRNAは5箇所で切断された.天然型のCmr複合体のもつcrRNAは3’末端側がふぞろいな混合物であったため,RNA切断の分子機構を解析するには不都合であった.そこで,Cmr複合体のそれぞれのサブユニットと1種類のcrRNAから再構成したCmr複合体を用いて切断実験を行った.その結果,46塩基のcrRNAを用いた場合も,3’側の3塩基が欠失した43塩基のcrRNAを用いた場合も,標的となるRNAは同じ5箇所で切断された.さらに,切断を経時的に解析した結果,3’側から順に5’側へむかい6塩基ごとに切断されることが明らかになった.すなわち,標的RNAに相補的に結合したcrRNAの5’側からの距離により切断の箇所が決定されていたので,この切断機構を5’ルーラー機構と名づけた.これに対し,P. furiosusに由来するCmr複合体の場合は,crRNAの3’側から数えて14塩基目の1箇所を切断する3’ルーラー機構により標的RNAを切断する6).また,S. solfataricusに由来するCmr複合体の場合は,末端からの距離によらずT-A部位を特異的に切断する7).このように,Cmr複合体でも生物種によりRNA切断の作用機作は異なっていた.
T. thermophilus HB8株のCmr複合体の立体構造をネガティブ染色電子顕微鏡法により決定したところ,約90×100×200Åの大きさのらせん状の構造をしていた.この構造におけるおのおののサブユニットの位置を調べるため,以下の実験を行った.まず,Cmr複合体にHisタグを認識する金粒子を結合させて電子顕微鏡により観察したところ,金粒子はCmr複合体の末端に結合していた.HisタグはCmr6のC末端に融合させているので,Cmr6はCmr複合体の末端(curled head部分)に位置することが強く示唆された.さらに,Cmr複合体の電子顕微鏡法による構造にCmr2-Cmr3複合体のX線結晶構造をあてはめたところ,curled head部分とは別の末端(tail部分)にあてはまった.Cmr1がCmr複合体から遊離しやすいことを考慮すると,Cmr1はcurled head部分の末端に位置すると推察された.さらに,約22Åの分解能で決定した電子顕微鏡法による構造をもとに決定したドメイン構造を解析したところ,4分子のCmr4と3分子のCmr5に相当するドメインがCmr複合体の中央部にらせん状に位置していることが見い出された.決定されたCmr複合体の立体構造によると,4分子のCmr4が約25Åの間隔で並んでおり,これはRNAの6~7塩基に相当する距離である.Cmr複合体は標的となるRNAを5箇所6塩基の間隔で切断したので,RNAを切断する活性の中心は4つのCmr4と,さらにもう1箇所,別のサブユニットにあると考えられた.RNA分解の活性中心を決定することは今後の研究課題のひとつである.
T. thermophilus HB8株のCmr複合体と同じCmr-αに分類されるP. furiosusに由来するCmr複合体も同様のらせん状構造をしている8).さらに,大腸菌に由来するCascade複合体も同様のらせん状の構造をしている9).Cascade複合体は,1分子のCse1,2分子のCse2,6分子のCas7,1分子のCas5e,1分子のCse6e,1分子のcrRNAから構成され,crRNA前駆体を切断し生成したcrRNAを取り込んで,このRNAと相補的な配列をもつ標的DNAと結合したのち,さらにCas3と結合して標的DNAを切断する.このように,Cmr-αとCascade複合体とは異なるはたらきをもつにもかかわらず類似した構造をとっていたので,この2つの複合体の起源は同じであると推察された.一方,Cmr-βに分類されるS. solfataricusに由来するCmr複合体は,1分子のCmr1,1分子のCmr2,1分子のCmr3,1分子のCmr4,1分子のCmr5,1分子のCmr6,6分子のCmr7からなり,RNAポリメラーゼの構造に類似した“カニのハサミ”のようなかたちをしている7).Cmr-βはRNAを標的としている点はCmr-αと類似していたが,構造が著しく異なるため,この2つの複合体の起源は異なると考えられた.
この研究により,らせん状の構造がcrRNAを結合して分子の表面に“提示”するCmr複合体およびCascade複合体の特徴であることがわかった.興味深いことに,真核生物のRNAi系においてガイドRNAを分子の表面に提示するArgonauteも同様の構造をしているので10),この構造はRNAを提示するタンパク質に共通した普遍的な構造である可能性がある.CRISPR-Cas系の研究が進むにつれ,この系は予想以上に多様性に富んでいることが明らかになってきた.たとえば,T. thermophilus HB8株のCmr複合体は,同じCmr-αに分類されるP. furiosusに由来するCmr複合体と構造および機能は類似しているものの,RNA切断の分子機構は異なり,前者は5箇所,後者は1箇所を切断する.T. thermophilus HB8株のCmr複合体は侵入してきた核酸をより迅速に排除できるよう進化してきたと考えられる.
T. thermophilus HB8株のもつCRISPR-Cas系すべての機能の全貌を明らかにすることにより,ひとつの細胞におけるこの系の体系的な理解,および,多様性の理解が進むとともに,生物とウイルスとの長い戦いのなかで培われてきた両者の進化の歴史をひも解くことができることを期待している.
略歴:1991年 東京大学大学院農学系研究科博士課程 修了,同年 協和発酵工業 研究員,2002年 理化学研究所 先任研究員,2006年 同 チームリーダーを経て,2013年より同 先任研究員.
研究テーマ:CRISPR-Cas系の構造および機能.
関心事:細菌のもつ環境応答のしくみやほかの生物とのコミュニケーションのしくみ,生体分子や生物の進化.
© 2013 新海 暁男 Licensed under CC 表示 2.1 日本
(理化学研究所 横山構造生物学研究室)
email:新海暁男
DOI: 10.7875/first.author.2013.131
Structure and activity of the RNA-targeting type III-B CRISPR-Cas complex of Thermus thermophilus.
Raymond H. J. Staals, Yoshihiro Agari, Saori Maki-Yonekura, Yifan Zhu, David W. Taylor, Esther van Duijn, Arjan Barendregt, Marnix Vlot, Jasper J. Koehorst, Keiko Sakamoto, Akiko Masuda, Naoshi Dohmae, Peter J. Schaap, Jennifer A. Doudna, Albert J.R. Heck, Koji Yonekura, John van der Oost, Akeo Shinkai
Molecular Cell, 52, 135-145 (2013)
要 約
CRISPR-Cas系は,細胞に侵入したファージのDNAやプラスミドなどの核酸に対する細菌に特有の獲得免疫系である.筆者らは,高度好熱菌Thermus thermophilus HB8株のもつ多種類のCRISPR-Cas系の役割や作用機作の全貌を明らかにすることをめざしている.今回,タイプIII-Bに分類されるCmr複合体の構造および機能を解析した.Cmr複合体は6種類のタンパク質Cmr1~Cmr6と小分子RNAであるcrRNAからなるが,解析の結果,1分子のCmr1,1分子のCmr2,1分子のCmr3,4分子のCmr4,3分子のCmr5,1分子のCmr6,1分子のcrRNAから構成されることが明らかになった.Cmr複合体はcrRNAとの相補的な配列を含む一本鎖RNAに対して特異的に,5箇所を6塩基の間隔で切断した.電子顕微鏡法による解析の結果,Cmr複合体は細長い形状をしており,中央部には4分子のCmr4と3分子のCmr5がらせん状に位置していた.Cmr4の間隔はRNAの6~7塩基に相当したことから,RNA分解の活性中心はCmr4にあると推察された.侵入したDNAの切断に関与する,大腸菌に由来するCascade複合体も同様のらせん構造をしていることから,Cmr複合体とCascade複合体は同じ起源から派生したと考えられた.
はじめに
CRISPR-Cas系は,ゲノム解析のなされている真正細菌の約40%,古細菌の約90%のもつ,真核生物におけるRNAi系に類似した,細菌に特有の獲得免疫系である1,2).この系は,25~50 bpのパリンドローム様の配列が25~50 bpの間隔のスペーサー配列を隔てリピート部位として存在するDNA領域であるCRISPR領域と,CRISPR領域の近傍に存在するcas遺伝子にコードされるタンパク質から構成されている.CRISPR領域のスペーサー配列がファージのDNAやプラスミドなど細胞へ侵入した核酸の配列の一部と同一である場合,細菌はそれらのDNA,あるいは,DNAから転写されたRNAを認識し切断する.CRISPR-Cas系による獲得免疫は,つぎの3段階からなる.1)侵入した核酸の一部分を切り出し新たなスペーサー配列としてCRISPR領域に挿入する.2)CRISPR領域の転写産物であるCRISPR RNA前駆体がCasの作用によりリピート部位において切断され,スペーサー配列を単位とする小分子RNAであるcrRNAが生成される.3)CasとcrRNAとの複合体が形成され,侵入したDNAの一部と相補的な配列をもつcrRNAを含む複合体が侵入したDNA(あるいは,RNA)に結合しこれを分解する.CRISPR-Cas系は,2)および3)の分子機構の違いによりタイプI~タイプIIIの3つに分類され,それぞれのタイプはさらにいくつかのサブタイプに分類される3).タイプI,タイプII,タイプIII-AではDNAを分解し,タイプIII-BではRNAを分解する.
高度好熱菌Thermus thermophilus HB8株は生命の起源に近いと考えられている細菌の一種で,比較的多くのCRISPR領域とCasをもつ4,5).CRISPR領域は,プラスミドpTT27に9箇所,染色体に2箇所のあわせて11箇所が存在し,これらのCRISPR領域はリピート部位の塩基配列の違いによりカテゴリーI~カテゴリーIIIの3つに分類される.さらに,T. thermophilus HB8株は,タイプI-E(Cascade複合体),タイプIII-A(Csm複合体),タイプIII-B(Cmr複合体)を含む,合計で約30種類のCasをもつ(図1).
筆者らは,T. thermophilus HB8株のもつCRISPR-Cas系の全容を解明しひとつの細菌における獲得免疫系を体系的に理解すること,さらに,CRISPR-Cas系の進化を考察することをめざしている.今回,タイプIII-Bに分類されるCmr複合体の構造と機能について解析した.
1.T. thermophilus HB8株のCmr複合体は6種類のタンパク質と小分子RNAから構成される
T. thermophilus HB8株からCmr複合体を単離するため,cmr6遺伝子の3’末端側にHisタグをコードするDNAを組み込み,Cmr6-Hisタグ融合タンパク質を発現させた.Niレジンを用いてタンパク質を精製したところ,6種類のタンパク質Cmr1~Cmr6と小分子RNAから構成されるCmr複合体を精製することができた.
これまでに研究されていたCmr複合体は,古細菌Pyrococcus furiosusに由来するものと同じく古細菌Sulfolobus solfataricusに由来するもので,それぞれ,6種類のタンパク質からなるCmr-αと7種類のタンパク質からなるCmr-βに分類されている.真正細菌T. thermophilus HB8株に由来するCmr複合体は,Cmr-αに分類された.
2.T. thermophilus HB8株のCmr複合体においてcrRNAは選択的に結合している
T. thermophilus HB8株のCmr複合体に含まれるRNAを同定するため,Cmr複合体からRNAを抽出しディープシークエンシング法により解析した.その結果,ほとんどすべてのRNAはCRISPR領域のスペーサー配列に由来する小分子RNAであるcrRNAであったが,いずれのスペーサー配列も一様に見い出されたのではなく,カテゴリーIのCRISPR領域のスペーサー配列にかたよっていた(図1).これらのcrRNAにコンセンサス配列はなく,とりうる2次構造にも共通性はなかった.crRNAの選択性における分子機構の解明は今後の研究課題のひとつである.一方,これまでに報告されているcrRNAと同様に,Cmr複合体に含まれるほとんどのcrRNAにも,5’末端に共通の8塩基の配列(T. thermophilus HB8株のCmr複合体の場合は5’-ATTGCGAC-3’)が見い出された.この配列はCRISPR領域のリピート部位に由来する5’タグ配列とよばれ,これまでに報告されているほかのcrRNAの場合と同様に,Cmr複合体と結合するため必要な配列と考えられた.また,crRNAの長さは一様ではなく,46塩基と40塩基のものが大半をしめており,3’末端はふぞろいであった.これらは,P. furiosusに由来するCmr複合体よりも1塩基だけ長かった.タイプIII CRISPRではCas6がcrRNA前駆体を分解することでcrRNAが生成される.crRNAの3’末端がふぞろいであったことは,Cas6の作用により生成したcrRNAの3’末端側は,未知のヌクレアーゼによりさらに切断されていることを示唆した.
3.T. thermophilus HB8株のCmr複合体のサブユニットの構成
T. thermophilus HB8株のCmr複合体の分子量をネイティブ質量分析法により解析したところ,おもなピークとして364.6 kDaおよび319.0 kDaに相当する2つが検出され,衝突解離実験では319.0 kDaのピークのみが見い出された.2つのピークの差45.6 kDaはCmr1に相当するため,Cmr複合体には1分子のCmr1が含まれ,このCmr1はCmr複合体から解離しやすいことが示唆された.ほかのサブユニットはCmr複合体から解離しづらいのか,分子数を解析できなかったため,大腸菌において発現させたそれぞれの組換えタンパク質を精製し,6種類のサブユニットすべてを混合して再構成した複合体,および,一部のサブユニットを欠いた複合体を調製して同様に解析した.その結果,Cmr複合体は1分子のCmr1,1分子のCmr2,1分子のCmr3,4分子のCmr4,3分子のCmr5,1分子のCmr6,1分子のcrRNAからなることが強く示唆された.
4.T. thermophilus HB8株のCmr複合体は標的RNAを5箇所6塩基の間隔で切断する
T. thermophilus HB8株のCmr複合体はMg2+に依存してcrRNAと相補的な配列を含む一本鎖RNAを特異的に切断した.すなわち,Cmr複合体は細胞に侵入したRNA,あるいは,侵入したDNAから転写されたRNAを分解することが強く示唆された(図2).標的となるRNAは5箇所で切断された.天然型のCmr複合体のもつcrRNAは3’末端側がふぞろいな混合物であったため,RNA切断の分子機構を解析するには不都合であった.そこで,Cmr複合体のそれぞれのサブユニットと1種類のcrRNAから再構成したCmr複合体を用いて切断実験を行った.その結果,46塩基のcrRNAを用いた場合も,3’側の3塩基が欠失した43塩基のcrRNAを用いた場合も,標的となるRNAは同じ5箇所で切断された.さらに,切断を経時的に解析した結果,3’側から順に5’側へむかい6塩基ごとに切断されることが明らかになった.すなわち,標的RNAに相補的に結合したcrRNAの5’側からの距離により切断の箇所が決定されていたので,この切断機構を5’ルーラー機構と名づけた.これに対し,P. furiosusに由来するCmr複合体の場合は,crRNAの3’側から数えて14塩基目の1箇所を切断する3’ルーラー機構により標的RNAを切断する6).また,S. solfataricusに由来するCmr複合体の場合は,末端からの距離によらずT-A部位を特異的に切断する7).このように,Cmr複合体でも生物種によりRNA切断の作用機作は異なっていた.
5.T. thermophilus HB8株のCmr複合体の立体構造
T. thermophilus HB8株のCmr複合体の立体構造をネガティブ染色電子顕微鏡法により決定したところ,約90×100×200Åの大きさのらせん状の構造をしていた.この構造におけるおのおののサブユニットの位置を調べるため,以下の実験を行った.まず,Cmr複合体にHisタグを認識する金粒子を結合させて電子顕微鏡により観察したところ,金粒子はCmr複合体の末端に結合していた.HisタグはCmr6のC末端に融合させているので,Cmr6はCmr複合体の末端(curled head部分)に位置することが強く示唆された.さらに,Cmr複合体の電子顕微鏡法による構造にCmr2-Cmr3複合体のX線結晶構造をあてはめたところ,curled head部分とは別の末端(tail部分)にあてはまった.Cmr1がCmr複合体から遊離しやすいことを考慮すると,Cmr1はcurled head部分の末端に位置すると推察された.さらに,約22Åの分解能で決定した電子顕微鏡法による構造をもとに決定したドメイン構造を解析したところ,4分子のCmr4と3分子のCmr5に相当するドメインがCmr複合体の中央部にらせん状に位置していることが見い出された.決定されたCmr複合体の立体構造によると,4分子のCmr4が約25Åの間隔で並んでおり,これはRNAの6~7塩基に相当する距離である.Cmr複合体は標的となるRNAを5箇所6塩基の間隔で切断したので,RNAを切断する活性の中心は4つのCmr4と,さらにもう1箇所,別のサブユニットにあると考えられた.RNA分解の活性中心を決定することは今後の研究課題のひとつである.
T. thermophilus HB8株のCmr複合体と同じCmr-αに分類されるP. furiosusに由来するCmr複合体も同様のらせん状構造をしている8).さらに,大腸菌に由来するCascade複合体も同様のらせん状の構造をしている9).Cascade複合体は,1分子のCse1,2分子のCse2,6分子のCas7,1分子のCas5e,1分子のCse6e,1分子のcrRNAから構成され,crRNA前駆体を切断し生成したcrRNAを取り込んで,このRNAと相補的な配列をもつ標的DNAと結合したのち,さらにCas3と結合して標的DNAを切断する.このように,Cmr-αとCascade複合体とは異なるはたらきをもつにもかかわらず類似した構造をとっていたので,この2つの複合体の起源は同じであると推察された.一方,Cmr-βに分類されるS. solfataricusに由来するCmr複合体は,1分子のCmr1,1分子のCmr2,1分子のCmr3,1分子のCmr4,1分子のCmr5,1分子のCmr6,6分子のCmr7からなり,RNAポリメラーゼの構造に類似した“カニのハサミ”のようなかたちをしている7).Cmr-βはRNAを標的としている点はCmr-αと類似していたが,構造が著しく異なるため,この2つの複合体の起源は異なると考えられた.
おわりに
この研究により,らせん状の構造がcrRNAを結合して分子の表面に“提示”するCmr複合体およびCascade複合体の特徴であることがわかった.興味深いことに,真核生物のRNAi系においてガイドRNAを分子の表面に提示するArgonauteも同様の構造をしているので10),この構造はRNAを提示するタンパク質に共通した普遍的な構造である可能性がある.CRISPR-Cas系の研究が進むにつれ,この系は予想以上に多様性に富んでいることが明らかになってきた.たとえば,T. thermophilus HB8株のCmr複合体は,同じCmr-αに分類されるP. furiosusに由来するCmr複合体と構造および機能は類似しているものの,RNA切断の分子機構は異なり,前者は5箇所,後者は1箇所を切断する.T. thermophilus HB8株のCmr複合体は侵入してきた核酸をより迅速に排除できるよう進化してきたと考えられる.
T. thermophilus HB8株のもつCRISPR-Cas系すべての機能の全貌を明らかにすることにより,ひとつの細胞におけるこの系の体系的な理解,および,多様性の理解が進むとともに,生物とウイルスとの長い戦いのなかで培われてきた両者の進化の歴史をひも解くことができることを期待している.
文 献
- Horvath, P. & Barrangou, R.: CRISPR/Cas, the immune system of bacteria and archaea. Science, 327, 167-170 (2010)[PubMed]
- Karginov, F. V. & Hannon, G. J.: The CRISPR system: small RNA-guided defense in bacteria and archaea. Mol. Cell, 37, 7-19 (2010)[PubMed]
- Makarova, K. S., Haft, D. H., Barrangou, R. et al.: Evolution and classification of the CRISPR-Cas systems. Nat. Rev. Microbiol., 9, 467-477 (2011)[PubMed]
- Agari, Y., Sakamoto, K., Tamakoshi, M. et al.: Transcription profile of Thermus thermophilus CRISPR systems after phage infection. J. Mol. Biol., 395, 270-281 (2010)[PubMed]
- Juranek, S., Eban, T., Altuvia, Y. et al.: A genome-wide view of the expression and processing patterns of Thermus thermophilus HB8 CRISPR RNAs. RNA, 18, 783-794 (2012)[PubMed]
- Hale, C. R., Zhao, P., Olson, S. et al.: RNA-guided RNA cleavage by a CRISPR RNA-Cas protein complex. Cell, 139, 945-956 (2009)[PubMed]
- Zhang, J., Rouillon, C., Kerou, M. et al.: Structure and mechanism of the CMR complex for CRISPR-mediated antiviral immunity. Mol. Cell, 45, 303-313 (2012)[PubMed]
- Spilman, M., Cocozaki, A., Hale, C. et al.: Structure of an RNA silencing complex of the CRISPR-Cas immune system. Mol. Cell, 52, 146-152 (2013)[PubMed]
- Wiedenheft, B., Lander, G. C., Zhou, K. et al.: Structures of the RNA-guided surveillance complex from a bacterial immune system. Nature, 477, 486-489 (2011)[PubMed]
- Kuhn, C. D. & Joshua-Tor, L.: Eukaryotic Argonautes come into focus. Trends Biochem. Sci., 38, 263-271 (2013)[PubMed]
著者プロフィール
略歴:1991年 東京大学大学院農学系研究科博士課程 修了,同年 協和発酵工業 研究員,2002年 理化学研究所 先任研究員,2006年 同 チームリーダーを経て,2013年より同 先任研究員.
研究テーマ:CRISPR-Cas系の構造および機能.
関心事:細菌のもつ環境応答のしくみやほかの生物とのコミュニケーションのしくみ,生体分子や生物の進化.
© 2013 新海 暁男 Licensed under CC 表示 2.1 日本