小さなペプチドによる転写因子の活性制御
影山裕二・近藤武史
(岡崎統合バイオサイエンスセンター 発生遺伝研究部門)
email:影山裕二
DOI: 10.7875/first.author.2010.011
Small peptides switch the transcriptional activity of Shavenbaby during Drosophila embryogenesis.
T. Kondo, S. Plaza, J. Zanet, E. Benrabah, P. Valenti, Y. Hashimoto, S. Kobayashi, F. Payre, Y. Kageyama
Science, 329, 336-339 (2010)
真核生物の転写産物のなかには明確なORFをもたないRNAが多く含まれており,これらはタンパク質をコードしないノンコーディングRNAであると考えられている.最近の研究から,これらの少なくとも一部は,翻訳されて小さなペプチドを産生する可能性が指摘されている.筆者らは,11アミノ酸残基あるいは32アミノ酸残基のペプチドをコードするショウジョウバエのpri遺伝子が,転写因子であるSVBタンパク質の活性制御を行っていることを見いだした.また,培養細胞を使った実験から,pri遺伝子はSVBのN末端領域の切断を誘導することにより,転写抑制因子から転写活性化因子への変換をひき起こしていることを明らかにした.今回の結果は,小さなペプチドが生体内で重要な役割をはたしていることを実証し,ペプチドのもつ新たな可能性を示すものである.
遺伝子とは何か? タンパク質をコードしているゲノムDNA断片が遺伝子と同等の意味をもっていたのは,Xist RNAをはじめとする機能性RNAが発見される以前の話である.では,転写産物がつくられていることを指標として,そこに遺伝子があるといってよいだろうか? ヒトゲノムの詳細な解析は,ゲノムの大部分が多少なりとも転写されていることを示しており,遺伝子の存在と転写産物の存在は必ずしも一致しないことを示唆している.
遺伝学者の立場からすれば,遺伝子とは突然変異によりその存在が立証されるものである.ゲノムDNAに異常が起こり,それがなんらかの遺伝的形質の変異(表現型)として認識されるのならば,それはその形質を支配する遺伝子が確かに存在していることを意味する.表現型の解析により遺伝子の機能を推察するというやり方は100年前のショウジョウバエ遺伝学の誕生からある古典的な手法であるが,多くの生物種でゲノムの全塩基配列が解明されている現在でさえ,もっとも強力な研究方法のひとつなのである.ここでは,表現型の解析に端を発する,小さなペプチドの作用機構に関する筆者らの研究成果について述べ,機能不明な遺伝子の解析例として紹介したい.
ゲノム塩基配列の解明にともない,そこから転写されているRNA産物に関するおびただしい情報が入手できるようになった.これらの結果から明らかになったことは,ゲノムの多くの領域から,明確なORF(open reading frame)をもたず,タンパク質をコードしていないと思われるRNAが転写されているという事実である1).このようなノンコーディングRNA(non-coding RNA)のうち,小さなもの(small RNA)はタンパク質に翻訳されているとは考えにくいが,分子量の大きなものについては翻訳されている可能性がある.
そもそもORFとは,読み取り枠に開始コドン(ATG,まれに,GTG,CTGなど)と終止コドン(TAA,TAG,TGA)とがそろってさえいればその要件をみたすので,RNAポリメラーゼIIにより転写される数百塩基以上の転写産物であれば,通常は複数のORFを含んでいる.ランダムに塩基配列を並べた場合に100アミノ酸残基以上のORFができることはまれであり,そのようなORFはタンパク質をコードしていると判断されるのに対し,100アミノ酸残基以下の短いORFは,多くの場合,無視される.したがって,短いORFしかみつからない場合は,その転写産物はしばしばノンコーディングRNAであるとみなされる.しかしながら,このような“ノンコーディングRNA”も,実際には小さなペプチドをコードしている可能性が残されており,筆者らの研究対象であるpolished rice(pri)遺伝子も,ノンコーディングRNAとして同定されたのち,小さなペプチドをコードしていることが判明した例のひとつである.
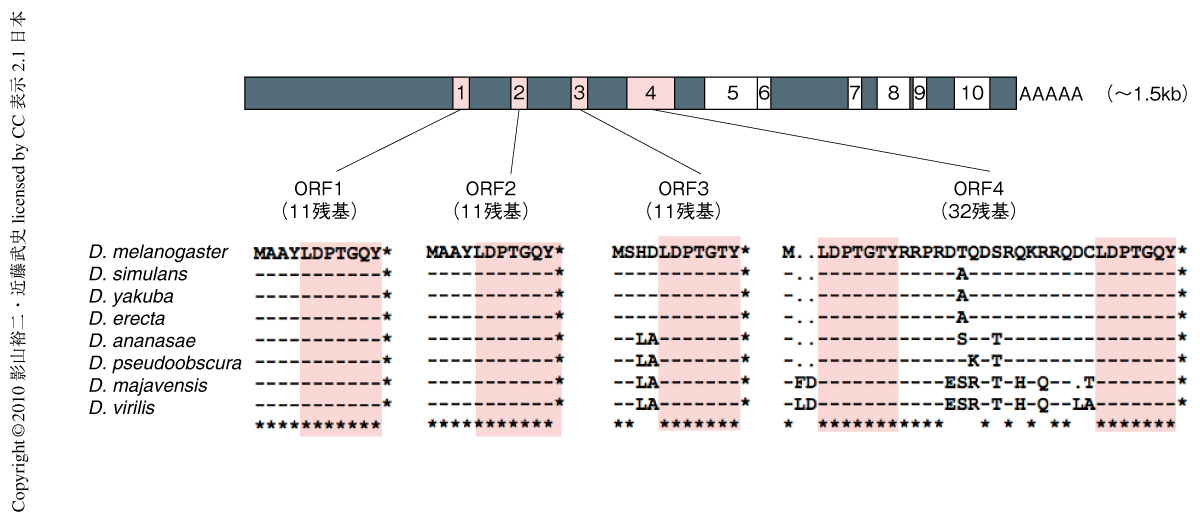
pri遺伝子はショウジョウバエにおける高分子量のノンコーディングRNA候補遺伝子として筆者らが同定した33個の遺伝子のうちのひとつであるが2),以前の研究により,pri遺伝子が4つのORFをもつポリシストロン性の遺伝子であり,これらのORFは互いによく似た11アミノ酸残基あるいは32アミノ酸残基のペプチドをコードしていることが明らかになっていた3,4)(図1).また,pri遺伝子は節足動物でよく保存された,真核生物でもっとも小さな機能的なORFをもつ遺伝子ファミリーの一員でもある4,5).ショウジョウバエpri変異体では,幼虫表皮細胞の細胞突起(trichome)および気管上皮細胞の細胞突起(taenidium)の形成に異常がみられ,これら細胞突起の形成の際に現れるアクチン束の集積もまた消失する.これらの表現型から,pri遺伝子はアクチン細胞骨格の再構成を介して細胞突起の形成に関与する遺伝子であることが示されたが,その分子機構に関しては不明であった.また,コクヌストモドキのpri相同遺伝子であるmille-pattes遺伝子は,ショウジョウバエとは異なり体節形成期に機能していることが示されていたが5),このような小さなペプチドがいかにして種間でまったく異なる生理機能を発揮しているのかについても興味深い点であった.これらの疑問に答えるために筆者らが最初に行ったのは,遺伝学的な相互作用の解析であった.
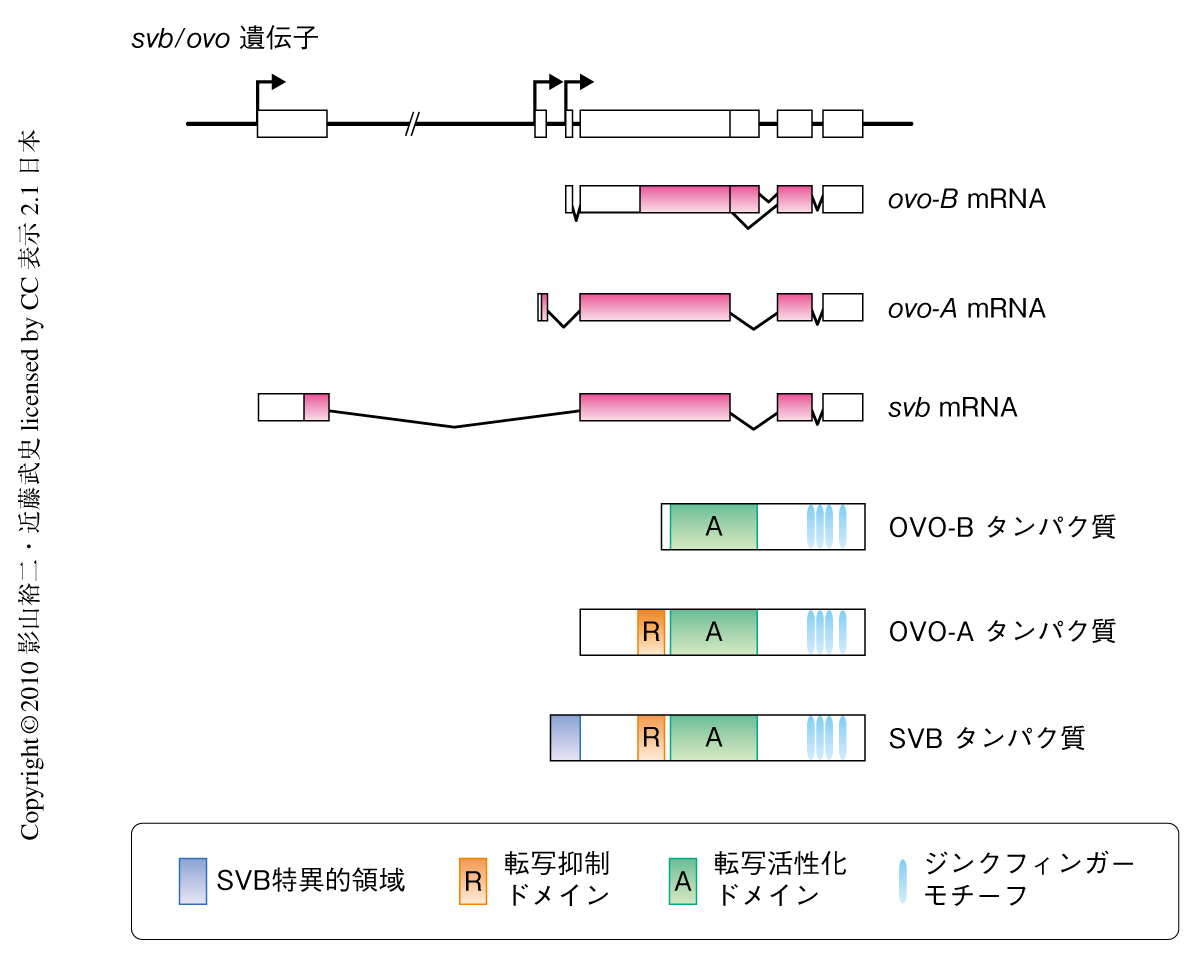
pri遺伝子の表現型のうち,幼虫表皮細胞の細胞突起の形成異常に関与している可能性がもっとも高いと考えられたのは,shavenbaby(svb)遺伝子であった.svb遺伝子の変異体はpri変異体と同じく細胞突起の欠失をひき起こし,また,svb遺伝子の過剰発現は過剰な突起形成を誘導することから,svb遺伝子は幼虫表皮細胞の細胞突起形成のマスター遺伝子であると考えられている.svb遺伝子の産物(SVBタンパク質)はジンクフィンガー型の転写因子であり(図2),幼虫表皮細胞の細胞突起形成にかかわる多くの遺伝子の発現制御を行っている6).
pri遺伝子とsvb遺伝子との遺伝学的な相互作用の有無を調べるため,遺伝子の発現を指標とする遺伝的上位性の検証を行った.pri変異体におけるsvb遺伝子の発現,あるいは,svb変異体におけるpri遺伝子の発現を調べると,いずれの場合も顕著な異常は示されないが,pri変異体におけるsvb遺伝子の下流遺伝子の発現を調べたところ,いずれの場合も劇的に減少(あるいは,完全に消失)していた.これらの結果は,pri遺伝子がSVBタンパク質の機能発現に関与している可能性を示すものであった.
pri遺伝子とsvb遺伝子の遺伝学的な相互作用をさらに詳細に解析するため,SVB/OVOタンパク質の過剰発現表現型に対するpri変異の影響を調べた.SVBの過剰発現表現型(細胞突起の異所的な形成)がpri変異により抑制されるのに対し,転写抑制ドメインをもたないOBO-Bアイソフォームの過剰発現では,野生型およびpri変異体のいずれにおいても,細胞突起の異所的な形成がみられた.また,SVBのN末端領域を欠いたアイソフォームであるOVO-Aの過剰発現は,pri遺伝子が存在する場合においても細胞突起形成を抑制した.これらの結果から,pri遺伝子はSVBアイソフォーム特異的に遺伝学的な相互作用を示すことが明らかとなり,この相互作用はSVBのN末端領域を介したものであろうと推測された.
pri変異体におけるSVBタンパク質の挙動をSVB-GFP融合タンパク質を用いて解析したところ,通常は核内で均一に分布しているようにみえるSVBタンパク質が,pri変異体ではドット状の局在を示すようになることが明らかとなった.このとき,転写活性化因子であるOVO-Bは核内に均一に分布し,転写抑制因子であるOVO-Aは核内にドット状に局在することから,pri遺伝子の活性に応じて,SVBが転写抑制型から転写活性化型へと変換されているのではないかと予想された.
この仮説を検証するため,SVBの標的遺伝子であるminiature遺伝子のエンハンサー領域(SVB/OVOの結合DNA配列を含む)にルシフェラーゼ遺伝子をコードするORFを融合させたレポーター遺伝子を用いて,ショウジョウバエ培養細胞(S2細胞)における転写活性化能の検定を行った.OVO-AおよびOVO-Bは,pri遺伝子の有無にかかわらず,それぞれ転写抑制および転写活性化活性を示すのに対し,SVBは,単独では転写抑制活性を,pri遺伝子発現プラスミドを同時に導入したときには転写活性化活性を示した.これらの結果は,SVBの転写活性化能がpri遺伝子依存的に転写抑制から転写活性化へとスイッチされることを示唆していた.
SVBタンパク質の転写活性化能の変化の実態を明らかにするため,ウェスタンブロット法により,ショウジョウバエS2細胞培養系におけるSVBの分子量を観察した.SVBを単独で培養細胞に導入した場合,SVBをコードするORFから推測される相応の分子量のバンド(全長SVB)が検出されるが,pri遺伝子発現プラスミドを同時に導入した場合には,このSVBのバンドの消失とともに,分子量の小さいSVBアイソフォーム(低分子量SVB)が検出された.この低分子量SVBは,SVBのC末端に付加されたタグやSVBの中央領域に対する特異抗体では検出されるものの,N末端領域に対する特異抗体では検出できないことから,N末端領域を欠失したアイソフォームであると考えられた.これらのことから,転写抑制型SVBの実体は全長SVBであり,転写活性化型SVBは低分子量SVBに相当するものと考えられた.
pri遺伝子による低分子量SVBの誘導には2通りの解釈が可能であった.pri遺伝子が全長SVBの途中にある別の開始コドンからの翻訳開始を誘導している可能性と,pri遺伝子が全長SVBの限定分解を誘導して低分子量SVBへの転換を促進している可能性である.これらを検証するため,以下の2つの実験を行った.ひとつは,光活性化GFPを用いた追跡実験である.SVBと光活性化GFPとの融合タンパク質を用い,PRIペプチド非存在下で全長SVBをパルス標識し,そののち,PRIペプチドの発現を誘導してSVBの核内局在への影響を顕微鏡下で観察した.実験開始時にはドット状であった全長SVB(転写抑制型SVB)は,PRIペプチド誘導後18時間で活性化型SVBと同様の均一な分布へと変化し,全長SVBが低分子量SVBへと直接変換されることが強く示唆された.もうひとつの実験は,低分子量SVBのN末端配列の決定である.SVBとPRIペプチドを安定的に発現する培養細胞系列を確立し,ここから低分子量SVBを精製してエドマン分解法によりアミノ酸配列を決定したところ,低分子量SVBのN末端は,ATG(あるいは,GTGなどのまれな開始コドン)からはじまる配列とは一致せず,転写抑制領域のC末端近くの種間でよく保存された領域にマップされた.したがって,pri遺伝子が別の開始コドンからの翻訳を誘導している可能性はほぼ否定され,限定分解により低分子量SVBが生成されているものと考えられた.
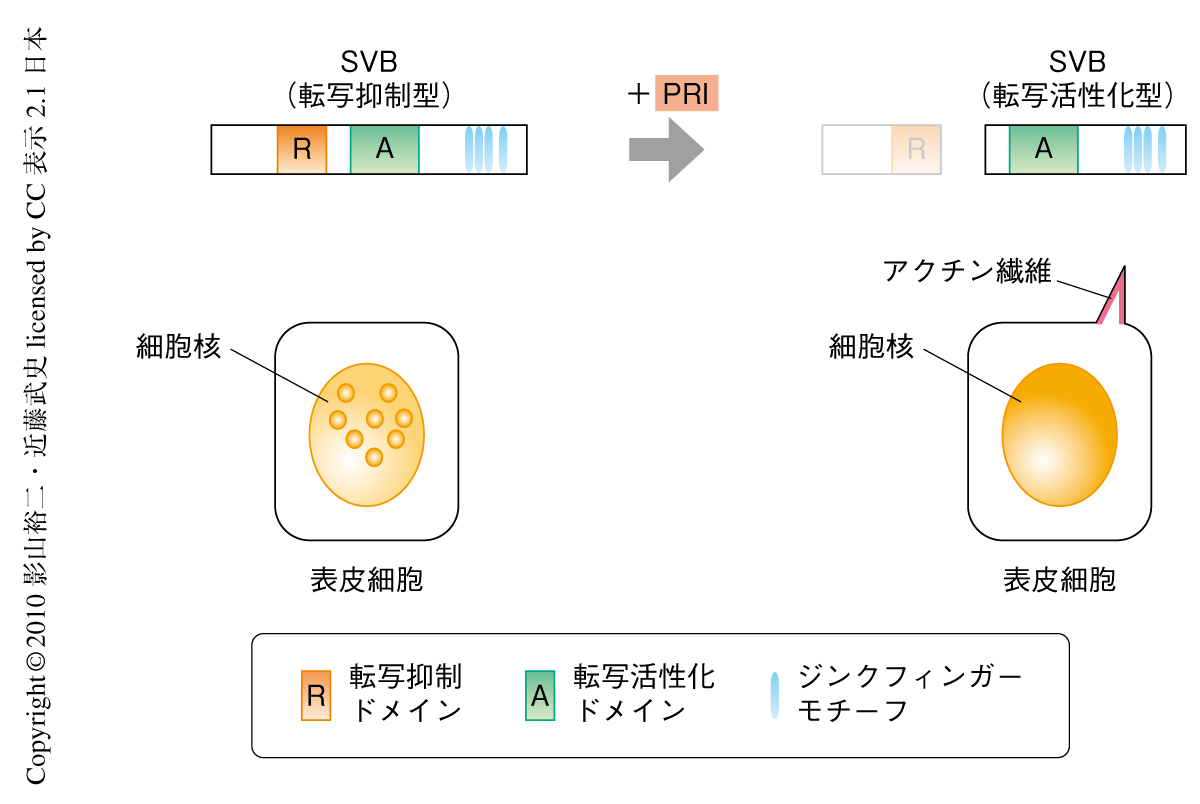
以上の実験結果はつぎのようにまとめることができる(図3).SVBはPRIペプチド非存在下では全長SVBとして核内にドット状に局在し,幼虫表皮細胞の細胞突起形成にかかわる標的遺伝子の早すぎる転写が起こらないようこれを抑制している(図3,左).pri遺伝子の発現がONになることでSVBは限定分解をうけ,転写抑制ドメインを欠失し核内に均一に分布する転写活性化因子へと転換される.その結果,SVBの標的遺伝子が発現し,アクチンの再構成などの一連の過程をへて,幼虫表皮細胞の細胞突起形成が誘導される(図3,右).PRIペプチドのような小さなペプチドが転写制御のスイッチとしてはたらき発生現象を制御しているという事実は,筆者らにとっても大きな驚きであった.
pri遺伝子がコードする小さなペプチドは,比較的大きな前駆体がプロセシングをうけて成熟型ペプチドとなる従来型の活性ペプチドとは異なる,新しいタイプのペプチドと考えられる(Desplanらは,これをマイクロペプチドとよんだ7)).PRIペプチドは分泌シグナルを含まないため,おそらくは,細胞内で機能しているものと予想される.同様の小さなペプチドをコードする遺伝子は,真核生物のゲノム中に多く存在するものと推測されているが8),多くの場合,それらの生理的な役割はまったく不明である.このように情報の少ない遺伝子の機能を明らかにしていくにあたって,遺伝学的な解析はおそらくもっとも効率的な方法であり,そのような未開の地への挑戦こそ遺伝学の醍醐味ではなかろうか.
略歴:1996年 総合研究大学院大学生命科学研究科 修了,日本学術振興会 特別研究員,1997年 米国Howard Hughes Medical Institute博士研究員,2001年 奈良先端科学技術大学院大学バイオサイエンス研究科 助手,2006年 科学技術振興機構 さきがけ研究者を経て,2010年より統合バイオサイエンス研究センター 特任助教.
研究テーマ:ショウジョウバエのゲノムからおもしろい遺伝子をみつけること.
抱負:遺伝学者の夢は,すべての遺伝子を完全なかたちで記述することである.ゲノムには多くの遺伝子が隠されており,すべてを語り尽くすには人の一生は短すぎる.せめて小さなペプチドの機能を明らかにすることくらいはできないものかと思うが,生体分子としてどのような活性があり,どのような因子と結合しているのか,とんと見当がつかない.まだまだ先は長そうである.
© 2010 影山裕二・近藤武史 Licensed under CC 表示 2.1 日本
(岡崎統合バイオサイエンスセンター 発生遺伝研究部門)
email:影山裕二
DOI: 10.7875/first.author.2010.011
Small peptides switch the transcriptional activity of Shavenbaby during Drosophila embryogenesis.
T. Kondo, S. Plaza, J. Zanet, E. Benrabah, P. Valenti, Y. Hashimoto, S. Kobayashi, F. Payre, Y. Kageyama
Science, 329, 336-339 (2010)
要 約
真核生物の転写産物のなかには明確なORFをもたないRNAが多く含まれており,これらはタンパク質をコードしないノンコーディングRNAであると考えられている.最近の研究から,これらの少なくとも一部は,翻訳されて小さなペプチドを産生する可能性が指摘されている.筆者らは,11アミノ酸残基あるいは32アミノ酸残基のペプチドをコードするショウジョウバエのpri遺伝子が,転写因子であるSVBタンパク質の活性制御を行っていることを見いだした.また,培養細胞を使った実験から,pri遺伝子はSVBのN末端領域の切断を誘導することにより,転写抑制因子から転写活性化因子への変換をひき起こしていることを明らかにした.今回の結果は,小さなペプチドが生体内で重要な役割をはたしていることを実証し,ペプチドのもつ新たな可能性を示すものである.
はじめに
遺伝子とは何か? タンパク質をコードしているゲノムDNA断片が遺伝子と同等の意味をもっていたのは,Xist RNAをはじめとする機能性RNAが発見される以前の話である.では,転写産物がつくられていることを指標として,そこに遺伝子があるといってよいだろうか? ヒトゲノムの詳細な解析は,ゲノムの大部分が多少なりとも転写されていることを示しており,遺伝子の存在と転写産物の存在は必ずしも一致しないことを示唆している.
遺伝学者の立場からすれば,遺伝子とは突然変異によりその存在が立証されるものである.ゲノムDNAに異常が起こり,それがなんらかの遺伝的形質の変異(表現型)として認識されるのならば,それはその形質を支配する遺伝子が確かに存在していることを意味する.表現型の解析により遺伝子の機能を推察するというやり方は100年前のショウジョウバエ遺伝学の誕生からある古典的な手法であるが,多くの生物種でゲノムの全塩基配列が解明されている現在でさえ,もっとも強力な研究方法のひとつなのである.ここでは,表現型の解析に端を発する,小さなペプチドの作用機構に関する筆者らの研究成果について述べ,機能不明な遺伝子の解析例として紹介したい.
1.コーディングvsノンコーディング
ゲノム塩基配列の解明にともない,そこから転写されているRNA産物に関するおびただしい情報が入手できるようになった.これらの結果から明らかになったことは,ゲノムの多くの領域から,明確なORF(open reading frame)をもたず,タンパク質をコードしていないと思われるRNAが転写されているという事実である1).このようなノンコーディングRNA(non-coding RNA)のうち,小さなもの(small RNA)はタンパク質に翻訳されているとは考えにくいが,分子量の大きなものについては翻訳されている可能性がある.
そもそもORFとは,読み取り枠に開始コドン(ATG,まれに,GTG,CTGなど)と終止コドン(TAA,TAG,TGA)とがそろってさえいればその要件をみたすので,RNAポリメラーゼIIにより転写される数百塩基以上の転写産物であれば,通常は複数のORFを含んでいる.ランダムに塩基配列を並べた場合に100アミノ酸残基以上のORFができることはまれであり,そのようなORFはタンパク質をコードしていると判断されるのに対し,100アミノ酸残基以下の短いORFは,多くの場合,無視される.したがって,短いORFしかみつからない場合は,その転写産物はしばしばノンコーディングRNAであるとみなされる.しかしながら,このような“ノンコーディングRNA”も,実際には小さなペプチドをコードしている可能性が残されており,筆者らの研究対象であるpolished rice(pri)遺伝子も,ノンコーディングRNAとして同定されたのち,小さなペプチドをコードしていることが判明した例のひとつである.
2.ショウジョウバエpri遺伝子
pri遺伝子はショウジョウバエにおける高分子量のノンコーディングRNA候補遺伝子として筆者らが同定した33個の遺伝子のうちのひとつであるが2),以前の研究により,pri遺伝子が4つのORFをもつポリシストロン性の遺伝子であり,これらのORFは互いによく似た11アミノ酸残基あるいは32アミノ酸残基のペプチドをコードしていることが明らかになっていた3,4)(図1).また,pri遺伝子は節足動物でよく保存された,真核生物でもっとも小さな機能的なORFをもつ遺伝子ファミリーの一員でもある4,5).ショウジョウバエpri変異体では,幼虫表皮細胞の細胞突起(trichome)および気管上皮細胞の細胞突起(taenidium)の形成に異常がみられ,これら細胞突起の形成の際に現れるアクチン束の集積もまた消失する.これらの表現型から,pri遺伝子はアクチン細胞骨格の再構成を介して細胞突起の形成に関与する遺伝子であることが示されたが,その分子機構に関しては不明であった.また,コクヌストモドキのpri相同遺伝子であるmille-pattes遺伝子は,ショウジョウバエとは異なり体節形成期に機能していることが示されていたが5),このような小さなペプチドがいかにして種間でまったく異なる生理機能を発揮しているのかについても興味深い点であった.これらの疑問に答えるために筆者らが最初に行ったのは,遺伝学的な相互作用の解析であった.
3.pri遺伝子はsvb遺伝子の標的遺伝子の発現に必須である
pri遺伝子の表現型のうち,幼虫表皮細胞の細胞突起の形成異常に関与している可能性がもっとも高いと考えられたのは,shavenbaby(svb)遺伝子であった.svb遺伝子の変異体はpri変異体と同じく細胞突起の欠失をひき起こし,また,svb遺伝子の過剰発現は過剰な突起形成を誘導することから,svb遺伝子は幼虫表皮細胞の細胞突起形成のマスター遺伝子であると考えられている.svb遺伝子の産物(SVBタンパク質)はジンクフィンガー型の転写因子であり(図2),幼虫表皮細胞の細胞突起形成にかかわる多くの遺伝子の発現制御を行っている6).
pri遺伝子とsvb遺伝子との遺伝学的な相互作用の有無を調べるため,遺伝子の発現を指標とする遺伝的上位性の検証を行った.pri変異体におけるsvb遺伝子の発現,あるいは,svb変異体におけるpri遺伝子の発現を調べると,いずれの場合も顕著な異常は示されないが,pri変異体におけるsvb遺伝子の下流遺伝子の発現を調べたところ,いずれの場合も劇的に減少(あるいは,完全に消失)していた.これらの結果は,pri遺伝子がSVBタンパク質の機能発現に関与している可能性を示すものであった.
4.pri遺伝子はSVBアイソフォームと遺伝学的に相互作用する
pri遺伝子とsvb遺伝子の遺伝学的な相互作用をさらに詳細に解析するため,SVB/OVOタンパク質の過剰発現表現型に対するpri変異の影響を調べた.SVBの過剰発現表現型(細胞突起の異所的な形成)がpri変異により抑制されるのに対し,転写抑制ドメインをもたないOBO-Bアイソフォームの過剰発現では,野生型およびpri変異体のいずれにおいても,細胞突起の異所的な形成がみられた.また,SVBのN末端領域を欠いたアイソフォームであるOVO-Aの過剰発現は,pri遺伝子が存在する場合においても細胞突起形成を抑制した.これらの結果から,pri遺伝子はSVBアイソフォーム特異的に遺伝学的な相互作用を示すことが明らかとなり,この相互作用はSVBのN末端領域を介したものであろうと推測された.
5.pri遺伝子はSVBタンパク質の核内局在を制御する
pri変異体におけるSVBタンパク質の挙動をSVB-GFP融合タンパク質を用いて解析したところ,通常は核内で均一に分布しているようにみえるSVBタンパク質が,pri変異体ではドット状の局在を示すようになることが明らかとなった.このとき,転写活性化因子であるOVO-Bは核内に均一に分布し,転写抑制因子であるOVO-Aは核内にドット状に局在することから,pri遺伝子の活性に応じて,SVBが転写抑制型から転写活性化型へと変換されているのではないかと予想された.
6.pri遺伝子はSVBタンパク質の転写活性化能を制御する
この仮説を検証するため,SVBの標的遺伝子であるminiature遺伝子のエンハンサー領域(SVB/OVOの結合DNA配列を含む)にルシフェラーゼ遺伝子をコードするORFを融合させたレポーター遺伝子を用いて,ショウジョウバエ培養細胞(S2細胞)における転写活性化能の検定を行った.OVO-AおよびOVO-Bは,pri遺伝子の有無にかかわらず,それぞれ転写抑制および転写活性化活性を示すのに対し,SVBは,単独では転写抑制活性を,pri遺伝子発現プラスミドを同時に導入したときには転写活性化活性を示した.これらの結果は,SVBの転写活性化能がpri遺伝子依存的に転写抑制から転写活性化へとスイッチされることを示唆していた.
7.pri遺伝子は低分子量SVBアイソフォームを誘導する
SVBタンパク質の転写活性化能の変化の実態を明らかにするため,ウェスタンブロット法により,ショウジョウバエS2細胞培養系におけるSVBの分子量を観察した.SVBを単独で培養細胞に導入した場合,SVBをコードするORFから推測される相応の分子量のバンド(全長SVB)が検出されるが,pri遺伝子発現プラスミドを同時に導入した場合には,このSVBのバンドの消失とともに,分子量の小さいSVBアイソフォーム(低分子量SVB)が検出された.この低分子量SVBは,SVBのC末端に付加されたタグやSVBの中央領域に対する特異抗体では検出されるものの,N末端領域に対する特異抗体では検出できないことから,N末端領域を欠失したアイソフォームであると考えられた.これらのことから,転写抑制型SVBの実体は全長SVBであり,転写活性化型SVBは低分子量SVBに相当するものと考えられた.
8.SVBタンパク質は限定分解をうける
pri遺伝子による低分子量SVBの誘導には2通りの解釈が可能であった.pri遺伝子が全長SVBの途中にある別の開始コドンからの翻訳開始を誘導している可能性と,pri遺伝子が全長SVBの限定分解を誘導して低分子量SVBへの転換を促進している可能性である.これらを検証するため,以下の2つの実験を行った.ひとつは,光活性化GFPを用いた追跡実験である.SVBと光活性化GFPとの融合タンパク質を用い,PRIペプチド非存在下で全長SVBをパルス標識し,そののち,PRIペプチドの発現を誘導してSVBの核内局在への影響を顕微鏡下で観察した.実験開始時にはドット状であった全長SVB(転写抑制型SVB)は,PRIペプチド誘導後18時間で活性化型SVBと同様の均一な分布へと変化し,全長SVBが低分子量SVBへと直接変換されることが強く示唆された.もうひとつの実験は,低分子量SVBのN末端配列の決定である.SVBとPRIペプチドを安定的に発現する培養細胞系列を確立し,ここから低分子量SVBを精製してエドマン分解法によりアミノ酸配列を決定したところ,低分子量SVBのN末端は,ATG(あるいは,GTGなどのまれな開始コドン)からはじまる配列とは一致せず,転写抑制領域のC末端近くの種間でよく保存された領域にマップされた.したがって,pri遺伝子が別の開始コドンからの翻訳を誘導している可能性はほぼ否定され,限定分解により低分子量SVBが生成されているものと考えられた.
9.pri遺伝子による幼虫表皮細胞の細胞突起の形成制御機構
以上の実験結果はつぎのようにまとめることができる(図3).SVBはPRIペプチド非存在下では全長SVBとして核内にドット状に局在し,幼虫表皮細胞の細胞突起形成にかかわる標的遺伝子の早すぎる転写が起こらないようこれを抑制している(図3,左).pri遺伝子の発現がONになることでSVBは限定分解をうけ,転写抑制ドメインを欠失し核内に均一に分布する転写活性化因子へと転換される.その結果,SVBの標的遺伝子が発現し,アクチンの再構成などの一連の過程をへて,幼虫表皮細胞の細胞突起形成が誘導される(図3,右).PRIペプチドのような小さなペプチドが転写制御のスイッチとしてはたらき発生現象を制御しているという事実は,筆者らにとっても大きな驚きであった.
おわりに
pri遺伝子がコードする小さなペプチドは,比較的大きな前駆体がプロセシングをうけて成熟型ペプチドとなる従来型の活性ペプチドとは異なる,新しいタイプのペプチドと考えられる(Desplanらは,これをマイクロペプチドとよんだ7)).PRIペプチドは分泌シグナルを含まないため,おそらくは,細胞内で機能しているものと予想される.同様の小さなペプチドをコードする遺伝子は,真核生物のゲノム中に多く存在するものと推測されているが8),多くの場合,それらの生理的な役割はまったく不明である.このように情報の少ない遺伝子の機能を明らかにしていくにあたって,遺伝学的な解析はおそらくもっとも効率的な方法であり,そのような未開の地への挑戦こそ遺伝学の醍醐味ではなかろうか.
文 献
- Wilusz, J. E., Sunwoo, H., Spector, D. L.: Long noncoding RNAs: functional surprises from the RNA world. Genes Dev., 23, 1494-1504 (2009)[PubMed]
- Inagaki, S., Numata, K., Kondo, T. et al.: Identification and expression analysis of putative mRNA-like non-coding RNA in Drosophila. Genes Cells, 10, 1163-1173 (2005)[PubMed]
- Kondo, T., Hashimoto, Y., Kato, K. et al.: Small peptide regulators of actin-based cell morphogenesis encoded by a polycistronic mRNA. Nat. Cell Biol., 9, 660-665 (2007)[PubMed]
- Galindo, M. I., Pueyo, J. I., Fouix, S. et al.: Peptides encoded by short ORFs control development and define a new eukaryotic gene family. PLoS Biol., 5, e106 (2007)[PubMed]
- Savard, J., Marques-Souza, H., Aranda, M. et al.: A segmentation gene in tribolium produces a polycistronic mRNA that codes for multiple conserved peptides. Cell, 126, 559-569 (2006)[PubMed]
- Chanut-Delalande, H., Fernandes, I., Roch, F. et al.: Shavenbaby couples patterning to epidermal cell shape control. PLoS Biol., 4, e290 (2006)[PubMed]
- Rosenberg, M. I. & Desplan, C.: Molecular biology. Hiding in plain sight. Science, 329, 284-285 (2010)[PubMed]
- Kastenmayer, J. P., Ni, L., Chu, A. et al.: Functional genomics of genes with small open reading frames (sORFs) in S. cerevisiae. Genome Res., 16, 365-373 (2006)[PubMed]
著者プロフィール
略歴:1996年 総合研究大学院大学生命科学研究科 修了,日本学術振興会 特別研究員,1997年 米国Howard Hughes Medical Institute博士研究員,2001年 奈良先端科学技術大学院大学バイオサイエンス研究科 助手,2006年 科学技術振興機構 さきがけ研究者を経て,2010年より統合バイオサイエンス研究センター 特任助教.
研究テーマ:ショウジョウバエのゲノムからおもしろい遺伝子をみつけること.
抱負:遺伝学者の夢は,すべての遺伝子を完全なかたちで記述することである.ゲノムには多くの遺伝子が隠されており,すべてを語り尽くすには人の一生は短すぎる.せめて小さなペプチドの機能を明らかにすることくらいはできないものかと思うが,生体分子としてどのような活性があり,どのような因子と結合しているのか,とんと見当がつかない.まだまだ先は長そうである.
© 2010 影山裕二・近藤武史 Licensed under CC 表示 2.1 日本