p62のリン酸化は選択的なオートファジーとKeap1-Nrf2系とを連動させる
一村義信・小松雅明
(東京都医学総合研究所 蛋白質リサイクルプロジェクト)
email:小松雅明
DOI: 10.7875/first.author.2013.119
Phosphorylation of p62 activates the Keap1-Nrf2 pathway during selective autophagy.
Yoshinobu Ichimura, Satoshi Waguri, Yu-shin Sou, Shun Kageyama, Jun Hasegawa, Ryosuke Ishimura, Tetsuya Saito, Yinjie Yang, Tsuguka Kouno, Toshiaki Fukutomi, Takayuki Hoshii, Atsushi Hirao, Kenji Takagi, Tsunehiro Mizushima, Hozumi Motohashi, Myung-Shik Lee, Tamotsu Yoshimori, Keiji Tanaka, Masayuki Yamamoto, Masaaki Komatsu
Molecular Cell, 51, 618-631 (2013)
p62はユビキチンシグナルを介してタンパク質の凝集体や異常なミトコンドリアに局在し,それらの構造体とともにオートファジーにより分解される.今回,筆者らは,p62の351番目のセリン残基がリン酸化されると,ユビキチンリガーゼアダプタータンパク質であるKeap1との結合親和性が著しく上昇し,Keap1の標的である転写因子Nrf2が安定化することにより一連の生体防御遺伝子の発現が上昇することを見い出した.このp62のリン酸化は選択的なオートファジーを誘導したとき,つまり,p62がタンパク質の凝集体や異常なミトコンドリアに局在したときに観察された.このことは,選択的なオートファジーとKeap1-Nrf2系とが連動していることを意味した.さらに,ヒトの肝細胞がんではリン酸化p62が異常に蓄積しており,Nrf2は恒常的に活性化されていた.このNrf2の活性化は肝がん細胞の微小環境における生存を可能にしていた.このことから,リン酸化p62とKeap1との相互作用に対する阻害剤はヒトの肝細胞がんの治療薬になりうるだろう.
細胞は酸化ストレス,代謝ストレス,細菌の感染などの非常事態に応答して種々の洗練された生体防御機構を発動し劣悪な環境をのりこえる.このような生体防御機構の代表的な例がオートファジーとKeap1-Nrf2系である.この2つの機構は酸化ストレス応答反応,代謝経路,自然免疫などに組み込まれており,その制御の不全は腫瘍の増殖をはじめさまざまな疾患に関与する.
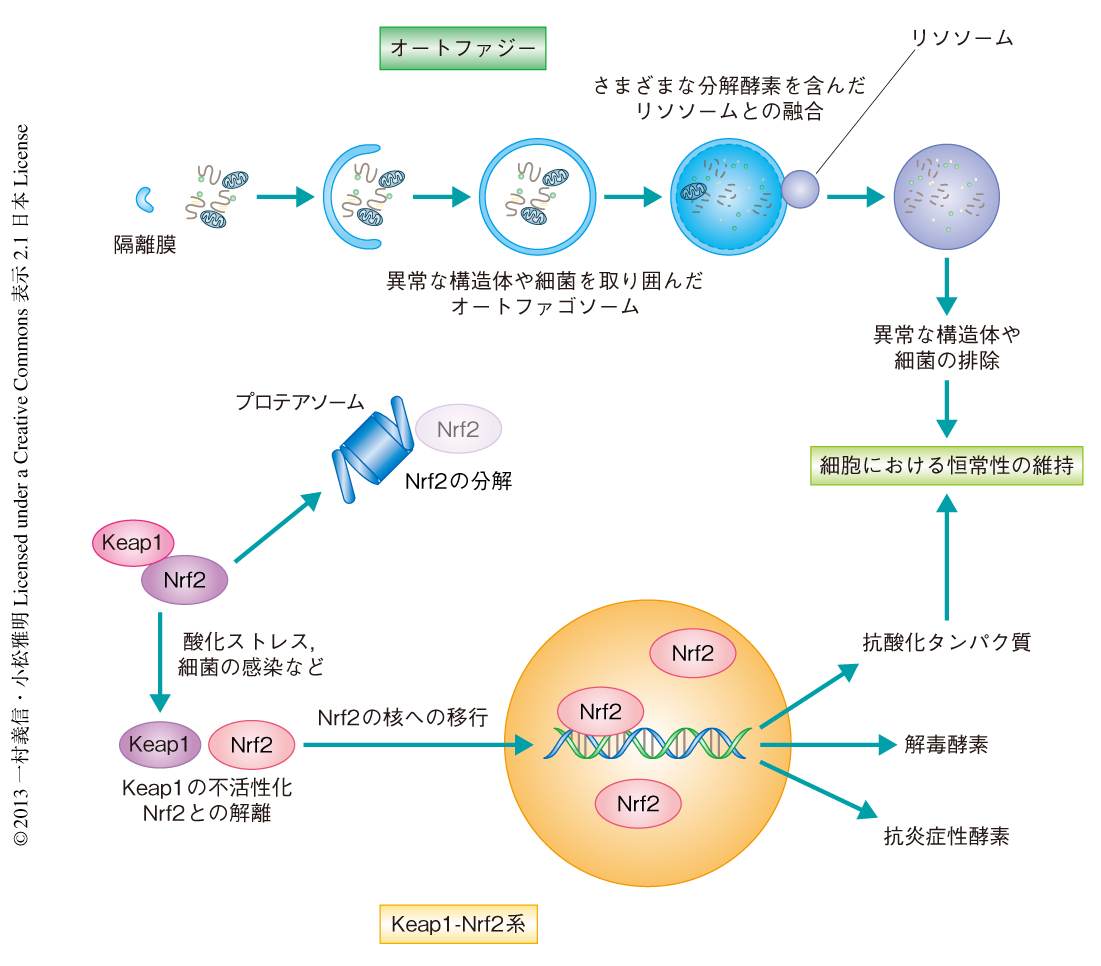
オートファジーは,細胞質に出現した隔離膜が細胞質の成分をとりかこみオートファゴソームが形成される過程と,オートファゴソームがリソソームと融合し細胞質の成分を分解する過程からなる(荒木保弘・大隅良典: 領域融合レビュー, 1, e005 2012 も参照されたい).オートファジーのもっとも基本的な役割は,栄養飢餓に応答した自己タンパク質分解を介したアミノ酸の供給である.その一方,選択的なオートファジーは,タンパク質凝集体,異常あるいは過剰なオルガネラ,さらには,細胞に侵入した細菌を特異的に排除することにより,細胞における恒常性の維持に貢献する1)(図1).p62(別名Sqstm1)はオートファゴソーム膜局在タンパク質LC3およびユビキチン化タンパク質と相互作用する領域をもつことから,ユビキチンシグナルを介しタンパク質凝集体,異常なミトコンドリア,細胞に侵入した細菌をオートファゴソームへと導くアダプタータンパク質であると想定されている2).実際に,p62はユビキチン陽性のタンパク質凝集体,異常なミトコンドリア,そして,細胞に侵入した細菌により断裂させられたエンドソーム膜に局在する.
Keap1-Nrf2系は,酸化ストレスに応答して転写因子Nrf2の活性を制御する機構である3).ユビキチンリガーゼアダプタータンパク質であるKeap1はNrf2のユビキチン化を促進することにより,プロテアソームによるNrf2の分解を促進する.一方,細胞がストレスに暴露されるとKeap1がそのシグナルを感知することでNrf2の分解が抑制され,安定化されたNrf2は核へと移行し,小Maf転写因子とともに生体防御酵素をコードする遺伝子の発現を誘導することにより,ストレスに対する生体防御機構が発動する(図1).
筆者らは,以前に,オートファジーが停滞,または,p62遺伝子の発現が上昇してp62が蓄積した場合,p62がKeap1のNrf2結合部位と競合的に結合することにより,Nrf2を活性化することを報告した4).また,p62遺伝子の発現はNrf2により正に制御されていたことから,正のフィードバックループの存在が示唆された5).しかし,p62によるNrf2活性化の制御の病態生理的な役割,また,選択的なオートファジーとの関連は不明のままであった.
筆者らは,以前に,Keap1のDCドメイン(315~598アミノ酸残基)とマウスのp62のKeap1との相互作用領域(346~358アミノ酸残基)との共結晶構造解析から,p62の351番目から354番目のアミノ酸残基Ser-Thr-Gly-GluがKeap1との結合に必須であること,また,その結合様式はKeap1とNrf2の79番目から82番目のアミノ酸残基Glu-Thr-Gly-Gluとの結合様式と酷似していることを見い出していた4,6).しかし,p62のSer351はKeap1のArg415とのみ水素結合を形成するのに対し,Nrf2のGlu79はKeap1の複数のアミノ酸残基と水素結合を形成する.事実,Keap1とp62との結合親和性は,Keap1とNrf2との結合親和性の約1/100であることが判明した.このことは,単純にp62が細胞において蓄積しただけではKeap1とNrf2との結合は阻害されないことを意味した.しかしながら,p62のSer-Thr-Gly-Gluは種間で完全に保存されていたことから,Ser351がリン酸化をうけることによりKeap1との結合親和性は著しく上昇し,Nrf2を活性化することが可能となるとの仮説をたてた.
この仮説を証明するため,Ser351のリン酸化したp62のKeap1との相互作用領域とKeap1のDCドメインとの共結晶構造解析を行った.予想どおり,Ser351はリン酸化することによりNrf2のGlu79と同様にKeap1の複数のアミノ酸残基との水素結合が可能になり,リン酸化していないときと比較してKeap1との結合親和性は30倍以上も上昇した.このことは,p62によるNrf2の活性化にはSer351のリン酸化が必要不可欠であることを意味した.実際に,Ser351をGluに置換することによりリン酸化を模倣した変異p62の過剰発現はKeap1とNrf2との相互作用を完全に阻害し,Nrf2の安定化およびNrf2の標的遺伝子の発現誘導をひき起こした.
p62のリン酸化はどのような環境において生じるのだろうか? p62はユビキチンシグナルを介して異常なミトコンドリアや細胞に侵入した細菌に集積する2).このような状況において,Nrf2の標的遺伝子の産物である一連の抗酸化タンパク質や抗炎症性酵素など生体防御酵素の発現が誘導されることは細胞にとり都合がよい.つまり,選択的なオートファジーが誘導される条件において,Keap1-Nrf2系も同時に活性化されれば細胞の防御機能が増す.この仮説を検証するため,選択的オートファジーが起こる条件において,p62のリン酸化と,それにひきつづくNrf2の活性化について検討した.
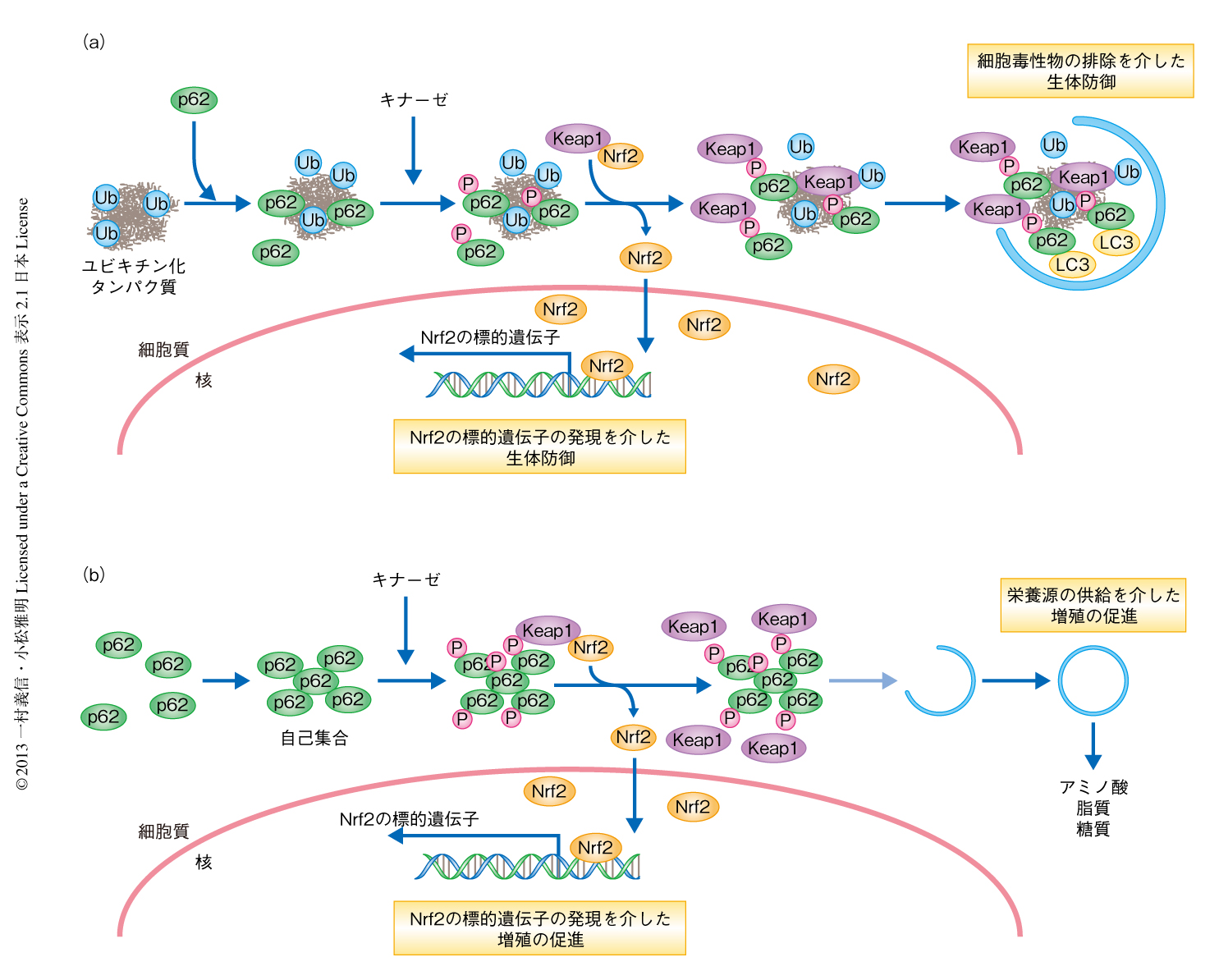
これまで報告されていたとおり,p62は酸化ストレスにより出現したタンパク質凝集体,脱共役剤により膜電位を消失した異常なミトコンドリア,さらに,細胞内に侵入したネズミチフス菌に集積した.重要なことに,これら選択的オートファジーにより分解される構造体に集積したp62はSer351がリン酸化されており,細胞質に存在するKeap1のこれらの構造体への局在の変化も観察された.p62のリン酸化およびKeap1の局在の変化と並行して,Nrf2の安定化および核への移行が起こり,Nrf2の標的遺伝子の発現誘導が起こった.p62遺伝子の欠損は,これらのストレスに応じたNrf2の核への移行および標的遺伝子の発現誘導を有意に抑制した.このことは,p62のSer351のリン酸化を介し,選択的オートファジーとKeap1-Nrf2系とが連動することを意味した(図2a).
筆者らは,これまで,マウスの肝臓においてオートファジーに必須の遺伝子であるAtg5遺伝子あるいはAtg7遺伝子を欠損させると良性の腫瘍をひき起こすこと7,8),この腫瘍の増殖はp62遺伝子を同時に欠損させることにより大幅に抑制されることを報告してきた7).重要なことに,Atg7遺伝子の欠損により肝臓に生じた腫瘍においては,Ser351のリン酸化したp62陽性かつKeap1陽性のタンパク質凝集体が蓄積しており,Nrf2の標的遺伝子の著しい発現誘導も確認された.これらの事実は,p62のリン酸化を介したNrf2の活性化が腫瘍の増殖に有利にはたらいていることを示唆した.一方,ヒトの肺がん,頭頸部がん,胆嚢がんにおいて,Nrf2遺伝子およびKeap1遺伝子に体細胞変異が同定されている.これらの変異は総じてKeap1とNrf2との相互作用の阻害をひき起こしNrf2の恒常的な活性化にいたる.また最近,PI3K-Akt経路が恒常的に活性化しているがん細胞において,Nrf2が生体防御遺伝子のみならず,ペントースリン酸経路やグルタミンから乳酸が産生されるグルタミノリシスに関与する酵素をコードする遺伝子の発現を上昇させ,微小環境における生存や抗がん剤への抵抗性をあたえるとともに,増殖に有利となる代謝の再編成をひき起こすことが明らかになった9).
ヒトの肝細胞がんやグリオーマにおいても,オートファジーの欠損による肝腫瘍と同様に,p62が過剰に蓄積し凝集することが知られていた8,10).筆者らも,約29%(102検体中30検体)のヒト肝細胞がん検体においてp62の蓄積および凝集化を確認するとともに,その凝集体において(マウスのSer351に対応する)Ser349がリン酸化されていること,さらに,凝集体にKeap1も含まれていることを形態学的に確認した.肝細胞がんにおけるp62のリン酸化の病態生理的な役割を明らかにするため,9つのヒト肝細胞がん株においてp62のSer349のリン酸化について調べたところ,Huh-1細胞株において顕著なp62のリン酸化およびNrf2の核への蓄積が確認された.Huh-1細胞にオートファジーの障害は認められなかったが,p62遺伝子の発現はほかの肝細胞がん株と比較して有意に高かった8).重要なことに,Huh-1細胞における足場に非依存的な増殖,および,ヌードマウスへの異種移植において確認された増殖は,p62遺伝子を欠損させることによりほぼ完全に抑制された.また,この増殖の抑制はp62遺伝子を欠損したHuh-1細胞に野生型p62あるいはSer349のリン酸化を模倣した変異p62を強制発現させることにより回復した一方,リン酸化しない変異p62の強制発現では回復しなかった.さらに,野生型p62あるいはSer349のリン酸化を模倣した変異p62の強制発現により回復したp62遺伝子欠損Huh-1細胞の足場に非依存的な増殖は,Nrf2のノックダウンにより抑制された.これらの結果は,p62のリン酸化を介したNrf2の活性化が肝細胞がんの増殖に決定的であることを意味した(図2b).
今後は,リン酸化p62を蓄積しているオートファジーの欠損により生じた肝腫瘍および肝細胞がんにおけるメタボローム解析などにより,実際に,Nrf2の活性化に依存した糖代謝およびアミノ酸代謝に再編成が起こっているのかどうか,明らかにしていく必要があるだろう.
おわりに
筆者らは,マウスの遺伝学的な解析により,p62によるNrf2の異常な活性化がオートファジーの欠損により生じた肝臓における病態の主因であることを明らかにしてきた4,11).しかし,これはヒトの病態ではありえないオートファジーの完全な阻害下における解析であり,p62の生理的な作用を反映しているとはいいがたかった.今回,生理的な状況におけるp62の局在の解析と遺伝学的な解析をもとに仮説をたて,オートファジーに関連したp62の生理的な役割,すなわち,オートファジーの選択的な基質を足場にしたp62によるNrf2の活性化の機構を明らかにすることができた(図2).
他方,ごく最近,筆者らは,米国のグループとの共同研究により,マクロファージにおいてAtg7遺伝子を欠損させると,p62の蓄積を介しNrf2の標的遺伝子であるスカベンジャー受容体をコードする遺伝子の発現が上昇すること,その結果,Atg7遺伝子を欠損したマクロファージでは結核菌などの細菌の取り込みが著しく増加することを報告した12).しかし,オートファジーの欠損により殺菌能力が阻害されている環境において細菌の取り込みを促進させるこの経路の生理的な機能はまったく不明である.感染の初期においては,今回の論文と同様に,マクロファージにおいてもリン酸化p62によるNrf2の活性化が起こるのであろう.この報告のモデルにしたがうと,感染の初期にNrf2が活性化されるとスカベンジャー受容体遺伝子の発現が上昇し,結核菌の取り込みが増加する.このとき,Nrf2がペントースリン酸経路にかかわる酵素などの遺伝子の発現を上昇させることによりNADPHの産生を促進し,貪食胞膜においてNADPHオキシダーゼによる殺菌を強めるようなことがあるのかもしれない.今後も,オートファジー欠損モデルを利用した新しい機構の発見が期待される.
略歴:2002年 総合研究大学院大学生命科学研究科博士課程 修了,同年 基礎生物学研究所 研究員,2005年 千葉大学大学院医学研究院 助手,2007年 順天堂大学医学部 助教を経て,2010年より東京都医学総合研究所 主席研究員.
研究テーマ:選択的オートファジー.
関心事:オートファジー研究領域の拡大.家庭菜園.
小松 雅明(Masaaki Komatsu)
東京都医学総合研究所 プロジェクトリーダー.
研究室URL:http://www.igakuken.or.jp/protein/
© 2013 一村義信・小松雅明 Licensed under CC 表示 2.1 日本
(東京都医学総合研究所 蛋白質リサイクルプロジェクト)
email:小松雅明
DOI: 10.7875/first.author.2013.119
Phosphorylation of p62 activates the Keap1-Nrf2 pathway during selective autophagy.
Yoshinobu Ichimura, Satoshi Waguri, Yu-shin Sou, Shun Kageyama, Jun Hasegawa, Ryosuke Ishimura, Tetsuya Saito, Yinjie Yang, Tsuguka Kouno, Toshiaki Fukutomi, Takayuki Hoshii, Atsushi Hirao, Kenji Takagi, Tsunehiro Mizushima, Hozumi Motohashi, Myung-Shik Lee, Tamotsu Yoshimori, Keiji Tanaka, Masayuki Yamamoto, Masaaki Komatsu
Molecular Cell, 51, 618-631 (2013)
この論文に出現する遺伝子・タンパク質のUniprot ID
p62(Q64337), Keap1(Q9Z2X8), Nrf2(Q60795), ユビキチン, ユビキチンリガーゼ, プロテアソーム, 小Maf転写因子, Atg5(Q99J83), Atg7(Q9D906), PI3K, Akt, スカベンジャー受容体, NADPHオキシダーゼ
要 約
p62はユビキチンシグナルを介してタンパク質の凝集体や異常なミトコンドリアに局在し,それらの構造体とともにオートファジーにより分解される.今回,筆者らは,p62の351番目のセリン残基がリン酸化されると,ユビキチンリガーゼアダプタータンパク質であるKeap1との結合親和性が著しく上昇し,Keap1の標的である転写因子Nrf2が安定化することにより一連の生体防御遺伝子の発現が上昇することを見い出した.このp62のリン酸化は選択的なオートファジーを誘導したとき,つまり,p62がタンパク質の凝集体や異常なミトコンドリアに局在したときに観察された.このことは,選択的なオートファジーとKeap1-Nrf2系とが連動していることを意味した.さらに,ヒトの肝細胞がんではリン酸化p62が異常に蓄積しており,Nrf2は恒常的に活性化されていた.このNrf2の活性化は肝がん細胞の微小環境における生存を可能にしていた.このことから,リン酸化p62とKeap1との相互作用に対する阻害剤はヒトの肝細胞がんの治療薬になりうるだろう.
はじめに
細胞は酸化ストレス,代謝ストレス,細菌の感染などの非常事態に応答して種々の洗練された生体防御機構を発動し劣悪な環境をのりこえる.このような生体防御機構の代表的な例がオートファジーとKeap1-Nrf2系である.この2つの機構は酸化ストレス応答反応,代謝経路,自然免疫などに組み込まれており,その制御の不全は腫瘍の増殖をはじめさまざまな疾患に関与する.
オートファジーは,細胞質に出現した隔離膜が細胞質の成分をとりかこみオートファゴソームが形成される過程と,オートファゴソームがリソソームと融合し細胞質の成分を分解する過程からなる(荒木保弘・大隅良典: 領域融合レビュー, 1, e005 2012 も参照されたい).オートファジーのもっとも基本的な役割は,栄養飢餓に応答した自己タンパク質分解を介したアミノ酸の供給である.その一方,選択的なオートファジーは,タンパク質凝集体,異常あるいは過剰なオルガネラ,さらには,細胞に侵入した細菌を特異的に排除することにより,細胞における恒常性の維持に貢献する1)(図1).p62(別名Sqstm1)はオートファゴソーム膜局在タンパク質LC3およびユビキチン化タンパク質と相互作用する領域をもつことから,ユビキチンシグナルを介しタンパク質凝集体,異常なミトコンドリア,細胞に侵入した細菌をオートファゴソームへと導くアダプタータンパク質であると想定されている2).実際に,p62はユビキチン陽性のタンパク質凝集体,異常なミトコンドリア,そして,細胞に侵入した細菌により断裂させられたエンドソーム膜に局在する.
Keap1-Nrf2系は,酸化ストレスに応答して転写因子Nrf2の活性を制御する機構である3).ユビキチンリガーゼアダプタータンパク質であるKeap1はNrf2のユビキチン化を促進することにより,プロテアソームによるNrf2の分解を促進する.一方,細胞がストレスに暴露されるとKeap1がそのシグナルを感知することでNrf2の分解が抑制され,安定化されたNrf2は核へと移行し,小Maf転写因子とともに生体防御酵素をコードする遺伝子の発現を誘導することにより,ストレスに対する生体防御機構が発動する(図1).
筆者らは,以前に,オートファジーが停滞,または,p62遺伝子の発現が上昇してp62が蓄積した場合,p62がKeap1のNrf2結合部位と競合的に結合することにより,Nrf2を活性化することを報告した4).また,p62遺伝子の発現はNrf2により正に制御されていたことから,正のフィードバックループの存在が示唆された5).しかし,p62によるNrf2活性化の制御の病態生理的な役割,また,選択的なオートファジーとの関連は不明のままであった.
1.リン酸化p62およびKeap1の構造解析
筆者らは,以前に,Keap1のDCドメイン(315~598アミノ酸残基)とマウスのp62のKeap1との相互作用領域(346~358アミノ酸残基)との共結晶構造解析から,p62の351番目から354番目のアミノ酸残基Ser-Thr-Gly-GluがKeap1との結合に必須であること,また,その結合様式はKeap1とNrf2の79番目から82番目のアミノ酸残基Glu-Thr-Gly-Gluとの結合様式と酷似していることを見い出していた4,6).しかし,p62のSer351はKeap1のArg415とのみ水素結合を形成するのに対し,Nrf2のGlu79はKeap1の複数のアミノ酸残基と水素結合を形成する.事実,Keap1とp62との結合親和性は,Keap1とNrf2との結合親和性の約1/100であることが判明した.このことは,単純にp62が細胞において蓄積しただけではKeap1とNrf2との結合は阻害されないことを意味した.しかしながら,p62のSer-Thr-Gly-Gluは種間で完全に保存されていたことから,Ser351がリン酸化をうけることによりKeap1との結合親和性は著しく上昇し,Nrf2を活性化することが可能となるとの仮説をたてた.
この仮説を証明するため,Ser351のリン酸化したp62のKeap1との相互作用領域とKeap1のDCドメインとの共結晶構造解析を行った.予想どおり,Ser351はリン酸化することによりNrf2のGlu79と同様にKeap1の複数のアミノ酸残基との水素結合が可能になり,リン酸化していないときと比較してKeap1との結合親和性は30倍以上も上昇した.このことは,p62によるNrf2の活性化にはSer351のリン酸化が必要不可欠であることを意味した.実際に,Ser351をGluに置換することによりリン酸化を模倣した変異p62の過剰発現はKeap1とNrf2との相互作用を完全に阻害し,Nrf2の安定化およびNrf2の標的遺伝子の発現誘導をひき起こした.
2.選択的なオートファジーを誘導したときにおけるp62のリン酸化とNrf2の活性化
p62のリン酸化はどのような環境において生じるのだろうか? p62はユビキチンシグナルを介して異常なミトコンドリアや細胞に侵入した細菌に集積する2).このような状況において,Nrf2の標的遺伝子の産物である一連の抗酸化タンパク質や抗炎症性酵素など生体防御酵素の発現が誘導されることは細胞にとり都合がよい.つまり,選択的なオートファジーが誘導される条件において,Keap1-Nrf2系も同時に活性化されれば細胞の防御機能が増す.この仮説を検証するため,選択的オートファジーが起こる条件において,p62のリン酸化と,それにひきつづくNrf2の活性化について検討した.
これまで報告されていたとおり,p62は酸化ストレスにより出現したタンパク質凝集体,脱共役剤により膜電位を消失した異常なミトコンドリア,さらに,細胞内に侵入したネズミチフス菌に集積した.重要なことに,これら選択的オートファジーにより分解される構造体に集積したp62はSer351がリン酸化されており,細胞質に存在するKeap1のこれらの構造体への局在の変化も観察された.p62のリン酸化およびKeap1の局在の変化と並行して,Nrf2の安定化および核への移行が起こり,Nrf2の標的遺伝子の発現誘導が起こった.p62遺伝子の欠損は,これらのストレスに応じたNrf2の核への移行および標的遺伝子の発現誘導を有意に抑制した.このことは,p62のSer351のリン酸化を介し,選択的オートファジーとKeap1-Nrf2系とが連動することを意味した(図2a).
3.腫瘍の増殖におけるp62のリン酸化とNrf2の活性化
筆者らは,これまで,マウスの肝臓においてオートファジーに必須の遺伝子であるAtg5遺伝子あるいはAtg7遺伝子を欠損させると良性の腫瘍をひき起こすこと7,8),この腫瘍の増殖はp62遺伝子を同時に欠損させることにより大幅に抑制されることを報告してきた7).重要なことに,Atg7遺伝子の欠損により肝臓に生じた腫瘍においては,Ser351のリン酸化したp62陽性かつKeap1陽性のタンパク質凝集体が蓄積しており,Nrf2の標的遺伝子の著しい発現誘導も確認された.これらの事実は,p62のリン酸化を介したNrf2の活性化が腫瘍の増殖に有利にはたらいていることを示唆した.一方,ヒトの肺がん,頭頸部がん,胆嚢がんにおいて,Nrf2遺伝子およびKeap1遺伝子に体細胞変異が同定されている.これらの変異は総じてKeap1とNrf2との相互作用の阻害をひき起こしNrf2の恒常的な活性化にいたる.また最近,PI3K-Akt経路が恒常的に活性化しているがん細胞において,Nrf2が生体防御遺伝子のみならず,ペントースリン酸経路やグルタミンから乳酸が産生されるグルタミノリシスに関与する酵素をコードする遺伝子の発現を上昇させ,微小環境における生存や抗がん剤への抵抗性をあたえるとともに,増殖に有利となる代謝の再編成をひき起こすことが明らかになった9).
ヒトの肝細胞がんやグリオーマにおいても,オートファジーの欠損による肝腫瘍と同様に,p62が過剰に蓄積し凝集することが知られていた8,10).筆者らも,約29%(102検体中30検体)のヒト肝細胞がん検体においてp62の蓄積および凝集化を確認するとともに,その凝集体において(マウスのSer351に対応する)Ser349がリン酸化されていること,さらに,凝集体にKeap1も含まれていることを形態学的に確認した.肝細胞がんにおけるp62のリン酸化の病態生理的な役割を明らかにするため,9つのヒト肝細胞がん株においてp62のSer349のリン酸化について調べたところ,Huh-1細胞株において顕著なp62のリン酸化およびNrf2の核への蓄積が確認された.Huh-1細胞にオートファジーの障害は認められなかったが,p62遺伝子の発現はほかの肝細胞がん株と比較して有意に高かった8).重要なことに,Huh-1細胞における足場に非依存的な増殖,および,ヌードマウスへの異種移植において確認された増殖は,p62遺伝子を欠損させることによりほぼ完全に抑制された.また,この増殖の抑制はp62遺伝子を欠損したHuh-1細胞に野生型p62あるいはSer349のリン酸化を模倣した変異p62を強制発現させることにより回復した一方,リン酸化しない変異p62の強制発現では回復しなかった.さらに,野生型p62あるいはSer349のリン酸化を模倣した変異p62の強制発現により回復したp62遺伝子欠損Huh-1細胞の足場に非依存的な増殖は,Nrf2のノックダウンにより抑制された.これらの結果は,p62のリン酸化を介したNrf2の活性化が肝細胞がんの増殖に決定的であることを意味した(図2b).
今後は,リン酸化p62を蓄積しているオートファジーの欠損により生じた肝腫瘍および肝細胞がんにおけるメタボローム解析などにより,実際に,Nrf2の活性化に依存した糖代謝およびアミノ酸代謝に再編成が起こっているのかどうか,明らかにしていく必要があるだろう.
おわりに
筆者らは,マウスの遺伝学的な解析により,p62によるNrf2の異常な活性化がオートファジーの欠損により生じた肝臓における病態の主因であることを明らかにしてきた4,11).しかし,これはヒトの病態ではありえないオートファジーの完全な阻害下における解析であり,p62の生理的な作用を反映しているとはいいがたかった.今回,生理的な状況におけるp62の局在の解析と遺伝学的な解析をもとに仮説をたて,オートファジーに関連したp62の生理的な役割,すなわち,オートファジーの選択的な基質を足場にしたp62によるNrf2の活性化の機構を明らかにすることができた(図2).
他方,ごく最近,筆者らは,米国のグループとの共同研究により,マクロファージにおいてAtg7遺伝子を欠損させると,p62の蓄積を介しNrf2の標的遺伝子であるスカベンジャー受容体をコードする遺伝子の発現が上昇すること,その結果,Atg7遺伝子を欠損したマクロファージでは結核菌などの細菌の取り込みが著しく増加することを報告した12).しかし,オートファジーの欠損により殺菌能力が阻害されている環境において細菌の取り込みを促進させるこの経路の生理的な機能はまったく不明である.感染の初期においては,今回の論文と同様に,マクロファージにおいてもリン酸化p62によるNrf2の活性化が起こるのであろう.この報告のモデルにしたがうと,感染の初期にNrf2が活性化されるとスカベンジャー受容体遺伝子の発現が上昇し,結核菌の取り込みが増加する.このとき,Nrf2がペントースリン酸経路にかかわる酵素などの遺伝子の発現を上昇させることによりNADPHの産生を促進し,貪食胞膜においてNADPHオキシダーゼによる殺菌を強めるようなことがあるのかもしれない.今後も,オートファジー欠損モデルを利用した新しい機構の発見が期待される.
文 献
- Mizushima, N. & Komatsu, M.: Autophagy: renovation of cells and tissues. Cell, 147, 728-741 (2011)[PubMed]
- Johansen, T. & Lamark, T.: Selective autophagy mediated by autophagic adapter proteins. Autophagy, 7, 279-296 (2011)[PubMed]
- Taguchi, K., Motohashi, H. & Yamamoto, M.: Molecular mechanisms of the Keap1-Nrf2 pathway in stress response and cancer evolution. Genes Cells, 16, 123-140 (2011)[PubMed]
- Komatsu, M., Kurokawa, H., Waguri, S. et al.: The selective autophagy substrate p62 activates the stress responsive transcription factor Nrf2 through inactivation of Keap1. Nat. Cell Biol., 12, 213-223 (2010)[PubMed]
- Jain, A., Lamark, T., Sjottem, E. et al.: p62/SQSTM1 is a target gene for transcription factor NRF2 and creates a positive feedback loop by inducing antioxidant response element-driven gene transcription. J. Biol. Chem., 285, 22576-22591 (2010)[PubMed]
- Padmanabhan, B., Tong, K. I., Ohta, T. et al.: Structural basis for defects of Keap1 activity provoked by its point mutations in lung cancer. Mol. Cell, 21, 689-700 (2006)[PubMed]
- Takamura, A., Komatsu, M., Hara, T. et al.: Autophagy-deficient mice develop multiple liver tumors. Genes Dev., 25, 795-800 (2011)[PubMed]
- Inami, Y., Waguri, S., Sakamoto, A. et al.: Persistent activation of Nrf2 through p62 in hepatocellular carcinoma cells. J. Cell Biol., 193, 275-284 (2011)[PubMed]
- Mitsuishi, Y., Taguchi, K., Kawatani, Y. et al.: Nrf2 redirects glucose and glutamine into anabolic pathways in metabolic reprogramming. Cancer Cell, 22, 66-79 (2012)[PubMed] [新着論文レビュー]
- Zatloukal, K., Stumptner, C., Fuchsbichler, A. et al.: p62 is a common component of cytoplasmic inclusions in protein aggregation diseases. Am. J. Pathol., 160, 255-263 (2002)[PubMed]
- Komatsu, M., Waguri, S., Koike, M. et al.: Homeostatic levels of p62 control cytoplasmic inclusion body formation in autophagy-deficient mice. Cell, 131, 1149-1163 (2007)[PubMed]
- Bonilla, D. L., Bhattacharya, A., Sha, Y. et al.: Autophagy regulates phagocytosis by modulating the expression of scavenger receptors. Immunity, 39, 537-547 (2013)[PubMed]
著者プロフィール
略歴:2002年 総合研究大学院大学生命科学研究科博士課程 修了,同年 基礎生物学研究所 研究員,2005年 千葉大学大学院医学研究院 助手,2007年 順天堂大学医学部 助教を経て,2010年より東京都医学総合研究所 主席研究員.
研究テーマ:選択的オートファジー.
関心事:オートファジー研究領域の拡大.家庭菜園.
小松 雅明(Masaaki Komatsu)
東京都医学総合研究所 プロジェクトリーダー.
研究室URL:http://www.igakuken.or.jp/protein/
© 2013 一村義信・小松雅明 Licensed under CC 表示 2.1 日本