マウスにおいて転写因子Six1およびSix4は生殖腺の形成と雄への分化を制御する
田中 聡・藤本由佳・西中村隆一
(熊本大学発生医学研究所 腎臓発生分野)
email:田中 聡,西中村隆一
DOI: 10.7875/first.author.2013.112
Homeoproteins Six1 and Six4 regulate male sex determination and mouse gonadal development.
Yuka Fujimoto, Satomi S. Tanaka, Yasuka L. Yamaguchi, Hiroki Kobayashi, Shunsuke Kuroki, Makoto Tachibana, Mai Shinomura, Yoshiakira Kanai, Ken-ichirou Morohashi, Kiyoshi Kawakami, Ryuichi Nishinakamura
Developmental Cell, 26, 416-430 (2013)
哺乳動物の性は性染色体の組合せにより受精卵の段階から遺伝学的に決定されているが,雌雄の性差の構築は妊娠中期の胎仔の生殖腺原基において,Y染色体に存在する精巣への分化を誘導する性決定遺伝子,Sry遺伝子が発現することにはじまる.しかし,この生殖腺原基の形成の機構やSry遺伝子の発現制御の機構については,いまだ十分には明らかにされていない.今回の研究では,転写因子Six1およびSix4が生殖腺原基の形成およびSry遺伝子の発現制御の両方を,それぞれ異なる独立した経路により制御していることが明らかにされた.Six1およびSix4を欠損したY染色体をもつXY型のマウスの胚では,Sry遺伝子の発現が低下し雄への分化に異常を示した.また,性分化のまえに形成される生殖腺原基の前駆細胞の数が減少しており,雌雄ともに生殖腺が小さくなっていた.しかし,Sry遺伝子を外来性に強制発現させることにより精巣の分化が誘導されたことから,最初に形成される生殖腺原基が小さくとも,十分量のSry遺伝子が発現していれば雄へと分化することが明らかになった.さらに,Six1およびSix4の下流の標的遺伝子として,生殖腺原基の形成に必須の核内受容体をコードするAd4BP遺伝子,および,Sry遺伝子の発現を制御する転写因子をコードするFog2遺伝子が同定された.そして,Ad4BPが生殖腺原基の形成,つまり,生殖腺の大きさの決定を行い,それとは独立して,Fog2がSry遺伝子の発現制御,つまり,性の決定を行っていることが明らかにされた.
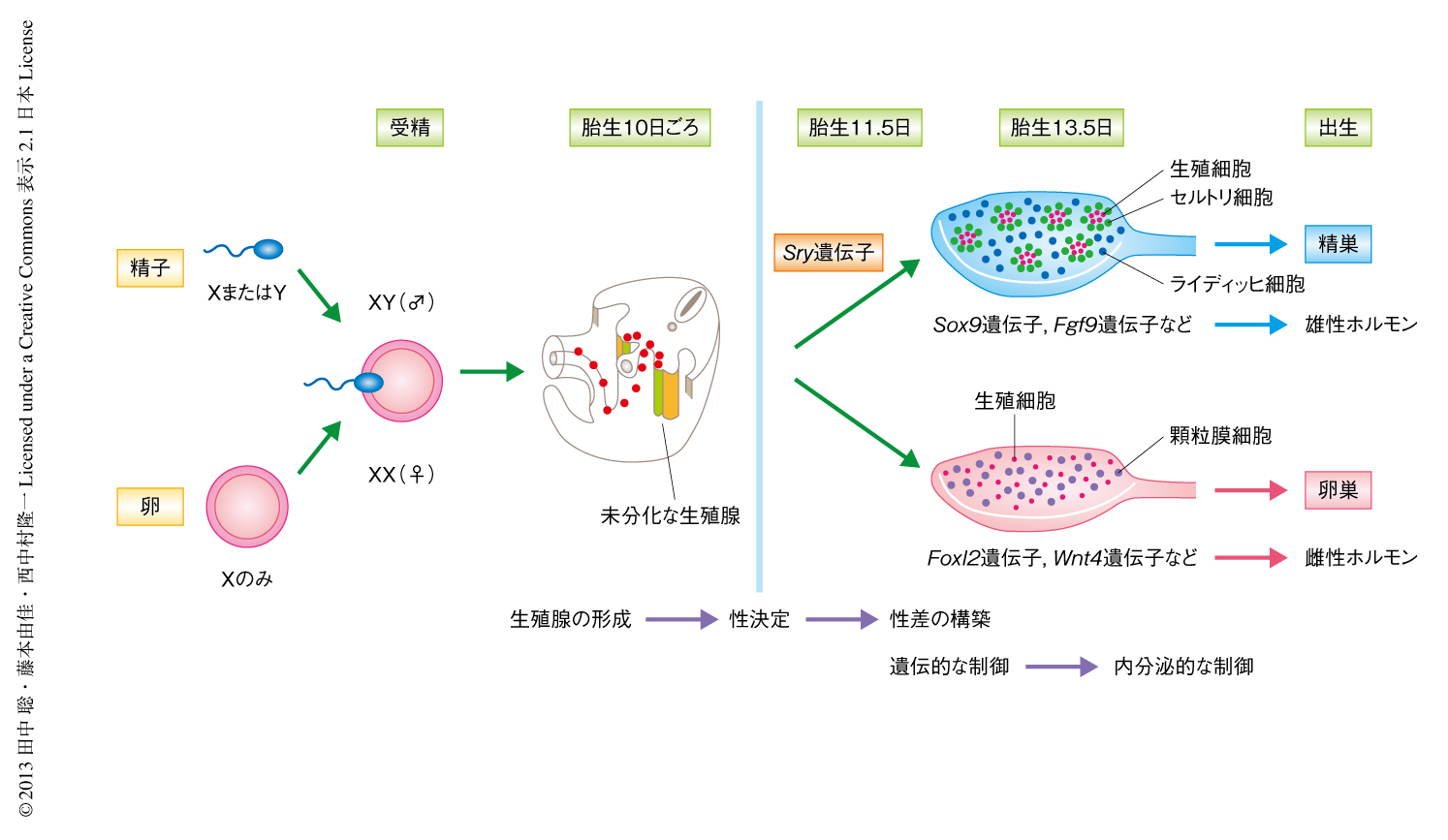
哺乳動物の性はXとYの性染色体の組合せ(雄はXY,雌はXX)により遺伝学的に決定されている.1990年代のはじめ,Y染色体に存在する性決定遺伝子としてSry遺伝子が同定され,このSry遺伝子が胎仔の未分化な生殖腺において発現し精巣の分化を誘導することより雄への分化が開始することが明らかになった1,2)(図1).そののち,Sry遺伝子を頂点とする雄への分化の分子機構についてはその全貌が明らかになりつつあるが,Sry遺伝子がどのようにしてはたらきはじめるのか,その上流の分子機構についてはいまだ十分な知見が得られていない.
ショウジョウバエのSix(sine oculis homeobox)ファミリーのホモログとして,マウスにおいてはSix1~Six6の6つが同定されている.Sixファミリーは転写因子でありSixドメインとホメオドメインをもち,ショウジョウバエのD-Six4は生殖巣体細胞の発生に重要な役割を担う.マウスのSixファミリーのうちSix1およびSix4は第12染色体の約100 kbの領域に近接して存在しており,胚における発現様式もよく重なる3).また,Six1およびSix4はMEF3部位とよばれるDNA結合配列に結合し,筋分化を誘導する上位の転写因子であるMyogeninやMyf5などの遺伝子の転写を活性化し,筋前駆細胞の形成や分化に重要な役割を担う4).さらに,Six1を欠損した胚,Six4を欠損した胚,Six1とSix4の両方を欠損した胚の表現型がそれぞれ異なることから,胚の発生においてSix1とSix4は重複した機能をもつことが示唆されている.たとえば,腎臓の発生においてはSix4を欠損した胚では症状は観察されないが,Six1を欠損した胚では部分的な腎臓の形成不全(片側の腎臓が形成されない,あるいは,小さい腎臓しか形成されないなど)を示し,さらに,Six1とSix4の両方を欠損した胚では両側の腎臓が完全に形成されない5).
この研究では,Six1およびSix4がSry遺伝子の発現するセルトリ細胞の前駆細胞の形成を誘導しSry遺伝子の発現する“場”(生殖腺)の大きさを制御すること,および,それとは独立した経路によりSry遺伝子の発現を誘導し性の決定を制御していることが明らかにされた.
Six1とSix4とのダブルノックアウトマウスは腎臓の欠損やほかの臓器の形成不全が原因で生後まもなく死亡する4-6).このダブルノックアウトマウスではY染色体をもつXY型の胎仔においても生殖腺が卵巣様の形態を示していた.Six1およびSix4は生殖腺原基にも発現する.組織学的な解析から,XY型のマウスにおいて精細管の形成は観察されず,精巣の体細胞マーカーであるSox9(セルトリ細胞)およびMis(ライディッヒ細胞)の陽性細胞もほとんど存在していなかった.Six1およびSix4を欠損した生殖腺においては,胎生13.5日においてすでにSox9陽性細胞は減少しており,一方,卵巣の体細胞マーカーであるFoxl2の陽性細胞が生殖腺の全域に存在していたことから,卵巣への分化が進行していることが明らかになった.そこで,性決定遺伝子であるSry遺伝子の発現について調べたところ極端に減少していた.以上のことから,Six1およびSix4はSry遺伝子の発現制御を介し性分化を制御していることが明らかになった.
Six1およびSix4はMEF3部位に結合して標的遺伝子の転写の活性化にはたらくことが知られているが,Sry遺伝子の推定されるプロモーター領域には機能的と考えられるMEF3部位は存在しなかった.そこで,Six1およびSix4はSry遺伝子の発現を間接的に制御していると考え,Sry遺伝子の発現制御への関与が示唆されている遺伝子の発現をSix1およびSix4を欠損した生殖腺において調べた.その結果,Fog2遺伝子(別名Zfpm2遺伝子)の発現が特異的に減少していた.その産物である転写因子Fog2はGata4と複合体を形成し,Sry遺伝子のプロモーター領域に結合して転写の活性化にはたらくことがin vitroにおいて示されており,また,Fog2とGata4との結合はSry遺伝子の発現に必須であることがノックアウトマウスを用いたin vivoにおける解析から明らかにされている7).Fog2遺伝子のプロモーター領域にはMEF3部位が存在しており,レポーターアッセイからこのMEF3部位に依存的にSix1およびSix4により転写の活性化が起こること,そして,クロマチン免疫沈降(ChIP)アッセイからこのMEF3部位にSix1およびSix4が特異的に結合することが明らかになった.以上から,Six1およびSix4は生殖腺の性分化においてFog2遺伝子を下流の直接の標的遺伝子として制御することにより,雄への分化(Sry遺伝子の発現)を誘導することが明らかになった.
生殖腺原基の形成は胎生9.5日ごろの胚において中腎領域の体腔上皮の細胞が増殖し,間充織領域に移行して肥厚することにはじまる(図1).そののち,始原生殖細胞が後腸をはなれて腸間膜をとおり生殖腺原基に定着し,卵巣と精巣のどちらにも分化できる未分化な生殖腺を形成する.Sry遺伝子はXY型のマウスの未分化な生殖腺においてセルトリ細胞の前駆細胞に発現し精巣への分化を誘導する.このSry遺伝子を発現するセルトリ細胞の前駆細胞は,体腔上皮に生じるAd4BP陽性細胞に由来することが報告されているが,その形成機構の詳細は明らかにされていない.
Six1およびSix4を欠損した生殖腺では雄への分化の異常のみならず,雌雄ともに生殖腺が小さくなることが観察された.そこで,Sry遺伝子が発現して性分化がはじまるまえの胎生10.5日において,Ad4BP陽性あるいはGata4陽性を示す生殖腺原基の前駆細胞の数を調べたところ,Six1およびSix4を欠損した胚においてともに半数以下に減少していた.そのために十分な数の生殖腺の体細胞が得られず,Six1およびSix4を欠損した生殖腺は雌雄ともに小さくなると考えられた.
生殖腺の形成に関与する遺伝子についてSix1およびSix4を欠損した生殖腺において調べたところ,Ad4BP遺伝子(別名Nr5a1/Sf1遺伝子)の発現が特異的に減少していた.その産物であるAd4BPは核内受容体であり,発現量に依存的に機能すると考えられている.そこで,Six1およびSix4のヘテロ変異マウス6) と,Ad4BPのヘテロ変異マウス8) を掛け合わせ,Six1 Six4 Ad4BPトリプルヘテロ変異マウスを作製したところ,このAd4BPの発現量の減少したトリプルヘテロ変異マウスの胚において,Ad4BP陽性の生殖腺原基の前駆細胞の数は減少していた.つまり,形成される生殖腺原基の前駆細胞の数はAd4BPの発現量に依存して変化することが,遺伝学的な解析により明らかにされた.
Six1およびSix4は生殖腺の形成期において体腔上皮に発現する.とくに,Six4の発現する細胞は,体腔上皮に生じるAd4BP陽性細胞とよく一致することから,Ad4BP遺伝子が生殖腺原基の前駆細胞の形成におけるSix1およびSix4の直接の下流の標的遺伝子であると考えられた.Ad4BP遺伝子のプロモーター領域にもMEF3部位が存在しており,レポーターアッセイからこのMEF3部位に依存的にSix1およびSix4により転写の活性化が起こること,そして,クロマチン免疫沈降アッセイからこのMEF3部位にSix1およびSix4が特異的に結合することが明らかになった.以上から,Six1およびSix4がAd4BP遺伝子の転写の活性化にはたらき,生殖腺原基の前駆細胞の形成を制御していることが明らかになった.
Six1およびSix4を欠損した生殖腺ではSry遺伝子が発現するまえの発生段階においてすでに生殖腺原基の前駆細胞の数の減少による生殖腺の低形成が観察されたことから,この2次的な影響により雄への分化が進行せず卵巣化している可能性も考えられた.そこで,外来性にSry遺伝子を発現することでXX型のマウスが性転換を起こし雄となるトランスジェニックマウスの系統(Hsp-Sry系統)を用いて9),レスキュー実験を行った.この外来性にSry遺伝子を強制発現させたXY型のマウスのSix1およびSix4を欠損した生殖腺では,Sox9陽性のセルトリ細胞が精細管を形成している像が観察され,雄への分化が進行していた.一方,初期に形成される生殖腺原基の前駆細胞の数の減少には変化はなかったことから,生殖腺原基の前駆細胞の数が少なくてもSry遺伝子が発現していれば雄への分化が誘導されることが明らかになった.
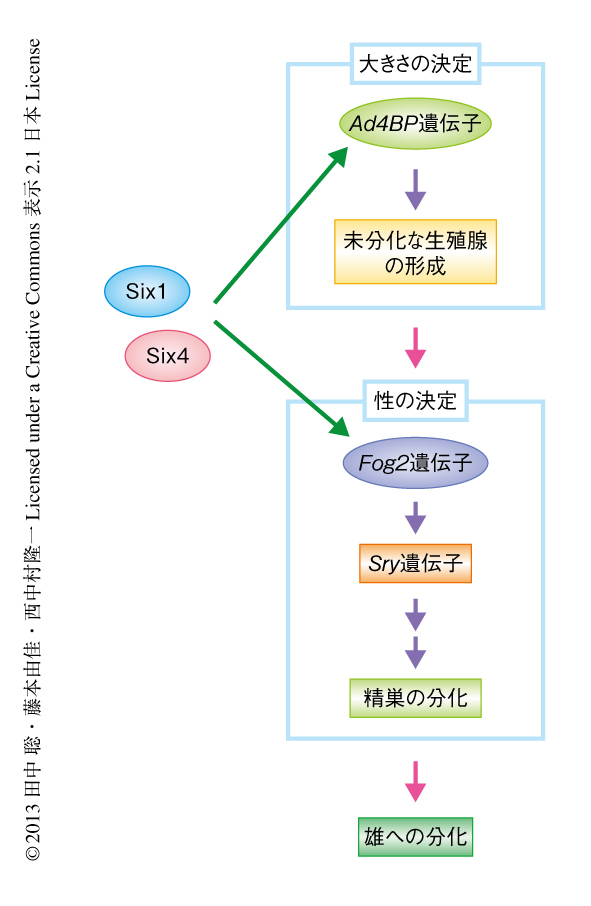
哺乳類の性分化の研究においては,性決定遺伝子であるSry遺伝子の発見ののち,Sry遺伝子をはたらかせる機構の解明が進んできた.今回,Six1およびSix4がSry遺伝子の発現する“場”(生殖腺)”の形成,さらに,その発現の誘導にかかわることが明らかになり(図2),この機構の解明において大きな進展をもたらす成果と考えられる.生殖腺原基の形成の機構については不明な点が多い.Six1およびSix4は,ほかの細胞系譜も含め形成される前駆細胞の集団のプールサイズの制御にはたらいている可能性が考えられる.そこで,幹細胞生物学的なアプローチを含め,その形成機構の解明をめざしたいと考えている.ヒトのSIX1遺伝子およびSIX4遺伝子はさまざまな遺伝病の原因遺伝子としても知られており,この研究で得られた知見は,その診断法や治療法の確立にも大きく貢献することが期待される.また,生殖腺は男女の性の違いを生み出す“もと”となる組織であるとともに,次世代を生み出す“もと”である生殖細胞(精子と卵子)を育てる組織でもある.この研究において得られた生殖腺の形成および分化に関する知見は,次世代へと生命を紡ぐしくみを解き明かすことにもつながると考えられる.
略歴:1996年 東京大学大学院農学生命科学研究科 修了,同年 三菱化学生命科学研究所 特別研究員,1999年 大阪府立母子保健総合医療センター研究所 常勤研究員,2003年 オーストラリアChildren's Medical Research Institute研究員を経て,2006年より熊本大学発生医学研究所 助教.
研究テーマ:マウスの生殖腺および生殖細胞の発生の機構.
藤本 由佳(Yuka Fujimoto)
熊本大学大学院医学教育部博士課程 在学中.
西中村 隆一(Ryuichi Nishinakamura)
熊本大学発生医学研究所 教授.
研究室URL:http://www.imeg.kumamoto-u.ac.jp/divisions/integrative_cell_biology/
© 2013 田中 聡・藤本由佳・西中村隆一 Licensed under CC 表示 2.1 日本
(熊本大学発生医学研究所 腎臓発生分野)
email:田中 聡,西中村隆一
DOI: 10.7875/first.author.2013.112
Homeoproteins Six1 and Six4 regulate male sex determination and mouse gonadal development.
Yuka Fujimoto, Satomi S. Tanaka, Yasuka L. Yamaguchi, Hiroki Kobayashi, Shunsuke Kuroki, Makoto Tachibana, Mai Shinomura, Yoshiakira Kanai, Ken-ichirou Morohashi, Kiyoshi Kawakami, Ryuichi Nishinakamura
Developmental Cell, 26, 416-430 (2013)
要 約
哺乳動物の性は性染色体の組合せにより受精卵の段階から遺伝学的に決定されているが,雌雄の性差の構築は妊娠中期の胎仔の生殖腺原基において,Y染色体に存在する精巣への分化を誘導する性決定遺伝子,Sry遺伝子が発現することにはじまる.しかし,この生殖腺原基の形成の機構やSry遺伝子の発現制御の機構については,いまだ十分には明らかにされていない.今回の研究では,転写因子Six1およびSix4が生殖腺原基の形成およびSry遺伝子の発現制御の両方を,それぞれ異なる独立した経路により制御していることが明らかにされた.Six1およびSix4を欠損したY染色体をもつXY型のマウスの胚では,Sry遺伝子の発現が低下し雄への分化に異常を示した.また,性分化のまえに形成される生殖腺原基の前駆細胞の数が減少しており,雌雄ともに生殖腺が小さくなっていた.しかし,Sry遺伝子を外来性に強制発現させることにより精巣の分化が誘導されたことから,最初に形成される生殖腺原基が小さくとも,十分量のSry遺伝子が発現していれば雄へと分化することが明らかになった.さらに,Six1およびSix4の下流の標的遺伝子として,生殖腺原基の形成に必須の核内受容体をコードするAd4BP遺伝子,および,Sry遺伝子の発現を制御する転写因子をコードするFog2遺伝子が同定された.そして,Ad4BPが生殖腺原基の形成,つまり,生殖腺の大きさの決定を行い,それとは独立して,Fog2がSry遺伝子の発現制御,つまり,性の決定を行っていることが明らかにされた.
はじめに
哺乳動物の性はXとYの性染色体の組合せ(雄はXY,雌はXX)により遺伝学的に決定されている.1990年代のはじめ,Y染色体に存在する性決定遺伝子としてSry遺伝子が同定され,このSry遺伝子が胎仔の未分化な生殖腺において発現し精巣の分化を誘導することより雄への分化が開始することが明らかになった1,2)(図1).そののち,Sry遺伝子を頂点とする雄への分化の分子機構についてはその全貌が明らかになりつつあるが,Sry遺伝子がどのようにしてはたらきはじめるのか,その上流の分子機構についてはいまだ十分な知見が得られていない.
ショウジョウバエのSix(sine oculis homeobox)ファミリーのホモログとして,マウスにおいてはSix1~Six6の6つが同定されている.Sixファミリーは転写因子でありSixドメインとホメオドメインをもち,ショウジョウバエのD-Six4は生殖巣体細胞の発生に重要な役割を担う.マウスのSixファミリーのうちSix1およびSix4は第12染色体の約100 kbの領域に近接して存在しており,胚における発現様式もよく重なる3).また,Six1およびSix4はMEF3部位とよばれるDNA結合配列に結合し,筋分化を誘導する上位の転写因子であるMyogeninやMyf5などの遺伝子の転写を活性化し,筋前駆細胞の形成や分化に重要な役割を担う4).さらに,Six1を欠損した胚,Six4を欠損した胚,Six1とSix4の両方を欠損した胚の表現型がそれぞれ異なることから,胚の発生においてSix1とSix4は重複した機能をもつことが示唆されている.たとえば,腎臓の発生においてはSix4を欠損した胚では症状は観察されないが,Six1を欠損した胚では部分的な腎臓の形成不全(片側の腎臓が形成されない,あるいは,小さい腎臓しか形成されないなど)を示し,さらに,Six1とSix4の両方を欠損した胚では両側の腎臓が完全に形成されない5).
この研究では,Six1およびSix4がSry遺伝子の発現するセルトリ細胞の前駆細胞の形成を誘導しSry遺伝子の発現する“場”(生殖腺)の大きさを制御すること,および,それとは独立した経路によりSry遺伝子の発現を誘導し性の決定を制御していることが明らかにされた.
1.転写因子Six1およびSix4は生殖腺の性決定に必須である
Six1とSix4とのダブルノックアウトマウスは腎臓の欠損やほかの臓器の形成不全が原因で生後まもなく死亡する4-6).このダブルノックアウトマウスではY染色体をもつXY型の胎仔においても生殖腺が卵巣様の形態を示していた.Six1およびSix4は生殖腺原基にも発現する.組織学的な解析から,XY型のマウスにおいて精細管の形成は観察されず,精巣の体細胞マーカーであるSox9(セルトリ細胞)およびMis(ライディッヒ細胞)の陽性細胞もほとんど存在していなかった.Six1およびSix4を欠損した生殖腺においては,胎生13.5日においてすでにSox9陽性細胞は減少しており,一方,卵巣の体細胞マーカーであるFoxl2の陽性細胞が生殖腺の全域に存在していたことから,卵巣への分化が進行していることが明らかになった.そこで,性決定遺伝子であるSry遺伝子の発現について調べたところ極端に減少していた.以上のことから,Six1およびSix4はSry遺伝子の発現制御を介し性分化を制御していることが明らかになった.
2.転写因子Six1およびSix4はFog2を介し性決定を制御する
Six1およびSix4はMEF3部位に結合して標的遺伝子の転写の活性化にはたらくことが知られているが,Sry遺伝子の推定されるプロモーター領域には機能的と考えられるMEF3部位は存在しなかった.そこで,Six1およびSix4はSry遺伝子の発現を間接的に制御していると考え,Sry遺伝子の発現制御への関与が示唆されている遺伝子の発現をSix1およびSix4を欠損した生殖腺において調べた.その結果,Fog2遺伝子(別名Zfpm2遺伝子)の発現が特異的に減少していた.その産物である転写因子Fog2はGata4と複合体を形成し,Sry遺伝子のプロモーター領域に結合して転写の活性化にはたらくことがin vitroにおいて示されており,また,Fog2とGata4との結合はSry遺伝子の発現に必須であることがノックアウトマウスを用いたin vivoにおける解析から明らかにされている7).Fog2遺伝子のプロモーター領域にはMEF3部位が存在しており,レポーターアッセイからこのMEF3部位に依存的にSix1およびSix4により転写の活性化が起こること,そして,クロマチン免疫沈降(ChIP)アッセイからこのMEF3部位にSix1およびSix4が特異的に結合することが明らかになった.以上から,Six1およびSix4は生殖腺の性分化においてFog2遺伝子を下流の直接の標的遺伝子として制御することにより,雄への分化(Sry遺伝子の発現)を誘導することが明らかになった.
3.転写因子Six1およびSix4は生殖腺原基の形成に必須である
生殖腺原基の形成は胎生9.5日ごろの胚において中腎領域の体腔上皮の細胞が増殖し,間充織領域に移行して肥厚することにはじまる(図1).そののち,始原生殖細胞が後腸をはなれて腸間膜をとおり生殖腺原基に定着し,卵巣と精巣のどちらにも分化できる未分化な生殖腺を形成する.Sry遺伝子はXY型のマウスの未分化な生殖腺においてセルトリ細胞の前駆細胞に発現し精巣への分化を誘導する.このSry遺伝子を発現するセルトリ細胞の前駆細胞は,体腔上皮に生じるAd4BP陽性細胞に由来することが報告されているが,その形成機構の詳細は明らかにされていない.
Six1およびSix4を欠損した生殖腺では雄への分化の異常のみならず,雌雄ともに生殖腺が小さくなることが観察された.そこで,Sry遺伝子が発現して性分化がはじまるまえの胎生10.5日において,Ad4BP陽性あるいはGata4陽性を示す生殖腺原基の前駆細胞の数を調べたところ,Six1およびSix4を欠損した胚においてともに半数以下に減少していた.そのために十分な数の生殖腺の体細胞が得られず,Six1およびSix4を欠損した生殖腺は雌雄ともに小さくなると考えられた.
4.転写因子Six1およびSix4はAd4BPを介し生殖腺原基の形成を制御する
生殖腺の形成に関与する遺伝子についてSix1およびSix4を欠損した生殖腺において調べたところ,Ad4BP遺伝子(別名Nr5a1/Sf1遺伝子)の発現が特異的に減少していた.その産物であるAd4BPは核内受容体であり,発現量に依存的に機能すると考えられている.そこで,Six1およびSix4のヘテロ変異マウス6) と,Ad4BPのヘテロ変異マウス8) を掛け合わせ,Six1 Six4 Ad4BPトリプルヘテロ変異マウスを作製したところ,このAd4BPの発現量の減少したトリプルヘテロ変異マウスの胚において,Ad4BP陽性の生殖腺原基の前駆細胞の数は減少していた.つまり,形成される生殖腺原基の前駆細胞の数はAd4BPの発現量に依存して変化することが,遺伝学的な解析により明らかにされた.
Six1およびSix4は生殖腺の形成期において体腔上皮に発現する.とくに,Six4の発現する細胞は,体腔上皮に生じるAd4BP陽性細胞とよく一致することから,Ad4BP遺伝子が生殖腺原基の前駆細胞の形成におけるSix1およびSix4の直接の下流の標的遺伝子であると考えられた.Ad4BP遺伝子のプロモーター領域にもMEF3部位が存在しており,レポーターアッセイからこのMEF3部位に依存的にSix1およびSix4により転写の活性化が起こること,そして,クロマチン免疫沈降アッセイからこのMEF3部位にSix1およびSix4が特異的に結合することが明らかになった.以上から,Six1およびSix4がAd4BP遺伝子の転写の活性化にはたらき,生殖腺原基の前駆細胞の形成を制御していることが明らかになった.
5.性分化と生殖腺原基の前駆細胞の形成は独立した経路により制御されている
Six1およびSix4を欠損した生殖腺ではSry遺伝子が発現するまえの発生段階においてすでに生殖腺原基の前駆細胞の数の減少による生殖腺の低形成が観察されたことから,この2次的な影響により雄への分化が進行せず卵巣化している可能性も考えられた.そこで,外来性にSry遺伝子を発現することでXX型のマウスが性転換を起こし雄となるトランスジェニックマウスの系統(Hsp-Sry系統)を用いて9),レスキュー実験を行った.この外来性にSry遺伝子を強制発現させたXY型のマウスのSix1およびSix4を欠損した生殖腺では,Sox9陽性のセルトリ細胞が精細管を形成している像が観察され,雄への分化が進行していた.一方,初期に形成される生殖腺原基の前駆細胞の数の減少には変化はなかったことから,生殖腺原基の前駆細胞の数が少なくてもSry遺伝子が発現していれば雄への分化が誘導されることが明らかになった.
おわりに
哺乳類の性分化の研究においては,性決定遺伝子であるSry遺伝子の発見ののち,Sry遺伝子をはたらかせる機構の解明が進んできた.今回,Six1およびSix4がSry遺伝子の発現する“場”(生殖腺)”の形成,さらに,その発現の誘導にかかわることが明らかになり(図2),この機構の解明において大きな進展をもたらす成果と考えられる.生殖腺原基の形成の機構については不明な点が多い.Six1およびSix4は,ほかの細胞系譜も含め形成される前駆細胞の集団のプールサイズの制御にはたらいている可能性が考えられる.そこで,幹細胞生物学的なアプローチを含め,その形成機構の解明をめざしたいと考えている.ヒトのSIX1遺伝子およびSIX4遺伝子はさまざまな遺伝病の原因遺伝子としても知られており,この研究で得られた知見は,その診断法や治療法の確立にも大きく貢献することが期待される.また,生殖腺は男女の性の違いを生み出す“もと”となる組織であるとともに,次世代を生み出す“もと”である生殖細胞(精子と卵子)を育てる組織でもある.この研究において得られた生殖腺の形成および分化に関する知見は,次世代へと生命を紡ぐしくみを解き明かすことにもつながると考えられる.
文 献
- Sinclair, A. H., Berta, P., Palmer, M. S. et al.: A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif. Nature, 346, 240-244 (1990)[PubMed]
- Koopman, P., Gubbay, J., Vivian, N. et al.: Male development of chromosomally female mice transgenic for Sry. Nature, 351, 117-121 (1991)[PubMed]
- Kawakami, K., Sato, S., Ozaki, H. et al.: Six family genes: structure and function as transcription factors and their roles in development. Bioessays, 22, 616-626 (2000)[PubMed]
- Grifone, R., Demignon, J., Houbron, C. et al.: Six1 and Six4 homeoproteins are required for Pax3 and Mrf expression during myogenesis in the mouse embryo. Development, 132, 2235-2249 (2005)[PubMed]
- Kobayashi, H., Kawakami, K., Asashima, M. et al.: Six1 and Six4 are essential for Gdnf expression in the metanephric mesenchyme and ureteric bud formation, while Six1 deficiency alone causes mesonephric-tubule defects. Mech. Dev., 124, 290-303 (2007)[PubMed]
- Konishi, Y., Ikeda, K., Iwakura, Y. et al.: Six1 and Six4 promote survival of sensory neurons during early trigeminal gangliogenesis. Brain Res., 1116, 93-102 (2006)[PubMed]
- Tevosian, S. G., Albrecht, K. H., Crispino, J. D. et al.: Gonadal differentiation, sex determination and normal Sry expression in mice require direct interaction between transcription partners GATA4 and FOG2. Development, 129, 4627-4634 (2002)[PubMed]
- Shinoda, K., Lei, H., Yoshii, H. et al.: Developmental defects of the ventromedial hypothalamic nucleus and pituitary gonadotroph in the Ftz-F1 disrupted mice. Dev. Dyn., 204, 22-29 (1995)[PubMed]
- Kidokoro, T., Matoba, S., Hiramatsu, R. et al.: Influence on spatiotemporal patterns of a male-specific Sox9 activation by ectopic Sry expression during early phases of testis differentiation in mice. Dev. Biol., 278, 511-525 (2005)[PubMed]
著者プロフィール
略歴:1996年 東京大学大学院農学生命科学研究科 修了,同年 三菱化学生命科学研究所 特別研究員,1999年 大阪府立母子保健総合医療センター研究所 常勤研究員,2003年 オーストラリアChildren's Medical Research Institute研究員を経て,2006年より熊本大学発生医学研究所 助教.
研究テーマ:マウスの生殖腺および生殖細胞の発生の機構.
藤本 由佳(Yuka Fujimoto)
熊本大学大学院医学教育部博士課程 在学中.
西中村 隆一(Ryuichi Nishinakamura)
熊本大学発生医学研究所 教授.
研究室URL:http://www.imeg.kumamoto-u.ac.jp/divisions/integrative_cell_biology/
© 2013 田中 聡・藤本由佳・西中村隆一 Licensed under CC 表示 2.1 日本