紡錘体軸の平面の方向への制御は上皮構造の維持に必要である
中嶋 悠一朗
(米国Stowers Institute for Medical Research)
email:中嶋悠一朗
DOI: 10.7875/first.author.2013.104
Epithelial junctions maintain tissue architecture by directing planar spindle orientation.
Yu-ichiro Nakajima, Emily J. Meyer, Amanda Kroesen, Sean A. McKinney, Matthew C. Gibson
Nature, 500, 359-362 (2013)
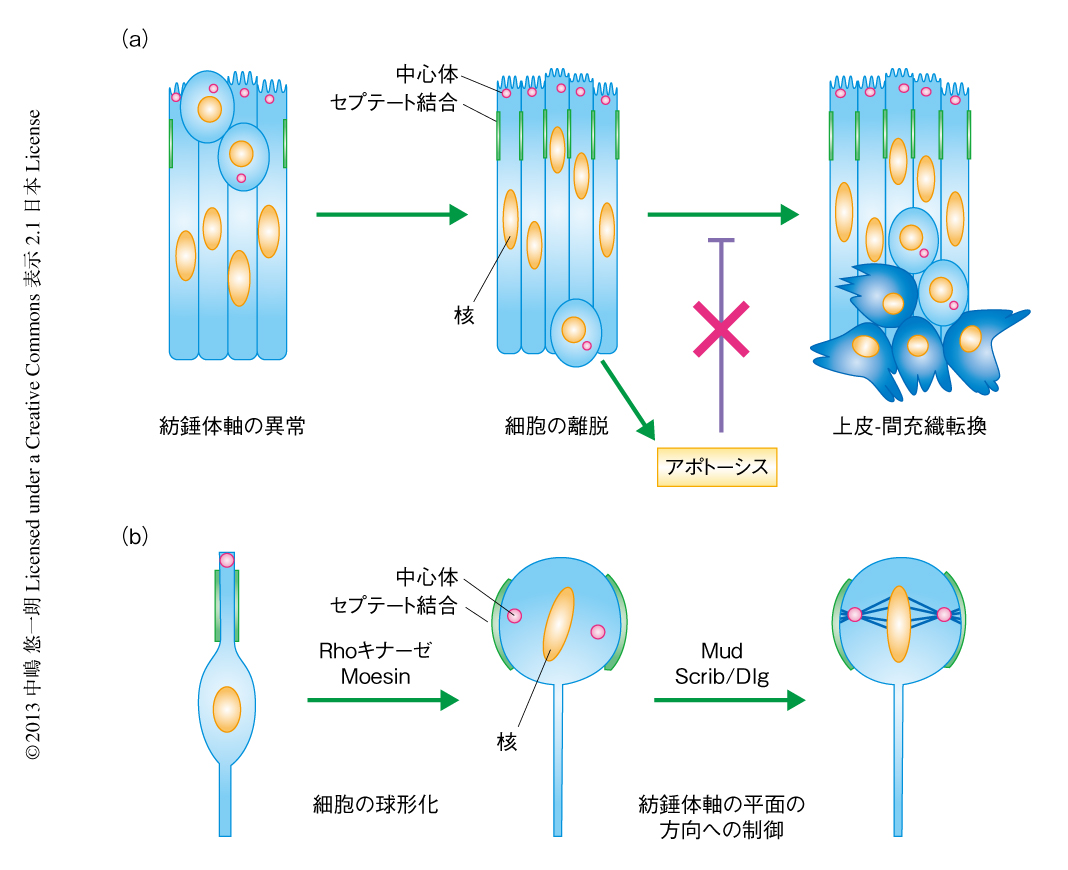
上皮細胞は対称分裂の際に紡錘体軸を上皮と平行に配置することを特徴とする.近年,この紡錘体軸の方向の異常ががんの悪性化など病態に関与する可能性が指摘されてきた.しかしながら,生体の上皮における紡錘体軸の平面の方向への制御機構,そして,その生理的な意義は明らかではなかった.筆者らは,ショウジョウバエの翅成虫原基をモデルとして,分裂装置を制御するMud,細胞皮質のアクトミオシン,細胞間結合領域に局在する腫瘍抑制タンパク質ScribおよびDlgが,紡錘体軸の方向の制御に必要であることを明らかにした.紡錘体軸に異常を示した細胞は上皮から離脱しアポトーシスを起こすことにより除去されるが,このアポトーシスを抑制すると異常な細胞は上皮の基底側において上皮-間充織転換様の表現型を示し腫瘍を形成することもわかった.この研究は,紡錘体軸の平面性が上皮構造の維持に必要であること,そして,紡錘体軸の異常による腫瘍化をアポトーシスにより抑制するという,上皮に内在する新規の腫瘍抑制機構を明らかにした.
多細胞生物の器官や付属肢をおおう上皮は,もっとも基本的なからだの構成単位である.上皮は外界と内部とをへだてる障壁としてはたらき,吸収や分泌を制御する.上皮がこれらの機能を正常に行うには,頂底軸の方向に極性をもつ上皮細胞が細胞間結合領域において互いに接着し細胞どうしのふるまいを調和させる,上皮の“完全性”を維持することが重要である.したがって,上皮構造は細胞の増殖,再配列,死など細胞の形態変化を許容しながらも,上皮の完全性を頑強に保証するためのしくみを備えているはずである.一方,この完全性の破綻は,頂底軸の極性の喪失のような上皮構造の異常をひき起こし,ひいては,がんの悪性化などの病態にもつながると考えられる.
発生の過程や恒常性の維持において,上皮細胞の多くは上皮に対し平行に細胞分裂し同じサイズの娘細胞を生み出す.上皮細胞の分裂は細胞の球形化という劇的な形態の変化にはじまり,紡錘体の形成,紡錘体軸の上皮の方向への配置(planar spindle orientation),上皮と直角の方向への分割,というプロセスをへる(図1a).紡錘体軸を上皮と平行に配置することにより娘細胞を上皮にとどまることを可能とするこのしくみは,上皮の完全性を保証し組織の成長や形態形成に寄与することが示唆されている1).近年,紡錘体軸の異常は多発性嚢胞腎やがんへの関与が指摘され,その制御機構の重要性が認識されはじめている2,3).しかしながら,生体の上皮において紡錘体軸を制御するしくみの多くは不明である.さらに重要なことに,紡錘体軸の異常が上皮組織においてどのような結果をもたらすのかという生理的な意義は明らかになっていない.その理由として,生体において適切な遺伝子操作が可能で紡錘体軸の異常という表現型を観察しやすい系が確立されていなかったことがあげられる.そこで,筆者らは,遺伝学的なツールが豊富で比較的単純な上皮構造をとるショウジョウバエの翅成虫原基をモデルとして,紡錘体軸の方向を制御するしくみとその生理的な意義を明らかにすることをめざした.
筆者らの研究室から,ショウジョウバエの翅成虫原基の円柱状細胞からなる偽重層上皮では,分裂期において上皮の頂端側にて細胞は球形化することが報告されている4).分裂期への進入とともにRhoキナーゼがミオシンをリン酸化し,アクトミオシンを収縮することにより細胞の球形化が誘導される.このとき興味深いことに,対称分裂は頂端側の細胞間結合領域のひとつであるセプテート結合とよばれる領域に限局して進行しており,この領域を有糸分裂帯(mitotic zone)と名づけた(図1b).分裂期における紡錘体軸の方向の制御機構について明らかにするため,中心体のマーカーを用いて紡錘体を詳細に観察した.その結果,分裂中期よりのちには球形化した細胞皮質にかこまれた紡錘体が有糸分裂帯に限局していた.また,紡錘体軸と上皮との角度を測定したところ,紡錘体軸の方向は上皮とほぼ平行に配置されていることが確認され,ショウジョウバエの翅成虫原基においても紡錘体軸の方向は精緻な制御をうけていることが示唆された.
紡錘体軸は間期における長軸の方向に配列しやすい性質のあることが示唆されている.しかしながら,ショウジョウバエの翅成虫原基における紡錘体軸の方向は長軸である頂端軸とは直角の方向であることから,なんらかの能動的な分子機構の関与が強く示唆された.そこで,紡錘体極に局在するタンパク質に注目し,脊椎動物におけるNuMAのオーソログであるMudを同定した.Mudはショウジョウバエの神経前駆細胞における非対称分裂や,胚外胚葉での対称分裂において紡錘体軸を制御することが知られている5).翅成虫原基においても,Mudは分裂期に紡錘体極に強く集積するという局在を示した.そして,翅成虫原基において特異的にMudをノックダウンしたところ,紡錘体軸に異常を示す分裂期の細胞の割合は有意に増加した.したがって,分裂装置を制御するMudは,紡錘体軸の方向の制御にも必要なタンパク質であることが明らかになった.
細胞皮質は星状体微小管との相互作用の場であり,球形化した細胞皮質とのアンカーが紡錘体の細胞における位置や紡錘体軸の方向の決定に関与することが培養細胞の系から示唆されている6).ショウジョウバエの翅成虫原基の分裂期の細胞においては,紡錘体の周辺の細胞皮質にアクチンフィラメントの顕著な集積,および,Rhoキナーゼを介したミオシンのリン酸化が観察される.さらには,ERM(Ezrin/Radixin/Moesin)タンパク質であるMoesinのリン酸化が分裂期の細胞皮質の基底側に検出された.Moesinはショウジョウバエにおける唯一のERMタンパク質であり,リン酸化型Moesinは細胞膜と細胞骨格とをつなぎ細胞を球形化させることができる7).これらの観察から,RhoキナーゼおよびMoesinがアクチン細胞骨格を分裂期において特異的に再編成することにより細胞皮質の形状を球形化させ,紡錘体軸の制御に関与していることが期待された.
細胞皮質のアクトミオシンの紡錘体軸の制御への関与について明らかにするため,薬理学的な実験を行った.アクチン重合の阻害剤であるCytochalasin DやRhoキナーゼの阻害剤であるY-27632を用いてアクトミオシンの収縮を阻害したところ,約80%もの分裂細胞において紡錘体軸が90度近く反転し,上皮とは直角の方向を示した.また,RhoキナーゼあるいはMoesinをノックダウンしたところ,それぞれ,約60%あるいは約30%の紡錘体軸が薬理学的な実験と同様の重篤な表現型を示した.したがって,細胞皮質のアクトミオシンは紡錘体軸の方向の制御に必須であることが明らかになった.
紡錘体の位置や方向が細胞皮質の形状による影響をうけるとして,紡錘体軸はどのようにして上皮と平行な面に正確に配置されるのだろうか? 免疫染色と透過型電子顕微鏡を用いた観察から,紡錘体極はセプテート結合に近接していることが見い出された.ここで,セプテート結合に局在するタンパク質が紡錘体のタンパク質と相互作用することにより紡錘体軸に平面の方向をあたえているのではないかと考え,ScribとDlgに着目した.これらはショウジョウバエにおいて頂底軸の極性の決定に必要なタンパク質として知られており8),scrib変異体およびdlg変異体は翅成虫原基において組織の破綻をともなう新生腫瘍様の表現型を示す9).したがって,もしScribやDlgが紡錘体軸の制御に関与している場合,紡錘体軸の異常が腫瘍化にかかわっている可能性も考えられた.
ScribおよびDlgの紡錘体軸の方向の制御への関与について調べるため,発生の途中のショウジョウバエの翅成虫原基において特異的にScribをノックダウンした.このとき,3齢幼虫期(孵卵ののち5日まで)に頂底軸の極性の喪失はみられなかったにもかかわらず,40%以上の細胞において紡錘体軸の方向に異常が観察された.同様の紡錘体軸の異常の表現型はDlgのノックダウンにおいてもみられた.さらに,scrib変異体のクローンを翅成虫原基に作製し紡錘体軸の方向を定量したところ,その方向はランダムになった.したがって,これらの結果から,細胞間結合領域に局在する腫瘍抑制タンパク質ScribおよびDlgは,紡錘体軸に平面の方向をあたえるタンパク質であることが示唆された.興味深いことに,Scribをノックダウンした翅成虫原基は,幼虫期の延長とともに紡錘体軸の異常から組織構造の破綻を示す新生腫瘍様の表現型へと移行していった.このことから,紡錘体軸の異常は腫瘍化に関与する可能性が示唆された.
紡錘体軸に異常を示した細胞は本当に腫瘍化に寄与しているのだろうか? MudあるいはRhoキナーゼの機能を欠損させたショウジョウバエの翅成虫原基では腫瘍化は誘導されなかったことから,紡錘体軸の異常だけでは腫瘍化に十分ではないことがわかった.そこで,紡錘体軸に異常を示した細胞がどのようにふるまうのかを生細胞イメージング法により観察した.通常の共焦点顕微鏡では画像の取得速度とレーザーによる光毒性が問題となり観察が困難であったため,SPIM(selective plane illumination microscopy,選択的平面照明顕微鏡法)を用いた翅成虫原基の生細胞イメージング系を確立した.このSPIMの利用により紡錘体軸を含んだ組織全体の観察が可能になり,その結果,重篤な紡錘体軸の異常を示した細胞の基底側の娘細胞が基底側へと下降していくようすが観察された.また,紡錘体軸が高頻度で異常になる翅成虫原基では,基底側に頂底軸の極性を失ったアポトーシス様の細胞が顕著にみられたことから,紡錘体軸の異常と細胞の上皮からの離脱,そして,アポトーシスが強く相関することが明らかになった.
紡錘体軸に異常を示した細胞は,通常は上皮から除去されてアポトーシスを起こすため,わかりやすい表現型として観察されなかった可能性がある.そこで,紡錘体軸に異常を示した細胞においてアポトーシスを阻害した場合にどのような効果がみられるのかを検討した.MudあるいはRhoキナーゼをノックダウンしたクローンをショウジョウバエの翅成虫原基に任意に作製し,カスパーゼ抑制タンパク質であるp35を共発現することによりアポトーシスを阻害したところ,これらのクローンは基底側にて異常な細胞のかたまりを形成し腫瘍様の表現型を示した.このとき興味深いことに,基底側の異常な細胞においてEカドヘリンの喪失,マトリックスメタロプロテアーゼ1の発現,アクチンの再編成といった上皮-間充織転換(epithelial-mesenchymal transition:EMT)様の特徴がみられた.これらの結果から,上皮には紡錘体軸に異常を示した細胞にアポトーシスを起こすことにより除去し,組織構造の重篤な破綻をふせぐしくみが備わっていることが示唆された.また,このアポトーシスのしくみがはたらかないと,紡錘体軸に異常を示した細胞が上皮-間充織転換様の効果を獲得し,腫瘍化に寄与することが明らかになった(図2a).
この研究により,ショウジョウバエの翅成虫原基における分裂期の紡錘体軸の方向は,分裂装置を制御するMud,細胞皮質のアクトミオシン,細胞間結合領域に局在する腫瘍抑制タンパク質ScribおよびDlgにより精密に制御されていることが示された(図2b).これまで,ScribおよびDlgは頂底軸の極性の決定に必要なタンパク質であり,その変異体は腫瘍様となることが長く知られていた.今回の報告は,ScribおよびDlgに上皮細胞の分裂において紡錘体軸に平面の方向をあたえるという新たな機能があることを明らかにし,紡錘体軸の異常がscrib変異体およびdlg変異体においてみられる組織構造の破綻に寄与している可能性を提示した.
また,この研究は,紡錘体軸の制御は上皮の完全性を維持する役割を担うだけでなく,アポトーシスとともに上皮の上皮-間充織転換を介した腫瘍化を抑制するはたらきがある,という新しい概念を提示した.これまでに,紡錘体軸の異常が腫瘍の悪性化に関与することは示唆されていたものの,その因果関係は明確ではなく,とくに,幹細胞ではない上皮細胞において紡錘体軸の方向に着目した研究は少なかった.細胞間結合領域を介した紡錘体軸の方向の制御機構,紡錘体軸の異常がもたらす上皮からの脱離とアポトーシスの誘導,紡錘体軸の異常が誘導するがん化のしくみ,などは,今回の報告から提示された重要なトピックであろう.興味深いことに,変異を獲得した異常な細胞が上皮のコンテクストから抜け出すことにより腫瘍化するという現象は,3次元培養したヒトの乳腺上皮に由来する細胞の実験系からも報告されている10).したがって,上皮から離脱した異常な細胞が腫瘍化の初期に貢献するしくみは種や組織をこえて保存されている可能性があり,脊椎動物の上皮においても紡錘体軸の異常が上皮構造の破綻につながるのか,今後の研究が待たれる.
略歴:2011年 東京大学大学院薬学系研究科 修了,同年 同 特任研究員を経て,米国Stowers Institute for Medical Research博士研究員.
研究テーマ:細胞分裂の制御を介した上皮組織の維持と破綻の分子細胞機構.
抱負:細胞のふるまいの丹念な観察と,実験による操作,そして,イマジネーション(妄想)を駆使して,新しいコンセプトを発信していきたい.
© 2013 中嶋 悠一朗 Licensed under CC 表示 2.1 日本
(米国Stowers Institute for Medical Research)
email:中嶋悠一朗
DOI: 10.7875/first.author.2013.104
Epithelial junctions maintain tissue architecture by directing planar spindle orientation.
Yu-ichiro Nakajima, Emily J. Meyer, Amanda Kroesen, Sean A. McKinney, Matthew C. Gibson
Nature, 500, 359-362 (2013)
要 約
上皮細胞は対称分裂の際に紡錘体軸を上皮と平行に配置することを特徴とする.近年,この紡錘体軸の方向の異常ががんの悪性化など病態に関与する可能性が指摘されてきた.しかしながら,生体の上皮における紡錘体軸の平面の方向への制御機構,そして,その生理的な意義は明らかではなかった.筆者らは,ショウジョウバエの翅成虫原基をモデルとして,分裂装置を制御するMud,細胞皮質のアクトミオシン,細胞間結合領域に局在する腫瘍抑制タンパク質ScribおよびDlgが,紡錘体軸の方向の制御に必要であることを明らかにした.紡錘体軸に異常を示した細胞は上皮から離脱しアポトーシスを起こすことにより除去されるが,このアポトーシスを抑制すると異常な細胞は上皮の基底側において上皮-間充織転換様の表現型を示し腫瘍を形成することもわかった.この研究は,紡錘体軸の平面性が上皮構造の維持に必要であること,そして,紡錘体軸の異常による腫瘍化をアポトーシスにより抑制するという,上皮に内在する新規の腫瘍抑制機構を明らかにした.
はじめに
多細胞生物の器官や付属肢をおおう上皮は,もっとも基本的なからだの構成単位である.上皮は外界と内部とをへだてる障壁としてはたらき,吸収や分泌を制御する.上皮がこれらの機能を正常に行うには,頂底軸の方向に極性をもつ上皮細胞が細胞間結合領域において互いに接着し細胞どうしのふるまいを調和させる,上皮の“完全性”を維持することが重要である.したがって,上皮構造は細胞の増殖,再配列,死など細胞の形態変化を許容しながらも,上皮の完全性を頑強に保証するためのしくみを備えているはずである.一方,この完全性の破綻は,頂底軸の極性の喪失のような上皮構造の異常をひき起こし,ひいては,がんの悪性化などの病態にもつながると考えられる.
発生の過程や恒常性の維持において,上皮細胞の多くは上皮に対し平行に細胞分裂し同じサイズの娘細胞を生み出す.上皮細胞の分裂は細胞の球形化という劇的な形態の変化にはじまり,紡錘体の形成,紡錘体軸の上皮の方向への配置(planar spindle orientation),上皮と直角の方向への分割,というプロセスをへる(図1a).紡錘体軸を上皮と平行に配置することにより娘細胞を上皮にとどまることを可能とするこのしくみは,上皮の完全性を保証し組織の成長や形態形成に寄与することが示唆されている1).近年,紡錘体軸の異常は多発性嚢胞腎やがんへの関与が指摘され,その制御機構の重要性が認識されはじめている2,3).しかしながら,生体の上皮において紡錘体軸を制御するしくみの多くは不明である.さらに重要なことに,紡錘体軸の異常が上皮組織においてどのような結果をもたらすのかという生理的な意義は明らかになっていない.その理由として,生体において適切な遺伝子操作が可能で紡錘体軸の異常という表現型を観察しやすい系が確立されていなかったことがあげられる.そこで,筆者らは,遺伝学的なツールが豊富で比較的単純な上皮構造をとるショウジョウバエの翅成虫原基をモデルとして,紡錘体軸の方向を制御するしくみとその生理的な意義を明らかにすることをめざした.
1.ショウジョウバエの翅成虫原基における分裂期の紡錘体軸の方向は分裂装置を制御するMudによる制御をうける
筆者らの研究室から,ショウジョウバエの翅成虫原基の円柱状細胞からなる偽重層上皮では,分裂期において上皮の頂端側にて細胞は球形化することが報告されている4).分裂期への進入とともにRhoキナーゼがミオシンをリン酸化し,アクトミオシンを収縮することにより細胞の球形化が誘導される.このとき興味深いことに,対称分裂は頂端側の細胞間結合領域のひとつであるセプテート結合とよばれる領域に限局して進行しており,この領域を有糸分裂帯(mitotic zone)と名づけた(図1b).分裂期における紡錘体軸の方向の制御機構について明らかにするため,中心体のマーカーを用いて紡錘体を詳細に観察した.その結果,分裂中期よりのちには球形化した細胞皮質にかこまれた紡錘体が有糸分裂帯に限局していた.また,紡錘体軸と上皮との角度を測定したところ,紡錘体軸の方向は上皮とほぼ平行に配置されていることが確認され,ショウジョウバエの翅成虫原基においても紡錘体軸の方向は精緻な制御をうけていることが示唆された.
紡錘体軸は間期における長軸の方向に配列しやすい性質のあることが示唆されている.しかしながら,ショウジョウバエの翅成虫原基における紡錘体軸の方向は長軸である頂端軸とは直角の方向であることから,なんらかの能動的な分子機構の関与が強く示唆された.そこで,紡錘体極に局在するタンパク質に注目し,脊椎動物におけるNuMAのオーソログであるMudを同定した.Mudはショウジョウバエの神経前駆細胞における非対称分裂や,胚外胚葉での対称分裂において紡錘体軸を制御することが知られている5).翅成虫原基においても,Mudは分裂期に紡錘体極に強く集積するという局在を示した.そして,翅成虫原基において特異的にMudをノックダウンしたところ,紡錘体軸に異常を示す分裂期の細胞の割合は有意に増加した.したがって,分裂装置を制御するMudは,紡錘体軸の方向の制御にも必要なタンパク質であることが明らかになった.
2.細胞皮質のアクトミオシンは紡錘体軸の方向の制御に必須である
細胞皮質は星状体微小管との相互作用の場であり,球形化した細胞皮質とのアンカーが紡錘体の細胞における位置や紡錘体軸の方向の決定に関与することが培養細胞の系から示唆されている6).ショウジョウバエの翅成虫原基の分裂期の細胞においては,紡錘体の周辺の細胞皮質にアクチンフィラメントの顕著な集積,および,Rhoキナーゼを介したミオシンのリン酸化が観察される.さらには,ERM(Ezrin/Radixin/Moesin)タンパク質であるMoesinのリン酸化が分裂期の細胞皮質の基底側に検出された.Moesinはショウジョウバエにおける唯一のERMタンパク質であり,リン酸化型Moesinは細胞膜と細胞骨格とをつなぎ細胞を球形化させることができる7).これらの観察から,RhoキナーゼおよびMoesinがアクチン細胞骨格を分裂期において特異的に再編成することにより細胞皮質の形状を球形化させ,紡錘体軸の制御に関与していることが期待された.
細胞皮質のアクトミオシンの紡錘体軸の制御への関与について明らかにするため,薬理学的な実験を行った.アクチン重合の阻害剤であるCytochalasin DやRhoキナーゼの阻害剤であるY-27632を用いてアクトミオシンの収縮を阻害したところ,約80%もの分裂細胞において紡錘体軸が90度近く反転し,上皮とは直角の方向を示した.また,RhoキナーゼあるいはMoesinをノックダウンしたところ,それぞれ,約60%あるいは約30%の紡錘体軸が薬理学的な実験と同様の重篤な表現型を示した.したがって,細胞皮質のアクトミオシンは紡錘体軸の方向の制御に必須であることが明らかになった.
3.腫瘍抑制タンパク質ScribおよびDlgは紡錘体軸に平面の方向をあたえる
紡錘体の位置や方向が細胞皮質の形状による影響をうけるとして,紡錘体軸はどのようにして上皮と平行な面に正確に配置されるのだろうか? 免疫染色と透過型電子顕微鏡を用いた観察から,紡錘体極はセプテート結合に近接していることが見い出された.ここで,セプテート結合に局在するタンパク質が紡錘体のタンパク質と相互作用することにより紡錘体軸に平面の方向をあたえているのではないかと考え,ScribとDlgに着目した.これらはショウジョウバエにおいて頂底軸の極性の決定に必要なタンパク質として知られており8),scrib変異体およびdlg変異体は翅成虫原基において組織の破綻をともなう新生腫瘍様の表現型を示す9).したがって,もしScribやDlgが紡錘体軸の制御に関与している場合,紡錘体軸の異常が腫瘍化にかかわっている可能性も考えられた.
ScribおよびDlgの紡錘体軸の方向の制御への関与について調べるため,発生の途中のショウジョウバエの翅成虫原基において特異的にScribをノックダウンした.このとき,3齢幼虫期(孵卵ののち5日まで)に頂底軸の極性の喪失はみられなかったにもかかわらず,40%以上の細胞において紡錘体軸の方向に異常が観察された.同様の紡錘体軸の異常の表現型はDlgのノックダウンにおいてもみられた.さらに,scrib変異体のクローンを翅成虫原基に作製し紡錘体軸の方向を定量したところ,その方向はランダムになった.したがって,これらの結果から,細胞間結合領域に局在する腫瘍抑制タンパク質ScribおよびDlgは,紡錘体軸に平面の方向をあたえるタンパク質であることが示唆された.興味深いことに,Scribをノックダウンした翅成虫原基は,幼虫期の延長とともに紡錘体軸の異常から組織構造の破綻を示す新生腫瘍様の表現型へと移行していった.このことから,紡錘体軸の異常は腫瘍化に関与する可能性が示唆された.
4.紡錘体軸に異常を示した細胞は上皮からの離脱をへてアポトーシスを起こす
紡錘体軸に異常を示した細胞は本当に腫瘍化に寄与しているのだろうか? MudあるいはRhoキナーゼの機能を欠損させたショウジョウバエの翅成虫原基では腫瘍化は誘導されなかったことから,紡錘体軸の異常だけでは腫瘍化に十分ではないことがわかった.そこで,紡錘体軸に異常を示した細胞がどのようにふるまうのかを生細胞イメージング法により観察した.通常の共焦点顕微鏡では画像の取得速度とレーザーによる光毒性が問題となり観察が困難であったため,SPIM(selective plane illumination microscopy,選択的平面照明顕微鏡法)を用いた翅成虫原基の生細胞イメージング系を確立した.このSPIMの利用により紡錘体軸を含んだ組織全体の観察が可能になり,その結果,重篤な紡錘体軸の異常を示した細胞の基底側の娘細胞が基底側へと下降していくようすが観察された.また,紡錘体軸が高頻度で異常になる翅成虫原基では,基底側に頂底軸の極性を失ったアポトーシス様の細胞が顕著にみられたことから,紡錘体軸の異常と細胞の上皮からの離脱,そして,アポトーシスが強く相関することが明らかになった.
5.アポトーシスの抑制のもと紡錘体軸に異常を示した細胞は上皮-間充織転換様の効果を獲得する
紡錘体軸に異常を示した細胞は,通常は上皮から除去されてアポトーシスを起こすため,わかりやすい表現型として観察されなかった可能性がある.そこで,紡錘体軸に異常を示した細胞においてアポトーシスを阻害した場合にどのような効果がみられるのかを検討した.MudあるいはRhoキナーゼをノックダウンしたクローンをショウジョウバエの翅成虫原基に任意に作製し,カスパーゼ抑制タンパク質であるp35を共発現することによりアポトーシスを阻害したところ,これらのクローンは基底側にて異常な細胞のかたまりを形成し腫瘍様の表現型を示した.このとき興味深いことに,基底側の異常な細胞においてEカドヘリンの喪失,マトリックスメタロプロテアーゼ1の発現,アクチンの再編成といった上皮-間充織転換(epithelial-mesenchymal transition:EMT)様の特徴がみられた.これらの結果から,上皮には紡錘体軸に異常を示した細胞にアポトーシスを起こすことにより除去し,組織構造の重篤な破綻をふせぐしくみが備わっていることが示唆された.また,このアポトーシスのしくみがはたらかないと,紡錘体軸に異常を示した細胞が上皮-間充織転換様の効果を獲得し,腫瘍化に寄与することが明らかになった(図2a).
おわりに
この研究により,ショウジョウバエの翅成虫原基における分裂期の紡錘体軸の方向は,分裂装置を制御するMud,細胞皮質のアクトミオシン,細胞間結合領域に局在する腫瘍抑制タンパク質ScribおよびDlgにより精密に制御されていることが示された(図2b).これまで,ScribおよびDlgは頂底軸の極性の決定に必要なタンパク質であり,その変異体は腫瘍様となることが長く知られていた.今回の報告は,ScribおよびDlgに上皮細胞の分裂において紡錘体軸に平面の方向をあたえるという新たな機能があることを明らかにし,紡錘体軸の異常がscrib変異体およびdlg変異体においてみられる組織構造の破綻に寄与している可能性を提示した.
また,この研究は,紡錘体軸の制御は上皮の完全性を維持する役割を担うだけでなく,アポトーシスとともに上皮の上皮-間充織転換を介した腫瘍化を抑制するはたらきがある,という新しい概念を提示した.これまでに,紡錘体軸の異常が腫瘍の悪性化に関与することは示唆されていたものの,その因果関係は明確ではなく,とくに,幹細胞ではない上皮細胞において紡錘体軸の方向に着目した研究は少なかった.細胞間結合領域を介した紡錘体軸の方向の制御機構,紡錘体軸の異常がもたらす上皮からの脱離とアポトーシスの誘導,紡錘体軸の異常が誘導するがん化のしくみ,などは,今回の報告から提示された重要なトピックであろう.興味深いことに,変異を獲得した異常な細胞が上皮のコンテクストから抜け出すことにより腫瘍化するという現象は,3次元培養したヒトの乳腺上皮に由来する細胞の実験系からも報告されている10).したがって,上皮から離脱した異常な細胞が腫瘍化の初期に貢献するしくみは種や組織をこえて保存されている可能性があり,脊椎動物の上皮においても紡錘体軸の異常が上皮構造の破綻につながるのか,今後の研究が待たれる.
文 献
- Morin, X. & Bellaiche, Y.: Mitotic spindle orientation in asymmetric and symmetric cell divisions during animal development. Dev. Cell, 21, 102-119 (2011)[PubMed]
- Noatynska, A., Gotta, M. & Meraldi, P.: Mitotic spindle (DIS)orientation and DISease: cause or consequence? J. Cell Biol., 199, 1025-1035 (2012)[PubMed]
- Pease, J. C. & Tirnauer, J. S.: Mitotic spindle misorientation in cancer-out of alignment and into the fire. J. Cell Sci., 124, 1007-1016 (2011)[PubMed]
- Meyer, E. J., Ikmi, A. & Gibson, M. C.: Interkinetic nuclear migration is a broadly conserved feature of cell division in pseudostratified epithelia. Curr. Biol., 21, 485-491 (2011)[PubMed]
- Izumi, Y., Ohta, N., Hisata, K. et al.: Drosophila Pins-binding protein Mud regulates spindle-polarity coupling and centrosome organization. Nat. Cell Biol., 8, 586-593 (2006)[PubMed]
- Sandquist, J. C., Kita, A. M .& Bement, W. M.: And the dead shall rise: actin and myosin return to the spindle. Dev. Cell, 21, 410-419 (2011)[PubMed]
- Fehon, R. G., McClatchey, A. I. & Bretscher, A.: Organizing the cell cortex: the role of ERM proteins. Nat. Rev. Mol. Cell Biol., 11, 276-287 (2010)[PubMed]
- Bilder, D. & Perrimon, N.: Localization of apical epithelial determinants by the basolateral PDZ protein Scribble. Nature, 403, 676-680 (2000)[PubMed]
- Bilder, D., Li, M. & Perrimon, N.: Cooperative regulation of cell polarity and growth by Drosophila tumor suppressors. Science, 289, 113-116 (2000)[PubMed]
- Leung, C. T. & Brugge, J. S.: Outgrowth of single oncogene-expressing cells from suppressive epithelial environments. Nature, 482, 410-413 (2012)[PubMed]
著者プロフィール
略歴:2011年 東京大学大学院薬学系研究科 修了,同年 同 特任研究員を経て,米国Stowers Institute for Medical Research博士研究員.
研究テーマ:細胞分裂の制御を介した上皮組織の維持と破綻の分子細胞機構.
抱負:細胞のふるまいの丹念な観察と,実験による操作,そして,イマジネーション(妄想)を駆使して,新しいコンセプトを発信していきたい.
© 2013 中嶋 悠一朗 Licensed under CC 表示 2.1 日本