細胞極性制御タンパク質mInscは非典型的な三量体Gタンパク質経路を介して好中球の遊走を制御する
鎌倉幸子・住本英樹
(九州大学大学院医学研究院 生化学分野)
email:住本英樹
DOI: 10.7875/first.author.2013.103
The cell polarity protein mInsc regulates neutrophil chemotaxis via a noncanonical G protein signaling pathway.
Sachiko Kamakura, Masatoshi Nomura, Junya Hayase, Yuko Iwakiri, Akihiko Nishikimi, Ryoichi Takayanagi, Yoshinori Fukui, Hideki Sumimoto
Developmental Cell, 26, 292-302 (2013)
ケモタキシスとは細胞が走化性因子の濃度勾配にしたがい遊走する現象であるが,そこでは運動能の亢進だけでなく遊走方向の維持が必要である.筆者らは,Gαiを含む三量体Gタンパク質に依存的な好中球の遊走の過程において,mInscというタンパク質が遊走の方向を制御していることを示した.遊走の過程では好中球の前方部に仮足が形成されるが,この仮足には走化性因子により生じた遊離のGDP結合型Gαiが集積し,それがmInscのパートナータンパク質であるLGN/AGS3との結合を介してmInscをリクルートすることを見い出した.さらに,mInscは進化的に保存された細胞極性制御タンパク質であるPar-aPKC複合体の仮足へのリクルートに必要であり,mInscを欠損した好中球,あるいは,aPKCの活性を阻害した好中球では,正常な運動能をもつにもかかわらず遊走の方向に異常がみられた.これは,形成された仮足が走化性因子の方向にむけ安定に維持されないことが原因であると考えられた.mInscが仮足を安定化するためにはLGN/AGS3を介したGDP結合型Gαiとの複合体の形成が必要であったことから,mInscは走化性因子により惹起されるGDP結合型Gαiに依存した,非典型的な三量体Gタンパク質経路を介して遊走の方向を制御すると考えられた.
ケモタキシスは細胞が走化性因子の濃度勾配にしたがい遊走する現象であり,発生の過程での形態形成や免疫応答において重要な役割を担う.白血球の一種である好中球は高等生物においてもっとも速い遊走速度をもち,体内に細菌や真菌など外来微生物が侵入するとケモタキシスによりどの細胞よりも早く侵入部位に到達し貪食して殺菌を行う1).好中球のケモタキシスはGαiを含む三量体Gタンパク質と共役した走化性因子受容体を介して起こる.一般に,Gタンパク質共役型受容体(G protein-coupled receptor:GPCR)が活性化するとGαサブユニットのGDP型からGTP型への変換が起こり,これがGαβγヘテロ三量体からGTP結合型GαおよびGβγの解離をひき起こす.“典型的”な三量体Gタンパク質経路ではGTP結合型GαおよびGβγのそれぞれが下流のエフェクターと結合し細胞内にシグナルを伝達する2).好中球のケモタキシスの過程ではGβγがキナーゼであるPI3Kγを活性化し運動能を亢進することが知られていたが,GTP結合型Gαiのエフェクターは知られておらず,Gαiサブユニットのケモタキシスにおける役割は不明であった.
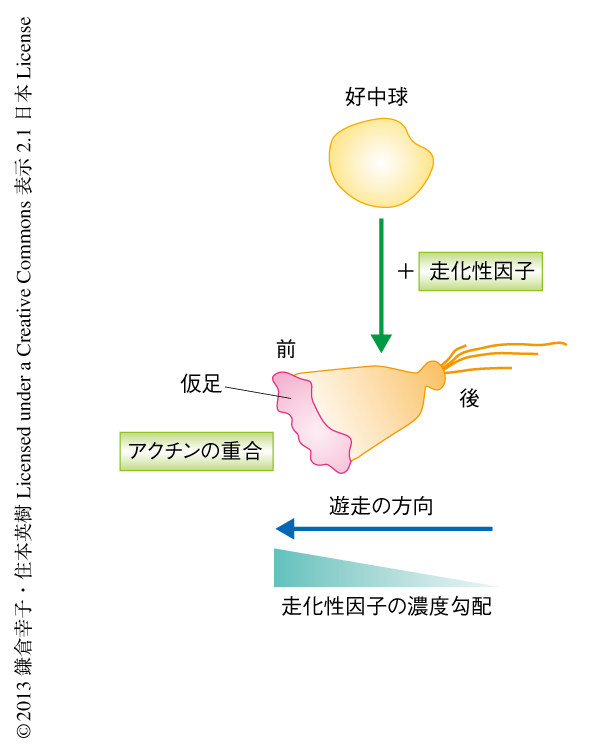
細胞が効率よくケモタキシスを起こすには,“運動能の亢進”だけでなく“遊走方向の維持”が必要である.好中球はGタンパク質共役型受容体を介する走化性因子,たとえば,細菌に由来するペプチドであるfMLPや補体に由来する成分であるC5aなどと反応すると静止期には球形だった形態がすばやく扇状に変化する(図1).このとき,細胞の前方部には仮足(pseudopod)が形成されるが,この仮足の形成は好中球における細胞極性の形成の目印となる.仮足ではアクチンの重合がさかんに起こり,これを原動力として運動能の亢進が起こる.その一方で,走化性因子の勾配にしたがい細胞極性が安定化することにより遊走方向が維持される3,4).しかしながら,ケモタキシスの過程でどのように細胞極性が維持されるのかについてはよくわかっていなかった.
細胞極性は進化的に保存された一群のタンパク質のはたらきにより形成され維持される5).そのようなタンパク質のうち,aPKC(atypical protein kinase C,非定型プロテインキナーゼC)はPar6と恒常的なヘテロ二量体を形成し細胞極性の形成におけるマスター酵素として機能する.aPKCはさらにアダプタータンパク質であるPar3と結合しうるが,このPar3-Par6-aPKC複合体は上皮細胞におけるタイトジャンクションの形成,ケラチノサイトや上皮系細胞の遊走,ショウジョウバエにおける神経幹細胞の非対称分裂といった種々の細胞極性の形成に寄与する5,6).ショウジョウバエの神経幹細胞ではPar3のホモログであるBazookaがPins(partner of Inscuteable)を介してInscuteableを神経幹細胞の頂端部に局在させることが非対称分裂に必須である.このInscuteableの哺乳類ホモログであるmInsc(mammalian Inscuteable)もまた,Par3および哺乳類Pins(LGNおよびAGS3)と同時に結合することができる7).LGN/AGS3はそのN末端領域にあるTPRモチーフを介してmInscと結合する一方,そのC末端領域にあるGoLoco/GPRモチーフを介して遊離の(Gβγと結合していない)GDP結合型Gαiと結合する.このGoLocoモチーフはGαサブユニットのうちGαiファミリーと特異的に結合することが知られている.mInscは哺乳類細胞において表皮細胞や神経系前駆細胞の分裂の方向を制御することが報告されている8).しかしながら,mInsc-LGN/AGS3複合体およびPar3-Par6-aPKC複合体が好中球のケモタキシスにおいて機能するかどうかについては知られていなかった.
走化性因子が特異的なGタンパク質共役型受容体に結合すると,GTP結合型GαiおよびGβγが放出される.GTP結合型Gαiはやがてそれ自体の酵素活性により加水分解され,遊離のGDP結合型Gαiとなる.好中球のケモタキシスの過程においてこの遊離のGDP結合型Gαiが少なからず生じていると考えられるが,このGDP結合型Gαiがシグナルの伝達に寄与しているかどうかについてはわかっていなかった.そこで,GDP結合型Gαiを検出するプローブとしてRGS12のGoLocoモチーフを含むタンパク質領域を用いた9).このプローブはGαサブユニットのなかでもGαiファミリーと特異的に結合するが,重要なことに,Gβγと結合してGαβγヘテロ三量体を形成したGDP結合型Gαiとは結合せず,遊離のGDP結合型Gαiとのみ結合する.このプローブにGSTタグを付加した組換えタンパク質を精製し,これを用いて細胞染色を試みた.走化性因子であるfMLPの濃度勾配のもとで遊走する好中球を固定し染色したところ,プローブのシグナルは前方の仮足に観察され,遊離のGDP結合型Gαiは遊走する好中球の仮足に集積することがわかった.このプローブによるシグナルは,未刺激の好中球や,百日咳毒素を処理することで受容体によるGTP結合型Gαiへの変換を抑制した好中球では検出されなかったことから,遊離のGDP結合型Gαiが好中球の前方に集積するためには,走化性因子によりGTP結合型Gαiの生じる必要があると考えられた.
好中球の前方に集積した遊離のGDP結合型Gαiのターゲットは何であろうか? mInscのパートナータンパク質であるLGNおよびAGS3はGoLocoモチーフを介して遊離のGDP結合型Gαiと結合する.そこで,遊走する好中球における内在性のAGS3の細胞内での局在について検討した.走化性因子であるfMLPの濃度勾配のもとで遊走する好中球を用いて抗AGS3抗体による免疫細胞染色を行ったところ,AGS3の仮足への集積が観察され,これは遊離GDP結合型Gαiの局在と一致した.おもしろいことに,内在性のmInscも同様に仮足に集積することがわかった.AGS3もmInscも,ともに未刺激の(細胞極性をもたない)好中球では細胞質に局在したことから,走化性因子により生じる遊離のGDP結合型GαiがAGS3およびmInscの仮足へのリクルートに必要だと考えられた.
mInscの生細胞における動態を調べるため,GFPを付加したmInscを好中球に発現させ,共焦点レーザー顕微鏡によるタイムラプス解析を行った.マイクロピペットを用いてごく少量のfMLPを好中球の近傍に放出すると,局所的にfMLPの濃度勾配が形成される.丸い形態をしている好中球は,fMLPに反応するとすばやく細胞極性を形成しマイクロピペットの先端にむかう.GFP標識mInscはfMLPの刺激のまえには細胞質に均一に局在していたが,好中球が遊走をはじめると同時に前方に集積した.一方,LGN/AGS3と結合できないmInsc変異体は10),細胞質に均一に局在したままだったことから,mInscのリクルートはLGN/AGS3との結合に依存することがわかった.一方,内在性のAGS3の好中球の前方への集積はmInscを欠損したマウスに由来する好中球においても観察されたことから,LGN/AGS3の局在はmInscに依存しないこともわかった.以上の結果から,fMLPの刺激により生じた遊離のGDP結合型Gαiが,LGN/AGS3を介してmInscを遊走する好中球の前方にリクルートすると考えられた.
好中球のケモタキシスにおけるmInscの役割を調べるため,mInscノックアウトマウスを作製した.このマウスに由来する好中球を用いてトランスウェル遊走アッセイを行ったところ,mInscを欠損した好中球は走化性因子であるfMLPおよびC5aに対する遊走の効率が野生型の好中球に比べ顕著に低かった.このことから,mInscがGタンパク質共役型受容体を介したケモタキシスを制御することが示唆された.一方で,fMLPおよびC5aにより誘導される活性酸素の産生や,PI3Kγ,AKT,ERK1/2の活性化について,mInscの欠損は影響をあたえなかった.これらのシグナルタンパク質の活性化はGβγに依存していることから,mInscはGβγによるシグナル伝達経路ではなく,おもにGαiサブユニットによるシグナル伝達経路を介して遊走を制御していることが予想された.
mInscは運動能と方向性のどちらを制御しているのかについて調べるため,走化性因子の濃度勾配のもとで遊走する好中球のタイムラプス解析を行い,その移動の軌跡を解析した.野生型の好中球はfMLPやC5aの濃度勾配にしたがって走化性因子の方向に直線性の高い軌跡をとり効率よく移動した.一方,mInscを欠損した好中球は蛇行するような軌跡を描き,濃度勾配に対し逆走する細胞もより多くみられた.運動能を評価するため移動速度を比較してみたところ,mInscを欠損した好中球は野生型の好中球と同等の運動能をもつことがわかった.このように,mInscは好中球のケモタキシスにおいて,運動能ではなく遊走の方向の制御に関与していると考えられた.
mInscによる遊走方向の制御の機構を調べるため,好中球において遊走の方向の制御に重要な仮足の形成および維持について解析した.好中球の細胞極性すなわち仮足の形成は,好中球を均一な濃度の走化性因子にさらしたときにも観察される.そのときの仮足の形成は一過性であるが,走化性因子の濃度勾配のもとでは仮足はより安定に維持されることが知られている.mInscを欠損した好中球を走化性因子であるfMLPの濃度勾配のもとにおくと,fMLPの濃度が高い方向に仮足の向いた細胞の割合が,野生型の好中球に比べ顕著に低いことがわかった.一方,均一な濃度のfMLPのもとでの仮足の形成の観察から,mInscを欠損した好中球において仮足の形成能そのものは正常であることがわかった.そこで,仮足が維持される時間についてより詳細に解析した.マイクロピペットを用いてごく少量のfMLPを近傍に放出することにより好中球を遊走させ,仮足の伸長の維持される時間を測定してみると,野生型の好中球に比べmInscを欠損した好中球ではその維持時間が短く,仮足の形成自体はさかんに起こるものの,退縮しやすいことがわかった.以上の結果から,mInscは走化性因子の方向に仮足を維持するのに必要であることが示唆された.
mInscが好中球の遊走を制御する際に,その下流で機能するタンパク質について検討した.以前の報告から,ケラチノサイトや上皮系細胞の遊走において細胞極性を制御するタンパク質としてPar3が知られていた3).筆者らはこれまでに,mInscがPar3およびLGNと同時に結合することを見い出していたことから7),遊走する好中球において内在性のPar3の局在を観察することにした.抗Par3抗体を用いた細胞染色の結果,走化性因子であるfMLPの濃度勾配のもとでPar3は前方の仮足に集積した.さらに,このPar3の集積はmInscを欠損した好中球では抑制されていたことから,mInscがPar3を仮足にリクルートすると考えられた.また筆者らは,mInscに結合しているPar3はaPKCおよびPar6とともに複合体を形成しうることを示している7,11).実際に,遊走する好中球においてPar6およびaPKCは,mInscに依存的に仮足に集積することもわかった.
aPKCの役割を知るため,aPKCの活性を阻害した好中球を用いて遊走の軌跡を解析した.aPKCに特異的な阻害ペプチドあるいは低分子阻害剤を処理したところ,対照となる細胞に比べ遊走の方向の正確性は低下した.このとき,運動能は影響をうけなかったことから,aPKCもまた運動能ではなく遊走の方向を制御していることが示唆された.以上の結果から,mInscは好中球のケモタキシスの過程においてPar3-Par6-aPKC複合体を前方にリクルートし,そこでaPKCが(未知の基質をリン酸化することにより)遊走の方向を制御すると考えられた.
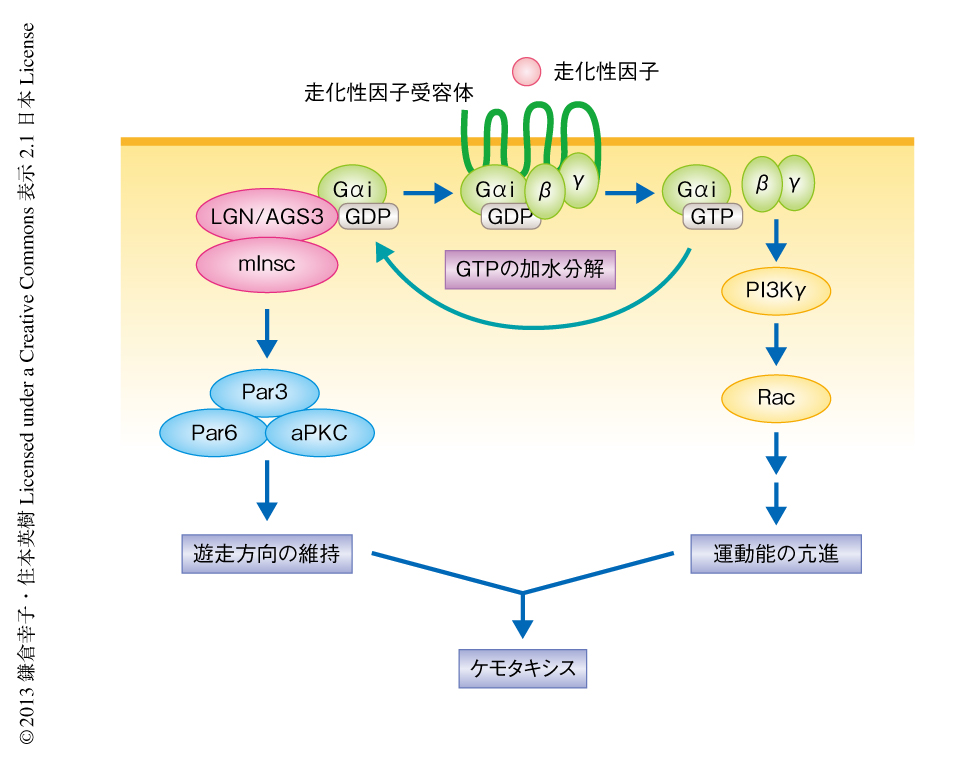
好中球のような速い移動速度をもつ細胞のケモタキシスにおいて走化性因子受容体の多くはGタンパク質共役型受容体であり,おもしろいことに,そのすべてがGαiファミリーと共役する.Gタンパク質共役型受容体の活性化によりGβγが放出されるが,その下流において活性化するキナーゼPI3Kγや低分子量Gタンパク質Racなどが細胞の前方においてアクチンの重合を促進することにより,運動能は亢進されると考えられている(図2).これまで,Gβγの下流のシグナル伝達経路については比較的よく解析されてきた一方で,Gαiサブユニットの役割についてはよくわかっていなかった.筆者らが示したGαiに特異的なmInscによる遊走の方向の制御は,走化性因子受容体とGαiとが共役する意義の,少なくとも一部を説明しうるかもしれない.
略歴:2000年 京都大学大学院理学研究科博士後期課程 修了,同年 東京大学分子細胞生物学研究所 研究員,2004年 九州大学生体防御医学研究所 助教を経て,2010年より九州大学大学院医学研究院 助教.
研究テーマ:好中球のケモタキシスにおける分子機構.
関心事:好中球の迅速かつ正確な遊走の不思議と,そのダイナミックな動き.
住本 英樹(Hideki Sumimoto)
九州大学大学院医学研究院 教授.
研究室URL:http://www.med.kyushu-u.ac.jp/biochem2/
© 2013 鎌倉幸子・住本英樹 Licensed under CC 表示 2.1 日本
(九州大学大学院医学研究院 生化学分野)
email:住本英樹
DOI: 10.7875/first.author.2013.103
The cell polarity protein mInsc regulates neutrophil chemotaxis via a noncanonical G protein signaling pathway.
Sachiko Kamakura, Masatoshi Nomura, Junya Hayase, Yuko Iwakiri, Akihiko Nishikimi, Ryoichi Takayanagi, Yoshinori Fukui, Hideki Sumimoto
Developmental Cell, 26, 292-302 (2013)
要 約
ケモタキシスとは細胞が走化性因子の濃度勾配にしたがい遊走する現象であるが,そこでは運動能の亢進だけでなく遊走方向の維持が必要である.筆者らは,Gαiを含む三量体Gタンパク質に依存的な好中球の遊走の過程において,mInscというタンパク質が遊走の方向を制御していることを示した.遊走の過程では好中球の前方部に仮足が形成されるが,この仮足には走化性因子により生じた遊離のGDP結合型Gαiが集積し,それがmInscのパートナータンパク質であるLGN/AGS3との結合を介してmInscをリクルートすることを見い出した.さらに,mInscは進化的に保存された細胞極性制御タンパク質であるPar-aPKC複合体の仮足へのリクルートに必要であり,mInscを欠損した好中球,あるいは,aPKCの活性を阻害した好中球では,正常な運動能をもつにもかかわらず遊走の方向に異常がみられた.これは,形成された仮足が走化性因子の方向にむけ安定に維持されないことが原因であると考えられた.mInscが仮足を安定化するためにはLGN/AGS3を介したGDP結合型Gαiとの複合体の形成が必要であったことから,mInscは走化性因子により惹起されるGDP結合型Gαiに依存した,非典型的な三量体Gタンパク質経路を介して遊走の方向を制御すると考えられた.
はじめに
ケモタキシスは細胞が走化性因子の濃度勾配にしたがい遊走する現象であり,発生の過程での形態形成や免疫応答において重要な役割を担う.白血球の一種である好中球は高等生物においてもっとも速い遊走速度をもち,体内に細菌や真菌など外来微生物が侵入するとケモタキシスによりどの細胞よりも早く侵入部位に到達し貪食して殺菌を行う1).好中球のケモタキシスはGαiを含む三量体Gタンパク質と共役した走化性因子受容体を介して起こる.一般に,Gタンパク質共役型受容体(G protein-coupled receptor:GPCR)が活性化するとGαサブユニットのGDP型からGTP型への変換が起こり,これがGαβγヘテロ三量体からGTP結合型GαおよびGβγの解離をひき起こす.“典型的”な三量体Gタンパク質経路ではGTP結合型GαおよびGβγのそれぞれが下流のエフェクターと結合し細胞内にシグナルを伝達する2).好中球のケモタキシスの過程ではGβγがキナーゼであるPI3Kγを活性化し運動能を亢進することが知られていたが,GTP結合型Gαiのエフェクターは知られておらず,Gαiサブユニットのケモタキシスにおける役割は不明であった.
細胞が効率よくケモタキシスを起こすには,“運動能の亢進”だけでなく“遊走方向の維持”が必要である.好中球はGタンパク質共役型受容体を介する走化性因子,たとえば,細菌に由来するペプチドであるfMLPや補体に由来する成分であるC5aなどと反応すると静止期には球形だった形態がすばやく扇状に変化する(図1).このとき,細胞の前方部には仮足(pseudopod)が形成されるが,この仮足の形成は好中球における細胞極性の形成の目印となる.仮足ではアクチンの重合がさかんに起こり,これを原動力として運動能の亢進が起こる.その一方で,走化性因子の勾配にしたがい細胞極性が安定化することにより遊走方向が維持される3,4).しかしながら,ケモタキシスの過程でどのように細胞極性が維持されるのかについてはよくわかっていなかった.
細胞極性は進化的に保存された一群のタンパク質のはたらきにより形成され維持される5).そのようなタンパク質のうち,aPKC(atypical protein kinase C,非定型プロテインキナーゼC)はPar6と恒常的なヘテロ二量体を形成し細胞極性の形成におけるマスター酵素として機能する.aPKCはさらにアダプタータンパク質であるPar3と結合しうるが,このPar3-Par6-aPKC複合体は上皮細胞におけるタイトジャンクションの形成,ケラチノサイトや上皮系細胞の遊走,ショウジョウバエにおける神経幹細胞の非対称分裂といった種々の細胞極性の形成に寄与する5,6).ショウジョウバエの神経幹細胞ではPar3のホモログであるBazookaがPins(partner of Inscuteable)を介してInscuteableを神経幹細胞の頂端部に局在させることが非対称分裂に必須である.このInscuteableの哺乳類ホモログであるmInsc(mammalian Inscuteable)もまた,Par3および哺乳類Pins(LGNおよびAGS3)と同時に結合することができる7).LGN/AGS3はそのN末端領域にあるTPRモチーフを介してmInscと結合する一方,そのC末端領域にあるGoLoco/GPRモチーフを介して遊離の(Gβγと結合していない)GDP結合型Gαiと結合する.このGoLocoモチーフはGαサブユニットのうちGαiファミリーと特異的に結合することが知られている.mInscは哺乳類細胞において表皮細胞や神経系前駆細胞の分裂の方向を制御することが報告されている8).しかしながら,mInsc-LGN/AGS3複合体およびPar3-Par6-aPKC複合体が好中球のケモタキシスにおいて機能するかどうかについては知られていなかった.
1.遊離のGDP結合型Gαiは遊走する好中球の前方に集積する
走化性因子が特異的なGタンパク質共役型受容体に結合すると,GTP結合型GαiおよびGβγが放出される.GTP結合型Gαiはやがてそれ自体の酵素活性により加水分解され,遊離のGDP結合型Gαiとなる.好中球のケモタキシスの過程においてこの遊離のGDP結合型Gαiが少なからず生じていると考えられるが,このGDP結合型Gαiがシグナルの伝達に寄与しているかどうかについてはわかっていなかった.そこで,GDP結合型Gαiを検出するプローブとしてRGS12のGoLocoモチーフを含むタンパク質領域を用いた9).このプローブはGαサブユニットのなかでもGαiファミリーと特異的に結合するが,重要なことに,Gβγと結合してGαβγヘテロ三量体を形成したGDP結合型Gαiとは結合せず,遊離のGDP結合型Gαiとのみ結合する.このプローブにGSTタグを付加した組換えタンパク質を精製し,これを用いて細胞染色を試みた.走化性因子であるfMLPの濃度勾配のもとで遊走する好中球を固定し染色したところ,プローブのシグナルは前方の仮足に観察され,遊離のGDP結合型Gαiは遊走する好中球の仮足に集積することがわかった.このプローブによるシグナルは,未刺激の好中球や,百日咳毒素を処理することで受容体によるGTP結合型Gαiへの変換を抑制した好中球では検出されなかったことから,遊離のGDP結合型Gαiが好中球の前方に集積するためには,走化性因子によりGTP結合型Gαiの生じる必要があると考えられた.
2.mInscおよびAGS3は遊走する好中球の前方にリクルートされる
好中球の前方に集積した遊離のGDP結合型Gαiのターゲットは何であろうか? mInscのパートナータンパク質であるLGNおよびAGS3はGoLocoモチーフを介して遊離のGDP結合型Gαiと結合する.そこで,遊走する好中球における内在性のAGS3の細胞内での局在について検討した.走化性因子であるfMLPの濃度勾配のもとで遊走する好中球を用いて抗AGS3抗体による免疫細胞染色を行ったところ,AGS3の仮足への集積が観察され,これは遊離GDP結合型Gαiの局在と一致した.おもしろいことに,内在性のmInscも同様に仮足に集積することがわかった.AGS3もmInscも,ともに未刺激の(細胞極性をもたない)好中球では細胞質に局在したことから,走化性因子により生じる遊離のGDP結合型GαiがAGS3およびmInscの仮足へのリクルートに必要だと考えられた.
mInscの生細胞における動態を調べるため,GFPを付加したmInscを好中球に発現させ,共焦点レーザー顕微鏡によるタイムラプス解析を行った.マイクロピペットを用いてごく少量のfMLPを好中球の近傍に放出すると,局所的にfMLPの濃度勾配が形成される.丸い形態をしている好中球は,fMLPに反応するとすばやく細胞極性を形成しマイクロピペットの先端にむかう.GFP標識mInscはfMLPの刺激のまえには細胞質に均一に局在していたが,好中球が遊走をはじめると同時に前方に集積した.一方,LGN/AGS3と結合できないmInsc変異体は10),細胞質に均一に局在したままだったことから,mInscのリクルートはLGN/AGS3との結合に依存することがわかった.一方,内在性のAGS3の好中球の前方への集積はmInscを欠損したマウスに由来する好中球においても観察されたことから,LGN/AGS3の局在はmInscに依存しないこともわかった.以上の結果から,fMLPの刺激により生じた遊離のGDP結合型Gαiが,LGN/AGS3を介してmInscを遊走する好中球の前方にリクルートすると考えられた.
3.mInscは好中球の遊走の方向を制御する
好中球のケモタキシスにおけるmInscの役割を調べるため,mInscノックアウトマウスを作製した.このマウスに由来する好中球を用いてトランスウェル遊走アッセイを行ったところ,mInscを欠損した好中球は走化性因子であるfMLPおよびC5aに対する遊走の効率が野生型の好中球に比べ顕著に低かった.このことから,mInscがGタンパク質共役型受容体を介したケモタキシスを制御することが示唆された.一方で,fMLPおよびC5aにより誘導される活性酸素の産生や,PI3Kγ,AKT,ERK1/2の活性化について,mInscの欠損は影響をあたえなかった.これらのシグナルタンパク質の活性化はGβγに依存していることから,mInscはGβγによるシグナル伝達経路ではなく,おもにGαiサブユニットによるシグナル伝達経路を介して遊走を制御していることが予想された.
mInscは運動能と方向性のどちらを制御しているのかについて調べるため,走化性因子の濃度勾配のもとで遊走する好中球のタイムラプス解析を行い,その移動の軌跡を解析した.野生型の好中球はfMLPやC5aの濃度勾配にしたがって走化性因子の方向に直線性の高い軌跡をとり効率よく移動した.一方,mInscを欠損した好中球は蛇行するような軌跡を描き,濃度勾配に対し逆走する細胞もより多くみられた.運動能を評価するため移動速度を比較してみたところ,mInscを欠損した好中球は野生型の好中球と同等の運動能をもつことがわかった.このように,mInscは好中球のケモタキシスにおいて,運動能ではなく遊走の方向の制御に関与していると考えられた.
4.mInscは遊走する好中球の前方で仮足を安定化する
mInscによる遊走方向の制御の機構を調べるため,好中球において遊走の方向の制御に重要な仮足の形成および維持について解析した.好中球の細胞極性すなわち仮足の形成は,好中球を均一な濃度の走化性因子にさらしたときにも観察される.そのときの仮足の形成は一過性であるが,走化性因子の濃度勾配のもとでは仮足はより安定に維持されることが知られている.mInscを欠損した好中球を走化性因子であるfMLPの濃度勾配のもとにおくと,fMLPの濃度が高い方向に仮足の向いた細胞の割合が,野生型の好中球に比べ顕著に低いことがわかった.一方,均一な濃度のfMLPのもとでの仮足の形成の観察から,mInscを欠損した好中球において仮足の形成能そのものは正常であることがわかった.そこで,仮足が維持される時間についてより詳細に解析した.マイクロピペットを用いてごく少量のfMLPを近傍に放出することにより好中球を遊走させ,仮足の伸長の維持される時間を測定してみると,野生型の好中球に比べmInscを欠損した好中球ではその維持時間が短く,仮足の形成自体はさかんに起こるものの,退縮しやすいことがわかった.以上の結果から,mInscは走化性因子の方向に仮足を維持するのに必要であることが示唆された.
5.mInscはPar3-Par6-aPKC複合体を仮足へとリクルートし遊走の方向を制御する
mInscが好中球の遊走を制御する際に,その下流で機能するタンパク質について検討した.以前の報告から,ケラチノサイトや上皮系細胞の遊走において細胞極性を制御するタンパク質としてPar3が知られていた3).筆者らはこれまでに,mInscがPar3およびLGNと同時に結合することを見い出していたことから7),遊走する好中球において内在性のPar3の局在を観察することにした.抗Par3抗体を用いた細胞染色の結果,走化性因子であるfMLPの濃度勾配のもとでPar3は前方の仮足に集積した.さらに,このPar3の集積はmInscを欠損した好中球では抑制されていたことから,mInscがPar3を仮足にリクルートすると考えられた.また筆者らは,mInscに結合しているPar3はaPKCおよびPar6とともに複合体を形成しうることを示している7,11).実際に,遊走する好中球においてPar6およびaPKCは,mInscに依存的に仮足に集積することもわかった.
aPKCの役割を知るため,aPKCの活性を阻害した好中球を用いて遊走の軌跡を解析した.aPKCに特異的な阻害ペプチドあるいは低分子阻害剤を処理したところ,対照となる細胞に比べ遊走の方向の正確性は低下した.このとき,運動能は影響をうけなかったことから,aPKCもまた運動能ではなく遊走の方向を制御していることが示唆された.以上の結果から,mInscは好中球のケモタキシスの過程においてPar3-Par6-aPKC複合体を前方にリクルートし,そこでaPKCが(未知の基質をリン酸化することにより)遊走の方向を制御すると考えられた.
おわりに
好中球のような速い移動速度をもつ細胞のケモタキシスにおいて走化性因子受容体の多くはGタンパク質共役型受容体であり,おもしろいことに,そのすべてがGαiファミリーと共役する.Gタンパク質共役型受容体の活性化によりGβγが放出されるが,その下流において活性化するキナーゼPI3Kγや低分子量Gタンパク質Racなどが細胞の前方においてアクチンの重合を促進することにより,運動能は亢進されると考えられている(図2).これまで,Gβγの下流のシグナル伝達経路については比較的よく解析されてきた一方で,Gαiサブユニットの役割についてはよくわかっていなかった.筆者らが示したGαiに特異的なmInscによる遊走の方向の制御は,走化性因子受容体とGαiとが共役する意義の,少なくとも一部を説明しうるかもしれない.
文 献
- Nathan, C.: Neutrophils and immunity: challenges and opportunities. Nat. Rev. Immunol., 6, 173-182 (2006)[PubMed]
- Oldham, W. M. & Hamm, H. E.: Heterotrimeric G protein activation by G-protein-coupled receptors. Nat. Rev. Mol. Cell Biol., 9, 60-71 (2008)[PubMed]
- Petrie, R. J., Doyle, A. D. & Yamada, K. M.: Random versus directionally persistent cell migration. Nat. Rev. Mol. Cell Biol., 10, 538-549 (2009)[PubMed]
- Stephens, L., Milne, L. & Hawkins, P.: Moving towards a better understanding of chemotaxis. Curr. Biol., 18, R485-R494 (2008)[PubMed]
- St Johnston, D. & Ahringer, J.: Cell polarity in eggs and epithelia: parallels and diversity. Cell, 141, 757-774 (2010)[PubMed]
- Knoblich, J. A.: Asymmetric cell division: recent developments and their implications for tumour biology. Nat. Rev. Mol. Cell Biol., 11, 849-860 (2010)[PubMed]
- Izaki, T., Kamakura, S., Kohjima, M. et al.: Two forms of human Inscuteable-related protein that links Par3 to the Pins homologues LGN and AGS3. Biochem. Biophys. Res. Commun., 341, 1001-1006 (2006)[PubMed]
- Lancaster, M. A. & Knoblich, J. A.: Spindle orientation in mammalian cerebral cortical development. Curr. Opin. Neurobiol., 22, 737-746 (2012)[PubMed]
- Kimple, R. J., De Vries, L., Tronchere, H. et al.: RGS12 and RGS14 GoLoco motifs are Gαi interaction sites with guanine nucleotide dissociation inhibitor activity. J. Biol. Chem., 276, 29275-29281 (2001)[PubMed]
- Yuzawa, S., Kamakura, S., Iwakiri, Y. et al.: Structural basis for interaction between the conserved cell polarity proteins Inscuteable and Leu-Gly-Asn repeat-enriched protein (LGN). Proc. Natl. Acad. Sci. USA, 108, 19210-19215 (2011)[PubMed]
- Sumimoto, H., Kamakura, S. & Ito, T.: Structure and function of the PB1 domain, a protein interaction module conserved in animals, fungi, amoebas, and plants. Sci. STKE, 2007, re6 (2007)[PubMed]
著者プロフィール
略歴:2000年 京都大学大学院理学研究科博士後期課程 修了,同年 東京大学分子細胞生物学研究所 研究員,2004年 九州大学生体防御医学研究所 助教を経て,2010年より九州大学大学院医学研究院 助教.
研究テーマ:好中球のケモタキシスにおける分子機構.
関心事:好中球の迅速かつ正確な遊走の不思議と,そのダイナミックな動き.
住本 英樹(Hideki Sumimoto)
九州大学大学院医学研究院 教授.
研究室URL:http://www.med.kyushu-u.ac.jp/biochem2/
© 2013 鎌倉幸子・住本英樹 Licensed under CC 表示 2.1 日本