MRAP2の機能喪失は哺乳類の肥満と関連する
浅井 真人
(米国Harvard Medical School,Boston Children's Hospital,Department of Medicine,Division of Endocrinology)
email:浅井真人
DOI: 10.7875/first.author.2013.098
Loss of function of the melanocortin 2 receptor accessory protein 2 is associated with mammalian obesity.
Masato Asai, Shwetha Ramachandrappa, Maria Joachim, Yuan Shen, Rong Zhang, Nikhil Nuthalapati, Visali Ramanathan, David E. Strochlic, Peter Ferket, Kirsten Linhart, Caroline Ho, Tatiana V. Novoselova, Sumedha Garg, Martin Ridderstråle, Claude Marcus, Joel N. Hirschhorn, Julia M. Keogh, Stephen O'Rahilly, Li F. Chan, Adrian J. Clark, I. Sadaf Farooqi, Joseph A. Majzoub
Science, 341, 275-278 (2013)
MRAPおよびMRAP2はin vitroにおいてメラノコルチン受容体から伝達されるシグナルを制御した.このうち脳で発現するMRAP2の役割を解明するため,MRAP2の全身および脳の視床下部に特異的なノックアウトマウスを作製した.これらのノックアウトマウスはどちらも離乳早期から重度の肥満になった.MRAP2は既知の肥満抑制遺伝子の産物であるメラノコルチン4型受容体と直接に相互作用し,メラノコルチン4型受容体により産生されるセカンドメッセンジャーcAMPの濃度を上昇させた.このことから,メラノコルチン4型受容体からのシグナル伝達の変容は,MRAP2遺伝子の破壊と肥満とのあいだに存在する因果関係を説明するのかもしれない.一方,重度かつ若年発症性の肥満患者からなるゲノムバンクを解析したところ,864人の肥満患者からMRAP2遺伝子において4つのヘテロ変異を発見したが,1864人の正常な体重をもつ対照からはこれらの変異はみつからなかった.これらMRAP2遺伝子の変異が肥満をひき起こしている可能性,すなわち,ヒトにおいて野生型のMRAP2遺伝子が体重の制御に寄与している可能性が考えられた.
肥満という用語は一般に,体脂肪の過剰な蓄積をさす.ほとんどの肥満は脂質の過剰な摂取などの環境因子に複数の遺伝因子がくわわり発症すると考えられるが,まれに,ひとつの遺伝子の変異だけで肥満が発症することがある.この単一遺伝子性肥満はすでに多くが知られているが1),それらの遺伝子変異がいかにして最終的に肥満につながるかの詳細な機構についてはわからない点が多い.そのなかで,比較的解明が進んでいるのはレプチンとその受容体であるレプチン受容体,αメラノサイト刺激ホルモンとその受容体であるメラノコルチン4型受容体である.具体的には,体内の脂肪細胞から血中に放出されるレプチンが血液脳関門をへて脳の視床下部にとどき,レプチン受容体を発現するPOMCニューロンを刺激,POMCニューロンはレプチンの刺激をうけてαメラノサイト刺激ホルモンを放出し,これを受け取るメラノコルチン4型受容体陽性ニューロンを刺激することが,最終的に摂食量や代謝を制御することにより体重を抑制するというレプチン-メラノコルチン経路である2,3).今回,筆者らがMRAP2遺伝子は体重抑制にかかわる遺伝子であると発見した研究のヒントは,メラノコルチン4型受容体と同じファミリーであるメラノコルチン2型受容体が副腎で十分に機能するためにはMRAPというタンパク質が必要だとした論文にあった4).メラノコルチン2型受容体の機能にMRAPが必要なら,視床下部において強い発現のみられるMRAP2の機能にはメラノコルチン4型受容体が必要であり,その遺伝子の破壊は肥満につながるだろうと,研究開始の当初より肥満の表現型を期待してノックアウトマウスの作製をはじめた.
発端となったのはヒトの先天性副腎皮質刺激ホルモン不応症に関する論文であった4).この論文は,副腎皮質において副腎皮質刺激ホルモンを受容し糖質コルチコイドの産生を刺激するメラノコルチン2型受容体という受容体には,MRAPという補助タンパク質が必要で,このタンパク質に変異があるとメラノコルチン2型受容体が十分にはたらかず,副腎皮質刺激ホルモンがあっても糖質コルチコイドの産生ができずに先天性の副腎不全になる,という特殊なタイプの遺伝疾患について報告していた.筆者らは,その産物はMRAPに非常によく似た構造をもつが,当時は自動化されたコンピューター解析により存在を予測されただけであったC6orf117遺伝子に着目した.このC6orf117遺伝子の産物はのちにMRAP2とよばれることになった.マウスの視床下部の組織を用いた二重in situハイブリダイゼーションにより,メラノコルチン4型受容体およびMRAP2をコードするmRNAは視床下部において同一の細胞にて発現することが確認された.そして,チャイニーズハムスター卵母細胞にメラノコルチン4型受容体の発現ベクター,MRAP2の発現ベクター,cAMP応答配列-ルシフェラーゼレポーター系を導入したin vitroの実験系において,MRAP2は確かにメラノコルチン4型受容体のαメラノサイト刺激ホルモンの濃度差を感受する機能を助けることが確認されたことから,MRAP2ノックアウトマウスの作製を決断した.
MRAP2ノックアウトマウスの作製には,使われはじめてまもない技術であったrecombineering法を用いた5).これは,大腸菌の内部での組換えを多用してプラスミドに固定した比較的大きなゲノム断片(10~15 kb)に,なるべく制限酵素を使わずにloxP配列を2か所挿入する効率のよいターゲティングベクターの作製法である.この方法を用い,全身のノックアウトマウスとコンディショナルノックアウトマウスを作製するためのトランスジェニックマウスを単一のターゲティングベクターから作製した.MRAP2の疎水性領域は種の違いをこえ保存性が高く,MRAP2とMRAPとのあいだにも高い相同性が認められた.MRAP2ノックアウトマウスではこの疎水性領域のすべてを含むエキソン約100 bpを削除し,フレームシフトにより以降のタンパク質の構造を破壊した.
129sv系のマウスにおいて作製したMRAP2ノックアウトマウスはメンデル比で出生し,ヘテロノックアウトマウスおよびホモノックアウトマウスは野生型マウスより有意に肥満した.この肥満の表現型はC57/BL6系のマウスでも再現することが確認された.129sv系の場合,MRAP2ノックアウトマウスの体重は脂質含量の低い通常の飼料をあたえたとき150日齢において50 g前後と,野生型マウスの体重(25 g前後)のほぼ倍になり,MRAP2は体重を抑制する重要な機能をもつことを示した.脳の視床下部に特異的なMRAP2ノックアウトマウスもやはり肥満の表現型を示し,MRAP2ノックアウトマウスの肥満は視床下部を介した効果であることがわかった.一方,MRAP2は副腎にも発現していることから,MRAP2の欠損が副腎においてメラノコルチン2型受容体の機能に影響している可能性を調べるため,糖質コルチコイドの日内変動やストレスを負荷したときの増加を測定したが,MRAP2ノックアウトマウスにこれらの異常はみられなかった.MRAP2ノックアウトマウスを自由に摂食させると野生型マウスに比べ約1割の過食を示したが,MRAP2ノックアウトマウスの摂食量を野生型マウスの摂食量以内に制限してもやはり肥満となった.いい換えると,MRAP2ノックアウトマウスは“過食がないのに太る”という非常に興味深い表現型を示した.肥満の直接の原因を調べるため,エネルギーの消費,餌の摂食量,糞のカロリーなどを詳細に測定したが,MRAP2ノックアウトマウスにおいて代謝の低下が生じているという証拠をつかむことはできなかった.
MRAP2がメラノコルチン4型受容体の機能に干渉するかどうかを調べるため,メラノコルチン受容体(1型~5型)もMRAPおよびMRAP2も内因性に発現しないチャイニーズハムスター卵母細胞に,メラノコルチン4型受容体の発現ベクター,MRAP2(野生型あるいは変異体)の発現ベクター,cAMP応答性配列-ルシフェラーゼレポーター系をいろいろな組合せで発現させたうえで,αメラノサイト刺激ホルモンを投与してcAMP濃度の上昇におよぼすMRAP2の影響を調べた.その結果,メラノコルチン4型受容体と野生型のMRAP2を導入したときだけ,細胞は細胞外のαメラノサイト刺激ホルモンの投与に敏感に反応した.一方,同じ実験を,メラノコルチン4型受容体をメラノコルチン3型受容体に置き換えて行ったところ,αメラノサイト刺激ホルモンに対するメラノコルチン3型受容体の反応はMRAP2を必要としていないことがわかった.
MRAP2ノックアウトマウスが肥満することを確認したのちに,重度かつ若年発症性の肥満患者からなるゲノムバンクにおいてゲノム解析を行い,864人の肥満者のゲノムからMRAP2遺伝子において4つのヘテロ変異を同定した.1864人の正常な体重をもつ対照のゲノムからはMRAP2遺伝子の変異は一例もみつからなかった.みつかった変異のうち,ひとつは全長205個のアミノ酸残基のうち24番目のアミノ酸残基を指定するコドンが終止コドンに置き換わるものであり,MRAP2のもつ疎水性領域を完全に失っているため実際の肥満の原因であった可能性が高いと思われたが,今回の研究で解析したゲノムバンクは家系調査をゆるしていなかったため,これ以上の変異家系の追跡はできなかった.ヒトにおいて,MRAP2遺伝子の変異を原因とした家族性の肥満がどのくらい存在するのか,今後,明らかにされるだろうと考える.
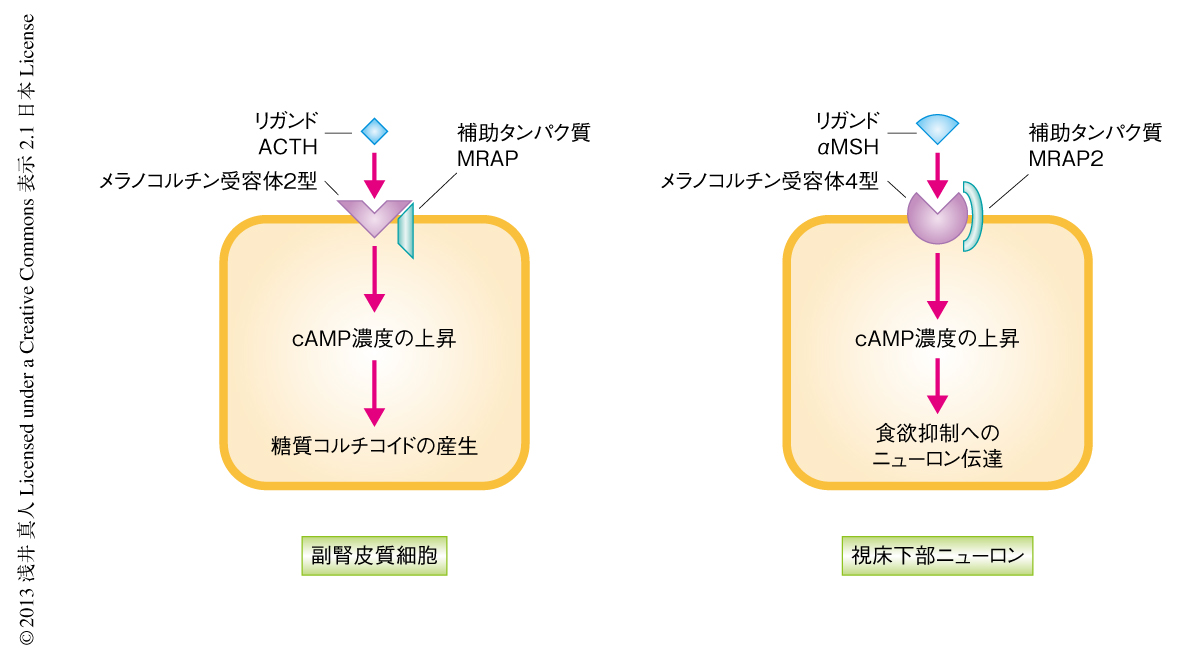
現在までの証拠から想像されるMRAP2の機能を示す(図1).まだいくつかの検証が必要ではあるが,MRAPやMRAP2が高度に保存された疎水性領域を膜貫通部位としてメラノコルチン受容体のシャペロンとしてはたらくという考えは魅力的である.MRAP2ノックアウトマウスにおいて副腎の機能に異常はないこと,毛の色に褪色はないことから,MRAP2は少なくとも副腎の機能において重要なメラノコルチン2型受容体,そして,毛の着色において重要なメラノコルチン1型受容体にとり必須ではないことも想像される.MRAPおよびMRAP2はメラノコルチン受容体のすべてに結合するという所見が報告されているが6),機能的には,MRAPにもMRAP2にも,メラノコルチン受容体の特定のサブタイプに対する指向性があると考えるのが現時点では自然な解釈かもしれない.
筆者らが興味をもつのは,MRAPおよびMRAP2,そして,メラノコルチン受容体ファミリーのそれぞれの祖先遺伝子がもっていた“原始の意味”である.メラノコルチン受容体のうちいくつかの遺伝子とMRAP2遺伝子は下等な脊椎動物であるヤツメウナギにも存在するが,現在までのところ,(脳があるものも含め)無脊椎動物には確認されていない7).比較的原始的な生物でこれらの祖先遺伝子がどのような役割をはたしているのかがわかったとき,高等な哺乳類において分化した,毛の着色,食欲の抑制,ストレスホルモンの受容とステロイドの産生,というばらばらな機能が総括的に記述されるのではないかと期待している.
肥満の原因を探るという点で,肥満が過食によるものなのか,代謝の低下によるものか,という誰もが少なからず興味をもつ歴史的な問いに対して,残念ながら今回の研究は十分に答えているとはいえない.それは,野生型のマウスと完全に等量の餌をあたえてもそれより太るMRAP2ノックアウトマウスにおいて,明確なエネルギー代謝の低下を証明することができなかったからである.こうした大きい問いに答えるには,脂肪と糖質は体内において本当に完全に兌換されるエネルギーなのか,糖質燃焼と脂肪燃焼の切り替えはどのような生化学的なシグナルにより行われるかなど,多くの問いに対しさきに答える必要がある.最近では,エネルギー代謝と燃料の選択(任意の時点でおもに脂肪が燃焼しているのか,糖質が燃焼しているのか)とを同時に継続して測定した結果,および,改良された数学モデルを用いて,体重の精度の高い予測をしようという取り組みがあり,肥満に関する長年の問いによりよい解答が示される可能性がある8).
略歴:2004年 名古屋大学大学院医学系研究科 修了,同年 米国Harvard Medical Schoolポスドク,2009年 名古屋大学環境医学研究所 客員研究者を経て,同年より名古屋大学大学院医学研究科 特任講師.
研究テーマ:肥満にとどまらず,神経内分泌一般.
関心事:シナプス可塑性,とくに,神経ペプチド分泌のしやすさと精神疾患との関連.
© 2013 浅井 真人 Licensed under CC 表示 2.1 日本
(米国Harvard Medical School,Boston Children's Hospital,Department of Medicine,Division of Endocrinology)
email:浅井真人
DOI: 10.7875/first.author.2013.098
Loss of function of the melanocortin 2 receptor accessory protein 2 is associated with mammalian obesity.
Masato Asai, Shwetha Ramachandrappa, Maria Joachim, Yuan Shen, Rong Zhang, Nikhil Nuthalapati, Visali Ramanathan, David E. Strochlic, Peter Ferket, Kirsten Linhart, Caroline Ho, Tatiana V. Novoselova, Sumedha Garg, Martin Ridderstråle, Claude Marcus, Joel N. Hirschhorn, Julia M. Keogh, Stephen O'Rahilly, Li F. Chan, Adrian J. Clark, I. Sadaf Farooqi, Joseph A. Majzoub
Science, 341, 275-278 (2013)
要 約
MRAPおよびMRAP2はin vitroにおいてメラノコルチン受容体から伝達されるシグナルを制御した.このうち脳で発現するMRAP2の役割を解明するため,MRAP2の全身および脳の視床下部に特異的なノックアウトマウスを作製した.これらのノックアウトマウスはどちらも離乳早期から重度の肥満になった.MRAP2は既知の肥満抑制遺伝子の産物であるメラノコルチン4型受容体と直接に相互作用し,メラノコルチン4型受容体により産生されるセカンドメッセンジャーcAMPの濃度を上昇させた.このことから,メラノコルチン4型受容体からのシグナル伝達の変容は,MRAP2遺伝子の破壊と肥満とのあいだに存在する因果関係を説明するのかもしれない.一方,重度かつ若年発症性の肥満患者からなるゲノムバンクを解析したところ,864人の肥満患者からMRAP2遺伝子において4つのヘテロ変異を発見したが,1864人の正常な体重をもつ対照からはこれらの変異はみつからなかった.これらMRAP2遺伝子の変異が肥満をひき起こしている可能性,すなわち,ヒトにおいて野生型のMRAP2遺伝子が体重の制御に寄与している可能性が考えられた.
はじめに
肥満という用語は一般に,体脂肪の過剰な蓄積をさす.ほとんどの肥満は脂質の過剰な摂取などの環境因子に複数の遺伝因子がくわわり発症すると考えられるが,まれに,ひとつの遺伝子の変異だけで肥満が発症することがある.この単一遺伝子性肥満はすでに多くが知られているが1),それらの遺伝子変異がいかにして最終的に肥満につながるかの詳細な機構についてはわからない点が多い.そのなかで,比較的解明が進んでいるのはレプチンとその受容体であるレプチン受容体,αメラノサイト刺激ホルモンとその受容体であるメラノコルチン4型受容体である.具体的には,体内の脂肪細胞から血中に放出されるレプチンが血液脳関門をへて脳の視床下部にとどき,レプチン受容体を発現するPOMCニューロンを刺激,POMCニューロンはレプチンの刺激をうけてαメラノサイト刺激ホルモンを放出し,これを受け取るメラノコルチン4型受容体陽性ニューロンを刺激することが,最終的に摂食量や代謝を制御することにより体重を抑制するというレプチン-メラノコルチン経路である2,3).今回,筆者らがMRAP2遺伝子は体重抑制にかかわる遺伝子であると発見した研究のヒントは,メラノコルチン4型受容体と同じファミリーであるメラノコルチン2型受容体が副腎で十分に機能するためにはMRAPというタンパク質が必要だとした論文にあった4).メラノコルチン2型受容体の機能にMRAPが必要なら,視床下部において強い発現のみられるMRAP2の機能にはメラノコルチン4型受容体が必要であり,その遺伝子の破壊は肥満につながるだろうと,研究開始の当初より肥満の表現型を期待してノックアウトマウスの作製をはじめた.
1.MRAP2ノックアウトマウスの作製前夜
発端となったのはヒトの先天性副腎皮質刺激ホルモン不応症に関する論文であった4).この論文は,副腎皮質において副腎皮質刺激ホルモンを受容し糖質コルチコイドの産生を刺激するメラノコルチン2型受容体という受容体には,MRAPという補助タンパク質が必要で,このタンパク質に変異があるとメラノコルチン2型受容体が十分にはたらかず,副腎皮質刺激ホルモンがあっても糖質コルチコイドの産生ができずに先天性の副腎不全になる,という特殊なタイプの遺伝疾患について報告していた.筆者らは,その産物はMRAPに非常によく似た構造をもつが,当時は自動化されたコンピューター解析により存在を予測されただけであったC6orf117遺伝子に着目した.このC6orf117遺伝子の産物はのちにMRAP2とよばれることになった.マウスの視床下部の組織を用いた二重in situハイブリダイゼーションにより,メラノコルチン4型受容体およびMRAP2をコードするmRNAは視床下部において同一の細胞にて発現することが確認された.そして,チャイニーズハムスター卵母細胞にメラノコルチン4型受容体の発現ベクター,MRAP2の発現ベクター,cAMP応答配列-ルシフェラーゼレポーター系を導入したin vitroの実験系において,MRAP2は確かにメラノコルチン4型受容体のαメラノサイト刺激ホルモンの濃度差を感受する機能を助けることが確認されたことから,MRAP2ノックアウトマウスの作製を決断した.
2.MRAP2ノックアウトマウスの作製
MRAP2ノックアウトマウスの作製には,使われはじめてまもない技術であったrecombineering法を用いた5).これは,大腸菌の内部での組換えを多用してプラスミドに固定した比較的大きなゲノム断片(10~15 kb)に,なるべく制限酵素を使わずにloxP配列を2か所挿入する効率のよいターゲティングベクターの作製法である.この方法を用い,全身のノックアウトマウスとコンディショナルノックアウトマウスを作製するためのトランスジェニックマウスを単一のターゲティングベクターから作製した.MRAP2の疎水性領域は種の違いをこえ保存性が高く,MRAP2とMRAPとのあいだにも高い相同性が認められた.MRAP2ノックアウトマウスではこの疎水性領域のすべてを含むエキソン約100 bpを削除し,フレームシフトにより以降のタンパク質の構造を破壊した.
3.MRAP2ノックアウトマウスは過食がなくとも肥満になる
129sv系のマウスにおいて作製したMRAP2ノックアウトマウスはメンデル比で出生し,ヘテロノックアウトマウスおよびホモノックアウトマウスは野生型マウスより有意に肥満した.この肥満の表現型はC57/BL6系のマウスでも再現することが確認された.129sv系の場合,MRAP2ノックアウトマウスの体重は脂質含量の低い通常の飼料をあたえたとき150日齢において50 g前後と,野生型マウスの体重(25 g前後)のほぼ倍になり,MRAP2は体重を抑制する重要な機能をもつことを示した.脳の視床下部に特異的なMRAP2ノックアウトマウスもやはり肥満の表現型を示し,MRAP2ノックアウトマウスの肥満は視床下部を介した効果であることがわかった.一方,MRAP2は副腎にも発現していることから,MRAP2の欠損が副腎においてメラノコルチン2型受容体の機能に影響している可能性を調べるため,糖質コルチコイドの日内変動やストレスを負荷したときの増加を測定したが,MRAP2ノックアウトマウスにこれらの異常はみられなかった.MRAP2ノックアウトマウスを自由に摂食させると野生型マウスに比べ約1割の過食を示したが,MRAP2ノックアウトマウスの摂食量を野生型マウスの摂食量以内に制限してもやはり肥満となった.いい換えると,MRAP2ノックアウトマウスは“過食がないのに太る”という非常に興味深い表現型を示した.肥満の直接の原因を調べるため,エネルギーの消費,餌の摂食量,糞のカロリーなどを詳細に測定したが,MRAP2ノックアウトマウスにおいて代謝の低下が生じているという証拠をつかむことはできなかった.
4.in vitroにおいてMRAP2はメラノコルチン4型受容体の機能に有意に干渉した
MRAP2がメラノコルチン4型受容体の機能に干渉するかどうかを調べるため,メラノコルチン受容体(1型~5型)もMRAPおよびMRAP2も内因性に発現しないチャイニーズハムスター卵母細胞に,メラノコルチン4型受容体の発現ベクター,MRAP2(野生型あるいは変異体)の発現ベクター,cAMP応答性配列-ルシフェラーゼレポーター系をいろいろな組合せで発現させたうえで,αメラノサイト刺激ホルモンを投与してcAMP濃度の上昇におよぼすMRAP2の影響を調べた.その結果,メラノコルチン4型受容体と野生型のMRAP2を導入したときだけ,細胞は細胞外のαメラノサイト刺激ホルモンの投与に敏感に反応した.一方,同じ実験を,メラノコルチン4型受容体をメラノコルチン3型受容体に置き換えて行ったところ,αメラノサイト刺激ホルモンに対するメラノコルチン3型受容体の反応はMRAP2を必要としていないことがわかった.
5.肥満者ゲノムバンクにおいてMRAP2遺伝子にヘテロ変異を同定した
MRAP2ノックアウトマウスが肥満することを確認したのちに,重度かつ若年発症性の肥満患者からなるゲノムバンクにおいてゲノム解析を行い,864人の肥満者のゲノムからMRAP2遺伝子において4つのヘテロ変異を同定した.1864人の正常な体重をもつ対照のゲノムからはMRAP2遺伝子の変異は一例もみつからなかった.みつかった変異のうち,ひとつは全長205個のアミノ酸残基のうち24番目のアミノ酸残基を指定するコドンが終止コドンに置き換わるものであり,MRAP2のもつ疎水性領域を完全に失っているため実際の肥満の原因であった可能性が高いと思われたが,今回の研究で解析したゲノムバンクは家系調査をゆるしていなかったため,これ以上の変異家系の追跡はできなかった.ヒトにおいて,MRAP2遺伝子の変異を原因とした家族性の肥満がどのくらい存在するのか,今後,明らかにされるだろうと考える.
おわりに
現在までの証拠から想像されるMRAP2の機能を示す(図1).まだいくつかの検証が必要ではあるが,MRAPやMRAP2が高度に保存された疎水性領域を膜貫通部位としてメラノコルチン受容体のシャペロンとしてはたらくという考えは魅力的である.MRAP2ノックアウトマウスにおいて副腎の機能に異常はないこと,毛の色に褪色はないことから,MRAP2は少なくとも副腎の機能において重要なメラノコルチン2型受容体,そして,毛の着色において重要なメラノコルチン1型受容体にとり必須ではないことも想像される.MRAPおよびMRAP2はメラノコルチン受容体のすべてに結合するという所見が報告されているが6),機能的には,MRAPにもMRAP2にも,メラノコルチン受容体の特定のサブタイプに対する指向性があると考えるのが現時点では自然な解釈かもしれない.
筆者らが興味をもつのは,MRAPおよびMRAP2,そして,メラノコルチン受容体ファミリーのそれぞれの祖先遺伝子がもっていた“原始の意味”である.メラノコルチン受容体のうちいくつかの遺伝子とMRAP2遺伝子は下等な脊椎動物であるヤツメウナギにも存在するが,現在までのところ,(脳があるものも含め)無脊椎動物には確認されていない7).比較的原始的な生物でこれらの祖先遺伝子がどのような役割をはたしているのかがわかったとき,高等な哺乳類において分化した,毛の着色,食欲の抑制,ストレスホルモンの受容とステロイドの産生,というばらばらな機能が総括的に記述されるのではないかと期待している.
肥満の原因を探るという点で,肥満が過食によるものなのか,代謝の低下によるものか,という誰もが少なからず興味をもつ歴史的な問いに対して,残念ながら今回の研究は十分に答えているとはいえない.それは,野生型のマウスと完全に等量の餌をあたえてもそれより太るMRAP2ノックアウトマウスにおいて,明確なエネルギー代謝の低下を証明することができなかったからである.こうした大きい問いに答えるには,脂肪と糖質は体内において本当に完全に兌換されるエネルギーなのか,糖質燃焼と脂肪燃焼の切り替えはどのような生化学的なシグナルにより行われるかなど,多くの問いに対しさきに答える必要がある.最近では,エネルギー代謝と燃料の選択(任意の時点でおもに脂肪が燃焼しているのか,糖質が燃焼しているのか)とを同時に継続して測定した結果,および,改良された数学モデルを用いて,体重の精度の高い予測をしようという取り組みがあり,肥満に関する長年の問いによりよい解答が示される可能性がある8).
文 献
- Farooqi, I. S. & O'Rahilly, S.: Monogenic obesity in humans. Annu. Rev. Med., 56, 443-458 (2005)[PubMed]
- Cummings, D. E. & Schwartz, M. W.: Melanocortins and body weight: a tale of two receptors. Nat. Genet., 26, 8-9 (2000)[PubMed]
- Walley, A. J., Asher, J. E. & Froguel, P.: The genetic contribution to non-syndromic human obesity. Nat. Rev. Genet., 10, 431-442 (2009)[PubMed]
- Metherell, L. A., Chapple, J. P., Cooray, S. et al.: Mutations in MRAP, encoding a new interacting partner of the ACTH receptor, cause familial glucocorticoid deficiency type 2. Nat. Genet., 37, 166-170 (2005)[PubMed]
- Liu, P., Jenkins, N. A. & Copeland, N. G.: A highly efficient recombineering-based method for generating conditional knockout mutations. Genome Res., 13, 476-484 (2003)[PubMed]
- Chan, L. F., Webb, T. R., Chung, T. T. et al.: MRAP and MRAP2 are bidirectional regulators of the melanocortin receptor family. Proc. Natl. Acad. Sci. USA, 106, 6146-6151 (2009)[PubMed]
- Kaelin, C. B., Candille, S. I., Yu, B. et al.: New ligands for melanocortin receptors. Int. J. Obes., 32, S19-S27 (2008)[PubMed]
- Guo, J. & Hall, K. D.: Predicting changes of body weight, body fat, energy expenditure and metabolic fuel selection in C57BL/6 mice. PLoS One, 5, e15961 (2011)[PubMed]
著者プロフィール
略歴:2004年 名古屋大学大学院医学系研究科 修了,同年 米国Harvard Medical Schoolポスドク,2009年 名古屋大学環境医学研究所 客員研究者を経て,同年より名古屋大学大学院医学研究科 特任講師.
研究テーマ:肥満にとどまらず,神経内分泌一般.
関心事:シナプス可塑性,とくに,神経ペプチド分泌のしやすさと精神疾患との関連.
© 2013 浅井 真人 Licensed under CC 表示 2.1 日本