体細胞性かつ機能獲得型のSETBP1遺伝子変異は骨髄性悪性腫瘍において白血病化の進展にともない認められる
牧島秀樹・Jaroslaw P Maciejewski
(米国Cleveland Clinic,Taussig Cancer Institute)
email:牧島秀樹
DOI: 10.7875/first.author.2013.096
Somatic SETBP1 mutations in myeloid malignancies.
Hideki Makishima, Kenichi Yoshida, Nhu Nguyen, Bartlomiej Przychodzen, Masashi Sanada, Yusuke Okuno, Kwok Peng Ng, Kristbjorn O. Gudmundsson, Bandana A. Vishwakarma, Andres Jerez, Ines Gomez-Segui, Mariko Takahashi, Yuichi Shiraishi, Yasunobu Nagata, Kathryn Guinta, Hiraku Mori, Mikkael A. Sekeres, Kenichi Chiba, Hiroko Tanaka, Hideki Muramatsu, Hirotoshi Sakaguchi, Ronald L. Paquette, Michael A. McDevitt, Seiji Kojima, Yogen Saunthararajah, Satoru Miyano, Lee-Yung Shih, Yang Du, Seishi Ogawa, Jaroslaw P Maciejewski
Nature Genetics, 45, 942-946 (2013)
今回,筆者らは,さまざまな骨髄性腫瘍症につき20例を全エキソンの塩基配列決定により解析し,SETBP1遺伝子の体細胞における変異が白血病の原因であることを見い出した.非定型慢性骨髄性白血病における最近の報告と同様に,SETBP1遺伝子の体細胞における変異はAsp868,Ser869,Gly870,Ile871,Asp880において特異的に認められ,先天性のSchinzel-Giedion症候群において報告された生殖細胞における変異の位置とほぼ一致していた.従来のSanger法よりも感度の高いディープシークエンシング法により,2次性の急性骨髄性白血病の17%,慢性骨髄単球性白血病の15%においてSETBP1遺伝子に変異が認められた.変異をもつ症例は高年齢や第7染色体のモノソミーあるいは第7染色体長腕の欠失などの予後不良因子と関係し,変異をもつ症例の予後は有意に不良であった.同一の症例における複数回の塩基配列決定により,SETBP1遺伝子の変異は骨髄異形成症候群の発症のときには認められず,2次性の急性骨髄性白血病にともない獲得されることが確認された.変異をもつSETBP1遺伝子を発現させると骨髄系の血液前駆細胞は不死化し,変異株は野生株に比べ増殖能が高くなった.以上より,SETBP1遺伝子の体細胞における変異は機能獲得型であり,2次性の急性骨髄性白血病への進展に関係し,骨髄性腫瘍の予後不良因子であることが明らかになった.
最近の塩基配列決定技術の発達により,骨髄腫瘍の原因となる遺伝子変異がつぎつぎと発見されている.従来の塩基配列決定法によるRUNX1遺伝子変異,JAK2遺伝子変異,RAS遺伝子変異の発見にひきつづき,SNPアレイを用いた検索によりCBL遺伝子変異,TET2遺伝子変異,EZH2遺伝子変異が明らかにされた1-3).最近では,次世代シークエンサーを用いてDNMT3A遺伝子,IDH1遺伝子,スプライソソ-ム関連遺伝子の体細胞における変異が骨髄腫瘍において発見されている4-7).このような背景のもと,筆者らは,全エキソンの塩基配列決定により骨髄腫瘍のゲノムを解析することにより,新たな原因遺伝子変異の検出を試みた.
さまざまな骨髄腫瘍20例において,全エキソンの塩基配列決定を腫瘍画分およびCD3陽性画分のDNAをセットにして行った.つづいて,Sanger法による塩基配列決定あるいはターゲットディープシークエンシング法により,アミノ酸の置換をともなう38個の体細胞における変異を確認した.このうち,7個の遺伝子については複数の症例において変異が認められ,そのうち,2例の芽球増加型不応性貧血症例において,SETBP1遺伝子において868番目のAspがAsnになるという同一の変異が認められた.
SETBP1はSETに結合する170 kDaの核タンパク質として報告され,慢性肉芽種において顆粒球系の造血の回復を促す作用が認められた8,9).SETBP1遺伝子の生殖細胞における変異はSchinzel-Giedion症候群の原因であり,この症候群において神経上皮性腫瘍をはじめ悪性腫瘍の合併が報告されている10).驚くべきことに,2例の骨髄腫瘍における体細胞変異は,Schinzel-Giedion症候群において報告されていた生殖細胞における変異とまったく同一のアミノ酸置換を示した.そこで,SETBP1遺伝子の変異について多数の骨髄腫瘍症例において検討することにした.
全コホート727例の検討では,7.2%に相当する52例においてSETBP1遺伝子に変異が認められた.868番目のAspがAsnとなる変異(28例),870番目のGlyがSerとなる変異(15例),871番目のIleがThrとなる変異(5例)が高頻度であり,868番目のAspがTyrとなる変異,869番目のSerがAsnとなる変異,880番目のAspがAsnとなる変異,880番目のAspがGluとなる変異がそれぞれ1例ずつ認められた.これらすべての変異は種のあいだできわめて保存されているSKI相同領域に位置していた.SNPアレイおよび変異のアレル頻度の検討から,すべての変異はヘテロ変異であることが明らかになった.さらに,ゲノムDNAとcDNAを用いた,868番目のAspがAsnとなる変異および870番目のGlyがSerとなる変異をターゲットにしたアレル特異的PCR法により,野生型のアレルに比較し同等以上の変異アレルの発現が確認された.病歴においてはSchinzel-Giedion症候群を示唆する所見は認められず,骨髄腫瘍において認められたすべての変異は体細胞性であった.SETBP1遺伝子変異は高年齢および第7染色体のモノソミーあるいは第7染色体長腕の欠失と有意に関連し,2次性の急性骨髄性白血病(113例中19例)および慢性骨髄単球性白血病(152例中22例)において高頻度であった一方,初発の急性骨髄性白血病(145例中1例)ではごくまれであった.これら変異陽性の症例のうち,12症例では複数の病期における塩基配列決定が可能であった.すべての症例において,初発の骨髄異形成症候群の病期ではSETBP1遺伝子変異は陰性であったが,2次性の急性骨髄性白血病の病期には陽性となり,進行にともない変異クローンは増加していた.以上より,SETBP1遺伝子変異は2次性白血病の発症と強く相関している可能性が示唆された.
骨髄腫瘍においてSETBP1遺伝子変異とほかの遺伝子の変異との関連を明らかにする目的で,血液腫瘍において重要とされている13つの遺伝子の塩基配列を決定した.その結果,興味深いことに,FLT3遺伝子変異およびNPM1遺伝子変異はSETBP1遺伝子変異をもつ症例には認められなかった.一方,CBL遺伝子変異のみが,野生型のSETBP1遺伝子をもつ症例に比較し,SETBP1遺伝子に変異をもつ症例において有意に高頻度であった.ディープシークエンシング法による解析の結果,多くの場合,CBL遺伝子変異はSETBP1遺伝子変異をもつサブクローンに認められた.しかしながら,免疫沈降法によるタンパク質の結合解析ではSETBP1とCBLとの直接的な関連は示されなかった.SETBP1遺伝子変異とCBL遺伝子変異の高頻度の合併については,たとえば,SETBP1遺伝子変異をもつ細胞のサイトカインに対する反応を間接的に増加させるなどの可能性が推定された.同様に,CBL遺伝子変異が高頻度に合併する非定型慢性骨髄性白血病および若年性骨髄単球性白血病(サイトカインへの過剰反応が診断基準となっている)において,SETBP1遺伝子変異もまた高頻度に認められる11,12).
正常な血液細胞におけるSETBP1遺伝子の発現は,骨髄系細胞およびCD34陽性細胞では低下していた.一方,リアルタイムPCR法による検討では,SETBP1遺伝子に変異をもつ症例においてSETBP1遺伝子は有意に高発現しており,マイクロアレイによる発現解析においても,SETBP1遺伝子は第7染色体の欠失,および,複雑核型の症例において有意に高発現していた.クラスタリング解析においてSETBP1遺伝子に変異をもつ症例とSETBP1遺伝子を高発現する症例は類似した遺伝子発現プロファイルを示し,TCF4遺伝子,BCL11A遺伝子,DNTT遺伝子などが共通して高発現していた.関連して,SETBP1遺伝子の近傍のCpG部位をメチル化アレイにより解析した結果,SETBP1遺伝子を高発現する症例においてDNAメチル化レベルの低下が確認された.しかしながら,SETBP1遺伝子の発現制御に関しては,MECOM遺伝子などをはじめ,さまざまな遺伝子がかかわる可能性があり,SETBP1遺伝子に変異をもつ症例における遺伝子発現の亢進の分子機構を含め,今後の詳細な検討が必要である.
全コホートにおいてSETBP1遺伝子変異は有意な予後不良因子であった.この傾向は年齢にかかわらず認められ,とくに60歳未満において顕著であった.同様に,正常な核型における解析でもSETBP1遺伝子について変異型と野生型とのあいだで全生存期間に有意差が認められた.多変量解析ではSETBP1遺伝子変異は,性別(男性),高年齢,ASXL1遺伝子変異,CBL遺伝子変異,DNMT3A遺伝子変異とともに,独立した予後不良因子であった.第7染色体のモノソミーあるいは第7染色体長腕の欠失は,単変量解析においては有意な予後不良因子であったが,多変量解析において有意差はみられなかった.サブグループにおける多変量解析について,国際予後スコアの適応が可能であった骨髄異形成症候群の症例および白血球12,000/μl未満の慢性骨髄単球性白血病の症例を対象として行った.このコホートでもSETBP1遺伝子変異は独立した予後不良因子であった.単変量解析において認められた国際予後スコアの有意差は多変量解析ではみられなかった.骨髄異形成症候群の単独,慢性骨髄単球性白血病の単独,2次性急性骨髄性白血病など,さらなるサブグループにおける解析では,SETBP1遺伝子変異は有意な予後不良因子とはならなかった.つぎに,SETBP1遺伝子変異を関連するCBL遺伝子変異と組み合わせて予後を解析した.慢性骨髄単球性白血病の単独コホートにおいて,野生型のSETBP1遺伝子かつ野生型のCBL遺伝子をもつ症例と,変異型のSETBP1遺伝子かつ変異型のCBL遺伝子をもつ症例を比較すると,変異型SETBP1遺伝子かつ変異型CBL遺伝子が予後不良因子となった.
これまでに,野生型のSETBP1遺伝子の高発現は骨髄系の血液前駆細胞を不死化することが報告されている13).高頻度に認められた868番目のAspがAsnとなる変異SETBP1遺伝子あるいは871番目のIleがThrとなる変異SETBP1遺伝子を発現させたところ,同様に骨髄系の血液前駆細胞は不死化した.野生型SETBP1遺伝子あるいは変異SETBP1遺伝子を同じ程度に発現させたところ,不死化した前駆細胞は変異SETBP1遺伝子を発現させたほうが有意に速く増殖した.これらの所見により,骨髄腫瘍におけるSETBP1遺伝子変異は機能獲得型であると推測された.野生型SETBP1遺伝子の高発現によりホメオボックス遺伝子であるHOXA9遺伝子およびHOXA10遺伝子の発現の亢進がひき起こされると報告されていたため13),変異SETBP1遺伝子の発現に関して同様の検討を行った.変異SETBP1遺伝子の発現による不死化細胞において,HOXA9遺伝子あるいはHOXA10遺伝子の発現を抑制するとコロニー形成能が低下した.臨床検体を用いたリアルタイムPCR法による解析により,SETBP1遺伝子に変異をもつ症例においてHOXA9遺伝子およびHOXA10遺伝子の発現亢進が認められ,SETBP1遺伝子の下流において発現の誘導されるHOXA9遺伝子およびHOXA10遺伝子が骨髄腫瘍における病態に重要なはたらきをもつことが示唆された.
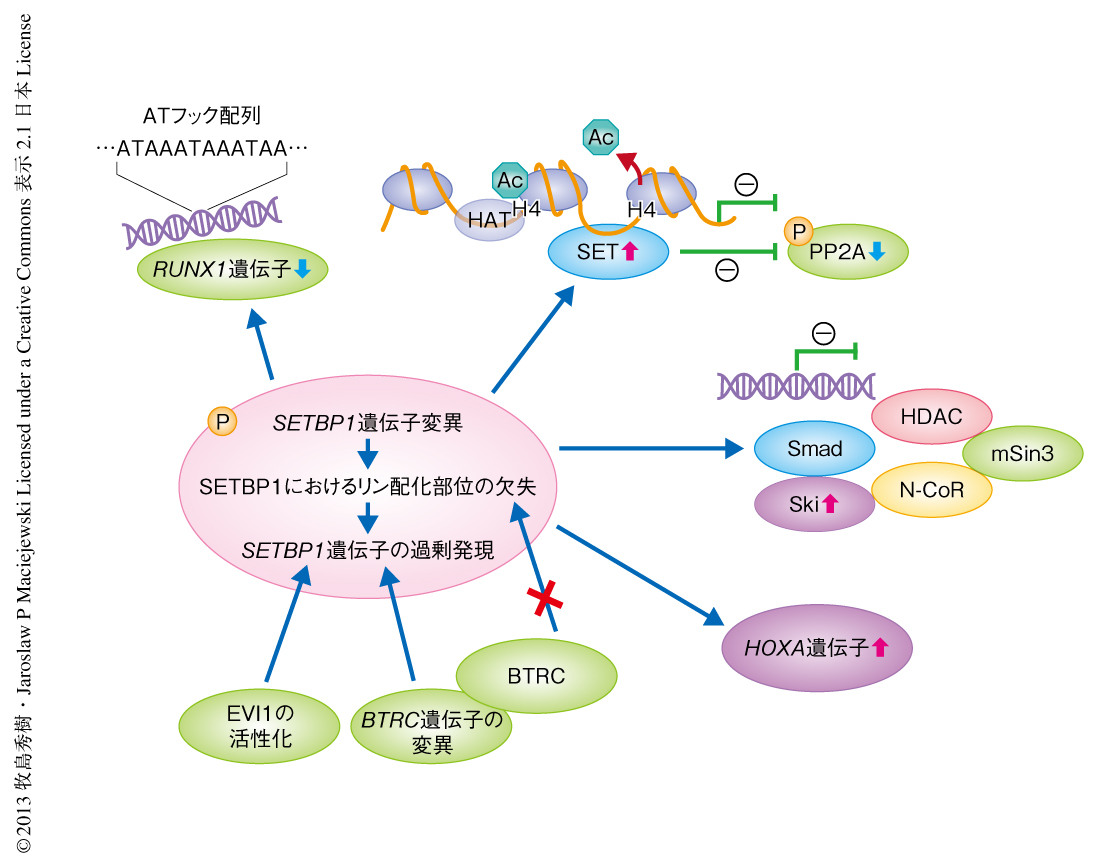
ホメオボックス遺伝子の発現亢進のほかにも,SETBP1遺伝子の変異にともなう複数の病態が考えられる(図1).たとえば,最近になり報告されたように,変異にともないタンパク質の安定性が増加し,その結果,機能をもつタンパク質の量が増加する可能性もある.あるいは,変異が集中して認められるSKI相同領域はSki/SnoNと相互作用を起こすことが報告されており,変異によりこの結合能が変化するのかもしれない.もうひとつの病因として,変異SETBP1遺伝子の発現による不死化細胞においてPP2Aのリン酸化が亢進するという所見が認められたことから,その機能抑制をも考慮すべきである.これらの所見は,SETBP1遺伝子に変異をもつ症例においてPP2Aの機能亢進を促す薬剤の可能性を拓くものである.
かぎられた部位に集中して起こる体細胞性のSETBP1遺伝子変異は,骨髄異形成症候群における2次性の急性骨髄性白血病発症と関連する,骨髄腫瘍において新たに発見された予後不良因子である.この機能獲得型の遺伝子変異は骨髄腫瘍における治療標的となる可能性があり,今後の検討が期待される.
略歴:2003年 信州大学大学院医学研究科博士課程 修了,同年 信州大学医学部附属病院 医員,2008年 米国Cleveland Clinicポストドクトラルフェローを経て,2012年より同 リサーチアソシエイト.
研究テーマ:骨髄腫瘍におけるゲノム異常.
抱負:骨髄腫瘍を治癒・根絶する.
Jaroslaw P Maciejewski
米国Cleveland ClinicにてDepartment Chair.
© 2013 牧島秀樹・Jaroslaw P Maciejewski Licensed under CC 表示 2.1 日本
(米国Cleveland Clinic,Taussig Cancer Institute)
email:牧島秀樹
DOI: 10.7875/first.author.2013.096
Somatic SETBP1 mutations in myeloid malignancies.
Hideki Makishima, Kenichi Yoshida, Nhu Nguyen, Bartlomiej Przychodzen, Masashi Sanada, Yusuke Okuno, Kwok Peng Ng, Kristbjorn O. Gudmundsson, Bandana A. Vishwakarma, Andres Jerez, Ines Gomez-Segui, Mariko Takahashi, Yuichi Shiraishi, Yasunobu Nagata, Kathryn Guinta, Hiraku Mori, Mikkael A. Sekeres, Kenichi Chiba, Hiroko Tanaka, Hideki Muramatsu, Hirotoshi Sakaguchi, Ronald L. Paquette, Michael A. McDevitt, Seiji Kojima, Yogen Saunthararajah, Satoru Miyano, Lee-Yung Shih, Yang Du, Seishi Ogawa, Jaroslaw P Maciejewski
Nature Genetics, 45, 942-946 (2013)
要 約
今回,筆者らは,さまざまな骨髄性腫瘍症につき20例を全エキソンの塩基配列決定により解析し,SETBP1遺伝子の体細胞における変異が白血病の原因であることを見い出した.非定型慢性骨髄性白血病における最近の報告と同様に,SETBP1遺伝子の体細胞における変異はAsp868,Ser869,Gly870,Ile871,Asp880において特異的に認められ,先天性のSchinzel-Giedion症候群において報告された生殖細胞における変異の位置とほぼ一致していた.従来のSanger法よりも感度の高いディープシークエンシング法により,2次性の急性骨髄性白血病の17%,慢性骨髄単球性白血病の15%においてSETBP1遺伝子に変異が認められた.変異をもつ症例は高年齢や第7染色体のモノソミーあるいは第7染色体長腕の欠失などの予後不良因子と関係し,変異をもつ症例の予後は有意に不良であった.同一の症例における複数回の塩基配列決定により,SETBP1遺伝子の変異は骨髄異形成症候群の発症のときには認められず,2次性の急性骨髄性白血病にともない獲得されることが確認された.変異をもつSETBP1遺伝子を発現させると骨髄系の血液前駆細胞は不死化し,変異株は野生株に比べ増殖能が高くなった.以上より,SETBP1遺伝子の体細胞における変異は機能獲得型であり,2次性の急性骨髄性白血病への進展に関係し,骨髄性腫瘍の予後不良因子であることが明らかになった.
はじめに
最近の塩基配列決定技術の発達により,骨髄腫瘍の原因となる遺伝子変異がつぎつぎと発見されている.従来の塩基配列決定法によるRUNX1遺伝子変異,JAK2遺伝子変異,RAS遺伝子変異の発見にひきつづき,SNPアレイを用いた検索によりCBL遺伝子変異,TET2遺伝子変異,EZH2遺伝子変異が明らかにされた1-3).最近では,次世代シークエンサーを用いてDNMT3A遺伝子,IDH1遺伝子,スプライソソ-ム関連遺伝子の体細胞における変異が骨髄腫瘍において発見されている4-7).このような背景のもと,筆者らは,全エキソンの塩基配列決定により骨髄腫瘍のゲノムを解析することにより,新たな原因遺伝子変異の検出を試みた.
1.SETBP1遺伝子の体細胞における変異の発見
さまざまな骨髄腫瘍20例において,全エキソンの塩基配列決定を腫瘍画分およびCD3陽性画分のDNAをセットにして行った.つづいて,Sanger法による塩基配列決定あるいはターゲットディープシークエンシング法により,アミノ酸の置換をともなう38個の体細胞における変異を確認した.このうち,7個の遺伝子については複数の症例において変異が認められ,そのうち,2例の芽球増加型不応性貧血症例において,SETBP1遺伝子において868番目のAspがAsnになるという同一の変異が認められた.
SETBP1はSETに結合する170 kDaの核タンパク質として報告され,慢性肉芽種において顆粒球系の造血の回復を促す作用が認められた8,9).SETBP1遺伝子の生殖細胞における変異はSchinzel-Giedion症候群の原因であり,この症候群において神経上皮性腫瘍をはじめ悪性腫瘍の合併が報告されている10).驚くべきことに,2例の骨髄腫瘍における体細胞変異は,Schinzel-Giedion症候群において報告されていた生殖細胞における変異とまったく同一のアミノ酸置換を示した.そこで,SETBP1遺伝子の変異について多数の骨髄腫瘍症例において検討することにした.
2.SETBP1遺伝子の変異の頻度と関連する臨床所見
全コホート727例の検討では,7.2%に相当する52例においてSETBP1遺伝子に変異が認められた.868番目のAspがAsnとなる変異(28例),870番目のGlyがSerとなる変異(15例),871番目のIleがThrとなる変異(5例)が高頻度であり,868番目のAspがTyrとなる変異,869番目のSerがAsnとなる変異,880番目のAspがAsnとなる変異,880番目のAspがGluとなる変異がそれぞれ1例ずつ認められた.これらすべての変異は種のあいだできわめて保存されているSKI相同領域に位置していた.SNPアレイおよび変異のアレル頻度の検討から,すべての変異はヘテロ変異であることが明らかになった.さらに,ゲノムDNAとcDNAを用いた,868番目のAspがAsnとなる変異および870番目のGlyがSerとなる変異をターゲットにしたアレル特異的PCR法により,野生型のアレルに比較し同等以上の変異アレルの発現が確認された.病歴においてはSchinzel-Giedion症候群を示唆する所見は認められず,骨髄腫瘍において認められたすべての変異は体細胞性であった.SETBP1遺伝子変異は高年齢および第7染色体のモノソミーあるいは第7染色体長腕の欠失と有意に関連し,2次性の急性骨髄性白血病(113例中19例)および慢性骨髄単球性白血病(152例中22例)において高頻度であった一方,初発の急性骨髄性白血病(145例中1例)ではごくまれであった.これら変異陽性の症例のうち,12症例では複数の病期における塩基配列決定が可能であった.すべての症例において,初発の骨髄異形成症候群の病期ではSETBP1遺伝子変異は陰性であったが,2次性の急性骨髄性白血病の病期には陽性となり,進行にともない変異クローンは増加していた.以上より,SETBP1遺伝子変異は2次性白血病の発症と強く相関している可能性が示唆された.
3.SETBP1遺伝子の変異と共存しうるほかの遺伝子の変異
骨髄腫瘍においてSETBP1遺伝子変異とほかの遺伝子の変異との関連を明らかにする目的で,血液腫瘍において重要とされている13つの遺伝子の塩基配列を決定した.その結果,興味深いことに,FLT3遺伝子変異およびNPM1遺伝子変異はSETBP1遺伝子変異をもつ症例には認められなかった.一方,CBL遺伝子変異のみが,野生型のSETBP1遺伝子をもつ症例に比較し,SETBP1遺伝子に変異をもつ症例において有意に高頻度であった.ディープシークエンシング法による解析の結果,多くの場合,CBL遺伝子変異はSETBP1遺伝子変異をもつサブクローンに認められた.しかしながら,免疫沈降法によるタンパク質の結合解析ではSETBP1とCBLとの直接的な関連は示されなかった.SETBP1遺伝子変異とCBL遺伝子変異の高頻度の合併については,たとえば,SETBP1遺伝子変異をもつ細胞のサイトカインに対する反応を間接的に増加させるなどの可能性が推定された.同様に,CBL遺伝子変異が高頻度に合併する非定型慢性骨髄性白血病および若年性骨髄単球性白血病(サイトカインへの過剰反応が診断基準となっている)において,SETBP1遺伝子変異もまた高頻度に認められる11,12).
4.骨髄腫瘍におけるSETBP1遺伝子の発現
正常な血液細胞におけるSETBP1遺伝子の発現は,骨髄系細胞およびCD34陽性細胞では低下していた.一方,リアルタイムPCR法による検討では,SETBP1遺伝子に変異をもつ症例においてSETBP1遺伝子は有意に高発現しており,マイクロアレイによる発現解析においても,SETBP1遺伝子は第7染色体の欠失,および,複雑核型の症例において有意に高発現していた.クラスタリング解析においてSETBP1遺伝子に変異をもつ症例とSETBP1遺伝子を高発現する症例は類似した遺伝子発現プロファイルを示し,TCF4遺伝子,BCL11A遺伝子,DNTT遺伝子などが共通して高発現していた.関連して,SETBP1遺伝子の近傍のCpG部位をメチル化アレイにより解析した結果,SETBP1遺伝子を高発現する症例においてDNAメチル化レベルの低下が確認された.しかしながら,SETBP1遺伝子の発現制御に関しては,MECOM遺伝子などをはじめ,さまざまな遺伝子がかかわる可能性があり,SETBP1遺伝子に変異をもつ症例における遺伝子発現の亢進の分子機構を含め,今後の詳細な検討が必要である.
5.SETBP1遺伝子の変異と予後との関連
全コホートにおいてSETBP1遺伝子変異は有意な予後不良因子であった.この傾向は年齢にかかわらず認められ,とくに60歳未満において顕著であった.同様に,正常な核型における解析でもSETBP1遺伝子について変異型と野生型とのあいだで全生存期間に有意差が認められた.多変量解析ではSETBP1遺伝子変異は,性別(男性),高年齢,ASXL1遺伝子変異,CBL遺伝子変異,DNMT3A遺伝子変異とともに,独立した予後不良因子であった.第7染色体のモノソミーあるいは第7染色体長腕の欠失は,単変量解析においては有意な予後不良因子であったが,多変量解析において有意差はみられなかった.サブグループにおける多変量解析について,国際予後スコアの適応が可能であった骨髄異形成症候群の症例および白血球12,000/μl未満の慢性骨髄単球性白血病の症例を対象として行った.このコホートでもSETBP1遺伝子変異は独立した予後不良因子であった.単変量解析において認められた国際予後スコアの有意差は多変量解析ではみられなかった.骨髄異形成症候群の単独,慢性骨髄単球性白血病の単独,2次性急性骨髄性白血病など,さらなるサブグループにおける解析では,SETBP1遺伝子変異は有意な予後不良因子とはならなかった.つぎに,SETBP1遺伝子変異を関連するCBL遺伝子変異と組み合わせて予後を解析した.慢性骨髄単球性白血病の単独コホートにおいて,野生型のSETBP1遺伝子かつ野生型のCBL遺伝子をもつ症例と,変異型のSETBP1遺伝子かつ変異型のCBL遺伝子をもつ症例を比較すると,変異型SETBP1遺伝子かつ変異型CBL遺伝子が予後不良因子となった.
6.SETBP1遺伝子の変異の機能解析
これまでに,野生型のSETBP1遺伝子の高発現は骨髄系の血液前駆細胞を不死化することが報告されている13).高頻度に認められた868番目のAspがAsnとなる変異SETBP1遺伝子あるいは871番目のIleがThrとなる変異SETBP1遺伝子を発現させたところ,同様に骨髄系の血液前駆細胞は不死化した.野生型SETBP1遺伝子あるいは変異SETBP1遺伝子を同じ程度に発現させたところ,不死化した前駆細胞は変異SETBP1遺伝子を発現させたほうが有意に速く増殖した.これらの所見により,骨髄腫瘍におけるSETBP1遺伝子変異は機能獲得型であると推測された.野生型SETBP1遺伝子の高発現によりホメオボックス遺伝子であるHOXA9遺伝子およびHOXA10遺伝子の発現の亢進がひき起こされると報告されていたため13),変異SETBP1遺伝子の発現に関して同様の検討を行った.変異SETBP1遺伝子の発現による不死化細胞において,HOXA9遺伝子あるいはHOXA10遺伝子の発現を抑制するとコロニー形成能が低下した.臨床検体を用いたリアルタイムPCR法による解析により,SETBP1遺伝子に変異をもつ症例においてHOXA9遺伝子およびHOXA10遺伝子の発現亢進が認められ,SETBP1遺伝子の下流において発現の誘導されるHOXA9遺伝子およびHOXA10遺伝子が骨髄腫瘍における病態に重要なはたらきをもつことが示唆された.
ホメオボックス遺伝子の発現亢進のほかにも,SETBP1遺伝子の変異にともなう複数の病態が考えられる(図1).たとえば,最近になり報告されたように,変異にともないタンパク質の安定性が増加し,その結果,機能をもつタンパク質の量が増加する可能性もある.あるいは,変異が集中して認められるSKI相同領域はSki/SnoNと相互作用を起こすことが報告されており,変異によりこの結合能が変化するのかもしれない.もうひとつの病因として,変異SETBP1遺伝子の発現による不死化細胞においてPP2Aのリン酸化が亢進するという所見が認められたことから,その機能抑制をも考慮すべきである.これらの所見は,SETBP1遺伝子に変異をもつ症例においてPP2Aの機能亢進を促す薬剤の可能性を拓くものである.
おわりに
かぎられた部位に集中して起こる体細胞性のSETBP1遺伝子変異は,骨髄異形成症候群における2次性の急性骨髄性白血病発症と関連する,骨髄腫瘍において新たに発見された予後不良因子である.この機能獲得型の遺伝子変異は骨髄腫瘍における治療標的となる可能性があり,今後の検討が期待される.
文 献
- Sanada, M., Suzuki, T., Shih, L. Y. et al.: Gain-of-function of mutated C-CBL tumour suppressor in myeloid neoplasms. Nature, 460, 904-908 (2009)[PubMed]
- Jankowska, A. M., Szpurka, H., Tiu, R. V. et al.: Loss of heterozygosity 4q24 and TET2 mutations associated with myelodysplastic/myeloproliferative neoplasms. Blood, 113, 6403-6410 (2009)[PubMed]
- Makishima, H., Jankowska, A. M., Tiu, R. V. et al.: Novel homo- and hemizygous mutations in EZH2 in myeloid malignancies. Leukemia, 24, 1799-1804 (2010)[PubMed]
- Ley, T. J., Ding, L., Walter, M. J. et al.: DNMT3A mutations in acute myeloid leukemia. N. Engl. J. Med., 363, 2424-2433 (2010)[PubMed]
- Mardis, E. R., Ding, L., Dooling, D. J. et al.: Recurring mutations found by sequencing an acute myeloid leukemia genome. N. Engl. J. Med., 361, 1058-1066 (2009)[PubMed]
- Yoshida, K., Sanada, M., Shiraishi, Y., et al.: Frequent pathway mutations of splicing machinery in myelodysplasia. Nature, 478, 64-69 (2011)[PubMed] [新着論文レビュー]
- Makishima, H., Visconte, V., Sakaguchi, H. et al.: Mutations in the spliceosome machinery, a novel and ubiquitous pathway in leukemogenesis. Blood, 119, 3203-3210 (2012)[PubMed]
- Minakuchi, M., Kakazu, N., Gorrin-Rivas, M. J., et al.: Identification and characterization of SEB, a novel protein that binds to the acute undifferentiated leukemia-associated protein SET. Eur. J. Biochem., 268, 1340-1351 (2001)[PubMed]
- Ott, M. G., Schmidt, M., Schwarzwaelder, K. et al.: Correction of X-linked chronic granulomatous disease by gene therapy, augmented by insertional activation of MDS1-EVI1, PRDM16 or SETBP1. Nat. Med., 12, 401-409 (2006)[PubMed]
- Hoischen, A., van Bon, B. W., Gilissen, C. et al.: De novo mutations of SETBP1 cause Schinzel-Giedion syndrome. Nat. Genet., 42, 483-485 (2010)[PubMed]
- Piazza, R., Valletta, S., Winkelmann, N. et al.: Recurrent SETBP1 mutations in atypical chronic myeloid leukemia. Nat. Genet., 45, 18-24 (2013)[PubMed]
- Sakaguchi, H., Okuno, Y., Muramatsu, H. et al.: Exome sequencing identifies secondary mutations of SETBP1 and JAK3 in juvenile myelomonocytic leukemia. Nat. Genet., 45, 937-941 (2013)[PubMed]
- Oakley, K., Han, Y., Vishwakarma, B. A. et al.: Setbp1 promotes the self-renewal of murine myeloid progenitors via activation of Hoxa9 and Hoxa10. Blood, 119, 6099-6108 (2012)[PubMed]
著者プロフィール
略歴:2003年 信州大学大学院医学研究科博士課程 修了,同年 信州大学医学部附属病院 医員,2008年 米国Cleveland Clinicポストドクトラルフェローを経て,2012年より同 リサーチアソシエイト.
研究テーマ:骨髄腫瘍におけるゲノム異常.
抱負:骨髄腫瘍を治癒・根絶する.
Jaroslaw P Maciejewski
米国Cleveland ClinicにてDepartment Chair.
© 2013 牧島秀樹・Jaroslaw P Maciejewski Licensed under CC 表示 2.1 日本