クロマチンリモデリングタンパク質SATB1は造血幹細胞のリンパ球系細胞への分化を誘導する
横田貴史1・佐藤友亮2・金倉 譲1
(1大阪大学大学院医学系研究科 血液・腫瘍内科学,2神戸松蔭女子学院大学人間科学部 生活学科食物栄養専攻)
email:横田貴史
DOI: 10.7875/first.author.2013.087
The Satb1 protein directs hematopoietic stem cell differentiation toward lymphoid lineages.
Yusuke Satoh, Takafumi Yokota, Takao Sudo, Motonari Kondo, Anne Lai, Paul W. Kincade, Taku Kouro, Ryuji Iida, Koichi Kokame, Toshiyuki Miyata, Yoko Habuchi, Keiko Matsui, Hirokazu Tanaka, Itaru Matsumura, Kenji Oritani, Terumi Kohwi-Shigematsu, Yuzuru Kanakura
Immunity, 38, 1105-1115 (2013)
造血幹細胞がリンパ球系細胞を産生する能力は,加齢や慢性的なストレスの影響により顕著に低下する.これまで,マウスを用いた研究から,個体の老化によりリンパ球系細胞の分化のきわめて早期の段階が影響をうけることが明らかにされてきたが,その詳細な分子機構は不明であった.今回,筆者らは,造血幹細胞がリンパ球系細胞へと分化する初期の段階においてクロマチンリモデリングタンパク質SATB1が重要なはたらきをし,造血幹細胞の老化にも関係していることを発見した.SATB1を欠損した造血幹細胞においては,in vitroおよびin vivoとも,リンパ球系細胞,とくにT細胞への分化能が著しく障害されていた.一方,SATB1を過剰に発現させた造血幹細胞では,B細胞およびT細胞の産生能が顕著に亢進した.また,SATB1の強制発現によりES細胞からのリンパ球系細胞の誘導効率も上昇させることができた.高齢なマウスの造血幹細胞ではSATB1の発現は低下していたが,外来的にSATB1をおぎなうことにより部分的ではあったがリンパ球系細胞の産生能は回復した.さらに,SATB1の過剰な発現により発現の変動する遺伝子を検索したところ,血液細胞の分化に関与する多数の遺伝子が影響をうけており,通常は骨髄間質細胞が産生するとされている幹細胞因子やインターロイキン7などリンパ球系細胞の分化に重要なサイトカインの発現が造血幹細胞において誘導されていることがわかった.今回の研究結果は,造血幹細胞からリンパ球系細胞への初期の分化におけるエピジェネティックな制御タンパク質の重要性を示すとともに,高齢者や免疫不全患者においてがんや感染症に対する免疫を活性化する新しい技術の開発にも寄与することが期待される.
免疫細胞は自己複製能と多分化能をもつ造血幹細胞から生涯をつうじて産生される.しかしながら,造血幹細胞の能力は一定ではなく,個体の発生や老化とともに変化する1).もっとも大きな変化のひとつとして,老化にともなうリンパ球系細胞の産生能の低下が知られている.事実,胎生期のマウスの造血幹細胞は若年のマウスの骨髄にある造血幹細胞に比べ,きわめて高いリンパ球系細胞の産生能を示す.一方,老化したマウスの造血幹細胞の分化能はリンパ球系細胞への方向性をほとんど消失しており,相対的に,骨髄球系細胞の方向にかたよっている.この現象はマウスにかぎらずヒトにおいても認められ,胎児期や臍帯血の造血幹細胞と成人の骨髄にある造血幹細胞とのあいだには,リンパ球系細胞の産生能において本質的な相違が存在する2).
筆者らは,造血幹細胞およびきわめて早期のリンパ球前駆細胞において発現する遺伝子のプロファイリングから,リンパ球系細胞の初期の分化を促進するタンパク質を探索した.そのため,免疫グロブリンやT細胞受容体の遺伝子再構成に必須であるRAG1という酵素のレポーターマウスであるRAG1-GFPノックインマウスを用いた3).このノックインマウスでは,これまでは造血幹細胞とされていた集団のなかにGFPの蛍光を発するRAG1陽性の早期リンパ球前駆細胞を検出することが可能である4,5).胎仔の肝臓から得た造血幹細胞の画分から造血幹細胞および早期リンパ球前駆細胞を高純度で分離し,発現する遺伝子を比較した.その結果,早期リンパ球前駆細胞において高く発現する遺伝子としてSatb1遺伝子を見い出した.さらに,若年のマウスと高齢のマウスの造血幹細胞を比較したところ,Satb1遺伝子の発現は加齢にともない低下することがわかった.以上を背景として,この研究では,リンパ球系細胞の初期の分化におけるSATB1の機能について,免疫老化の観点を含め解析を行った.
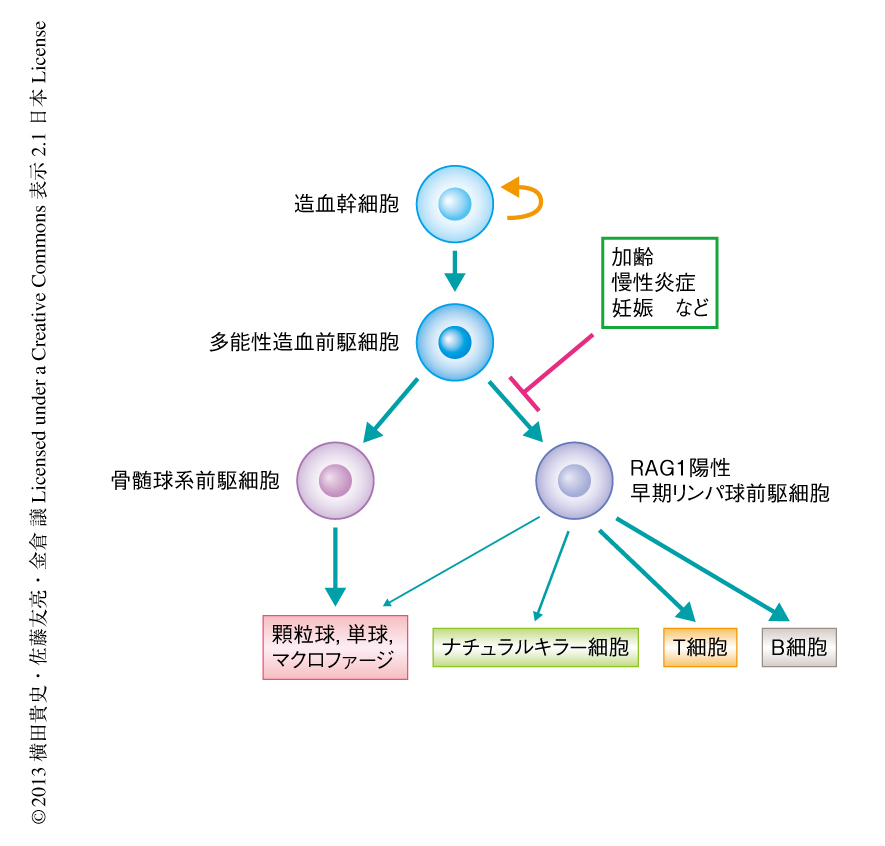
筆者らは,過去の研究において,RAG1-GFPノックインマウスを用いてこれまでは造血幹細胞とされていた細胞の集団から早期リンパ球前駆細胞を分離する方法を確立した4,5).この早期リンパ球前駆細胞は,リンパ球系細胞への高い分化能をもつ一方,造血幹細胞を定義づける長期の造血再構築能はすでに失っており,骨髄系細胞への分化能も低下していた.さらに,この早期リンパ球前駆細胞はステロイドホルモンの投与や妊娠により骨髄から急速に消失し,その一方で,造血幹細胞や骨髄球前駆細胞あるいは赤芽球系前駆細胞は維持されることがわかった6).以上のことから,早期リンパ球前駆細胞は獲得免疫系をささえるリンパ球系細胞の分化の過程において,外界からのストレスや個体の生理的な要求を反映する重要な段階に位置するものと考えられた(図1).
これらの成果をふまえ,多能性造血幹細胞が獲得免疫系の細胞へと分化する初期の段階の分子機構の解明を目的として,造血幹細胞および早期リンパ球前駆細胞における遺伝子の発現を比較した.その結果,早期リンパ球前駆細胞においてはすでに免疫グロブリンやT細胞受容体の遺伝子が発現しており,予想をはるかにこえて,多くのリンパ球系細胞に関連する遺伝子の発現の上昇と骨髄球細胞あるいは赤芽球細胞に関連する遺伝子の発現の低下が認められた.このことから,リンパ球系細胞の初期の分化は,たんに主要な転写因子の階層的な発現により進行するのではなく,ゲノム全体の発現の方向性を包括的に制御するタンパク質が存在し,必要な部分を活性化すると同時に不必要な部分を抑制するというエピジェネティックな制御のもと進行すると考えた.そこで,造血幹細胞の画分に遺伝子の発現が認められ,かつ,早期リンパ球前駆細胞において遺伝子の発現が上昇するクロマチンリモデリングタンパク質を探索した結果,SATB1を候補タンパク質として見い出した.
生後8~10週齢のマウスの骨髄から,造血幹細胞,早期リンパ球前駆細胞,リンパ系前駆細胞,骨髄球系前駆細胞を分離し,Satb1遺伝子に特異的なプライマーを用いてその発現を検討したところ,発現のレベルは造血幹細胞からリンパ球系細胞へと分化が進行するにつれて急速に上昇した.その一方で,骨髄球系前駆細胞では発現レベルは顕著に低下していた.このことから,造血幹細胞からリンパ球系細胞への初期の分化の過程において,クロマチンリモデリングタンパク質SATB1がなんらかのはたらきをしているものと推測した.
SATB1は胸腺細胞において高く発現しており,T細胞の分化に重要であることがノックアウトマウスの表現型から明らかにされていたが7),造血幹細胞における発現が重要なのかどうかは不明であった.そこで,SATB1ノックアウトマウスから造血幹細胞を分離し,種々の培養系,あるいは,致死量の放射線を照射した野生型マウスへの移植実験により,分化能および増殖能を評価した.リンパ球系細胞への分化を支持する間質細胞株として,MS5細胞,OP9細胞,OP9-Delta1細胞との共培養の結果,SATB1を欠損した造血幹細胞はT細胞のみならずB細胞への分化にも問題を生じることがわかった.一方,メチルセルロースコロニーアッセイでは骨髄赤芽球コロニーの形成能に異常を認めず,むしろ,コロニーを形成する骨髄球前駆細胞および赤芽球系前駆細胞の数は野生型の造血幹細胞と比較し増加していた.生体への移植実験では,SATB1を欠損した造血幹細胞はおもにT細胞への分化において顕著な障害を示した.興味深いことに,SATB1を欠損した造血幹細胞を移植したマウスの脾臓において,正常では認めないCD3陽性CD4 CD8二重陰性細胞やCD3 CD4 CD8三重陰性細胞が認められ,胸腺におけるT細胞の分化における障害が示唆された.以上の結果から,造血幹細胞においてSATB1はリンパ球系細胞への分化および増殖に重要なはたらきをしており,とくに生体においてはT細胞への分化に必須であることがわかった.
レトロウイルスベクターを用いてSATB1を造血幹細胞に過剰に発現させ,分化能および増殖能の変化を調べた.リンパ球系細胞への分化を支持する間質細胞株として,MS5細胞,OP9細胞,OP9-Delta1細胞との共培養において,SATB1を過剰に発現させた造血幹細胞は対照の造血幹細胞と比較し,T細胞およびB細胞についてともに高い分化能および増殖能を示した.とくに,B細胞の産生能の亢進が顕著で,MS5細胞との共培養系におけるCD19陽性B細胞の産生数は,SATB1の過剰発現により対照の50~300倍に増幅された.この結果が,SATB1の過剰発現により造血幹細胞から誘導されたB細胞の一部が腫瘍性に増殖したためではないことを確認するため,限界希釈法によりB細胞への分化能をもつ造血幹細胞の頻度を評価した.その結果,SATB1の過剰発現により,リンパ球系細胞への分化能をもつ造血幹細胞の頻度は対照の約3.5倍に増加しており,SATB1の発現により腫瘍細胞が誘導されたのではなく,個々の造血幹細胞の分化能に変動が起こったと考えられた.さらに,SATB1を過剰発現させた造血幹細胞を,致死量の放射線を照射した野生型マウスに移植したところ,対照となる造血幹細胞の移植と比較して早期にリンパ球系細胞の回復を示し,移植ののち2週目にはT細胞およびB細胞とも高いキメリズムを示した.また,移植から3カ月の観察の範囲では,SATB1を過剰発現させた造血幹細胞を移植したマウス8匹に造血器腫瘍の発生を認めなかった.
SATB1はT細胞において多数の造血因子および造血因子受容体の遺伝子の発現に影響をあたえることが報告されていたことから7),造血幹細胞においてもSATB1の発現により多くの種類の遺伝子の発現が影響をうけるものと推測された.そこで,成体のマウスの骨髄から造血幹細胞を高純度で分離し,SATB1-GFP遺伝子,あるいは,対照となるGFP遺伝子のみを組み込んだレトロウイルスベクターを導入したのち,発現した遺伝子の違いをマイクロアレイにより検討した.その結果,これまで,リンパ球系細胞の初期の分化を階層的な遺伝子発現の制御により促進することが知られていた主要な転写因子,PU.1(Sfpi1遺伝子),Ikaros(Ikzf1遺伝子),E2A(Tcf3遺伝子),Notch1(Notch1遺伝子)に明らかな発現の変化を認めなかったが,Sp4遺伝子,Maf遺伝子,Fos遺伝子,Id3遺伝子など,リンパ球系細胞の分化に関連する転写因子をコードする遺伝子の発現がSATB1を過剰に発現した造血幹細胞において上昇していた.興味深いことに,通常は骨髄間質細胞が産生することが知られている幹細胞因子やインターロイキン7などリンパ球系細胞の分化に重要なサイトカインの発現が,SATB1の過剰発現により造血幹細胞において誘導される現象も認められた.その一方で,骨髄球系細胞の分化にきわめて重要なG-CSFの受容体をコードするCsf3r遺伝子の発現は抑制されていた.以上の結果から,SATB1は造血幹細胞において多くの遺伝子の発現を包括的に制御し,分化の方向性をリンパ球系細胞へと誘導するものと考えられた.
ES細胞(embryonic stem cell,胚性幹細胞)からのリンパ球系細胞の誘導については,B細胞に関してはOP9細胞との共培養系が,T細胞に関してはNotchリガンドを導入したOP9-Delta1細胞との共培養系が,すでに確立されている8,9).これらの培養系を用いてES細胞を中胚葉系の細胞へと分化させた段階でSATB1を強制発現させ,リンパ球系細胞の産生能を調べた.SATB1をレトロウイルスベクターを用いて過剰に発現させたES細胞に由来する中胚葉系の細胞から,リンパ球系細胞を効率よく誘導することができた.さらに,テトラサイクリンの除去によりSATB1が誘導されるES細胞株を作製して検討した結果においても,B細胞およびT細胞とも誘導効率は上昇した.
はじめに述べたように,造血幹細胞のリンパ球系細胞の産生能は,加齢とともに急速に低下する.その原因として,個体の老化にともなう造血幹細胞の質的な変化が推測されてきたが,その具体的な分子機構は不明であった.高齢のマウスの造血幹細胞においてSATB1の発現が低下していることに着目し,SATB1の発現を外来的におぎなうことにより,高齢のマウスの造血幹細胞におけるリンパ球系細胞の産生能が回復するかどうか検討した.生後2年のRAG1-GFPノックインマウスの骨髄から造血幹細胞を分離し,レトロウイルスベクターを用いてSATB1を導入し培養した結果,対照となる遺伝子を導入した造血幹細胞と比較して,約3倍の数のB細胞が産生された.このことから,SATB1の発現量の低下は造血幹細胞の老化に関与しており,その発現量を増加させることにより,少なくとも部分的にはリンパ球系細胞の産生能を回復させうるものと考えられた.
今回の研究により,筆者らは,造血幹細胞からリンパ球系細胞への分化の方向づけにおいて,クロマチン構造の制御を介し多数の遺伝子の発現を包括的に制御するクロマチンリモデリングタンパク質タンパク質SATB1が関与していることを示した.老化や慢性的なストレスは造血幹細胞におけるSATB1の発現を低下させ,その結果,造血幹細胞の分化能に質的な変化を生じ,リンパ球系細胞の産生能の低下をひき起こすと考えられた.
最近の報告では,加齢によりリンパ球系細胞の分化の衰えたマウスにおいて,蓄積した古いB細胞を取り除く処置を行うと,骨髄にて新しいB細胞を産生する能力が回復することが示されている10).このことは,加齢にともなう造血幹細胞の質的な変化は決して不可逆なものではなく,環境を変化させることにより若返らせうる可能性を示唆している.SATB1の過剰発現によるリンパ球系細胞の産生能の部分的な回復はこの仮説を支持するものであり,今後,リンパ球系細胞の分化の再生を促す新しい手法の開発にもつながるであろう.
略歴:2000年 大阪大学大学院医学系研究科にて博士号取得,同年 米国Oklahoma Medical Research Foundation,2004年 大阪大学大学院医学系研究科 特任研究員を経て,2008年より同 助教,および,大阪大学医学部 講師.
研究テーマ:造血幹細胞の生理的な特質,リンパ球系細胞の初期の分化の制御機構.
抱負:臨床の研究室ですが,基礎的な研究もしっかり続けていきたい.
佐藤 友亮(Yusuke Satoh)
神戸松蔭女子学院大学人間科学部 准教授.
金倉 譲(Yuzuru Kanakura)
大阪大学大学院医学系研究科 教授.
研究室URL:http://www.hematology.pro/index.html
© 2013 横田貴史・佐藤友亮・金倉 譲 Licensed under CC 表示 2.1 日本
(1大阪大学大学院医学系研究科 血液・腫瘍内科学,2神戸松蔭女子学院大学人間科学部 生活学科食物栄養専攻)
email:横田貴史
DOI: 10.7875/first.author.2013.087
The Satb1 protein directs hematopoietic stem cell differentiation toward lymphoid lineages.
Yusuke Satoh, Takafumi Yokota, Takao Sudo, Motonari Kondo, Anne Lai, Paul W. Kincade, Taku Kouro, Ryuji Iida, Koichi Kokame, Toshiyuki Miyata, Yoko Habuchi, Keiko Matsui, Hirokazu Tanaka, Itaru Matsumura, Kenji Oritani, Terumi Kohwi-Shigematsu, Yuzuru Kanakura
Immunity, 38, 1105-1115 (2013)
要 約
造血幹細胞がリンパ球系細胞を産生する能力は,加齢や慢性的なストレスの影響により顕著に低下する.これまで,マウスを用いた研究から,個体の老化によりリンパ球系細胞の分化のきわめて早期の段階が影響をうけることが明らかにされてきたが,その詳細な分子機構は不明であった.今回,筆者らは,造血幹細胞がリンパ球系細胞へと分化する初期の段階においてクロマチンリモデリングタンパク質SATB1が重要なはたらきをし,造血幹細胞の老化にも関係していることを発見した.SATB1を欠損した造血幹細胞においては,in vitroおよびin vivoとも,リンパ球系細胞,とくにT細胞への分化能が著しく障害されていた.一方,SATB1を過剰に発現させた造血幹細胞では,B細胞およびT細胞の産生能が顕著に亢進した.また,SATB1の強制発現によりES細胞からのリンパ球系細胞の誘導効率も上昇させることができた.高齢なマウスの造血幹細胞ではSATB1の発現は低下していたが,外来的にSATB1をおぎなうことにより部分的ではあったがリンパ球系細胞の産生能は回復した.さらに,SATB1の過剰な発現により発現の変動する遺伝子を検索したところ,血液細胞の分化に関与する多数の遺伝子が影響をうけており,通常は骨髄間質細胞が産生するとされている幹細胞因子やインターロイキン7などリンパ球系細胞の分化に重要なサイトカインの発現が造血幹細胞において誘導されていることがわかった.今回の研究結果は,造血幹細胞からリンパ球系細胞への初期の分化におけるエピジェネティックな制御タンパク質の重要性を示すとともに,高齢者や免疫不全患者においてがんや感染症に対する免疫を活性化する新しい技術の開発にも寄与することが期待される.
はじめに
免疫細胞は自己複製能と多分化能をもつ造血幹細胞から生涯をつうじて産生される.しかしながら,造血幹細胞の能力は一定ではなく,個体の発生や老化とともに変化する1).もっとも大きな変化のひとつとして,老化にともなうリンパ球系細胞の産生能の低下が知られている.事実,胎生期のマウスの造血幹細胞は若年のマウスの骨髄にある造血幹細胞に比べ,きわめて高いリンパ球系細胞の産生能を示す.一方,老化したマウスの造血幹細胞の分化能はリンパ球系細胞への方向性をほとんど消失しており,相対的に,骨髄球系細胞の方向にかたよっている.この現象はマウスにかぎらずヒトにおいても認められ,胎児期や臍帯血の造血幹細胞と成人の骨髄にある造血幹細胞とのあいだには,リンパ球系細胞の産生能において本質的な相違が存在する2).
筆者らは,造血幹細胞およびきわめて早期のリンパ球前駆細胞において発現する遺伝子のプロファイリングから,リンパ球系細胞の初期の分化を促進するタンパク質を探索した.そのため,免疫グロブリンやT細胞受容体の遺伝子再構成に必須であるRAG1という酵素のレポーターマウスであるRAG1-GFPノックインマウスを用いた3).このノックインマウスでは,これまでは造血幹細胞とされていた集団のなかにGFPの蛍光を発するRAG1陽性の早期リンパ球前駆細胞を検出することが可能である4,5).胎仔の肝臓から得た造血幹細胞の画分から造血幹細胞および早期リンパ球前駆細胞を高純度で分離し,発現する遺伝子を比較した.その結果,早期リンパ球前駆細胞において高く発現する遺伝子としてSatb1遺伝子を見い出した.さらに,若年のマウスと高齢のマウスの造血幹細胞を比較したところ,Satb1遺伝子の発現は加齢にともない低下することがわかった.以上を背景として,この研究では,リンパ球系細胞の初期の分化におけるSATB1の機能について,免疫老化の観点を含め解析を行った.
1.リンパ球系細胞の初期の分化とSATB1の発現
筆者らは,過去の研究において,RAG1-GFPノックインマウスを用いてこれまでは造血幹細胞とされていた細胞の集団から早期リンパ球前駆細胞を分離する方法を確立した4,5).この早期リンパ球前駆細胞は,リンパ球系細胞への高い分化能をもつ一方,造血幹細胞を定義づける長期の造血再構築能はすでに失っており,骨髄系細胞への分化能も低下していた.さらに,この早期リンパ球前駆細胞はステロイドホルモンの投与や妊娠により骨髄から急速に消失し,その一方で,造血幹細胞や骨髄球前駆細胞あるいは赤芽球系前駆細胞は維持されることがわかった6).以上のことから,早期リンパ球前駆細胞は獲得免疫系をささえるリンパ球系細胞の分化の過程において,外界からのストレスや個体の生理的な要求を反映する重要な段階に位置するものと考えられた(図1).
これらの成果をふまえ,多能性造血幹細胞が獲得免疫系の細胞へと分化する初期の段階の分子機構の解明を目的として,造血幹細胞および早期リンパ球前駆細胞における遺伝子の発現を比較した.その結果,早期リンパ球前駆細胞においてはすでに免疫グロブリンやT細胞受容体の遺伝子が発現しており,予想をはるかにこえて,多くのリンパ球系細胞に関連する遺伝子の発現の上昇と骨髄球細胞あるいは赤芽球細胞に関連する遺伝子の発現の低下が認められた.このことから,リンパ球系細胞の初期の分化は,たんに主要な転写因子の階層的な発現により進行するのではなく,ゲノム全体の発現の方向性を包括的に制御するタンパク質が存在し,必要な部分を活性化すると同時に不必要な部分を抑制するというエピジェネティックな制御のもと進行すると考えた.そこで,造血幹細胞の画分に遺伝子の発現が認められ,かつ,早期リンパ球前駆細胞において遺伝子の発現が上昇するクロマチンリモデリングタンパク質を探索した結果,SATB1を候補タンパク質として見い出した.
生後8~10週齢のマウスの骨髄から,造血幹細胞,早期リンパ球前駆細胞,リンパ系前駆細胞,骨髄球系前駆細胞を分離し,Satb1遺伝子に特異的なプライマーを用いてその発現を検討したところ,発現のレベルは造血幹細胞からリンパ球系細胞へと分化が進行するにつれて急速に上昇した.その一方で,骨髄球系前駆細胞では発現レベルは顕著に低下していた.このことから,造血幹細胞からリンパ球系細胞への初期の分化の過程において,クロマチンリモデリングタンパク質SATB1がなんらかのはたらきをしているものと推測した.
2.SATB1の機能の欠損は造血幹細胞のリンパ球系細胞への分化能を障害する
SATB1は胸腺細胞において高く発現しており,T細胞の分化に重要であることがノックアウトマウスの表現型から明らかにされていたが7),造血幹細胞における発現が重要なのかどうかは不明であった.そこで,SATB1ノックアウトマウスから造血幹細胞を分離し,種々の培養系,あるいは,致死量の放射線を照射した野生型マウスへの移植実験により,分化能および増殖能を評価した.リンパ球系細胞への分化を支持する間質細胞株として,MS5細胞,OP9細胞,OP9-Delta1細胞との共培養の結果,SATB1を欠損した造血幹細胞はT細胞のみならずB細胞への分化にも問題を生じることがわかった.一方,メチルセルロースコロニーアッセイでは骨髄赤芽球コロニーの形成能に異常を認めず,むしろ,コロニーを形成する骨髄球前駆細胞および赤芽球系前駆細胞の数は野生型の造血幹細胞と比較し増加していた.生体への移植実験では,SATB1を欠損した造血幹細胞はおもにT細胞への分化において顕著な障害を示した.興味深いことに,SATB1を欠損した造血幹細胞を移植したマウスの脾臓において,正常では認めないCD3陽性CD4 CD8二重陰性細胞やCD3 CD4 CD8三重陰性細胞が認められ,胸腺におけるT細胞の分化における障害が示唆された.以上の結果から,造血幹細胞においてSATB1はリンパ球系細胞への分化および増殖に重要なはたらきをしており,とくに生体においてはT細胞への分化に必須であることがわかった.
3.SATB1の過剰な発現により造血幹細胞のリンパ球系細胞の産生能は亢進する
レトロウイルスベクターを用いてSATB1を造血幹細胞に過剰に発現させ,分化能および増殖能の変化を調べた.リンパ球系細胞への分化を支持する間質細胞株として,MS5細胞,OP9細胞,OP9-Delta1細胞との共培養において,SATB1を過剰に発現させた造血幹細胞は対照の造血幹細胞と比較し,T細胞およびB細胞についてともに高い分化能および増殖能を示した.とくに,B細胞の産生能の亢進が顕著で,MS5細胞との共培養系におけるCD19陽性B細胞の産生数は,SATB1の過剰発現により対照の50~300倍に増幅された.この結果が,SATB1の過剰発現により造血幹細胞から誘導されたB細胞の一部が腫瘍性に増殖したためではないことを確認するため,限界希釈法によりB細胞への分化能をもつ造血幹細胞の頻度を評価した.その結果,SATB1の過剰発現により,リンパ球系細胞への分化能をもつ造血幹細胞の頻度は対照の約3.5倍に増加しており,SATB1の発現により腫瘍細胞が誘導されたのではなく,個々の造血幹細胞の分化能に変動が起こったと考えられた.さらに,SATB1を過剰発現させた造血幹細胞を,致死量の放射線を照射した野生型マウスに移植したところ,対照となる造血幹細胞の移植と比較して早期にリンパ球系細胞の回復を示し,移植ののち2週目にはT細胞およびB細胞とも高いキメリズムを示した.また,移植から3カ月の観察の範囲では,SATB1を過剰発現させた造血幹細胞を移植したマウス8匹に造血器腫瘍の発生を認めなかった.
4.SATB1は造血幹細胞においてリンパ球系細胞の分化に関与する多くの遺伝子の発現に影響をあたえる
SATB1はT細胞において多数の造血因子および造血因子受容体の遺伝子の発現に影響をあたえることが報告されていたことから7),造血幹細胞においてもSATB1の発現により多くの種類の遺伝子の発現が影響をうけるものと推測された.そこで,成体のマウスの骨髄から造血幹細胞を高純度で分離し,SATB1-GFP遺伝子,あるいは,対照となるGFP遺伝子のみを組み込んだレトロウイルスベクターを導入したのち,発現した遺伝子の違いをマイクロアレイにより検討した.その結果,これまで,リンパ球系細胞の初期の分化を階層的な遺伝子発現の制御により促進することが知られていた主要な転写因子,PU.1(Sfpi1遺伝子),Ikaros(Ikzf1遺伝子),E2A(Tcf3遺伝子),Notch1(Notch1遺伝子)に明らかな発現の変化を認めなかったが,Sp4遺伝子,Maf遺伝子,Fos遺伝子,Id3遺伝子など,リンパ球系細胞の分化に関連する転写因子をコードする遺伝子の発現がSATB1を過剰に発現した造血幹細胞において上昇していた.興味深いことに,通常は骨髄間質細胞が産生することが知られている幹細胞因子やインターロイキン7などリンパ球系細胞の分化に重要なサイトカインの発現が,SATB1の過剰発現により造血幹細胞において誘導される現象も認められた.その一方で,骨髄球系細胞の分化にきわめて重要なG-CSFの受容体をコードするCsf3r遺伝子の発現は抑制されていた.以上の結果から,SATB1は造血幹細胞において多くの遺伝子の発現を包括的に制御し,分化の方向性をリンパ球系細胞へと誘導するものと考えられた.
5.SATB1の過剰発現によりES細胞においてもリンパ球系細胞の産生能は亢進する
ES細胞(embryonic stem cell,胚性幹細胞)からのリンパ球系細胞の誘導については,B細胞に関してはOP9細胞との共培養系が,T細胞に関してはNotchリガンドを導入したOP9-Delta1細胞との共培養系が,すでに確立されている8,9).これらの培養系を用いてES細胞を中胚葉系の細胞へと分化させた段階でSATB1を強制発現させ,リンパ球系細胞の産生能を調べた.SATB1をレトロウイルスベクターを用いて過剰に発現させたES細胞に由来する中胚葉系の細胞から,リンパ球系細胞を効率よく誘導することができた.さらに,テトラサイクリンの除去によりSATB1が誘導されるES細胞株を作製して検討した結果においても,B細胞およびT細胞とも誘導効率は上昇した.
6.老化した造血幹細胞のリンパ球系細胞の産生能はSATB1の過剰発現により部分的に回復する
はじめに述べたように,造血幹細胞のリンパ球系細胞の産生能は,加齢とともに急速に低下する.その原因として,個体の老化にともなう造血幹細胞の質的な変化が推測されてきたが,その具体的な分子機構は不明であった.高齢のマウスの造血幹細胞においてSATB1の発現が低下していることに着目し,SATB1の発現を外来的におぎなうことにより,高齢のマウスの造血幹細胞におけるリンパ球系細胞の産生能が回復するかどうか検討した.生後2年のRAG1-GFPノックインマウスの骨髄から造血幹細胞を分離し,レトロウイルスベクターを用いてSATB1を導入し培養した結果,対照となる遺伝子を導入した造血幹細胞と比較して,約3倍の数のB細胞が産生された.このことから,SATB1の発現量の低下は造血幹細胞の老化に関与しており,その発現量を増加させることにより,少なくとも部分的にはリンパ球系細胞の産生能を回復させうるものと考えられた.
おわりに
今回の研究により,筆者らは,造血幹細胞からリンパ球系細胞への分化の方向づけにおいて,クロマチン構造の制御を介し多数の遺伝子の発現を包括的に制御するクロマチンリモデリングタンパク質タンパク質SATB1が関与していることを示した.老化や慢性的なストレスは造血幹細胞におけるSATB1の発現を低下させ,その結果,造血幹細胞の分化能に質的な変化を生じ,リンパ球系細胞の産生能の低下をひき起こすと考えられた.
最近の報告では,加齢によりリンパ球系細胞の分化の衰えたマウスにおいて,蓄積した古いB細胞を取り除く処置を行うと,骨髄にて新しいB細胞を産生する能力が回復することが示されている10).このことは,加齢にともなう造血幹細胞の質的な変化は決して不可逆なものではなく,環境を変化させることにより若返らせうる可能性を示唆している.SATB1の過剰発現によるリンパ球系細胞の産生能の部分的な回復はこの仮説を支持するものであり,今後,リンパ球系細胞の分化の再生を促す新しい手法の開発にもつながるであろう.
文 献
- Zhang, Q., Iida, R., Yokota, T. et al.: Early events in lymphopoiesis: an update. Curr. Opin. Hematol., 20, 265-272 (2013)[PubMed]
- Rossi, M. I., Yokota, T., Medina, K. L. et al.: B lymphopoiesis is active throughout human life, but there are developmental age-related changes. Blood, 101, 576-584 (2003)[PubMed]
- Kuwata, N., Igarashi, H., Ohmura, T. et al.: Cutting edge: absence of expression of RAG1 in peritoneal B-1 cells detected by knocking into RAG1 locus with green fluorescent protein gene. J. Immunol., 163, 6355-6359 (1999)[PubMed]
- Igarashi, H., Gregory, S. C., Yokota, T. et al.: Transcription from the RAG1 locus marks the earliest lymphocyte progenitors in bone marrow. Immunity, 17, 117-130 (2002)[PubMed]
- Yokota, T., Kouro, T., Hirose, J. et al.: Unique properties of fetal lymphoid progenitors identified according to RAG1 gene expression. Immunity, 19, 365-375 (2003)[PubMed]
- Yokota, T., Oritani, K., Garrett, K. P. et al.: Soluble frizzled-related protein 1 is estrogen inducible in bone marrow stromal cells and suppresses the earliest events in lymphopoiesis. J. Immunol., 181, 6061-6072 (2008)[PubMed]
- Alvarez, J. D., Yasui, D. H., Niida, H. et al.: The MAR-binding protein SATB1 orchestrates temporal and spatial expression of multiple genes during T-cell development. Genes Dev., 14, 521-535 (2000)[PubMed]
- Nakano, T., Kodama, H. & Honjo, T.: Generation of lymphohematopoietic cells from embryonic stem cells in culture. Science, 265, 1098-1101 (1994)[PubMed]
- Schmitt, T. M., de Pooter, R. F., Gronski, M. A. et al.: Induction of T cell development and establishment of T cell competence from embryonic stem cells differentiated in vitro. Nat. Immunol., 5, 410-417 (2004)[PubMed]
- Keren, Z., Naor, S., Nussbaum, S. et al.: B-cell depletion reactivates B lymphopoiesis in the BM and rejuvenates the B lineage in aging. Blood, 117, 3104-3112 (2011)[PubMed]
著者プロフィール
略歴:2000年 大阪大学大学院医学系研究科にて博士号取得,同年 米国Oklahoma Medical Research Foundation,2004年 大阪大学大学院医学系研究科 特任研究員を経て,2008年より同 助教,および,大阪大学医学部 講師.
研究テーマ:造血幹細胞の生理的な特質,リンパ球系細胞の初期の分化の制御機構.
抱負:臨床の研究室ですが,基礎的な研究もしっかり続けていきたい.
佐藤 友亮(Yusuke Satoh)
神戸松蔭女子学院大学人間科学部 准教授.
金倉 譲(Yuzuru Kanakura)
大阪大学大学院医学系研究科 教授.
研究室URL:http://www.hematology.pro/index.html
© 2013 横田貴史・佐藤友亮・金倉 譲 Licensed under CC 表示 2.1 日本