神経の活動は前初期遺伝子であるArc遺伝子を介しシナプスの刈り込みを促進する
三國貴康・狩野方伸
(東京大学大学院医学系研究科 神経生理学分野)
email:三國貴康,狩野方伸
DOI: 10.7875/first.author.2013.088
Arc/Arg3.1 is a postsynaptic mediator of activity-dependent synapse elimination in the developing cerebellum.
Takayasu Mikuni, Naofumi Uesaka, Hiroyuki Okuno, Hirokazu Hirai, Karl Deisseroth, Haruhiko Bito, Masanobu Kano
Neuron, 78, 1024-1035 (2013)
生後まもない脳にはシナプスが過剰に存在するが,発達の過程において不要なシナプスは淘汰され機能的な神経回路が完成する.この過程は“シナプス刈り込み”とよばれ,神経回路が成熟するために不可欠とされている.これまで,シナプス刈り込みに神経の活動が必須であることは知られていたが,その詳細な分子機構は不明であった.今回,筆者らは,発達期の小脳におけるシナプス刈り込みには前初期遺伝子であるArc遺伝子の発現が必要であることを明らかにした.マウスの小脳のプルキンエ細胞の神経活動を上昇させると,登上線維のシナプス刈り込みが促進された.この促進にはプルキンエ細胞においてP/Q型電位依存性Ca2+チャネルとArcが必要であった.Arcをノックダウンしたプルキンエ細胞では生後12日齢よりのちのシナプス刈り込みに異常があり,細胞体の周辺にシナプスが残存していた.ArcとP/Q型電位依存性Ca2+チャネルの同時ノックダウンによるシナプス刈り込みの阻害の効果は,P/Q型電位依存性Ca2+チャネルの単独ノックダウンによる阻害の効果と同等であった.以上から,前初期遺伝子産物ArcはP/Q型電位依存性Ca2+チャネルの下流においてプルキンエ細胞の細胞体の周辺のシナプスを除去することにより,シナプス刈り込みを完成させていることが示された.
脳が正常に機能するためには,ニューロンが適切な相手と適切な数および強さの結合を形成し,機能的な神経回路がつくられなければならない.生まれたばかりの動物の脳には過剰なシナプスが存在するが,生後の発達の過程において,必要なシナプスは残り,不要なシナプスは除去されて,機能的な神経回路が完成する.この過程は“シナプス刈り込み”とよばれており,生後の発達期の機能的な神経回路の形成に不可欠とされている1,2).これまでの研究から,正常なシナプス刈り込みにはニューロンの電気的な活動が必須であることが知られていた3,4).しかし,神経の活動によりどのような分子機構がはたらいてシナプス刈り込みが起こるのかは不明であった.
中枢神経系において,唯一,シナプス刈り込みを定量的に評価できるのは,小脳の登上線維とプルキンエ細胞とのあいだのシナプスであり,この研究では,その生後の変化を解析の対象にした(図1).生後まもない動物のプルキンエ細胞では,5本以上の弱い登上線維がプルキンエ細胞の細胞体にシナプスを形成しているが,発達の過程において1本の登上線維が選択され強化されて樹状突起へと移行し,細胞体に残存する弱い登上線維は除去される.その結果,成熟した動物では1本の強い登上線維が樹状突起にシナプスを形成している5).これまで,プルキンエ細胞の活動を抑制するとシナプス刈り込みが障害されることが示されてきたが4,6),その詳細な分子機構は不明であった.今回の研究では,シナプス刈り込みをin vitroにおいて再現できる延髄と小脳の共培養標本を用いた7).プルキンエ細胞における神経活動の上昇によりP/Q型電位依存性Ca2+チャネルからCa2+が流入し,ひきつづいて起こる前初期遺伝子Arc遺伝子の発現の誘導によりシナプス刈り込みが促進されることが示された.さらに,in vivoの小脳において,Arcはプルキンエ細胞の細胞体の周辺の過剰なシナプスを除去するシナプス刈り込みの最終段階に必要であり,シナプス刈り込みを完成させる役割をはたすことを明らかにした.
プルキンエ細胞の神経活動とシナプス刈り込みとの関係を調べるため,プルキンエ細胞において神経活動を上昇させたときのシナプス刈り込みについて調べた.延髄と小脳の共培養標本のプルキンエ細胞にレンチウイルスベクターを用いてチャネルロドプシン2という青色光により開口するチャネル8) を発現させ,2日間にわたり青色光の刺激をあたえることでプルキンエ細胞の神経活動を上昇させた.光刺激ののち,個々のプルキンエ細胞からホールセル記録を行い,登上線維を1本ずつ別々に電気刺激したときにひき起こされるシナプス電流を測定することにより,プルキンエ細胞に何本の登上線維が結合しているかを調べた.すると,神経活動を上昇させたプルキンエ細胞ではシナプス刈り込みが促進されていた.ウイルスベクターを用いてP/Q型電位依存性Ca2+チャネルあるいは前初期遺伝子産物Arcの発現をノックダウンしたうえでプルキンエ細胞の神経活動を上昇させたところ,シナプス刈り込みの促進はみられなくなった.以上から,神経活動に依存的なシナプス刈り込みの促進にはP/Q型電位依存性Ca2+チャネルおよび前初期遺伝子産物Arcが必要なことが示された.
プルキンエ細胞においてArc遺伝子が神経活動に依存的に発現しているのかどうか調べるため,延髄と小脳の共培養標本のプルキンエ細胞の神経活動を高K+刺激により上昇させたところ,Arc遺伝子の発現の上昇を認めた.P/Q型電位依存性Ca2+チャネルを阻害したうえで高K+刺激をあたえたところ,Arc遺伝子の発現の上昇は認められなくなった.これらの結果から,プルキンエ細胞においてArc遺伝子は神経活動に依存的に発現し,その発現にはP/Q型電位依存性Ca2+チャネルが必要であることが示された.一方,発達期におけるArc遺伝子の発現量の推移をリアルタイムPCR法により定量したところ,Arc遺伝子の発現量はシナプス刈り込みが起こる時期において2倍以上に増加していることを見い出した.
Arcがin vivoにおいてもシナプス刈り込みに必要かどうか調べるため,生後2~3日齢のマウスの小脳にArcをノックダウンするためのウイルスベクターを注入した.個々のプルキンエ細胞からホールセル記録を行い,登上線維を1本ずつ別々に電気刺激したときにひき起こされるシナプス電流を測定することにより,プルキンエ細胞に何本の登上線維が結合しているかを調べた.その結果,生後11日齢ごろまでシナプス刈り込みは正常に起こるが,以降のシナプス刈り込みの過程は障害されていることが明らかになった.免疫組織学的な手法を用いてArcをノックダウンしたプルキンエ細胞を形態学的に解析したところ,正常ならシナプス刈り込みが完成している時期において,登上線維のシナプスが細胞体の周辺に残存していることがわかった.以上から,Arcはプルキンエ細胞の細胞体の周辺のシナプスを除去することにより,シナプス刈り込みの最終段階にはたらいていることが明らかになった(図2).
プルキンエ細胞の神経活動に依存的なシナプス刈り込みにはP/Q型電位依存性Ca2+チャネルとArcが必要であることと,プルキンエ細胞における神経活動に依存的なArc遺伝子の発現にはP/Q型電位依存性Ca2+チャネルが必要であることから,ArcはP/Q型電位依存性Ca2+チャネルの下流においてシナプス刈り込みに関与していることが考えられた.この可能性を検証するため,P/Q型電位依存性Ca2+チャネルをノックダウンしたプルキンエ細胞において,Arcのノックダウンがシナプス刈り込みをさらに阻害するかどうか調べた.その結果,P/Q型電位依存性Ca2+チャネルとArcの両方をノックダウンしたプルキンエ細胞と,P/Q型電位依存性Ca2+チャネルのみをノックダウンしたプルキンエ細胞では,シナプス刈り込みの阻害の効果は同等であった.これにより,ArcはP/Q型電位依存性Ca2+チャネルの下流においてシナプス刈り込みに関与していることが示された.P/Q型電位依存性Ca2+チャネルのノックダウンによるシナプス刈り込みの阻害は,Arcの過剰な発現により回復するかどうか調べた.P/Q型電位依存性Ca2+チャネルをノックダウンしArcを過剰発現させたプルキンエ細胞と,P/Q型電位依存性Ca2+チャネルをノックダウンしたプルキンエ細胞を比較したところ,シナプス刈り込みの阻害の効果は同等であった.以上より,P/Q型電位依存性Ca2+チャネルの下流においては,Arcのみがシナプス刈り込みに関与するのではなく,ほかのCa2+依存性の分子機構の存在することが示唆された.
シナプス刈り込みは正常な脳の発達に重要である.社会性障害をきたす代表的な疾患である統合失調症や発達障害の病因としては神経回路の発達の異常が知られており,これは発達の特定の時期に起こるシナプス刈り込みの異常による可能性が指摘されている.一方,発達障害をきたすいくつかの症候群の疾患モデルマウスの脳にはArc遺伝子の発現に異常のあることが,最近,あいついで報告されている9,10).これらの疾患モデルマウスにおいて,脳のどの部位にどのようなシナプス刈り込みの異常があるかを調べ,さらに,ヒトにおける臨床的な検証と組み合わせることにより,これらの精神疾患の病態をArcおよびシナプス刈り込みの視点から解明することのできる可能性がある.
略歴:2012年 東京大学大学院医学系研究科博士課程 修了,同年 同 特任研究員を経て,2013年より米国Max Planck Florida Institute for Neuroscienceポスドク.
研究テーマ:神経活動に依存的なシナプスの構造変化の分子機構.
狩野 方伸(Masanobu Kano)
東京大学大学院医学系研究科 教授.
研究室URL:http://plaza.umin.ac.jp/~neurophy/Kano_Lab_j/Top_j.html
© 2013 三國貴康・狩野方伸 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 神経生理学分野)
email:三國貴康,狩野方伸
DOI: 10.7875/first.author.2013.088
Arc/Arg3.1 is a postsynaptic mediator of activity-dependent synapse elimination in the developing cerebellum.
Takayasu Mikuni, Naofumi Uesaka, Hiroyuki Okuno, Hirokazu Hirai, Karl Deisseroth, Haruhiko Bito, Masanobu Kano
Neuron, 78, 1024-1035 (2013)
要 約
生後まもない脳にはシナプスが過剰に存在するが,発達の過程において不要なシナプスは淘汰され機能的な神経回路が完成する.この過程は“シナプス刈り込み”とよばれ,神経回路が成熟するために不可欠とされている.これまで,シナプス刈り込みに神経の活動が必須であることは知られていたが,その詳細な分子機構は不明であった.今回,筆者らは,発達期の小脳におけるシナプス刈り込みには前初期遺伝子であるArc遺伝子の発現が必要であることを明らかにした.マウスの小脳のプルキンエ細胞の神経活動を上昇させると,登上線維のシナプス刈り込みが促進された.この促進にはプルキンエ細胞においてP/Q型電位依存性Ca2+チャネルとArcが必要であった.Arcをノックダウンしたプルキンエ細胞では生後12日齢よりのちのシナプス刈り込みに異常があり,細胞体の周辺にシナプスが残存していた.ArcとP/Q型電位依存性Ca2+チャネルの同時ノックダウンによるシナプス刈り込みの阻害の効果は,P/Q型電位依存性Ca2+チャネルの単独ノックダウンによる阻害の効果と同等であった.以上から,前初期遺伝子産物ArcはP/Q型電位依存性Ca2+チャネルの下流においてプルキンエ細胞の細胞体の周辺のシナプスを除去することにより,シナプス刈り込みを完成させていることが示された.
はじめに
脳が正常に機能するためには,ニューロンが適切な相手と適切な数および強さの結合を形成し,機能的な神経回路がつくられなければならない.生まれたばかりの動物の脳には過剰なシナプスが存在するが,生後の発達の過程において,必要なシナプスは残り,不要なシナプスは除去されて,機能的な神経回路が完成する.この過程は“シナプス刈り込み”とよばれており,生後の発達期の機能的な神経回路の形成に不可欠とされている1,2).これまでの研究から,正常なシナプス刈り込みにはニューロンの電気的な活動が必須であることが知られていた3,4).しかし,神経の活動によりどのような分子機構がはたらいてシナプス刈り込みが起こるのかは不明であった.
中枢神経系において,唯一,シナプス刈り込みを定量的に評価できるのは,小脳の登上線維とプルキンエ細胞とのあいだのシナプスであり,この研究では,その生後の変化を解析の対象にした(図1).生後まもない動物のプルキンエ細胞では,5本以上の弱い登上線維がプルキンエ細胞の細胞体にシナプスを形成しているが,発達の過程において1本の登上線維が選択され強化されて樹状突起へと移行し,細胞体に残存する弱い登上線維は除去される.その結果,成熟した動物では1本の強い登上線維が樹状突起にシナプスを形成している5).これまで,プルキンエ細胞の活動を抑制するとシナプス刈り込みが障害されることが示されてきたが4,6),その詳細な分子機構は不明であった.今回の研究では,シナプス刈り込みをin vitroにおいて再現できる延髄と小脳の共培養標本を用いた7).プルキンエ細胞における神経活動の上昇によりP/Q型電位依存性Ca2+チャネルからCa2+が流入し,ひきつづいて起こる前初期遺伝子Arc遺伝子の発現の誘導によりシナプス刈り込みが促進されることが示された.さらに,in vivoの小脳において,Arcはプルキンエ細胞の細胞体の周辺の過剰なシナプスを除去するシナプス刈り込みの最終段階に必要であり,シナプス刈り込みを完成させる役割をはたすことを明らかにした.
図1 登上線維とプルキンエ細胞とのあいだに形成されるシナプスの生後の発達
出生の直後のプルキンエ細胞には,同等の強さの複数の登上線維がシナプスを形成している.生後10日齢ごろには,生後1週齢に選択的に強化された1本の登上線維が,プルキンエ細胞の樹状突起へと移行しはじめる.強化されなかった“弱い”登上線維は細胞体にシナプスを形成したままである.生後3週齢ごろには,細胞体に形成された“弱い”登上線維のシナプスは除去され,1本の“強い”登上線維のシナプスのみが樹状突起に維持されるようになる.
[Download]
出生の直後のプルキンエ細胞には,同等の強さの複数の登上線維がシナプスを形成している.生後10日齢ごろには,生後1週齢に選択的に強化された1本の登上線維が,プルキンエ細胞の樹状突起へと移行しはじめる.強化されなかった“弱い”登上線維は細胞体にシナプスを形成したままである.生後3週齢ごろには,細胞体に形成された“弱い”登上線維のシナプスは除去され,1本の“強い”登上線維のシナプスのみが樹状突起に維持されるようになる.
[Download]
1.プルキンエ細胞の神経活動に依存的なシナプス刈り込みにはP/Q型電位依存性Ca2+チャネルと前初期遺伝子産物Arcが必要である
プルキンエ細胞の神経活動とシナプス刈り込みとの関係を調べるため,プルキンエ細胞において神経活動を上昇させたときのシナプス刈り込みについて調べた.延髄と小脳の共培養標本のプルキンエ細胞にレンチウイルスベクターを用いてチャネルロドプシン2という青色光により開口するチャネル8) を発現させ,2日間にわたり青色光の刺激をあたえることでプルキンエ細胞の神経活動を上昇させた.光刺激ののち,個々のプルキンエ細胞からホールセル記録を行い,登上線維を1本ずつ別々に電気刺激したときにひき起こされるシナプス電流を測定することにより,プルキンエ細胞に何本の登上線維が結合しているかを調べた.すると,神経活動を上昇させたプルキンエ細胞ではシナプス刈り込みが促進されていた.ウイルスベクターを用いてP/Q型電位依存性Ca2+チャネルあるいは前初期遺伝子産物Arcの発現をノックダウンしたうえでプルキンエ細胞の神経活動を上昇させたところ,シナプス刈り込みの促進はみられなくなった.以上から,神経活動に依存的なシナプス刈り込みの促進にはP/Q型電位依存性Ca2+チャネルおよび前初期遺伝子産物Arcが必要なことが示された.
2.プルキンエ細胞における神経活動に依存的なArc遺伝子の発現にはP/Q型電位依存性Ca2+チャネルが必要である
プルキンエ細胞においてArc遺伝子が神経活動に依存的に発現しているのかどうか調べるため,延髄と小脳の共培養標本のプルキンエ細胞の神経活動を高K+刺激により上昇させたところ,Arc遺伝子の発現の上昇を認めた.P/Q型電位依存性Ca2+チャネルを阻害したうえで高K+刺激をあたえたところ,Arc遺伝子の発現の上昇は認められなくなった.これらの結果から,プルキンエ細胞においてArc遺伝子は神経活動に依存的に発現し,その発現にはP/Q型電位依存性Ca2+チャネルが必要であることが示された.一方,発達期におけるArc遺伝子の発現量の推移をリアルタイムPCR法により定量したところ,Arc遺伝子の発現量はシナプス刈り込みが起こる時期において2倍以上に増加していることを見い出した.
3.Arcはシナプス刈り込みの最終段階にはたらく
Arcがin vivoにおいてもシナプス刈り込みに必要かどうか調べるため,生後2~3日齢のマウスの小脳にArcをノックダウンするためのウイルスベクターを注入した.個々のプルキンエ細胞からホールセル記録を行い,登上線維を1本ずつ別々に電気刺激したときにひき起こされるシナプス電流を測定することにより,プルキンエ細胞に何本の登上線維が結合しているかを調べた.その結果,生後11日齢ごろまでシナプス刈り込みは正常に起こるが,以降のシナプス刈り込みの過程は障害されていることが明らかになった.免疫組織学的な手法を用いてArcをノックダウンしたプルキンエ細胞を形態学的に解析したところ,正常ならシナプス刈り込みが完成している時期において,登上線維のシナプスが細胞体の周辺に残存していることがわかった.以上から,Arcはプルキンエ細胞の細胞体の周辺のシナプスを除去することにより,シナプス刈り込みの最終段階にはたらいていることが明らかになった(図2).
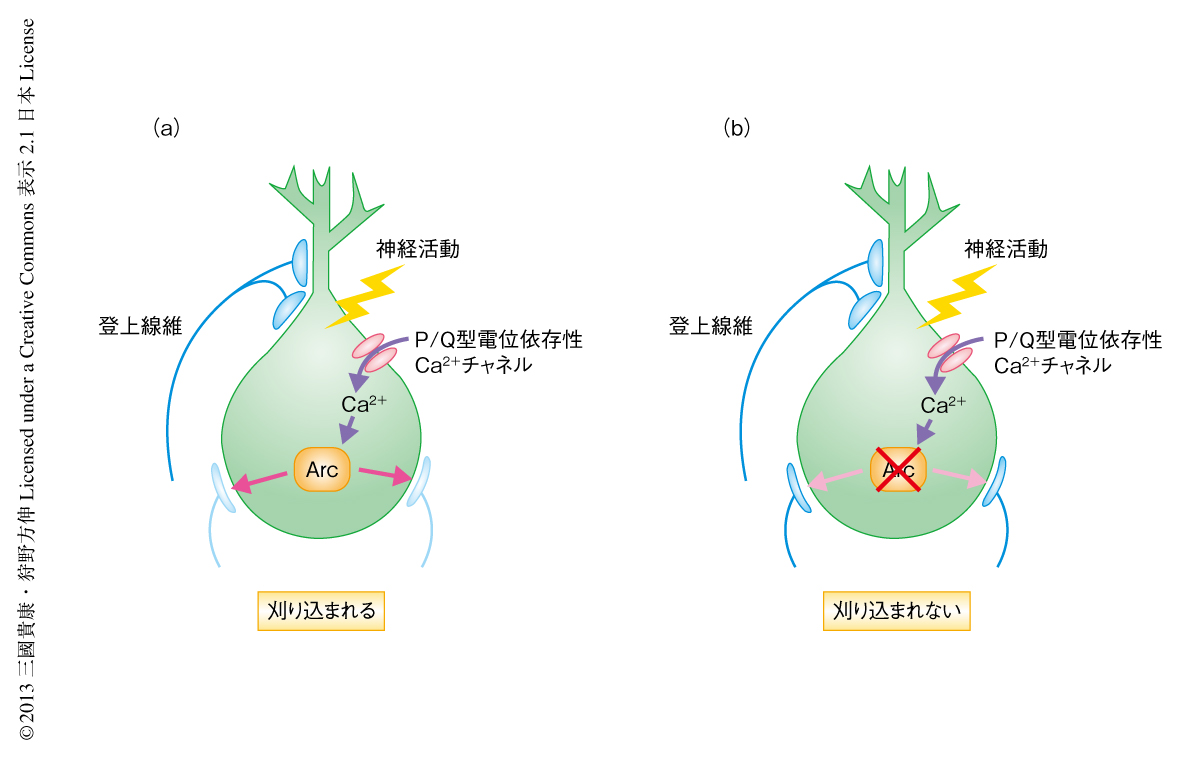
図2 神経活動に依存的なシナプス刈り込みにおけるArcの役割
(a)正常なプルキンエ細胞.神経活動によりP/Q型電位依存性Ca2+チャネルからCa2+が流入し,Arc遺伝子の発現が誘導される.発現したArcにより細胞体に結合している登上線維のシナプスは刈り込まれ,シナプス刈り込みが完成する.
(b)Arcをノックダウンしたプルキンエ細胞.神経活動によりP/Q型電位依存性Ca2+チャネルからCa2+が流入してもArc遺伝子の発現は誘導されない.その結果,細胞体に結合している登上線維のシナプスは刈り込まれずに残存する.
[Download]
(a)正常なプルキンエ細胞.神経活動によりP/Q型電位依存性Ca2+チャネルからCa2+が流入し,Arc遺伝子の発現が誘導される.発現したArcにより細胞体に結合している登上線維のシナプスは刈り込まれ,シナプス刈り込みが完成する.
(b)Arcをノックダウンしたプルキンエ細胞.神経活動によりP/Q型電位依存性Ca2+チャネルからCa2+が流入してもArc遺伝子の発現は誘導されない.その結果,細胞体に結合している登上線維のシナプスは刈り込まれずに残存する.
[Download]
4.ArcはP/Q型電位依存性Ca2+チャネルの下流においてシナプス刈り込みに関与する
プルキンエ細胞の神経活動に依存的なシナプス刈り込みにはP/Q型電位依存性Ca2+チャネルとArcが必要であることと,プルキンエ細胞における神経活動に依存的なArc遺伝子の発現にはP/Q型電位依存性Ca2+チャネルが必要であることから,ArcはP/Q型電位依存性Ca2+チャネルの下流においてシナプス刈り込みに関与していることが考えられた.この可能性を検証するため,P/Q型電位依存性Ca2+チャネルをノックダウンしたプルキンエ細胞において,Arcのノックダウンがシナプス刈り込みをさらに阻害するかどうか調べた.その結果,P/Q型電位依存性Ca2+チャネルとArcの両方をノックダウンしたプルキンエ細胞と,P/Q型電位依存性Ca2+チャネルのみをノックダウンしたプルキンエ細胞では,シナプス刈り込みの阻害の効果は同等であった.これにより,ArcはP/Q型電位依存性Ca2+チャネルの下流においてシナプス刈り込みに関与していることが示された.P/Q型電位依存性Ca2+チャネルのノックダウンによるシナプス刈り込みの阻害は,Arcの過剰な発現により回復するかどうか調べた.P/Q型電位依存性Ca2+チャネルをノックダウンしArcを過剰発現させたプルキンエ細胞と,P/Q型電位依存性Ca2+チャネルをノックダウンしたプルキンエ細胞を比較したところ,シナプス刈り込みの阻害の効果は同等であった.以上より,P/Q型電位依存性Ca2+チャネルの下流においては,Arcのみがシナプス刈り込みに関与するのではなく,ほかのCa2+依存性の分子機構の存在することが示唆された.
おわりに
シナプス刈り込みは正常な脳の発達に重要である.社会性障害をきたす代表的な疾患である統合失調症や発達障害の病因としては神経回路の発達の異常が知られており,これは発達の特定の時期に起こるシナプス刈り込みの異常による可能性が指摘されている.一方,発達障害をきたすいくつかの症候群の疾患モデルマウスの脳にはArc遺伝子の発現に異常のあることが,最近,あいついで報告されている9,10).これらの疾患モデルマウスにおいて,脳のどの部位にどのようなシナプス刈り込みの異常があるかを調べ,さらに,ヒトにおける臨床的な検証と組み合わせることにより,これらの精神疾患の病態をArcおよびシナプス刈り込みの視点から解明することのできる可能性がある.
文 献
- Katz, L. C. & Shatz, C. J.: Synaptic activity and the construction of cortical circuits. Science, 274, 1133-1138 (1996)[PubMed]
- Kano, M. & Hashimoto, K.: Synapse elimination in the central nervous system. Curr. Opin. Neurobiol., 19, 154-161 (2009)[PubMed]
- Buffelli, M., Burgess, R. W., Feng, G. et al.: Genetic evidence that relative synaptic efficacy biases the outcome of synaptic competition. Nature, 424, 430-434 (2003)[PubMed]
- Lorenzetto, E., Caselli, L., Feng, G. et al.: Genetic perturbation of postsynaptic activity regulates synapse elimination in developing cerebellum. Proc. Natl. Acad. Sci. USA, 106, 16475-16480 (2009)[PubMed]
- Watanabe, M. & Kano, M.: Climbing fiber synapse elimination in cerebellar Purkinje cells. Eur. J. Neurosci., 34, 1697-1710 (2011)[PubMed]
- Hashimoto, K., Tsujita, M., Miyazaki, T. et al.: Postsynaptic P/Q-type Ca2+ channel in Purkinje cell mediates synaptic competition and elimination in developing cerebellum. Proc. Natl. Acad. Sci. USA, 108, 9987-9992 (2011)[PubMed]
- Uesaka, N., Mikuni, T., Hashimoto, K. et al.: Organotypic coculture preparation for the study of developmental synapse elimination in mammalian brain. J. Neurosci., 32, 11657-11670 (2012)[PubMed]
- Boyden, E. S., Zhang, F., Bamberg, E. et al.: Millisecond-timescale, genetically targeted optical control of neural activity. Nat. Neurosci., 8, 1263-1268 (2005)[PubMed]
- Greer, P. L., Hanayama, R., Bloodgood, B. L. et al.: The Angelman Syndrome protein Ube3A regulates synapse development by ubiquitinating Arc. Cell, 140, 704-716 (2010)[PubMed]
- Auerbach, B. D., Osterweil, E. K. & Bear, M. F.: Mutations causing syndromic autism define an axis of synaptic pathophysiology. Nature, 480, 63-68 (2011)[PubMed]
著者プロフィール
略歴:2012年 東京大学大学院医学系研究科博士課程 修了,同年 同 特任研究員を経て,2013年より米国Max Planck Florida Institute for Neuroscienceポスドク.
研究テーマ:神経活動に依存的なシナプスの構造変化の分子機構.
狩野 方伸(Masanobu Kano)
東京大学大学院医学系研究科 教授.
研究室URL:http://plaza.umin.ac.jp/~neurophy/Kano_Lab_j/Top_j.html
© 2013 三國貴康・狩野方伸 Licensed under CC 表示 2.1 日本