微小管とTACC-TOG複合体は染色体の配置を変換することにより減数分裂における組換えと正確な染色体分配の連携を制御する
角井康貢1・佐藤政充2
(1英国Cancer Research UK London Research Institute,2早稲田大学先進理工学部 生命医科学科)
email:角井康貢,佐藤政充
DOI: 10.7875/first.author.2013.084
Microtubules and Alp7-Alp14 (TACC-TOG) reposition chromosomes before meiotic segregation.
Yasutaka Kakui, Masamitsu Sato, Naoyuki Okada, Takashi Toda, Masayuki Yamamoto
Nature Cell Biology, 15, 786-796 (2013)
生物が子孫を残すためには減数分裂の正確な遂行が不可欠である.減数分裂では子孫の多様性を生み出す組換えを行うため,染色体の配置は大きく変換される.これにより,染色体の動原体はスピンドル極体から離れた位置に配置されるが,これは,直後に起こる染色体分配の異常をひき起こす可能性がある.にもかかわらず,実際には細胞はなんらかの方法によりこのリスクを回避し,染色体分配を正確に遂行している.筆者らは,3色蛍光生細胞イメージング法により,減数第1分裂が開始するとき核において特殊な微小管が形成され,これが動原体の位置を再変換することにより染色体分配の異常のリスクを排除していることを発見した.さらには,微小管結合タンパク質であるTACC-TOG複合体がPolo様キナーゼによるリン酸化をうけて動原体へ局在することにより動原体が効率よく微小管に捕捉されること,Dis1/TOGがDam1複合体と協調して微小管の脱重合を促進することを明らかにした.すなわち,微小管,2つのTOGタンパク質,Polo様キナーゼによる染色体の配置の変換により,減数分裂組換えは直後の染色体分配へと安全にひきつがれていた.
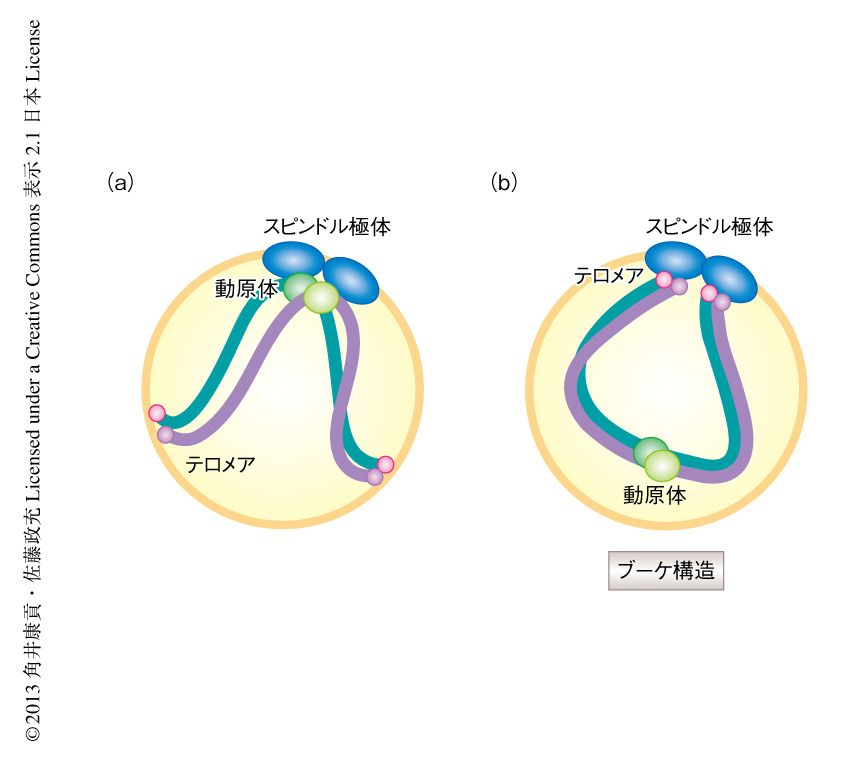
細胞が増殖をくり返すためには,染色体分配を正しく制御することが不可欠である.染色体を分配するため,染色体のセントロメアに形成された動原体は,紡錘極から伸長してきた微小管により捕捉され,両極へと引っ張られる.この過程にエラーが起こると細胞のがん化や細胞死,先天性異常の原因となることが知られている1).そこで,このエラーを防ぐため細胞はさまざまなくふうをこらして染色体分配を正しく制御している.酵母では動原体を高等生物の中心体に相当するスピンドル極体の近くにつなぎとめ,紡錘体微小管により捕捉されやすくすることにより安全な染色体分配を保障している2)(図1a).
減数分裂は,染色体の組換えと,それにつづく2回の連続した染色体分配により(減数第1分裂および減数第2分裂),配偶子(精子および卵子,酵母では胞子)を形成する特別な分裂の様式である.減数分裂では組換えにより父方に由来する遺伝子と母方に由来する遺伝子を交換することで,子孫の遺伝的な多様性を生み出している.組換えを効率よく行うため,動原体はスピンドル極体から遠く離され,これと入れ替わるように染色体の末端にあるテロメアがスピンドル極体の近傍に集合し,ブーケ構造が形成される3)(図1b).このブーケ構造は酵母から哺乳類まで共通して観察されることが知られている4).ブーケ構造は組換えに適した染色体の配置であるが,動原体とスピンドル極体とのあいだに距離があるぶん,染色体分配におけるリスクが高いはずである.ところが,実際には染色体分配の異常は観察されないことから,細胞には未知の分子機構が存在し,動原体の不利な配置のもたらす染色体分配におけるリスクを回避していると推察された.そこで,筆者らは,染色体の配置に着目し,細胞がどのようにしてブーケ構造という特殊な状況から染色体分配を正確に行っているかを解析した.
減数分裂の組換えの終了から減数第1分裂の開始にかけ,動原体,テロメア,スピンドル極体の3か所の挙動を3色蛍光生細胞イメージング法により観察した.その結果,動原体とテロメアの配置がダイナミックに入れ替わり,動原体は減数第1分裂の開始のまえにスピンドル極体に集合することがわかった.動原体がスピンドル極体ヘとむかうこと,および,スピンドル極体は微小管の形成にかかわることから,微小管に注目してさらなる解析を行った.微小管重合阻害剤により微小管のはたらきを抑制したところ,染色体の配置の変換は起こらなかった.さらに,3色蛍光生細胞イメージング法により微小管と動原体の挙動を同時に観察したところ,この時期にのみ,核において形成される放射状の微小管が動原体を捕捉し,微小管の脱重合にともない動原体をスピンドル極体ヘと運んでいることを発見した.放射状の微小管の構造は体細胞分裂や減数第2分裂においては観察されなかったことから,特殊な構造の微小管を時期特異的に形成することにより染色体分配におけるリスクを回避していることが示唆された.
微小管による動原体の運搬にはどのようなタンパク質がかかわっているのだろうか.人工的な系を用いた動原体の運搬に関するこれまでの報告から5-7),TOGタンパク質,Dam1複合体,微小管モータータンパク質の3者が重要な役割をはたしている可能性が示唆された.そこで,これらのタンパク質を欠損した細胞における微小管および動原体の挙動を観察した.分裂酵母におけるTOGホモログであるDis1,あるいは,Dam1複合体を欠損した細胞では,動原体は微小管と接着するが,スピンドル極体へと効率よく運ばれなかった.そこで,dis1変異体およびdam1変異体における微小管の短縮の速度を定量したところ,動原体と接着した微小管の短縮速度は大きく低下していた.一方,微小管モータータンパク質であるキネシンやダイニンを欠損させても動原体はスピンドル極体ヘと運ばれたことから,これらのタンパク質は動原体の運搬には関与していないと考えられた.つづいて,Dis1とDam1複合体とのあいだの局在の依存関係について調べた.dam1破壊株におけるDis1の局在パターンは野生株のものと変わらなかったが,dis1破壊株ではDam1の動原体への局在は不安定化していた.これらの結果から,Dis1とDam1複合体は協調し,動原体における微小管の脱重合を促進することにより,動原体のスピンドル極体への運搬に関与していることが明らかになった.
分裂酵母のもうひとつのTOGのホモログであるAlp14についても同様に解析した.Alp14はTACCのホモログであるAlp7と複合体を形成し微小管の形成を促進することが知られている8).Alp7の減数分裂における局在を調べたところ,動原体に強く局在することが見い出された.体細胞分裂において,Alp7は微小管に運ばれるかたちで動原体の表面に局在するが,減数分裂における動原体への局在には微小管を必要としなかった.そのため,Alp7-Alp14複合体は減数分裂において特別な機能をもつと推察された.
しかしながら,Alp7あるいはAlp14を欠損すると微小管の形成における異常が大きく,Alp7-Alp14複合体が動原体において発揮する機能をピンポイントに調べることはできなかった.そこで,動原体に局在できなくなるようなAlp7-Alp14複合体の変異体の作製,ならびに,Alp7-Alp14複合体が動原体に局在するための足場となるタンパク質の同定を行った.外来性TEVプロテアーゼを用いてAlp7-Alp14複合体を動原体において特異的に除去すると,動原体はいったん微小管により捕捉されるものの,微小管の短縮にともない微小管から脱落することがわかった.つづいて,Alp7の動原体への局在にかかわるタンパク質として,動原体の構成タンパク質であるNdc80-Nuf2複合体に着目した.Nuf2は減数分裂においてAlp7と強く相互作用していることが共免疫沈降により確認できたため,Ndc80-Nuf2複合体は動原体においてAlp7-Alp14複合体の足場になっていると考えられた.そこで,nuf2変異体において動原体および微小管の動きを観察した結果,動原体が微小管から脱落するようすが頻繁に観察された.以上の結果から,Alp7-Alp14複合体は減数分裂において,微小管に依存しないかたちで動原体に局在することにより,微小管による動原体の捕捉をサポートしていることが明らかになった.
つづいて,Alp7-Alp14複合体が減数分裂においてのみ動原体へと局在する分子基盤の解明をめざした.Alp7-Alp14複合体の足場として同定した動原体タンパク質Ndc80-Nuf2複合体は,体細胞分裂においても動原体に存在している.そのため,減数分裂に特異的に起こるタンパク質の修飾がこれらの相互作用を促進する可能性があると考えた.Polo様キナーゼPlo1は体細胞分裂においてはスピンドル極体に局在するが,減数分裂においては動原体にも存在することが報告されていた9).plo1変異体におけるAlp7の局在を調べたところ,動原体におけるAlp7の局在性の低下がみられた.そこで,plo1変異体において動原体に野生型Plo1のキナーゼドメインを人工的にリクルートさせると,Alp7の動原体への局在が回復した.これに対して,不活性化型のPlo1キナーゼドメインを用いた場合にはAlp7の局在は回復しなかった.
Plo1によるAlp7のリン酸化部位をin vitroキナーゼアッセイにより探索した結果,C末端側のTACCドメインがPlo1によりリン酸化されることがわかった.このTACCドメインにはPolo様キナーゼによるリン酸化のコンセンサス配列が4か所存在し,これらのSerおよびThrをAlaに置換した非リン酸化型Alp7はin vitroにおいてPlo1によるリン酸化をほとんどうけなかった.また,大腸菌から精製したAlp7はPlo1によるリン酸化の処理を施すことにより,動原体タンパク質であるNuf2との相互作用が強くなった.これに対して,非リン酸化型Alp7を用いた場合には,Plo1によるリン酸化の有無にかかわらずNuf2との相互作用はみられなかった.
これに一致するように,非リン酸化型Alp7は減数分裂における動原体への局在が著しく低下しており,in vivoにおいてもAlp7はPlo1によるリン酸化をうけて動原体へと局在することが示された.非リン酸化型Alp7を発現した細胞では微小管からの動原体の脱落が頻繁に観察され,減数第1分裂での染色体分配にも異常が生じた.これらの結果をあわせて,Plo1がリン酸化を介してAlp7-Alp14複合体を動原体へと局在させ,微小管と動原体との接着を促進していることが明らかになった.
チューブリンの低温感受性変異体では低温において微小管が形成されないため,体細胞分裂期においても動原体を捕捉することができない.ここで,温度を上昇させるとチューブリンの機能が回復し,微小管が再形成されて動原体を捕捉する場面を人工的につくりだすことができる.このチューブリン変異体を用いた人工的な動原体運搬アッセイにおいて,Alp7-Alp14複合体が減数分裂のときのような機能を発揮できるかどうか検討した.すなわち,体細胞分裂のとき動原体には局在しないAlp7-Alp14複合体を,動原体タンパク質CENP-Cと融合させることにより動原体に強制的にリクルートしそのはたらきを調べた.Alp7-Alp14複合体を動原体へと人工的にリクルートすることにより,チューブリン変異体における動原体の捕捉および運搬には若干の改善がみられたが,その効果は限定的であった.これは,体細胞分裂ではスピンドル極体からの放射状の微小管の形成が効率よく起こらないことが原因であると考えられた.
したがって,分裂酵母は減数分裂において,Alp7-Alp14複合体の動原体への局在と放射状の微小管の形成という2つの現象を促進することにより,スピンドル極体から遠く離れた動原体を効率よく回収し,組換えに由来する染色体分配におけるリスクを回避しているといえた.
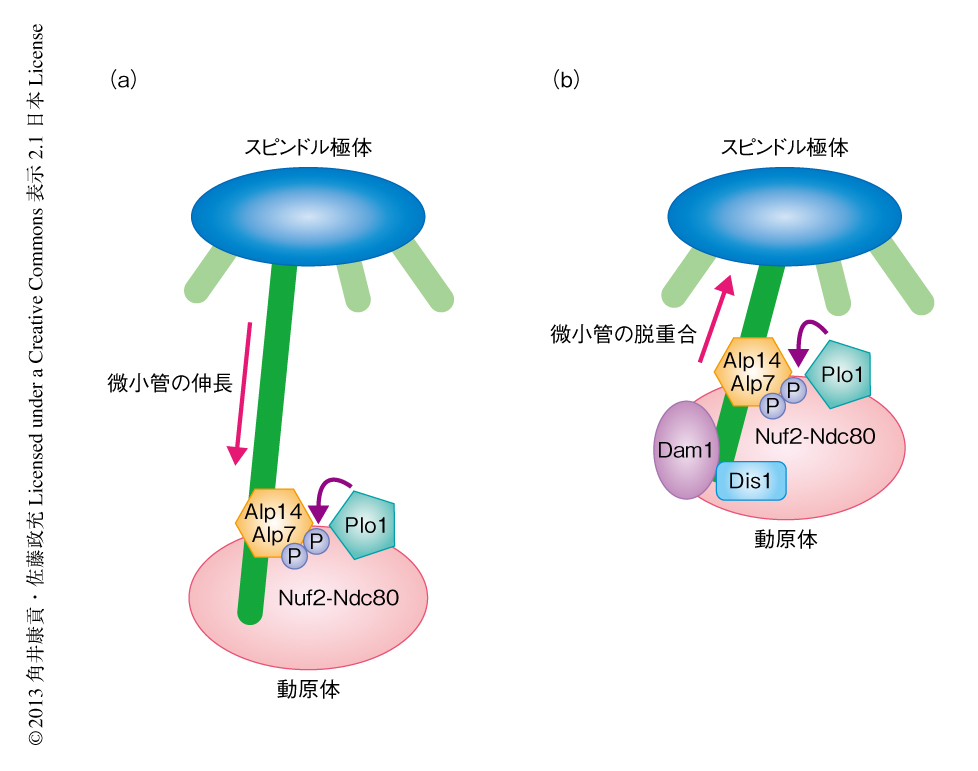
この研究により,減数分裂における組換えと染色体分配との連携は,微小管,TOGタンパク質,Polo様キナーゼのはたらきにより制御されていることがわかった(図2).減数分裂においてみられる微小管による動原体の捕捉は生理的な条件において起こるものであり,これまでの体細胞分裂を用いた人工的な実験系において解析されていた類似の現象とは異なる.実際に,この研究により発見された減数分裂における現象と,体細胞分裂における人工的な現象は異なる分子機構により制御されていることが明確となった.TOGタンパク質は微小管の重合促進タンパク質であることがin vivoおよびin vitroにおいて示されている一方,in vitroにおいては微小管の脱重合を促進できることも報告されていた10).今回のデータは,分裂酵母のTOGホモログであるDis1がin vivoにおいて微小管の脱重合を促進していること示したはじめての例といえる.
また,この研究により,動原体は微小管の脱重合により運搬されていることがわかった.微小管の脱重合による動原体の運搬は分裂の後期において広く観察されており,減数分裂における動原体の運搬機構の解析は,その分子機構の解明にもつながるであろう.さらには,放射状の微小管がどのようにして時期特異的に形成されるかを追求することにより,微小管の新しい制御機構が明らかになることが期待される.
略歴:2011年 東京大学大学院理学系研究科博士課程 修了,同年 同 特任研究員を経て,2012年より英国Cancer Research UK London Research InstituteにてResearch fellow.
研究テーマ:染色体の高次構造と分裂期における凝縮の機構.
抱負:複雑にみえる生命現象を,誰にでもわかるようシンプルに伝えられるようにしていきたい.
佐藤 政充(Masamitsu Sato)
早稲田大学先進理工学部 准教授.
© 2013 角井康貢・佐藤政充 Licensed under CC 表示 2.1 日本
(1英国Cancer Research UK London Research Institute,2早稲田大学先進理工学部 生命医科学科)
email:角井康貢,佐藤政充
DOI: 10.7875/first.author.2013.084
Microtubules and Alp7-Alp14 (TACC-TOG) reposition chromosomes before meiotic segregation.
Yasutaka Kakui, Masamitsu Sato, Naoyuki Okada, Takashi Toda, Masayuki Yamamoto
Nature Cell Biology, 15, 786-796 (2013)
要 約
生物が子孫を残すためには減数分裂の正確な遂行が不可欠である.減数分裂では子孫の多様性を生み出す組換えを行うため,染色体の配置は大きく変換される.これにより,染色体の動原体はスピンドル極体から離れた位置に配置されるが,これは,直後に起こる染色体分配の異常をひき起こす可能性がある.にもかかわらず,実際には細胞はなんらかの方法によりこのリスクを回避し,染色体分配を正確に遂行している.筆者らは,3色蛍光生細胞イメージング法により,減数第1分裂が開始するとき核において特殊な微小管が形成され,これが動原体の位置を再変換することにより染色体分配の異常のリスクを排除していることを発見した.さらには,微小管結合タンパク質であるTACC-TOG複合体がPolo様キナーゼによるリン酸化をうけて動原体へ局在することにより動原体が効率よく微小管に捕捉されること,Dis1/TOGがDam1複合体と協調して微小管の脱重合を促進することを明らかにした.すなわち,微小管,2つのTOGタンパク質,Polo様キナーゼによる染色体の配置の変換により,減数分裂組換えは直後の染色体分配へと安全にひきつがれていた.
はじめに
細胞が増殖をくり返すためには,染色体分配を正しく制御することが不可欠である.染色体を分配するため,染色体のセントロメアに形成された動原体は,紡錘極から伸長してきた微小管により捕捉され,両極へと引っ張られる.この過程にエラーが起こると細胞のがん化や細胞死,先天性異常の原因となることが知られている1).そこで,このエラーを防ぐため細胞はさまざまなくふうをこらして染色体分配を正しく制御している.酵母では動原体を高等生物の中心体に相当するスピンドル極体の近くにつなぎとめ,紡錘体微小管により捕捉されやすくすることにより安全な染色体分配を保障している2)(図1a).
減数分裂は,染色体の組換えと,それにつづく2回の連続した染色体分配により(減数第1分裂および減数第2分裂),配偶子(精子および卵子,酵母では胞子)を形成する特別な分裂の様式である.減数分裂では組換えにより父方に由来する遺伝子と母方に由来する遺伝子を交換することで,子孫の遺伝的な多様性を生み出している.組換えを効率よく行うため,動原体はスピンドル極体から遠く離され,これと入れ替わるように染色体の末端にあるテロメアがスピンドル極体の近傍に集合し,ブーケ構造が形成される3)(図1b).このブーケ構造は酵母から哺乳類まで共通して観察されることが知られている4).ブーケ構造は組換えに適した染色体の配置であるが,動原体とスピンドル極体とのあいだに距離があるぶん,染色体分配におけるリスクが高いはずである.ところが,実際には染色体分配の異常は観察されないことから,細胞には未知の分子機構が存在し,動原体の不利な配置のもたらす染色体分配におけるリスクを回避していると推察された.そこで,筆者らは,染色体の配置に着目し,細胞がどのようにしてブーケ構造という特殊な状況から染色体分配を正確に行っているかを解析した.
1.減数第1分裂にさきだち微小管が染色体の配置を変換する
減数分裂の組換えの終了から減数第1分裂の開始にかけ,動原体,テロメア,スピンドル極体の3か所の挙動を3色蛍光生細胞イメージング法により観察した.その結果,動原体とテロメアの配置がダイナミックに入れ替わり,動原体は減数第1分裂の開始のまえにスピンドル極体に集合することがわかった.動原体がスピンドル極体ヘとむかうこと,および,スピンドル極体は微小管の形成にかかわることから,微小管に注目してさらなる解析を行った.微小管重合阻害剤により微小管のはたらきを抑制したところ,染色体の配置の変換は起こらなかった.さらに,3色蛍光生細胞イメージング法により微小管と動原体の挙動を同時に観察したところ,この時期にのみ,核において形成される放射状の微小管が動原体を捕捉し,微小管の脱重合にともない動原体をスピンドル極体ヘと運んでいることを発見した.放射状の微小管の構造は体細胞分裂や減数第2分裂においては観察されなかったことから,特殊な構造の微小管を時期特異的に形成することにより染色体分配におけるリスクを回避していることが示唆された.
2.Dis1/TOGはDam1/DASH複合体と協調して動原体をスピンドル極体へと運ぶ
微小管による動原体の運搬にはどのようなタンパク質がかかわっているのだろうか.人工的な系を用いた動原体の運搬に関するこれまでの報告から5-7),TOGタンパク質,Dam1複合体,微小管モータータンパク質の3者が重要な役割をはたしている可能性が示唆された.そこで,これらのタンパク質を欠損した細胞における微小管および動原体の挙動を観察した.分裂酵母におけるTOGホモログであるDis1,あるいは,Dam1複合体を欠損した細胞では,動原体は微小管と接着するが,スピンドル極体へと効率よく運ばれなかった.そこで,dis1変異体およびdam1変異体における微小管の短縮の速度を定量したところ,動原体と接着した微小管の短縮速度は大きく低下していた.一方,微小管モータータンパク質であるキネシンやダイニンを欠損させても動原体はスピンドル極体ヘと運ばれたことから,これらのタンパク質は動原体の運搬には関与していないと考えられた.つづいて,Dis1とDam1複合体とのあいだの局在の依存関係について調べた.dam1破壊株におけるDis1の局在パターンは野生株のものと変わらなかったが,dis1破壊株ではDam1の動原体への局在は不安定化していた.これらの結果から,Dis1とDam1複合体は協調し,動原体における微小管の脱重合を促進することにより,動原体のスピンドル極体への運搬に関与していることが明らかになった.
3.TACC-TOG複合体は減数分裂において動原体にあらかじめ局在し微小管による動原体の捕捉をサポートする
分裂酵母のもうひとつのTOGのホモログであるAlp14についても同様に解析した.Alp14はTACCのホモログであるAlp7と複合体を形成し微小管の形成を促進することが知られている8).Alp7の減数分裂における局在を調べたところ,動原体に強く局在することが見い出された.体細胞分裂において,Alp7は微小管に運ばれるかたちで動原体の表面に局在するが,減数分裂における動原体への局在には微小管を必要としなかった.そのため,Alp7-Alp14複合体は減数分裂において特別な機能をもつと推察された.
しかしながら,Alp7あるいはAlp14を欠損すると微小管の形成における異常が大きく,Alp7-Alp14複合体が動原体において発揮する機能をピンポイントに調べることはできなかった.そこで,動原体に局在できなくなるようなAlp7-Alp14複合体の変異体の作製,ならびに,Alp7-Alp14複合体が動原体に局在するための足場となるタンパク質の同定を行った.外来性TEVプロテアーゼを用いてAlp7-Alp14複合体を動原体において特異的に除去すると,動原体はいったん微小管により捕捉されるものの,微小管の短縮にともない微小管から脱落することがわかった.つづいて,Alp7の動原体への局在にかかわるタンパク質として,動原体の構成タンパク質であるNdc80-Nuf2複合体に着目した.Nuf2は減数分裂においてAlp7と強く相互作用していることが共免疫沈降により確認できたため,Ndc80-Nuf2複合体は動原体においてAlp7-Alp14複合体の足場になっていると考えられた.そこで,nuf2変異体において動原体および微小管の動きを観察した結果,動原体が微小管から脱落するようすが頻繁に観察された.以上の結果から,Alp7-Alp14複合体は減数分裂において,微小管に依存しないかたちで動原体に局在することにより,微小管による動原体の捕捉をサポートしていることが明らかになった.
4.Alp7はPolo様キナーゼPlo1によりリン酸化されることで減数分裂に特異的に動原体に局在する
つづいて,Alp7-Alp14複合体が減数分裂においてのみ動原体へと局在する分子基盤の解明をめざした.Alp7-Alp14複合体の足場として同定した動原体タンパク質Ndc80-Nuf2複合体は,体細胞分裂においても動原体に存在している.そのため,減数分裂に特異的に起こるタンパク質の修飾がこれらの相互作用を促進する可能性があると考えた.Polo様キナーゼPlo1は体細胞分裂においてはスピンドル極体に局在するが,減数分裂においては動原体にも存在することが報告されていた9).plo1変異体におけるAlp7の局在を調べたところ,動原体におけるAlp7の局在性の低下がみられた.そこで,plo1変異体において動原体に野生型Plo1のキナーゼドメインを人工的にリクルートさせると,Alp7の動原体への局在が回復した.これに対して,不活性化型のPlo1キナーゼドメインを用いた場合にはAlp7の局在は回復しなかった.
Plo1によるAlp7のリン酸化部位をin vitroキナーゼアッセイにより探索した結果,C末端側のTACCドメインがPlo1によりリン酸化されることがわかった.このTACCドメインにはPolo様キナーゼによるリン酸化のコンセンサス配列が4か所存在し,これらのSerおよびThrをAlaに置換した非リン酸化型Alp7はin vitroにおいてPlo1によるリン酸化をほとんどうけなかった.また,大腸菌から精製したAlp7はPlo1によるリン酸化の処理を施すことにより,動原体タンパク質であるNuf2との相互作用が強くなった.これに対して,非リン酸化型Alp7を用いた場合には,Plo1によるリン酸化の有無にかかわらずNuf2との相互作用はみられなかった.
これに一致するように,非リン酸化型Alp7は減数分裂における動原体への局在が著しく低下しており,in vivoにおいてもAlp7はPlo1によるリン酸化をうけて動原体へと局在することが示された.非リン酸化型Alp7を発現した細胞では微小管からの動原体の脱落が頻繁に観察され,減数第1分裂での染色体分配にも異常が生じた.これらの結果をあわせて,Plo1がリン酸化を介してAlp7-Alp14複合体を動原体へと局在させ,微小管と動原体との接着を促進していることが明らかになった.
5.チューブリンの変異体における染色体分配の異常はAlp7-Alp14複合体を動原体へと人工的に局在させることにより部分的に抑圧される
チューブリンの低温感受性変異体では低温において微小管が形成されないため,体細胞分裂期においても動原体を捕捉することができない.ここで,温度を上昇させるとチューブリンの機能が回復し,微小管が再形成されて動原体を捕捉する場面を人工的につくりだすことができる.このチューブリン変異体を用いた人工的な動原体運搬アッセイにおいて,Alp7-Alp14複合体が減数分裂のときのような機能を発揮できるかどうか検討した.すなわち,体細胞分裂のとき動原体には局在しないAlp7-Alp14複合体を,動原体タンパク質CENP-Cと融合させることにより動原体に強制的にリクルートしそのはたらきを調べた.Alp7-Alp14複合体を動原体へと人工的にリクルートすることにより,チューブリン変異体における動原体の捕捉および運搬には若干の改善がみられたが,その効果は限定的であった.これは,体細胞分裂ではスピンドル極体からの放射状の微小管の形成が効率よく起こらないことが原因であると考えられた.
したがって,分裂酵母は減数分裂において,Alp7-Alp14複合体の動原体への局在と放射状の微小管の形成という2つの現象を促進することにより,スピンドル極体から遠く離れた動原体を効率よく回収し,組換えに由来する染色体分配におけるリスクを回避しているといえた.
おわりに
この研究により,減数分裂における組換えと染色体分配との連携は,微小管,TOGタンパク質,Polo様キナーゼのはたらきにより制御されていることがわかった(図2).減数分裂においてみられる微小管による動原体の捕捉は生理的な条件において起こるものであり,これまでの体細胞分裂を用いた人工的な実験系において解析されていた類似の現象とは異なる.実際に,この研究により発見された減数分裂における現象と,体細胞分裂における人工的な現象は異なる分子機構により制御されていることが明確となった.TOGタンパク質は微小管の重合促進タンパク質であることがin vivoおよびin vitroにおいて示されている一方,in vitroにおいては微小管の脱重合を促進できることも報告されていた10).今回のデータは,分裂酵母のTOGホモログであるDis1がin vivoにおいて微小管の脱重合を促進していること示したはじめての例といえる.
また,この研究により,動原体は微小管の脱重合により運搬されていることがわかった.微小管の脱重合による動原体の運搬は分裂の後期において広く観察されており,減数分裂における動原体の運搬機構の解析は,その分子機構の解明にもつながるであろう.さらには,放射状の微小管がどのようにして時期特異的に形成されるかを追求することにより,微小管の新しい制御機構が明らかになることが期待される.
文 献
- Weaver, B. A. & Cleveland, D. W.: Does aneuploidy cause cancer? Curr. Opin. Cell Biol., 18, 658-667 (2006)[PubMed]
- Funabiki, H., Hagan, I., Uzawa, S. et al.: Cell cycle-dependent specific positioning and clustering of centromeres and telomeres in fission yeast. J. Cell Biol., 121, 961-976 (1993)[PubMed]
- Chikashige, Y., Ding, D. Q., Funabiki, H. et al.: Telomere-led premeiotic chromosome movement in fission yeast. Science, 264, 270-273 (1994)[PubMed]
- Scherthan, H.: A bouquet makes ends meet. Nat. Rev. Mol. Cell Biol., 2, 621-627 (2001)[PubMed]
- Gachet, Y., Reyes, C., Courtheoux, T. et al.: Sister kinetochore recapture in fission yeast occurs by two distinct mechanisms, both requiring Dam1 and Klp2. Mol. Biol. Cell, 19, 1646-1662 (2008)[PubMed]
- Franco, A., Meadows, J. C. & Millar, J. B.: The Dam1/DASH complex is required for the retrieval of unclustered kinetochores in fission yeast. J. Cell Sci., 120, 3345-3351 (2007)[PubMed]
- Gandhi, S. R., Gierlinski, M., Mino, A. et al.: Kinetochore-dependent microtubule rescue ensures their efficient and sustained interactions in early mitosis. Dev. Cell, 21, 920-933 (2011)[PubMed]
- Sato, M. & Toda, T.: Alp7/TACC is a crucial target in Ran-GTPase-dependent spindle formation in fission yeast. Nature, 447, 334-337 (2007)[PubMed]
- Krapp, A., Del Rosario, E. C. & Simanis, V.: The role of Schizosaccharomyces pombe dma1 in spore formation during meiosis. J. Cell Sci., 123, 3284-3293 (2010)[PubMed]
- Shirasu-Hiza, M., Coughlin, P. & Mitchison, T.: Identification of XMAP215 as a microtubule-destabilizing factor in Xenopus egg extract by biochemical purification. J. Cell Biol., 161, 349-358 (2003)[PubMed]
著者プロフィール
略歴:2011年 東京大学大学院理学系研究科博士課程 修了,同年 同 特任研究員を経て,2012年より英国Cancer Research UK London Research InstituteにてResearch fellow.
研究テーマ:染色体の高次構造と分裂期における凝縮の機構.
抱負:複雑にみえる生命現象を,誰にでもわかるようシンプルに伝えられるようにしていきたい.
佐藤 政充(Masamitsu Sato)
早稲田大学先進理工学部 准教授.
© 2013 角井康貢・佐藤政充 Licensed under CC 表示 2.1 日本