骨組織の内部の骨細胞は造血幹細胞の動員を制御する
浅田 騰1・片山義雄2・谷本光音1
(1岡山大学大学院医歯薬学総合研究科 血液・腫瘍・呼吸器内科学,2神戸大学大学院医学研究科 血液内科学分野)
email:浅田 騰,片山義雄
DOI: 10.7875/first.author.2013.082
Matrix-embedded osteocytes regulate mobilization of hematopoietic stem/progenitor cells.
Noboru Asada, Yoshio Katayama, Mari Sato, Kentaro Minagawa, Kanako Wakahashi, Hiroki Kawano, Yuko Kawano, Akiko Sada, Kyoji Ikeda, Toshimitsu Matsui, Mitsune Tanimoto
Cell Stem Cell, 6, 737-747 (2013)
造血幹細胞および造血前駆細胞はG-CSFの投与により骨髄におけるニッチを離れ末梢血へと誘導される.この現象は動員とよばれるが,筆者らは,これまで,G-CSFによる動員をつうじて骨芽細胞ニッチの機能を解析してきた.今回,骨芽細胞よりもさらに骨の内部にある骨細胞がG-CSFによる造血幹細胞の動員に重要であることを発見した.G-CSFの投与により骨細胞は抑制され,しかも,骨細胞は骨芽細胞よりも早期に影響をうけることが明らかになった.また,骨細胞はG-CSFの投与により惹起された交感神経シグナルをうけて抑制されることが考えられた.生体において骨細胞を除去したマウス,あるいは,骨細胞ネットワークに異常のあるマウスでは,G-CSFによる造血幹細胞および造血前駆細胞の動員は著しく障害されており,骨細胞ネットワークはG-CSFによる動員に必須であると思われた.また,骨細胞の除去により,骨芽細胞ニッチおよび骨髄マクロファージの障害,骨髄におけるcxcl12遺伝子の発現の上昇と造血幹細胞における静止期細胞の割合の増加を認めたことから,骨細胞は骨芽細胞ニッチのみならず,骨髄においてニッチを制御する細胞や傍血管のニッチ細胞にも影響をあたえる,造血系の制御において重要なプレーヤーのひとつであると考えられた.
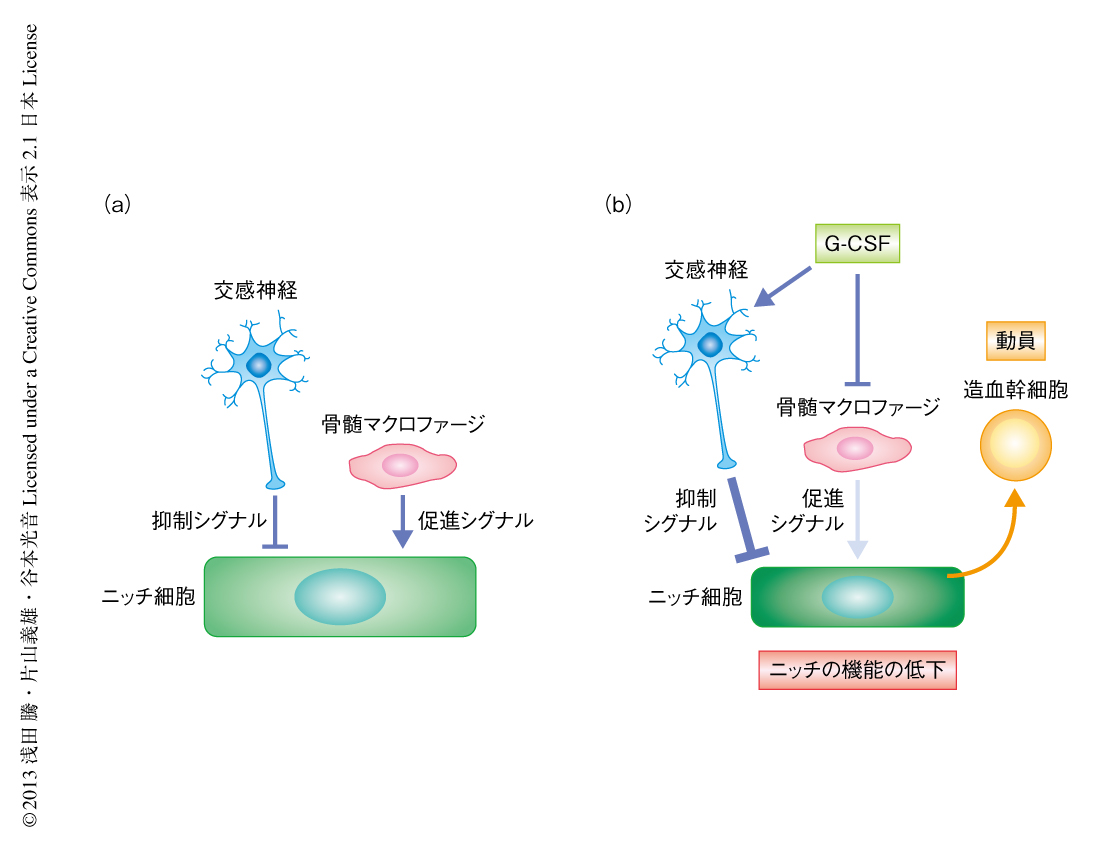
造血幹細胞はふだん骨髄においてニッチとよばれる特定の場所にいることが知られている.ニッチを構成する多くの細胞のうち,骨の内膜にある骨芽細胞はもっとも古くから研究されており,G-CSF(granulocyte-colony stimulating factor,顆粒球コロニー刺激因子)による造血幹細胞および造血前駆細胞の動員への関与が知られている1,2).ニッチの機能は交感神経からの抑制シグナルとマクロファージからの支持シグナルとのバランスにより保たれており,G-CSFは交感神経シグナルを増強しマクロファージを抑制することによりこのバランスをかたむけ,骨芽細胞ニッチの抑制をまねく3,4)(図1).骨芽細胞は骨髄と骨組織との境界に存在するが,骨組織の側からの制御については知られていなかった.骨組織には骨芽細胞が分化した骨細胞が多く存在し,特徴的な細胞突起を伸ばしてとなりあう骨細胞どうしあるいは骨内膜の表面の骨芽細胞と連絡している5).骨細胞は機械的な刺激を感知して骨芽細胞および破骨細胞の機能を制御することが知られている6).この研究において,筆者らは,骨芽細胞ニッチの制御における骨細胞の役割を検討し,G-CSFによる造血幹細胞および造血前駆細胞の動員において骨細胞が必須であることを明らかにした.
G-CSFの投与により骨芽細胞が抑制をうけることが知られていたため,G-CSFの投与による骨細胞の変化を遺伝子発現の解析により検討した.野生型マウスにG-CSFを12時間おき8回投与し,1回,2回,4回,6回,8回の投与ののち大腿骨を採取し,骨芽細胞に関連する遺伝子あるいは骨細胞に関連する遺伝子の発現の変化を解析したところ,骨芽細胞に関連する遺伝子は6回あるいは8回の投与ののちその発現が抑制されるのに対し,骨細胞に関連する遺伝子の発現は1回の投与ののちというきわめて早期の段階に抑制されていた.骨芽細胞と骨細胞とをより明確に分離するため,G-CSFを1回投与したマウスの骨組織をコラゲナーゼとEDTAで処理することにより骨芽細胞の画分と骨細胞の画分とに分離し,それぞれの画分においてG-CSFの投与による遺伝子発現の変化を解析したところ,骨芽細胞の画分ではG-CSFの投与により遺伝子発現の抑制を認めなかったが,骨細胞の画分では骨細胞に関連する遺伝子の発現が抑制された.
また,G-CSFによる骨細胞の形態学的な変化をとらえるため,G-CSFを投与したのちに骨組織のファロイジン染色を行ったところ,G-CSFの投与により骨細胞において細胞突起が著明に抑制されることがわかり,この変化は,骨の深部にある骨細胞よりも骨内膜に近い骨細胞においてより顕著にみられることも明らかになった.
筆者らは,以前の研究において,G-CSFは交感神経シグナルの増強を惹起し,交感神経より放出されたカテコールアミンが骨芽細胞に存在するβ2アドレナリン受容体を介して骨芽細胞を抑制することにより,ニッチの機能の破綻をまねき動員の起こることを示している3,7).G-CSFの投与による骨細胞の変化における交感神経系の関与を確かめるため,まず,骨髄においてカテコールアミンの生合成における初発酵素であるチロシンヒドロキシラーゼに陽性を示す交感神経線維の分布を免疫染色により検討したところ,骨内膜の周辺まで分布しており,骨内膜に近い骨細胞は骨芽細胞と同様にβ2アドレナリン受容体を発現していた.G-CSFの投与により生じる骨細胞に関連する遺伝子の発現の変化が交感神経シグナルにより生じているかどうかを調べるため,外科的に交感神経を切除したマウスにおいて,G-CSFの投与により生じる骨細胞に関連する遺伝子の発現の変化を解析した.擬似手術を施した骨ではG-CSFの投与により骨細胞に関連する遺伝子の発現の抑制がみられたが,交感神経を切除した骨では発現の抑制を認めなかった.以上より,骨細胞は交感神経シグナルをうけてG-CSFによる造血幹細胞および造血前駆細胞の動員を制御している可能性が考えられた.
G-CSFによる造血幹細胞および造血前駆細胞の動員における骨細胞の役割を直接的に検討するため,生体において骨細胞を特異的に除去できるDMP-1-DTRトランスジェニックマウスを用い,骨細胞の少ないosteocyte less(OL)マウスにおけるG-CSFによる動員を,コロニーアッセイ法,フローサイトメトリー,競合的長期造血再構築能アッセイ法を用い検討した.OLマウスでは骨髄において造血幹細胞および造血前駆細胞に変化を認めなかったが,G-CSFによる動員は著しく障害されていた.また,定常状態での脾臓におけるコロニーを形成する細胞の数を比較したところ,OLマウスにおいて有意に少ないことがわかった.すなわち,骨細胞がないと造血幹細胞および造血前駆細胞は骨髄から末梢血へと出られないのである.動員は造血幹細胞および造血前駆細胞が骨髄から離れる現象であるが,これとは逆の過程であるホーミングにおける骨細胞の役割を検討するため,致死的な強度の放射線を照射したOLマウスと野生型マウスに静脈をへて骨髄細胞を移植し,3時間のちに骨髄を採取して造血幹細胞および造血前駆細胞がどれだけホーミングしたかを比較したところ,OLマウスと野生型マウスとで有意な差は認められず,骨細胞は骨髄からの造血幹細胞および造血前駆細胞の動員という現象に特異的に関与していることが示唆された.
骨細胞は細胞突起を介して骨芽細胞と連絡しており,骨芽細胞の機能を制御しているという報告のあることから,骨細胞を除去したマウスにおける動員の不全の原因は骨芽細胞にあるのではないかと考えた.骨細胞を除去したマウスの骨芽細胞を形態学的に観察したところ,骨芽細胞の丈が短くなっており,まさにペシャンコといった様相であった.骨芽細胞が分泌する代表的なタンパク質Osteocalcinの発現も低下しており,機能的にも抑制されていることが示唆された.すなわち,骨細胞の除去により骨芽細胞ニッチが障害されることによって動員に障害の起こっている可能性が考えられた.
また,最近の研究により,骨髄においてマクロファージが骨芽細胞や傍血管のニッチ細胞の機能をサポートしており,G-CSFを投与したときには骨髄マクロファージが抑制されることにより,ニッチをサポートする機能が減弱しニッチの機能の低下にいたることが明らかにされている4,8).骨細胞を除去したのちの骨髄標本においてこの骨髄マクロファージの変化を検討したところ,F4/80陽性の骨髄マクロファージが骨内膜から消失しており,骨細胞は骨髄マクロファージにも影響をあたえ骨芽細胞ニッチを制御していることが示唆された.
ニッチ細胞の分泌するケモカインであるCXCL12には造血幹細胞をニッチにつなぎとめる作用があり,G-CSFによる動員において,骨髄におけるCXCL12の低下がかぎとなるイベントであるとされている9).しかしながら,骨細胞を除去したマウスにG-CSFを投与すると,骨髄においてCXCL12が低下するにもかかわらず,造血幹細胞の動員は障害されていた.また,CXCL12の対抗受容体であるCXCR4に対するアンタゴニストAMD3100を投与すると動員の起こることが知られている.興味深いことに,G-CSFの投与では動員の起こらない骨細胞を除去したマウスにおいても,AMD3100の投与による動員は正常であった.すなわち,骨細胞により制御される動員の機構において,CXCL12の低下だけでは十分でない可能性が考えられた.
また,CXCL12は造血幹細胞の動員だけでなく造血幹細胞の維持にも重要であり,ニッチ細胞はCXCL12を高く発現することが知られている.おもしろいことに,骨細胞を除去すると骨髄においてcxcl12遺伝子をコードするmRNAの発現が上昇した.これは,おそらく骨髄に存在するcxcl12遺伝子を多く発現する細胞,すなわち,傍血管のニッチ細胞における発現の上昇をみていたものと予想された.さらに,この発現の上昇を反映して,造血幹細胞の多く含まれるCD34陰性LSK細胞においてG0期の細胞の割合が増加しており,このことは,骨細胞からのシグナルが骨髄のニッチ細胞に影響をあたえ,造血幹細胞の細胞周期を制御していることを示唆した.
G-CSFの投与により骨細胞において細胞突起が抑制されたこと,骨細胞を除去したマウスでは動員の障害を認めたことから,G-CSFによる動員には骨細胞の形成するネットワークが重要であるとの仮説をたてた.老化モデルとして知られており骨粗鬆症を起こしまた骨細胞の配列に異常のあるKlothoを欠損したマウスにでは,骨細胞ネットワークは破綻していた.そして,予想どおり,Klothoを欠損したマウスでは骨細胞を除去したマウスと同様に,骨髄における造血幹細胞の数に変化はなかったがG-CSFによる動員はほとんどみられなかった.
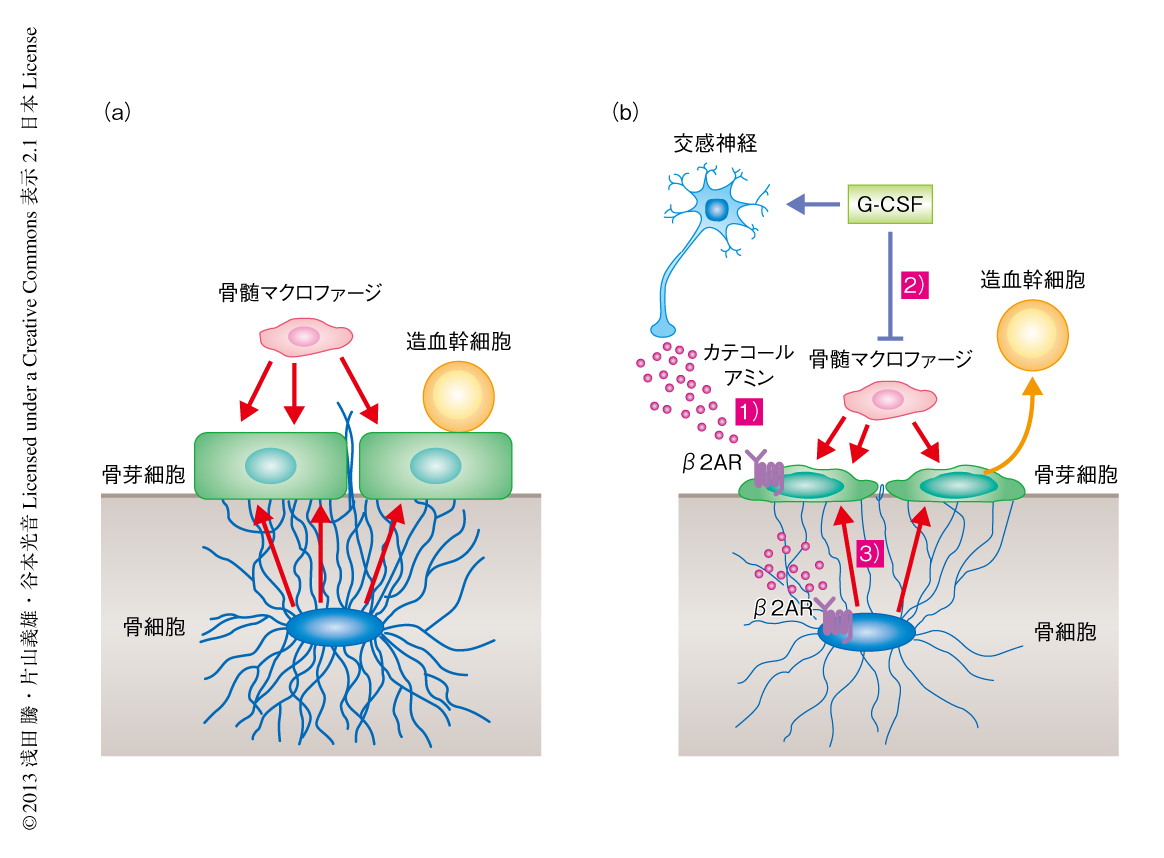
今回,筆者らは,G-CSFによる造血幹細胞の動員における新たなプレーヤーとして骨細胞のはたらきを明らかにし,骨芽細胞ニッチは骨髄の側から骨髄マクロファージによる制御をうけ,骨組織の側からは骨細胞による制御をうける,という新たな構図をうきぼりにした.G-CSFを投与したとき骨芽細胞は以下の3つの経路からの抑制をうけ,ニッチの機能が破綻し造血幹細胞の動員の起こることが考えられた.1つ目は,活性化された交感神経よりカテコールアミンが放出され,これが骨芽細胞に存在するβ2アドレナリン受容体にはたらいて直接に抑制する経路.2つ目は,骨髄マクロファージがG-CSFによる抑制をうけて骨芽細胞への支持シグナルが弱まる経路.そして3つ目は,カテコールアミンが骨細胞に作用して骨細胞の抑制をまねき,骨芽細胞への支持シグナルが弱まる経路である(図2).
今回の結果から,造血系は神経や骨組織といった多臓器からの影響をうけ制御されていることを再認識することができた.血液系あるいは血液疾患の病態を考える際,血液細胞だけでなく,骨組織や周辺の組織を含めた広い視点でとらえる必要があるだろう.
略歴:岡山大学大学院医歯薬学総合研究科博士課程 在学中.
研究テーマ:造血幹細胞ニッチ.
抱負:造血を制御する影のプレーヤーや分子機構を探索することで,複雑な造血系の制御の解明に挑みます.
片山 義雄(Yoshio Katayama)
神戸大学大学院医学研究科 講師.
谷本 光音(Mitsune Tanimoto)
岡山大学大学院医歯薬学総合研究科 教授.
© 2013 浅田 騰・片山義雄・谷本光音 Licensed under CC 表示 2.1 日本
(1岡山大学大学院医歯薬学総合研究科 血液・腫瘍・呼吸器内科学,2神戸大学大学院医学研究科 血液内科学分野)
email:浅田 騰,片山義雄
DOI: 10.7875/first.author.2013.082
Matrix-embedded osteocytes regulate mobilization of hematopoietic stem/progenitor cells.
Noboru Asada, Yoshio Katayama, Mari Sato, Kentaro Minagawa, Kanako Wakahashi, Hiroki Kawano, Yuko Kawano, Akiko Sada, Kyoji Ikeda, Toshimitsu Matsui, Mitsune Tanimoto
Cell Stem Cell, 6, 737-747 (2013)
要 約
造血幹細胞および造血前駆細胞はG-CSFの投与により骨髄におけるニッチを離れ末梢血へと誘導される.この現象は動員とよばれるが,筆者らは,これまで,G-CSFによる動員をつうじて骨芽細胞ニッチの機能を解析してきた.今回,骨芽細胞よりもさらに骨の内部にある骨細胞がG-CSFによる造血幹細胞の動員に重要であることを発見した.G-CSFの投与により骨細胞は抑制され,しかも,骨細胞は骨芽細胞よりも早期に影響をうけることが明らかになった.また,骨細胞はG-CSFの投与により惹起された交感神経シグナルをうけて抑制されることが考えられた.生体において骨細胞を除去したマウス,あるいは,骨細胞ネットワークに異常のあるマウスでは,G-CSFによる造血幹細胞および造血前駆細胞の動員は著しく障害されており,骨細胞ネットワークはG-CSFによる動員に必須であると思われた.また,骨細胞の除去により,骨芽細胞ニッチおよび骨髄マクロファージの障害,骨髄におけるcxcl12遺伝子の発現の上昇と造血幹細胞における静止期細胞の割合の増加を認めたことから,骨細胞は骨芽細胞ニッチのみならず,骨髄においてニッチを制御する細胞や傍血管のニッチ細胞にも影響をあたえる,造血系の制御において重要なプレーヤーのひとつであると考えられた.
はじめに
造血幹細胞はふだん骨髄においてニッチとよばれる特定の場所にいることが知られている.ニッチを構成する多くの細胞のうち,骨の内膜にある骨芽細胞はもっとも古くから研究されており,G-CSF(granulocyte-colony stimulating factor,顆粒球コロニー刺激因子)による造血幹細胞および造血前駆細胞の動員への関与が知られている1,2).ニッチの機能は交感神経からの抑制シグナルとマクロファージからの支持シグナルとのバランスにより保たれており,G-CSFは交感神経シグナルを増強しマクロファージを抑制することによりこのバランスをかたむけ,骨芽細胞ニッチの抑制をまねく3,4)(図1).骨芽細胞は骨髄と骨組織との境界に存在するが,骨組織の側からの制御については知られていなかった.骨組織には骨芽細胞が分化した骨細胞が多く存在し,特徴的な細胞突起を伸ばしてとなりあう骨細胞どうしあるいは骨内膜の表面の骨芽細胞と連絡している5).骨細胞は機械的な刺激を感知して骨芽細胞および破骨細胞の機能を制御することが知られている6).この研究において,筆者らは,骨芽細胞ニッチの制御における骨細胞の役割を検討し,G-CSFによる造血幹細胞および造血前駆細胞の動員において骨細胞が必須であることを明らかにした.
1.骨細胞はG-CSFの投与により抑制をうける
G-CSFの投与により骨芽細胞が抑制をうけることが知られていたため,G-CSFの投与による骨細胞の変化を遺伝子発現の解析により検討した.野生型マウスにG-CSFを12時間おき8回投与し,1回,2回,4回,6回,8回の投与ののち大腿骨を採取し,骨芽細胞に関連する遺伝子あるいは骨細胞に関連する遺伝子の発現の変化を解析したところ,骨芽細胞に関連する遺伝子は6回あるいは8回の投与ののちその発現が抑制されるのに対し,骨細胞に関連する遺伝子の発現は1回の投与ののちというきわめて早期の段階に抑制されていた.骨芽細胞と骨細胞とをより明確に分離するため,G-CSFを1回投与したマウスの骨組織をコラゲナーゼとEDTAで処理することにより骨芽細胞の画分と骨細胞の画分とに分離し,それぞれの画分においてG-CSFの投与による遺伝子発現の変化を解析したところ,骨芽細胞の画分ではG-CSFの投与により遺伝子発現の抑制を認めなかったが,骨細胞の画分では骨細胞に関連する遺伝子の発現が抑制された.
また,G-CSFによる骨細胞の形態学的な変化をとらえるため,G-CSFを投与したのちに骨組織のファロイジン染色を行ったところ,G-CSFの投与により骨細胞において細胞突起が著明に抑制されることがわかり,この変化は,骨の深部にある骨細胞よりも骨内膜に近い骨細胞においてより顕著にみられることも明らかになった.
2.骨細胞は交感神経による制御をうける
筆者らは,以前の研究において,G-CSFは交感神経シグナルの増強を惹起し,交感神経より放出されたカテコールアミンが骨芽細胞に存在するβ2アドレナリン受容体を介して骨芽細胞を抑制することにより,ニッチの機能の破綻をまねき動員の起こることを示している3,7).G-CSFの投与による骨細胞の変化における交感神経系の関与を確かめるため,まず,骨髄においてカテコールアミンの生合成における初発酵素であるチロシンヒドロキシラーゼに陽性を示す交感神経線維の分布を免疫染色により検討したところ,骨内膜の周辺まで分布しており,骨内膜に近い骨細胞は骨芽細胞と同様にβ2アドレナリン受容体を発現していた.G-CSFの投与により生じる骨細胞に関連する遺伝子の発現の変化が交感神経シグナルにより生じているかどうかを調べるため,外科的に交感神経を切除したマウスにおいて,G-CSFの投与により生じる骨細胞に関連する遺伝子の発現の変化を解析した.擬似手術を施した骨ではG-CSFの投与により骨細胞に関連する遺伝子の発現の抑制がみられたが,交感神経を切除した骨では発現の抑制を認めなかった.以上より,骨細胞は交感神経シグナルをうけてG-CSFによる造血幹細胞および造血前駆細胞の動員を制御している可能性が考えられた.
3.骨細胞を除去したマウスではG-CSFによる動員が障害される
G-CSFによる造血幹細胞および造血前駆細胞の動員における骨細胞の役割を直接的に検討するため,生体において骨細胞を特異的に除去できるDMP-1-DTRトランスジェニックマウスを用い,骨細胞の少ないosteocyte less(OL)マウスにおけるG-CSFによる動員を,コロニーアッセイ法,フローサイトメトリー,競合的長期造血再構築能アッセイ法を用い検討した.OLマウスでは骨髄において造血幹細胞および造血前駆細胞に変化を認めなかったが,G-CSFによる動員は著しく障害されていた.また,定常状態での脾臓におけるコロニーを形成する細胞の数を比較したところ,OLマウスにおいて有意に少ないことがわかった.すなわち,骨細胞がないと造血幹細胞および造血前駆細胞は骨髄から末梢血へと出られないのである.動員は造血幹細胞および造血前駆細胞が骨髄から離れる現象であるが,これとは逆の過程であるホーミングにおける骨細胞の役割を検討するため,致死的な強度の放射線を照射したOLマウスと野生型マウスに静脈をへて骨髄細胞を移植し,3時間のちに骨髄を採取して造血幹細胞および造血前駆細胞がどれだけホーミングしたかを比較したところ,OLマウスと野生型マウスとで有意な差は認められず,骨細胞は骨髄からの造血幹細胞および造血前駆細胞の動員という現象に特異的に関与していることが示唆された.
4.骨細胞の除去による骨芽細胞および骨髄のニッチの変化
骨細胞は細胞突起を介して骨芽細胞と連絡しており,骨芽細胞の機能を制御しているという報告のあることから,骨細胞を除去したマウスにおける動員の不全の原因は骨芽細胞にあるのではないかと考えた.骨細胞を除去したマウスの骨芽細胞を形態学的に観察したところ,骨芽細胞の丈が短くなっており,まさにペシャンコといった様相であった.骨芽細胞が分泌する代表的なタンパク質Osteocalcinの発現も低下しており,機能的にも抑制されていることが示唆された.すなわち,骨細胞の除去により骨芽細胞ニッチが障害されることによって動員に障害の起こっている可能性が考えられた.
また,最近の研究により,骨髄においてマクロファージが骨芽細胞や傍血管のニッチ細胞の機能をサポートしており,G-CSFを投与したときには骨髄マクロファージが抑制されることにより,ニッチをサポートする機能が減弱しニッチの機能の低下にいたることが明らかにされている4,8).骨細胞を除去したのちの骨髄標本においてこの骨髄マクロファージの変化を検討したところ,F4/80陽性の骨髄マクロファージが骨内膜から消失しており,骨細胞は骨髄マクロファージにも影響をあたえ骨芽細胞ニッチを制御していることが示唆された.
ニッチ細胞の分泌するケモカインであるCXCL12には造血幹細胞をニッチにつなぎとめる作用があり,G-CSFによる動員において,骨髄におけるCXCL12の低下がかぎとなるイベントであるとされている9).しかしながら,骨細胞を除去したマウスにG-CSFを投与すると,骨髄においてCXCL12が低下するにもかかわらず,造血幹細胞の動員は障害されていた.また,CXCL12の対抗受容体であるCXCR4に対するアンタゴニストAMD3100を投与すると動員の起こることが知られている.興味深いことに,G-CSFの投与では動員の起こらない骨細胞を除去したマウスにおいても,AMD3100の投与による動員は正常であった.すなわち,骨細胞により制御される動員の機構において,CXCL12の低下だけでは十分でない可能性が考えられた.
また,CXCL12は造血幹細胞の動員だけでなく造血幹細胞の維持にも重要であり,ニッチ細胞はCXCL12を高く発現することが知られている.おもしろいことに,骨細胞を除去すると骨髄においてcxcl12遺伝子をコードするmRNAの発現が上昇した.これは,おそらく骨髄に存在するcxcl12遺伝子を多く発現する細胞,すなわち,傍血管のニッチ細胞における発現の上昇をみていたものと予想された.さらに,この発現の上昇を反映して,造血幹細胞の多く含まれるCD34陰性LSK細胞においてG0期の細胞の割合が増加しており,このことは,骨細胞からのシグナルが骨髄のニッチ細胞に影響をあたえ,造血幹細胞の細胞周期を制御していることを示唆した.
5.G-CSFによる造血幹細胞の動員においては骨細胞ネットワークが重要である
G-CSFの投与により骨細胞において細胞突起が抑制されたこと,骨細胞を除去したマウスでは動員の障害を認めたことから,G-CSFによる動員には骨細胞の形成するネットワークが重要であるとの仮説をたてた.老化モデルとして知られており骨粗鬆症を起こしまた骨細胞の配列に異常のあるKlothoを欠損したマウスにでは,骨細胞ネットワークは破綻していた.そして,予想どおり,Klothoを欠損したマウスでは骨細胞を除去したマウスと同様に,骨髄における造血幹細胞の数に変化はなかったがG-CSFによる動員はほとんどみられなかった.
おわりに
今回,筆者らは,G-CSFによる造血幹細胞の動員における新たなプレーヤーとして骨細胞のはたらきを明らかにし,骨芽細胞ニッチは骨髄の側から骨髄マクロファージによる制御をうけ,骨組織の側からは骨細胞による制御をうける,という新たな構図をうきぼりにした.G-CSFを投与したとき骨芽細胞は以下の3つの経路からの抑制をうけ,ニッチの機能が破綻し造血幹細胞の動員の起こることが考えられた.1つ目は,活性化された交感神経よりカテコールアミンが放出され,これが骨芽細胞に存在するβ2アドレナリン受容体にはたらいて直接に抑制する経路.2つ目は,骨髄マクロファージがG-CSFによる抑制をうけて骨芽細胞への支持シグナルが弱まる経路.そして3つ目は,カテコールアミンが骨細胞に作用して骨細胞の抑制をまねき,骨芽細胞への支持シグナルが弱まる経路である(図2).
今回の結果から,造血系は神経や骨組織といった多臓器からの影響をうけ制御されていることを再認識することができた.血液系あるいは血液疾患の病態を考える際,血液細胞だけでなく,骨組織や周辺の組織を含めた広い視点でとらえる必要があるだろう.
文 献
- Calvi, L. M., Adams, G. B., Weibrecht, K. W. et al.: Osteoblastic cells regulate the haematopoietic stem cell niche. Nature, 425, 841-846 (2003)[PubMed]
- Christopher, M. J. & Link, D. C.: Granulocyte colony-stimulating factor induces osteoblast apoptosis and inhibits osteoblast differentiation. J. Bone Miner. Res., 23, 1765-1774 (2008)[PubMed]
- Katayama, Y., Battista, M., Kao, W. M. et al.: Signals from the sympathetic nervous system regulate hematopoietic stem cell egress from bone marrow. Cell, 124, 407-421 (2006)[PubMed]
- Chow, A., Lucas, D., Hidalgo, A. et al.: Bone marrow CD169+ macrophages promote the retention of hematopoietic stem and progenitor cells in the mesenchymal stem cell niche. J. Exp. Med., 208, 261-271 (2011)[PubMed]
- Bonewald, L. F.: The amazing osteocyte. J. Bone Miner. Res., 26, 229-238 (2011)[PubMed]
- Tatsumi, S., Ishii, K., Amizuka, N. et al.: Targeted ablation of osteocytes induces osteoporosis with defective mechanotransduction. Cell Metab., 5, 464-475 (2007)[PubMed]
- Kawamori, Y., Katayama, Y., Asada, N. et al.: Role for vitamin D receptor in the neuronal control of the hematopoietic stem cell niche. Blood, 116, 5528-5535 (2010)[PubMed]
- Winkler, I. G., Sims, N. A., Pettit, A. R. et al.: Bone marrow macrophages maintain hematopoietic stem cell (HSC) niches and their depletion mobilizes HSCs. Blood, 116, 4815-4828 (2010)[PubMed]
- Petit, I., Szyper-Kravitz, M., Nagler, A. et al.: G-CSF induces stem cell mobilization by decreasing bone marrow SDF-1 and up-regulating CXCR4. Nat. Immunol., 3, 687-694 (2002)[PubMed]
著者プロフィール
略歴:岡山大学大学院医歯薬学総合研究科博士課程 在学中.
研究テーマ:造血幹細胞ニッチ.
抱負:造血を制御する影のプレーヤーや分子機構を探索することで,複雑な造血系の制御の解明に挑みます.
片山 義雄(Yoshio Katayama)
神戸大学大学院医学研究科 講師.
谷本 光音(Mitsune Tanimoto)
岡山大学大学院医歯薬学総合研究科 教授.
© 2013 浅田 騰・片山義雄・谷本光音 Licensed under CC 表示 2.1 日本