分泌タンパク質の成熟化を監視するpHに依存的な新たなタンパク質の品質管理機構の発見
増井翔史1・Roberto Sitia2・稲葉謙次1
(1九州大学生体防御医学研究所 蛋白質化学分野,2イタリアSan Raffaele Scientific Institute,Divisions of Genetics and Cell Biology)
email:増井翔史
DOI: 10.7875/first.author.2013.075
A pH-regulated quality control cycle for surveillance of secretory protein assembly.
Stefano Vavassori, Margherita Cortini, Shoji Masui, Sara Sannino, Tiziana Anelli, Imma R. Caserta, Claudio Fagioli, Maria F. Mossuto, Arianna Fornili, Eelco van Anken, Massimo Degano, Kenji Inaba, Roberto Sitia
Molecular Cell, 50, 783-792 (2013)
小胞体は分泌タンパク質や膜タンパク質が立体構造を獲得する場であり,厳正なタンパク質の品質管理機構が存在する.タンパク質の立体構造の形成において重要な役割を担うジスルフィド結合の形成においては,主としてEro1-PDI酸化経路がはたらいている.興味深いことに,Ero1は小胞体において機能する酸化酵素であるにもかかわらず,小胞体局在シグナルをもたない.Ero1の小胞体への局在は,小胞体局在シグナルRDEL配列をもつPDIファミリータンパク質のひとつERp44に依存することが,過去に報告されている.この研究において,筆者らは,小胞体とゴルジ体とのあいだのpH勾配がERp44によるEro1の小胞体への局在において重要な役割をもつことを示した.ERp44のC末端テール領域はpHに依存的に開閉が制御されており,その結果として,ERp44とEro1との親和性が大きく変化することを見い出した.すなわち,pHが弱酸性のゴルジ体ではERp44のC末端テール領域が開くことによりERp44とEro1は強く結合し,小胞体局在シグナルと結合するKDEL受容体とともに,ゴルジ体から小胞体へと逆輸送される.一方,pHが中性の小胞体ではERp44のC末端テール領域は閉じEro1はERp44から解離する.同様の機構により,正しい高次構造を形成していない未成熟の免疫グロブリンやアディポネクチンなどもERp44のはたらきによりゴルジ体から小胞体へと逆輸送され,高次構造を形成するまで分泌が抑制されていた.以上より,筆者らは,小胞体とゴルジ体とのあいだのpH勾配によるERp44を介した新たなタンパク質の品質管理機構を提唱した.
小胞体は分泌タンパク質や膜タンパク質が正常な立体構造を獲得する場となるオルガネラである1).小胞体で新規に合成されたタンパク質はEro1-PDI酸化経路(PDI:protein disulfide isomerase,タンパク質ジスルフィドイソメラーゼ)などによるジスルフィド結合の導入や2),カルネキシン/カルレテキュリン回路などによるフォールディングの促進や修復をうける3).正しい立体構造を獲得した新生タンパク質は分泌経路にそってゴルジ体を経由したのち,それぞれ指定の区画へと輸送される.一方,小胞体に局在すべきタンパク質や完全な高次構造をとっていない未成熟なタンパク質は,ゴルジ体へと分泌されてもCOPI被覆小胞を介して小胞体へと逆輸送される4).そのひとつの経路においてPDIファミリータンパク質のメンバーであるERp44は,小胞体へと逆輸送すべきタンパク質を認識し,小胞体局在シグナルと結合するKDEL受容体と結合することにより逆輸送されると報告されている5,6).しかしながら,ERp44がどのような機構により基質となるタンパク質と結合および解離し,また,その機能が制御されているのか,分子構造レベルでの詳細は未解明であった.
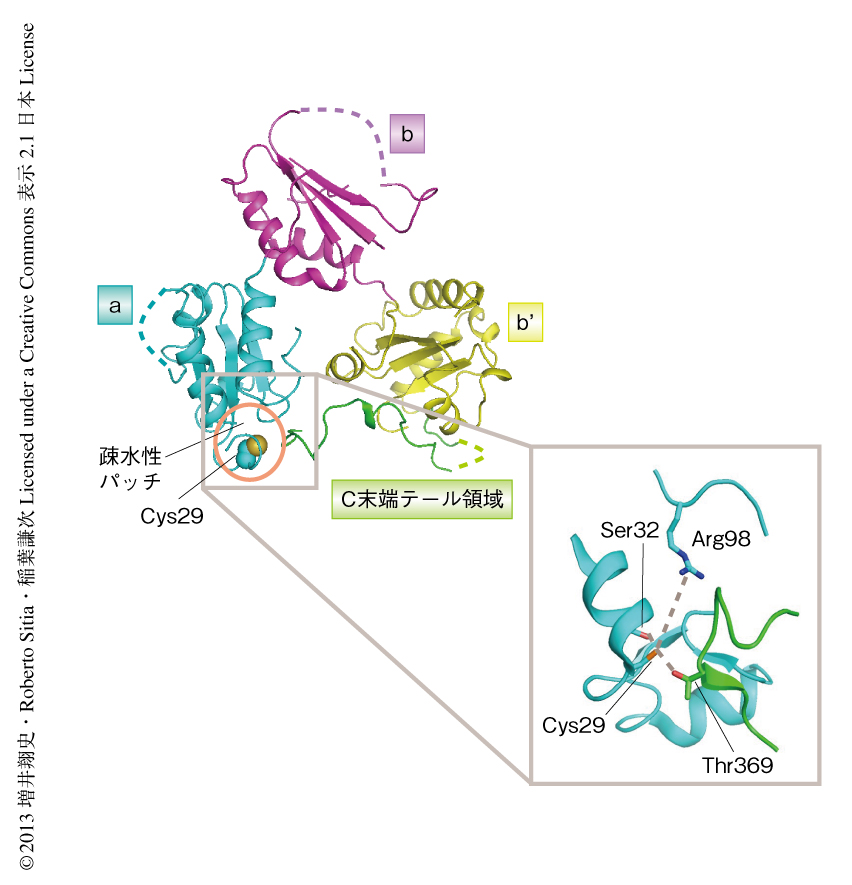
ERp44の結晶構造は,2008年に報告された7).ERp44はクローバー状にならんだ3つのチオレドキシン様ドメイン(N末端側から,aドメイン,bドメイン,b’ドメインの順)と,C末端側に存在するテール領域(C末端テール領域)から構成される.aドメインには基質との共有結合にかかわるとされるCys29と,そのまわりに疎水性パッチが存在する.結晶構造においては,C末端テール領域に存在するThr369がaドメインのCys29と水素結合を形成することによりC末端テール領域は閉じた状態にあり,基質となるタンパク質との結合に重要と考えられるCys29および疎水性パッチはおおわれた状態にある(図1).
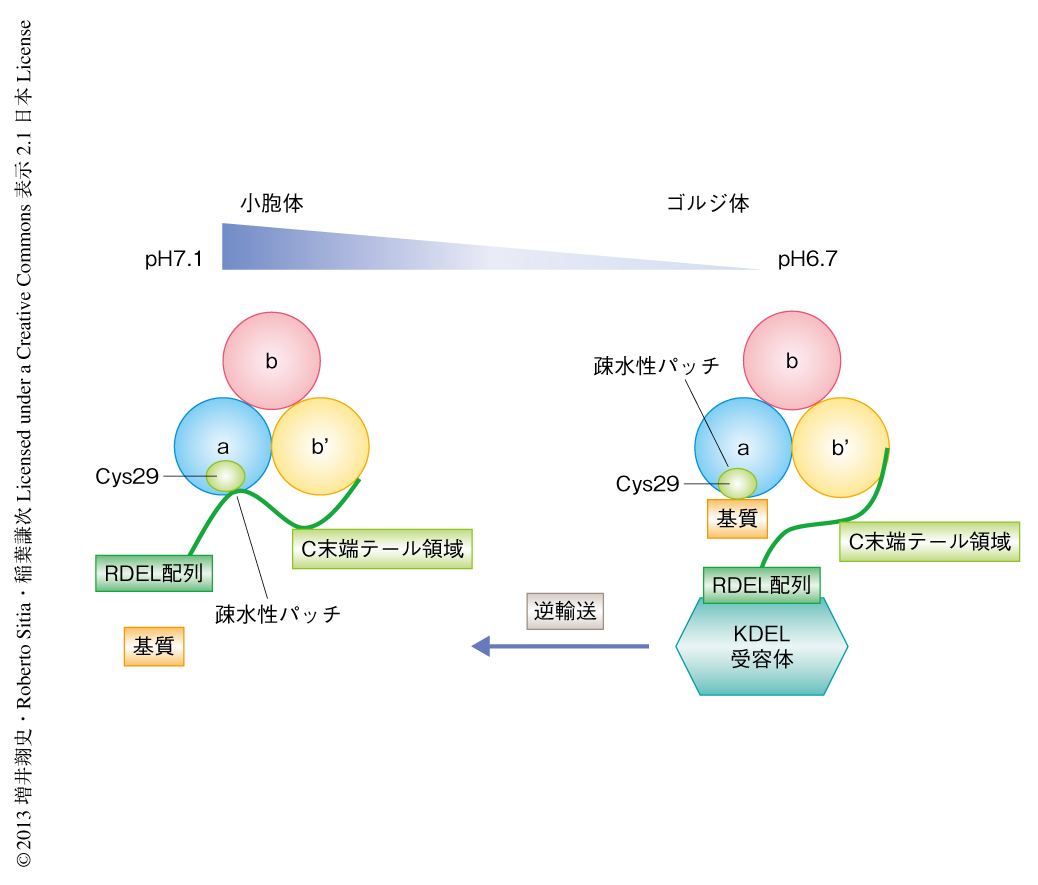
小胞体(pHは,約7.1)とゴルジ体(pHは,約6.7)とのあいだに存在するpH勾配に着目して,ERp44はpHに依存的にC末端テール領域を開閉することにより基質との結合および解離を制御しているという作業仮説をたてて研究を進めた.すなわち,ゴルジ体においてはERp44のC末端テール領域は開き,Cys29とその周辺の疎水性パッチが露出することにより基質と強く結合する.一方,小胞体においてはC末端テール領域が閉じることにより,基質であるEro1はERp44から解離する.この仮説を検証するため,疎水性蛍光プローブであるANSを用いてERp44のpHに依存的なC末端テール領域の開閉の観測を試みた.
ANSは疎水性領域に結合することで,より短波長側に強く蛍光を発するという性質をもつ.ERp44の存在下においてpH 7.5およびpH 6.5にてANSの蛍光スペクトルを観測したところ,pHの低下にともなう蛍光強度の顕著な上昇が観測された.つぎに,C末端テール領域の動きを抑えるため,閉じた状態においてCys29と水素結合することの知られるC末端テール領域のThr369(図1)をCysに変異させ,Cys29とこのCys369をジスルフィド結合させた変異体を作製した.その結果,この変異体はpHに依存的な蛍光強度の変化を示さなかったが,還元剤であるジチオスレイトールによりジスルフィド結合を切断すると,野生型と同様にpHに依存的な蛍光強度の変化が観測された.以上の結果は,pHが酸性側にシフトすることによりC末端テール領域が開き疎水性領域が露出することを示唆した.
ERp44においてC末端テール領域が開くことによるCys29のタンパク質の表面への露出をより直接的に観測するため,システイン修飾試薬であるMal-PEGによるCys29の修飾効率をpH 6~8の範囲で調べた.その結果,pHが8から6に下がるにつれMal-PEGにより修飾されるCys29の割合は大きく増加したことから,酸性側においてCys29はタンパク質の表面に露出することが示唆された.一方,Thr369をCysに変異させたERp44変異体はジスルフィド結合によりC末端テール領域が恒常的に閉じた状態にあるため,pHによらずCys29がMal-PEGにより修飾されることはなかった.以上の2つの結果は,ERp44のpHに依存的なC末端テール領域の開閉による,Cys29およびそのまわりの疎水性領域の露出あるいは遮蔽を強く示唆するものであった.
興味深いことに,ERp44のpHに依存的なC末端テール領域の開閉は,もうひとつの重要な事象にもかかわっていた.通常,小胞体局在シグナルはタンパク質のC末端側に存在し,ERp44も例外ではない.したがって,ERp44におけるC末端テール領域の開閉はその小胞体局在シグナル(RDEL配列)の動きあるいは認識されやすさにも大きく影響すると予想された.実際に,小胞体局在シグナルと結合するKDEL受容体によるERp44の認識とC末端テール領域の開閉は深くかかわっていた.Thr369をCysに変異させることでC末端テール領域が閉じた状態で固定されたERp44変異体は,RDEL配列を削除したERp44変異体と同じ程度に細胞の外へと漏出した.これに対し,RDEL配列とCys369とのあいだにFLAGタグを挿入することによりRDEL配列の可動域を増加させたERp44変異体は,細胞の外への漏出量が大きく抑制された.つまり,ERp44のC末端テール領域のpHに依存的な開閉は,基質との結合のみならず,KDEL受容体によるRDEL配列の認識されやすさをも制御していた.
小胞体とゴルジ体とのあいだのpH勾配が,細胞においてERp44の生理的な意義を制御しているのかどうか検討した.ゴルジ体膜にはGPHRというCl-チャネルが存在し,ゴルジ体のpHを低下させるはたらきをもつことが報告されている8).RNAi法によりGPHRの発現をノックダウンし,pHへの感受性の高い蛍光タンパク質pHluorinsを用いてpHを測定したところ,ゴルジ体におけるpHは7.0にまで上昇し,小胞体とゴルジ体とのあいだのpH勾配はおおよそ消失した.注目すべきことに,GPHRをノックダウンしたときと通常のときとでERp44によるEro1の分泌の抑制を比較したところ,pH勾配の消失によりEro1の分泌を抑制する効果は劇的に減少した.Ero1にくわえ,ERp44の基質であることの知られるアディポネクチンや免疫グロブリンMサブユニットについても同様の結果であった.一方,ERp44の生理的な基質ではないα1アンチトリプシンや分泌経路に誘導されるsGFPについては,細胞の外への漏出量にほとんど変化はみられなかった.このことは,小胞体とゴルジ体とのあいだのpH勾配がERp44の生理的な機能の発現に深くかかわっていることを意味し,細胞においてもERp44のpHに依存的なC末端テール領域の開閉による機能制御が行われていることが強く示唆された.
ERp44のC末端テール領域の開閉はpHにより制御されるという事実は,鍵となるアミノ酸残基のプロトン化および脱プロトン化がその制御に深くかかわることを意味する.そこで,タンパク質におけるアミノ酸残基のpKa値を推定するソフトウェアPROPKA3を用い,ERp44のCys29のpKa値を算出した.その結果,通常はシステイン残基のpKa値は9.0程度であるのに対し,Cys29のpKa値は7.7と見積もられた.実際に,ERp44においてCys29はSer32およびThr369の側鎖や主鎖のカルボニル基と水素結合を形成し,Arg98とも静電相互作用することにより,Cys29のチオレートアニオン状態は安定化されていると考えられた(図1).そこで,ERp44においてCys29と相互作用するアミノ酸残基の変異体を作製し,さきに述べたMal-PEG修飾のアッセイによりC末端テール領域の開閉状態を調べたところ,これらERp44変異体はすべてC末端テール領域がpHに非依存的に開いている状態にあることが判明した.また,C末端テール領域が欠失した状態のERp44におけるCys29のpKa値は8.7と算出された.以上の結果から,ERp44において,pHが中性付近ではCys29がチオレートアニオンとしてまわりのアミノ酸残基と相互作用することによりC末端テール領域は閉じた状態で安定化されるのに対し,弱酸性のpHではCys29がプロトン化することによりまわりのアミノ酸残基との相互作用が崩壊し,C末端テール領域は開くと解釈することができた.
以上の結果にくわえ,Ero1とERp44とのあいだのpHの変化による親和性の変化を表面プラズモン共鳴(surface plasmon resonance:SPR)測定により解析したところ,野生型ERp44ではpHが7.5から6.5に下がるにつれEro1との親和性が約6倍に上昇した.すなわち,ERp44の基質との結合性は顕著なpH依存性を示した.これに対し,C末端テール領域がつねに開いている状態のERp44変異体は,pHに関係なくEro1との強い結合性を示すことがわかった.
C末端テール領域がつねに開いている状態のERp44変異体は,細胞においても野生型ERp44とは大きく異なる性質を示すことが確認された.野生型ERp44は細胞において限られた基質とのみジスルフィド結合を形成して複合体を形成し,しかも,その複合体の量はGPHRのノックダウンにより大きく減少した.すなわち,通常の細胞ではGPHRのはたらきによりゴルジ体のpHは低く保たれERp44の基質との結合能は保たれているが,小胞体とゴルジ体とのあいだのpH勾配が消失すると,ERp44のC末端テール領域は閉じた状態でとどまり基質との結合能は大きく減少する.一方,C末端テール領域がつねに開いている状態のERp44変異体は多くの内在性タンパク質と複合体を形成し,そのなかにはERp44の生理的な基質ではないものも含まれると考えられた.しかも,これら複合体の量はGPHRのノックダウンにより減少することはなかった.以上の結果から,ERp44におけるpHに依存的なC末端テール領域の開閉はERp44が生理的な基質を選別するうえでも重要な役割を担っていると解釈することができた.
この研究において,ERp44のpHに依存的な構造変化と,それにもとづく基質との親和性の制御機構,および,それを利用した小胞体における滞留の機構が解明された.この機構はKDEL/RDEL配列をもたない小胞体局在性のタンパク質を小胞体へと逆輸送するだけでなく,高次構造をとらずに小胞体の外へと分泌されたタンパク質を小胞体へ送り返し,完全な高次構造の形成を促進するうえでも重要な意味をもっていた(図2).すなわち,ERp44は小胞体よりさきの分泌段階においてタンパク質の品質管理を行う(さらに下流へと分泌させるか,それとも,小胞体へと逆戻りさせるか,判断する),中心的なプレイヤーと解釈することができた.このように,細胞には二重三重にもわたるタンパク質の厳正な監視機構が存在したのである.残された重要課題は,ERp44がタンパク質の成熟体と未成熟体とをどのような分子機構により認識しているのかについてであり,その意味でも,ERp44と基質タンパク質との複合体の結晶構造解析が待たれるところである.
略歴:九州大学大学院医学系学府博士課程 在学中.
研究テーマ:小胞体ではたらく酸化酵素Ero1と,その細胞における局在を制御するタンパク質ERp44の構造と分子機構.
Roberto Sitia
イタリアSan Raffaele Scientific InstituteにてProfessor.
稲葉 謙次(Kenji Inaba)
東北大学多元物質科学研究所 教授.
© 2013 増井翔史・Roberto Sitia・稲葉謙次 Licensed under CC 表示 2.1 日本
(1九州大学生体防御医学研究所 蛋白質化学分野,2イタリアSan Raffaele Scientific Institute,Divisions of Genetics and Cell Biology)
email:増井翔史
DOI: 10.7875/first.author.2013.075
A pH-regulated quality control cycle for surveillance of secretory protein assembly.
Stefano Vavassori, Margherita Cortini, Shoji Masui, Sara Sannino, Tiziana Anelli, Imma R. Caserta, Claudio Fagioli, Maria F. Mossuto, Arianna Fornili, Eelco van Anken, Massimo Degano, Kenji Inaba, Roberto Sitia
Molecular Cell, 50, 783-792 (2013)
要 約
小胞体は分泌タンパク質や膜タンパク質が立体構造を獲得する場であり,厳正なタンパク質の品質管理機構が存在する.タンパク質の立体構造の形成において重要な役割を担うジスルフィド結合の形成においては,主としてEro1-PDI酸化経路がはたらいている.興味深いことに,Ero1は小胞体において機能する酸化酵素であるにもかかわらず,小胞体局在シグナルをもたない.Ero1の小胞体への局在は,小胞体局在シグナルRDEL配列をもつPDIファミリータンパク質のひとつERp44に依存することが,過去に報告されている.この研究において,筆者らは,小胞体とゴルジ体とのあいだのpH勾配がERp44によるEro1の小胞体への局在において重要な役割をもつことを示した.ERp44のC末端テール領域はpHに依存的に開閉が制御されており,その結果として,ERp44とEro1との親和性が大きく変化することを見い出した.すなわち,pHが弱酸性のゴルジ体ではERp44のC末端テール領域が開くことによりERp44とEro1は強く結合し,小胞体局在シグナルと結合するKDEL受容体とともに,ゴルジ体から小胞体へと逆輸送される.一方,pHが中性の小胞体ではERp44のC末端テール領域は閉じEro1はERp44から解離する.同様の機構により,正しい高次構造を形成していない未成熟の免疫グロブリンやアディポネクチンなどもERp44のはたらきによりゴルジ体から小胞体へと逆輸送され,高次構造を形成するまで分泌が抑制されていた.以上より,筆者らは,小胞体とゴルジ体とのあいだのpH勾配によるERp44を介した新たなタンパク質の品質管理機構を提唱した.
はじめに
小胞体は分泌タンパク質や膜タンパク質が正常な立体構造を獲得する場となるオルガネラである1).小胞体で新規に合成されたタンパク質はEro1-PDI酸化経路(PDI:protein disulfide isomerase,タンパク質ジスルフィドイソメラーゼ)などによるジスルフィド結合の導入や2),カルネキシン/カルレテキュリン回路などによるフォールディングの促進や修復をうける3).正しい立体構造を獲得した新生タンパク質は分泌経路にそってゴルジ体を経由したのち,それぞれ指定の区画へと輸送される.一方,小胞体に局在すべきタンパク質や完全な高次構造をとっていない未成熟なタンパク質は,ゴルジ体へと分泌されてもCOPI被覆小胞を介して小胞体へと逆輸送される4).そのひとつの経路においてPDIファミリータンパク質のメンバーであるERp44は,小胞体へと逆輸送すべきタンパク質を認識し,小胞体局在シグナルと結合するKDEL受容体と結合することにより逆輸送されると報告されている5,6).しかしながら,ERp44がどのような機構により基質となるタンパク質と結合および解離し,また,その機能が制御されているのか,分子構造レベルでの詳細は未解明であった.
1.ERp44の構造的な特徴
ERp44の結晶構造は,2008年に報告された7).ERp44はクローバー状にならんだ3つのチオレドキシン様ドメイン(N末端側から,aドメイン,bドメイン,b’ドメインの順)と,C末端側に存在するテール領域(C末端テール領域)から構成される.aドメインには基質との共有結合にかかわるとされるCys29と,そのまわりに疎水性パッチが存在する.結晶構造においては,C末端テール領域に存在するThr369がaドメインのCys29と水素結合を形成することによりC末端テール領域は閉じた状態にあり,基質となるタンパク質との結合に重要と考えられるCys29および疎水性パッチはおおわれた状態にある(図1).
2.ERp44のpHに依存的なC末端テール領域の開閉
小胞体(pHは,約7.1)とゴルジ体(pHは,約6.7)とのあいだに存在するpH勾配に着目して,ERp44はpHに依存的にC末端テール領域を開閉することにより基質との結合および解離を制御しているという作業仮説をたてて研究を進めた.すなわち,ゴルジ体においてはERp44のC末端テール領域は開き,Cys29とその周辺の疎水性パッチが露出することにより基質と強く結合する.一方,小胞体においてはC末端テール領域が閉じることにより,基質であるEro1はERp44から解離する.この仮説を検証するため,疎水性蛍光プローブであるANSを用いてERp44のpHに依存的なC末端テール領域の開閉の観測を試みた.
ANSは疎水性領域に結合することで,より短波長側に強く蛍光を発するという性質をもつ.ERp44の存在下においてpH 7.5およびpH 6.5にてANSの蛍光スペクトルを観測したところ,pHの低下にともなう蛍光強度の顕著な上昇が観測された.つぎに,C末端テール領域の動きを抑えるため,閉じた状態においてCys29と水素結合することの知られるC末端テール領域のThr369(図1)をCysに変異させ,Cys29とこのCys369をジスルフィド結合させた変異体を作製した.その結果,この変異体はpHに依存的な蛍光強度の変化を示さなかったが,還元剤であるジチオスレイトールによりジスルフィド結合を切断すると,野生型と同様にpHに依存的な蛍光強度の変化が観測された.以上の結果は,pHが酸性側にシフトすることによりC末端テール領域が開き疎水性領域が露出することを示唆した.
ERp44においてC末端テール領域が開くことによるCys29のタンパク質の表面への露出をより直接的に観測するため,システイン修飾試薬であるMal-PEGによるCys29の修飾効率をpH 6~8の範囲で調べた.その結果,pHが8から6に下がるにつれMal-PEGにより修飾されるCys29の割合は大きく増加したことから,酸性側においてCys29はタンパク質の表面に露出することが示唆された.一方,Thr369をCysに変異させたERp44変異体はジスルフィド結合によりC末端テール領域が恒常的に閉じた状態にあるため,pHによらずCys29がMal-PEGにより修飾されることはなかった.以上の2つの結果は,ERp44のpHに依存的なC末端テール領域の開閉による,Cys29およびそのまわりの疎水性領域の露出あるいは遮蔽を強く示唆するものであった.
3.C末端テール領域の開閉によるERp44とKDEL受容体との親和性の制御
興味深いことに,ERp44のpHに依存的なC末端テール領域の開閉は,もうひとつの重要な事象にもかかわっていた.通常,小胞体局在シグナルはタンパク質のC末端側に存在し,ERp44も例外ではない.したがって,ERp44におけるC末端テール領域の開閉はその小胞体局在シグナル(RDEL配列)の動きあるいは認識されやすさにも大きく影響すると予想された.実際に,小胞体局在シグナルと結合するKDEL受容体によるERp44の認識とC末端テール領域の開閉は深くかかわっていた.Thr369をCysに変異させることでC末端テール領域が閉じた状態で固定されたERp44変異体は,RDEL配列を削除したERp44変異体と同じ程度に細胞の外へと漏出した.これに対し,RDEL配列とCys369とのあいだにFLAGタグを挿入することによりRDEL配列の可動域を増加させたERp44変異体は,細胞の外への漏出量が大きく抑制された.つまり,ERp44のC末端テール領域のpHに依存的な開閉は,基質との結合のみならず,KDEL受容体によるRDEL配列の認識されやすさをも制御していた.
4.pHに依存的に制御されるERp44の生理的な機能
小胞体とゴルジ体とのあいだのpH勾配が,細胞においてERp44の生理的な意義を制御しているのかどうか検討した.ゴルジ体膜にはGPHRというCl-チャネルが存在し,ゴルジ体のpHを低下させるはたらきをもつことが報告されている8).RNAi法によりGPHRの発現をノックダウンし,pHへの感受性の高い蛍光タンパク質pHluorinsを用いてpHを測定したところ,ゴルジ体におけるpHは7.0にまで上昇し,小胞体とゴルジ体とのあいだのpH勾配はおおよそ消失した.注目すべきことに,GPHRをノックダウンしたときと通常のときとでERp44によるEro1の分泌の抑制を比較したところ,pH勾配の消失によりEro1の分泌を抑制する効果は劇的に減少した.Ero1にくわえ,ERp44の基質であることの知られるアディポネクチンや免疫グロブリンMサブユニットについても同様の結果であった.一方,ERp44の生理的な基質ではないα1アンチトリプシンや分泌経路に誘導されるsGFPについては,細胞の外への漏出量にほとんど変化はみられなかった.このことは,小胞体とゴルジ体とのあいだのpH勾配がERp44の生理的な機能の発現に深くかかわっていることを意味し,細胞においてもERp44のpHに依存的なC末端テール領域の開閉による機能制御が行われていることが強く示唆された.
5.ERp44によるpHセンシングの分子機構
ERp44のC末端テール領域の開閉はpHにより制御されるという事実は,鍵となるアミノ酸残基のプロトン化および脱プロトン化がその制御に深くかかわることを意味する.そこで,タンパク質におけるアミノ酸残基のpKa値を推定するソフトウェアPROPKA3を用い,ERp44のCys29のpKa値を算出した.その結果,通常はシステイン残基のpKa値は9.0程度であるのに対し,Cys29のpKa値は7.7と見積もられた.実際に,ERp44においてCys29はSer32およびThr369の側鎖や主鎖のカルボニル基と水素結合を形成し,Arg98とも静電相互作用することにより,Cys29のチオレートアニオン状態は安定化されていると考えられた(図1).そこで,ERp44においてCys29と相互作用するアミノ酸残基の変異体を作製し,さきに述べたMal-PEG修飾のアッセイによりC末端テール領域の開閉状態を調べたところ,これらERp44変異体はすべてC末端テール領域がpHに非依存的に開いている状態にあることが判明した.また,C末端テール領域が欠失した状態のERp44におけるCys29のpKa値は8.7と算出された.以上の結果から,ERp44において,pHが中性付近ではCys29がチオレートアニオンとしてまわりのアミノ酸残基と相互作用することによりC末端テール領域は閉じた状態で安定化されるのに対し,弱酸性のpHではCys29がプロトン化することによりまわりのアミノ酸残基との相互作用が崩壊し,C末端テール領域は開くと解釈することができた.
以上の結果にくわえ,Ero1とERp44とのあいだのpHの変化による親和性の変化を表面プラズモン共鳴(surface plasmon resonance:SPR)測定により解析したところ,野生型ERp44ではpHが7.5から6.5に下がるにつれEro1との親和性が約6倍に上昇した.すなわち,ERp44の基質との結合性は顕著なpH依存性を示した.これに対し,C末端テール領域がつねに開いている状態のERp44変異体は,pHに関係なくEro1との強い結合性を示すことがわかった.
C末端テール領域がつねに開いている状態のERp44変異体は,細胞においても野生型ERp44とは大きく異なる性質を示すことが確認された.野生型ERp44は細胞において限られた基質とのみジスルフィド結合を形成して複合体を形成し,しかも,その複合体の量はGPHRのノックダウンにより大きく減少した.すなわち,通常の細胞ではGPHRのはたらきによりゴルジ体のpHは低く保たれERp44の基質との結合能は保たれているが,小胞体とゴルジ体とのあいだのpH勾配が消失すると,ERp44のC末端テール領域は閉じた状態でとどまり基質との結合能は大きく減少する.一方,C末端テール領域がつねに開いている状態のERp44変異体は多くの内在性タンパク質と複合体を形成し,そのなかにはERp44の生理的な基質ではないものも含まれると考えられた.しかも,これら複合体の量はGPHRのノックダウンにより減少することはなかった.以上の結果から,ERp44におけるpHに依存的なC末端テール領域の開閉はERp44が生理的な基質を選別するうえでも重要な役割を担っていると解釈することができた.
おわりに
この研究において,ERp44のpHに依存的な構造変化と,それにもとづく基質との親和性の制御機構,および,それを利用した小胞体における滞留の機構が解明された.この機構はKDEL/RDEL配列をもたない小胞体局在性のタンパク質を小胞体へと逆輸送するだけでなく,高次構造をとらずに小胞体の外へと分泌されたタンパク質を小胞体へ送り返し,完全な高次構造の形成を促進するうえでも重要な意味をもっていた(図2).すなわち,ERp44は小胞体よりさきの分泌段階においてタンパク質の品質管理を行う(さらに下流へと分泌させるか,それとも,小胞体へと逆戻りさせるか,判断する),中心的なプレイヤーと解釈することができた.このように,細胞には二重三重にもわたるタンパク質の厳正な監視機構が存在したのである.残された重要課題は,ERp44がタンパク質の成熟体と未成熟体とをどのような分子機構により認識しているのかについてであり,その意味でも,ERp44と基質タンパク質との複合体の結晶構造解析が待たれるところである.
文 献
- Hurtley, S. M. & Helenius, A.: Protein oligomerization in the endoplasmic reticulum. Annu. Rev. Cell Biol., 5, 277-307 (1989)[PubMed]
- Araki, K. & Inaba, K.: Structure, mechanism and evolution of Ero1 family enzymes. Antioxid. Redox Signal., 16, 790-799 (2012)[PubMed]
- Ellgaard, L. & Helenius, A.: Quality control in the endoplasmic reticulum. Nat. Rev. Mol. Cell Biol., 4, 181-191 (2003)[PubMed]
- Munro, S. & Pelham, H. R. B.: A C-terminal signal prevents secretion of luminal ER proteins. Cell, 48, 899-907 (1987)[PubMed]
- Anelli, T., Alessio, M., Bachi A. et al.: Thiol-mediated protein retention in the endoplasmic reticulum: the role of ERp44. EMBO J., 22, 5015-5022 (2003)[PubMed]
- Anelli, T., Ceppi, S., Bergamelli, L. et al.: Sequential steps and checkpoints in the early exocytic compartment during sevretory IgM biogenesis. EMBO J., 26, 4177-4188 (2007)[PubMed]
- Wang, L., Vavassori, S., Li, S. et al.: Crystal structure of human ERp44 shows a dynamic functional modulation by its carboxy-terminal tail. EMBO Rep., 9, 642-647 (2008)[PubMed]
- Maeda, Y., Ide, T., Koike, L. et al.: GPHR is a novel anion channel critical for acidification and functions of the Golgi apparatus. Nat. Cell Biol., 10, 1135-1145 (2008)[PubMed]
著者プロフィール
略歴:九州大学大学院医学系学府博士課程 在学中.
研究テーマ:小胞体ではたらく酸化酵素Ero1と,その細胞における局在を制御するタンパク質ERp44の構造と分子機構.
Roberto Sitia
イタリアSan Raffaele Scientific InstituteにてProfessor.
稲葉 謙次(Kenji Inaba)
東北大学多元物質科学研究所 教授.
© 2013 増井翔史・Roberto Sitia・稲葉謙次 Licensed under CC 表示 2.1 日本