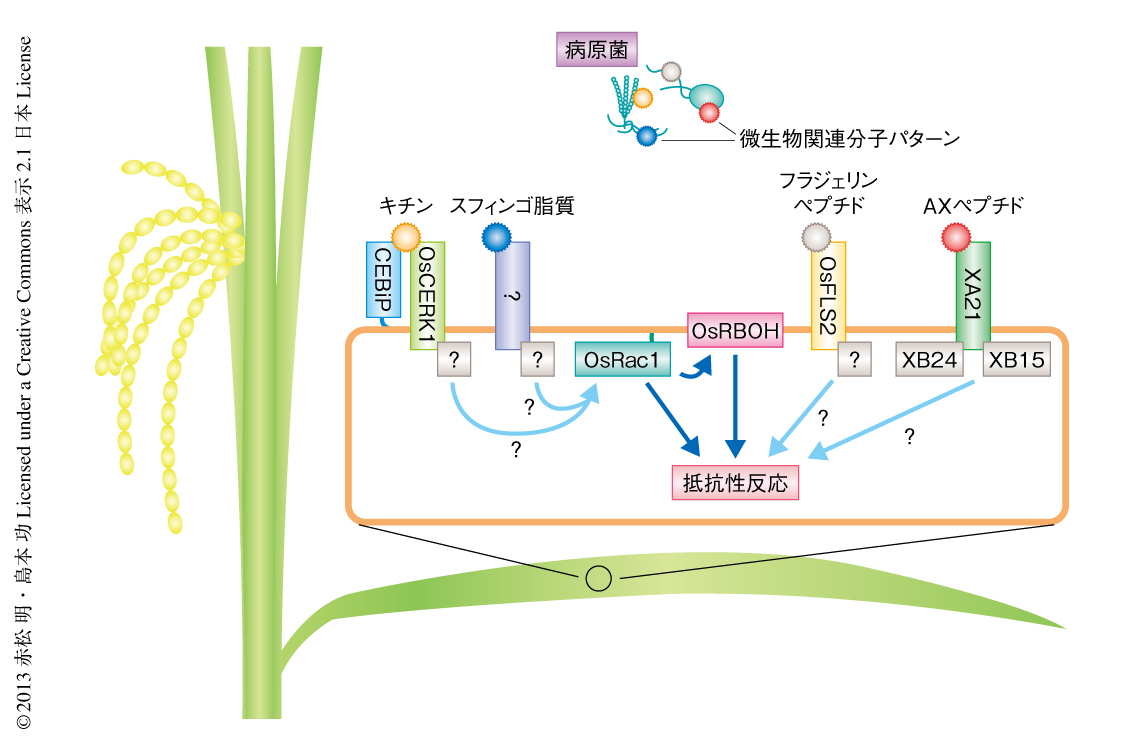
キチンにより誘導されるイネの免疫応答は受容体型キナーゼとキチン結合タンパク質との複合体,GEF,低分子量Gタンパク質からなるモジュールにより制御される
赤松 明・島本 功
(奈良先端科学技術大学院大学バイオサイエンス研究科 植物分子遺伝学研究室)
email:赤松 明
DOI: 10.7875/first.author.2013.057
An OsCEBiP/OsCERK1-OsRacGEF1-OsRac1 module is an essential early component of chitin-induced rice immunity.
Akira Akamatsu, Hann Lin Wong, Masayuki Fujiwara, Jun Okuda, Keita Nishide, Kazumi Uno, Keiko Imai, Kenji Umemura, Tsutomu Kawasaki, Yoji Kawano, Ko Shimamoto
Cell Host & Microbe, 13, 465-476 (2013)
植物の細胞膜には病原菌の感染を認識するための多数の受容体型キナーゼが存在する.受容体型キナーゼであるOsCERK1と,真菌の細胞壁を構成するキチンと結合するタンパク質OsCEBiPは,細胞膜において複合体を形成しキチンを認識する.しかしながら,認識ののち細胞内において起こるシグナル伝達機構は明らかにされていない.筆者らは,イネにおいて,キチンにより細胞膜にて低分子量Gタンパク質であるOsRac1が非常にすばやく活性化されることを時空間的な解析から見い出した.また,このOsRac1の活性化はGEFであるOsRacGEF1によることを明らかにした.OsRacGEF1はOsCERK1の細胞内ドメインと相互作用しており,キチンの刺激に依存してその549番目のセリン残基がリン酸化された.OsRacGEF1はこのリン酸化により活性化され,OsRac1の活性化を促すことが明らかになった.さらに,OsCERK1とOsRacGEF1を含むタンパク質複合体が小胞体から細胞膜まで小胞輸送されていることが示され,細胞膜においてOsRac1をくわえたOsCERK1-OsRacGEF1-OsRac1複合体が形成されていることが示唆された.これまでの知見とあわせると,イネの細胞膜においては,受容体型キナーゼとキチン結合タンパク質との複合体,GEF,低分子量Gタンパク質からなるモジュールが機能することが重要であると考えられた.
植物は自然環境に存在する無数の病原菌の脅威につねにさらされている.植物が病原菌に対抗するため基本となる戦略は,微生物関連分子パターン誘導性免疫(MAMP-triggered immunity:MTI)である1).これは,微生物関連分子パターン(microbe-associated molecular pattern:MAMP)とよばれる病原菌の細胞表層に普遍的に存在する非特異的な分子を,植物が細胞膜に存在する受容体により認識することでひき起こす抵抗性であり,活性酸素種の産生,抵抗性関連遺伝子の発現,抗菌性物質ファイトアレキシンの産生などをひき起こす.キチンはこれまでもっとも研究されている微生物関連分子パターンのひとつである.イネにおけるキチンの認識には,LysMモチーフをもつ細胞膜タンパク質OsCEBiPと,受容体型キナーゼOsCERK1が不可欠である2,3).OsCEBiPはキチンと直接に結合する受容体であるが,細胞内にドメインをもたない.一方で,OsCERK1はキチンと結合する能力はないが,細胞内にキナーゼドメインをもつ.そのため,これら2つのタンパク質が細胞膜において協調してキチンの受容を行っていると考えられている.しかしながら,これら受容体が細胞内にシグナルを伝達する分子機構はこれまで明らかにされていなかった.
筆者らは,これまでに,Rac/Rop型の低分子量Gタンパク質OsRac1がイネの免疫応答における重要なスイッチタンパク質であることを明らかにしてきた(図1).恒常的活性型OsRac1を過剰発現するイネは親和性イネいもち病菌に対し強い抵抗性を示し,キチンやスフィンゴ脂質といった微生物関連分子パターンを処理すると野生型のイネと比べ活性酸素種の産生量が増加する.このことは,OsRac1が微生物関連分子パターン誘導性免疫機構に関与していることを示唆する4).また,これまで,OsRac1の下流においてはNADPHオキシダーゼであるOsRBOHや,植物の細胞壁の主要な構成成分であるリグニンの合成酵素であるCCR1が機能することなどが明らかになっている5,6).このように,OsRac1によりさまざまな下流のタンパク質が制御されることで病原菌に対する抵抗性が成立している.しかしながら,これまでOsRac1の活性化を制御する活性化タンパク質の存在は明らかにされていない.そこで,今回の研究では,微生物関連分子パターン誘導性免疫機構におけるOsRac1の活性化制御機構を明らかにすることにより,OsCERK1が細胞内にシグナルを伝達する分子機構を解析した.
微生物関連分子パターンのシグナルによりOsRac1が活性化されるかどうかを検証するため,FRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)を利用した生体内センサーRaichu-OsRac1を使用した7).このセンサーはOsRac1がGTPと結合しているときより強くFRETを生じるもので,これをイネ培養細胞のプロトプラストに一過的に発現させた.Raichu-OsRac1を発現したイネ培養細胞にキチンを処理すると,3分以内にFRET値の上昇することが観察された.この結果は,微生物関連分子パターンの受容ののち3分以内に,OsRac1が細胞膜においてGDP型からGTP型へと変換され活性化していることを示唆した.また,キチン以外の微生物関連分子パターンではどのような反応を示すか検証するため,微生物関連分子パターンの一種として同定されているイネいもち病菌に由来するスフィンゴ脂質を処理し同様の解析を行ったところ,キチンを処理した場合とほぼ同様の結果が得られた.以上の結果から,イネの細胞では病原菌に感染した際,病原菌のもつ微生物関連分子パターンにより細胞膜においてOsRac1が急速に活性化されていると考えられた.
OsRac1が活性化されるまでの経路を明らかにするためにも,OsRac1を直接的に活性化するGEF(guanine nucleotide exchange factor,グアニンヌクレオチド変換因子)を探索することが必要であった.そのために,OsRac1を用いた酵母ツーハイブリットスクリーニングを行った.その結果,植物に特異的に存在するPRONE型のGEFが相互作用タンパク質として同定され,これをOsRacGEF1と名づけた.BiFC(bimolecular fluorescence complementation,2分子蛍光相補)法による解析,および,プルダウン解析から,OsRacGEF1はOsRac1の活性化の状態に左右されることなくOsRac1と結合していることが明らかになった.また,FRETセンサーRaichu-OsRac1を用いた解析や生化学的な解析から,OsRacGEF1は細胞膜においてOsRac1を直接に活性化するタンパク質であることも示された.イネの重要な病害となっているイネいもち病菌の感染に対する抵抗性においてOsRacGEF1が機能するかどうか検証するため,RNAi法によりOsRacGEF1の発現を抑制したイネを作出した.それらに対し,イネいもち病菌を感染させると,野生型のイネよりも大きな病斑とイネいもち病菌の増殖が観察された.これらの結果は,OsRacGEF1の発現を抑制したイネではイネいもち病菌に対する抵抗性が低下していることを示した.以上のことから,イネの微生物関連分子パターン誘導性免疫機構では,OsRacGEF1によりOsRac1が活性化されていると考えられた.
PRONE型のGEFはリン酸化によりその活性が制御されていることが報告されていた8).そこで,まずOsRacGEF1とOsCERK1との相互作用を共免疫沈降法およびBiFC法により検証した.その結果,これらが細胞膜および小胞体において相互作用していることが示された.さらに,FRETセンサーを用いた解析から,OsRacGEF1の549番目のSerをAlaに置換した疑似リン酸化変異体は,野生型OsRacGEF1よりもOsRac1を強く活性化することが示された.また,この549番目のSerのリン酸化がイネいもち病菌に対する抵抗性に必要であるかどうか検証するため,この疑似リン酸化変異OsRacGEF1を過剰発現するイネを作出しイネいもち病菌を感染させたところ,野生型のイネよりも大きな病斑とイネいもち病菌の増殖が観察され,抵抗性の低下することが示された.この結果は,この疑似リン酸化変異OsRacGEF1が内在性のOsRacGEF1に対しドミナントに機能したためであると思われた.キチンに依存的にOsRacGEF1の549番目のSerがリン酸化されているかどうかを検証するため,キチンにより処理したイネの細胞からタンパク質を抽出し質量分析によりリン酸化の有無を調べた.その結果,OsRacGEF1の549番目のSerのリン酸化のみが検出された.つぎに,このキチンに依存的なリン酸化をひき起こすキナーゼを明らかにしようとした.イネにおいてキチンの受容体を構成する受容体型キナーゼOsCERK1は細胞内に機能的なキナーゼドメインをもつ2).大腸菌に発現させ精製したOsCERK1のキナーゼドメインとOsRacGEF1を用いてリン酸化解析を行った.その結果,OsCERK1の基質はOsRacGEF1であることが明らかになった.以上の結果から,OsRacGEF1はOsCERK1のもつ細胞内キナーゼドメインにより活性が制御されていると考えられた.
さらに,OsCERK1以外の受容体型キナーゼがOsRacGEF1を制御しているかどうかを検証するため,OsRacGEF1とイネのフラジェリン受容体OsFLS2および白葉枯れ病菌に由来するペプチドの受容体であるXA21との相互作用解析を行った.その結果,OsRacGEF1はOsFLS2と結合することが示された.
さきに述べたOsRacGEF1とOsCERK1を用いたBiFC法による解析の結果,BiFCのシグナルは細胞膜および小胞体に局在することが示された.そのため,OsRacGEF1とOsCERK1とは小胞体において相互作用し,そののち,複合体として細胞膜まで輸送されていることが予想された.これまでの報告から,OsCERK1は小胞体においてHsp90およびHop/Stiと相互作用し,複合体として細胞膜まで輸送されることが示唆されている9).そこで,OsRacGEF1およびOsRac1も同様の複合体に含まれるかどうか検証した.シロイヌナズナAtSar1の恒常的活性化型変異体は小胞体からゴルジ体への小胞輸送を阻害することが知られている10).蛍光タンパク質によりそれぞれ標識したOsRacGEF1,OsCERK1,OsRac1をそれぞれ発現するイネOc細胞のプロトプラストに恒常的活性化型変異AtSar1を共発現させた.その結果,OsRacGEF1およびOsCERK1の細胞膜における局在は減少し小胞体において多く観察されるようになった.このことから,OsRacGEF1およびOsCERK1は小胞輸送により小胞体から細胞膜まで輸送されていることが示唆された.
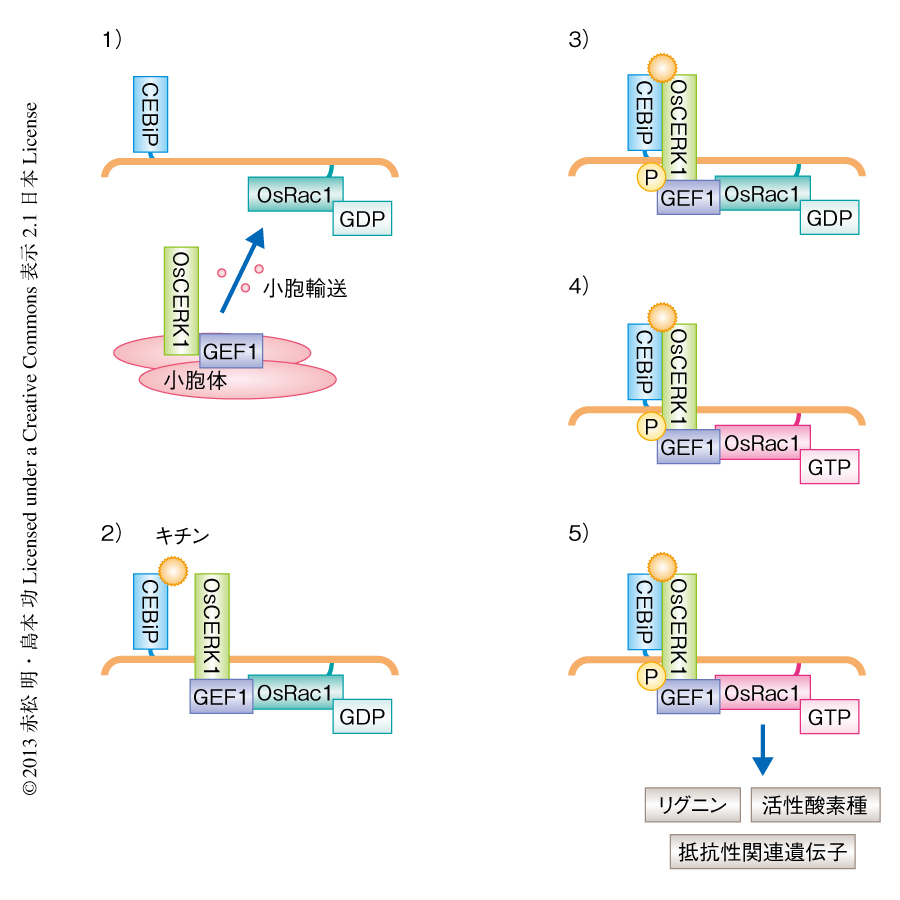
この研究はOsRac1の活性化タンパク質を探索するところからスタートし,OsRac1の上流における活性化経路を明らかにすることにより受容体型キナーゼのシグナル伝達機構を明らかにしようとした.その結果,つぎのような経路が明らかになった(図2).1)イネの細胞内では小胞体においてOsCERK1およびOsRacGEF1を含む複合体が形成され,細胞膜まで小胞輸送される.2)細胞膜においてOsRac1を含む複合体が形成される.3)OsCEBiPとOsCERK1からなる複合体がキチンを認識すると,OsCERK1のもつ細胞内キナーゼドメインがOsRacGEF1をリン酸化する.4)リン酸化により活性化されたOsRacGEF1はOsRac1をGTP結合型に変換し活性化する.5)活性化されたOsRac1はさまざまな下流のタンパク質と相互作用しあってシグナルを伝達し,イネの微生物関連分子パターン誘導性免疫機構が開始される.さらに,この研究から,スフィンゴ脂質によりOsRac1が活性化されることや,OsRacGEF1はフラジェリン受容体であるOsFLS2とも相互作用することが示された.そのため,この受容体型キナーゼとキチン結合タンパク質との複合体,GEF,低分子量Gタンパク質からなるモジュールは,構成タンパク質を変えることによりさまざまな微生物関連分子パターンに対応していると考えられた.
今回の研究において,OsRac1の活性化のようすを時空間的に明らかにするためFRETセンサーであるRaichuを用いた.Raichuは動物においては頻繁にRasタンパク質の活性化の挙動を明らかにしてきたが,植物での使用例はなかった.筆者らは,RaichuをOsRac1用に改変しイネでの使用を試みた.使用を開始した当初は安定したFRET値を得ることが困難であったが,たびかさなる条件検討の結果から安定した結果を得ることができるようになった.今後は,培養細胞だけではなく植物体における使用や,ほかの植物種での使用を目標にしたいと考えている.
最後に,最近,受容体様細胞質キナーゼであるOsRLCK185がOsCERK1により直接にリン酸化されるというたいへん興味深い報告がなされた11)(新着論文レビュー でも掲載).このOsRLCK185はMAPキナーゼカスケードにシグナルを伝達する.このことから,イネにおいてはOsCERK1の下流には少なくとも2つの経路が存在していると考えられる.これらの経路の相互作用の詳細を明らかにすることができれば,イネの微生物関連分子パターン誘導性免疫機構の解明がまた一歩進むと考えられる.
略歴:2013年 奈良先端科学技術大学院大学バイオサイエンス研究科博士課程 修了,同年より同 博士研究員.
研究テーマ:植物における低分子量Gタンパク質の機能解析.
島本 功(Ko Shimamoto)
奈良先端科学技術大学院大学バイオサイエンス研究科 教授.
研究室URL:http://bsw3.naist.jp/simamoto/simamoto.html
© 2013 赤松 明・島本 功 Licensed under CC 表示 2.1 日本
(奈良先端科学技術大学院大学バイオサイエンス研究科 植物分子遺伝学研究室)
email:赤松 明
DOI: 10.7875/first.author.2013.057
An OsCEBiP/OsCERK1-OsRacGEF1-OsRac1 module is an essential early component of chitin-induced rice immunity.
Akira Akamatsu, Hann Lin Wong, Masayuki Fujiwara, Jun Okuda, Keita Nishide, Kazumi Uno, Keiko Imai, Kenji Umemura, Tsutomu Kawasaki, Yoji Kawano, Ko Shimamoto
Cell Host & Microbe, 13, 465-476 (2013)
要 約
植物の細胞膜には病原菌の感染を認識するための多数の受容体型キナーゼが存在する.受容体型キナーゼであるOsCERK1と,真菌の細胞壁を構成するキチンと結合するタンパク質OsCEBiPは,細胞膜において複合体を形成しキチンを認識する.しかしながら,認識ののち細胞内において起こるシグナル伝達機構は明らかにされていない.筆者らは,イネにおいて,キチンにより細胞膜にて低分子量Gタンパク質であるOsRac1が非常にすばやく活性化されることを時空間的な解析から見い出した.また,このOsRac1の活性化はGEFであるOsRacGEF1によることを明らかにした.OsRacGEF1はOsCERK1の細胞内ドメインと相互作用しており,キチンの刺激に依存してその549番目のセリン残基がリン酸化された.OsRacGEF1はこのリン酸化により活性化され,OsRac1の活性化を促すことが明らかになった.さらに,OsCERK1とOsRacGEF1を含むタンパク質複合体が小胞体から細胞膜まで小胞輸送されていることが示され,細胞膜においてOsRac1をくわえたOsCERK1-OsRacGEF1-OsRac1複合体が形成されていることが示唆された.これまでの知見とあわせると,イネの細胞膜においては,受容体型キナーゼとキチン結合タンパク質との複合体,GEF,低分子量Gタンパク質からなるモジュールが機能することが重要であると考えられた.
はじめに
植物は自然環境に存在する無数の病原菌の脅威につねにさらされている.植物が病原菌に対抗するため基本となる戦略は,微生物関連分子パターン誘導性免疫(MAMP-triggered immunity:MTI)である1).これは,微生物関連分子パターン(microbe-associated molecular pattern:MAMP)とよばれる病原菌の細胞表層に普遍的に存在する非特異的な分子を,植物が細胞膜に存在する受容体により認識することでひき起こす抵抗性であり,活性酸素種の産生,抵抗性関連遺伝子の発現,抗菌性物質ファイトアレキシンの産生などをひき起こす.キチンはこれまでもっとも研究されている微生物関連分子パターンのひとつである.イネにおけるキチンの認識には,LysMモチーフをもつ細胞膜タンパク質OsCEBiPと,受容体型キナーゼOsCERK1が不可欠である2,3).OsCEBiPはキチンと直接に結合する受容体であるが,細胞内にドメインをもたない.一方で,OsCERK1はキチンと結合する能力はないが,細胞内にキナーゼドメインをもつ.そのため,これら2つのタンパク質が細胞膜において協調してキチンの受容を行っていると考えられている.しかしながら,これら受容体が細胞内にシグナルを伝達する分子機構はこれまで明らかにされていなかった.
筆者らは,これまでに,Rac/Rop型の低分子量Gタンパク質OsRac1がイネの免疫応答における重要なスイッチタンパク質であることを明らかにしてきた(図1).恒常的活性型OsRac1を過剰発現するイネは親和性イネいもち病菌に対し強い抵抗性を示し,キチンやスフィンゴ脂質といった微生物関連分子パターンを処理すると野生型のイネと比べ活性酸素種の産生量が増加する.このことは,OsRac1が微生物関連分子パターン誘導性免疫機構に関与していることを示唆する4).また,これまで,OsRac1の下流においてはNADPHオキシダーゼであるOsRBOHや,植物の細胞壁の主要な構成成分であるリグニンの合成酵素であるCCR1が機能することなどが明らかになっている5,6).このように,OsRac1によりさまざまな下流のタンパク質が制御されることで病原菌に対する抵抗性が成立している.しかしながら,これまでOsRac1の活性化を制御する活性化タンパク質の存在は明らかにされていない.そこで,今回の研究では,微生物関連分子パターン誘導性免疫機構におけるOsRac1の活性化制御機構を明らかにすることにより,OsCERK1が細胞内にシグナルを伝達する分子機構を解析した.
1.微生物関連分子パターンは細胞膜においてOsRac1の活性化を非常にすばやく誘導する
微生物関連分子パターンのシグナルによりOsRac1が活性化されるかどうかを検証するため,FRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)を利用した生体内センサーRaichu-OsRac1を使用した7).このセンサーはOsRac1がGTPと結合しているときより強くFRETを生じるもので,これをイネ培養細胞のプロトプラストに一過的に発現させた.Raichu-OsRac1を発現したイネ培養細胞にキチンを処理すると,3分以内にFRET値の上昇することが観察された.この結果は,微生物関連分子パターンの受容ののち3分以内に,OsRac1が細胞膜においてGDP型からGTP型へと変換され活性化していることを示唆した.また,キチン以外の微生物関連分子パターンではどのような反応を示すか検証するため,微生物関連分子パターンの一種として同定されているイネいもち病菌に由来するスフィンゴ脂質を処理し同様の解析を行ったところ,キチンを処理した場合とほぼ同様の結果が得られた.以上の結果から,イネの細胞では病原菌に感染した際,病原菌のもつ微生物関連分子パターンにより細胞膜においてOsRac1が急速に活性化されていると考えられた.
2.微生物関連分子パターン誘導性免疫機構においてOsRacGEF1がOsRac1の活性化を制御する
OsRac1が活性化されるまでの経路を明らかにするためにも,OsRac1を直接的に活性化するGEF(guanine nucleotide exchange factor,グアニンヌクレオチド変換因子)を探索することが必要であった.そのために,OsRac1を用いた酵母ツーハイブリットスクリーニングを行った.その結果,植物に特異的に存在するPRONE型のGEFが相互作用タンパク質として同定され,これをOsRacGEF1と名づけた.BiFC(bimolecular fluorescence complementation,2分子蛍光相補)法による解析,および,プルダウン解析から,OsRacGEF1はOsRac1の活性化の状態に左右されることなくOsRac1と結合していることが明らかになった.また,FRETセンサーRaichu-OsRac1を用いた解析や生化学的な解析から,OsRacGEF1は細胞膜においてOsRac1を直接に活性化するタンパク質であることも示された.イネの重要な病害となっているイネいもち病菌の感染に対する抵抗性においてOsRacGEF1が機能するかどうか検証するため,RNAi法によりOsRacGEF1の発現を抑制したイネを作出した.それらに対し,イネいもち病菌を感染させると,野生型のイネよりも大きな病斑とイネいもち病菌の増殖が観察された.これらの結果は,OsRacGEF1の発現を抑制したイネではイネいもち病菌に対する抵抗性が低下していることを示した.以上のことから,イネの微生物関連分子パターン誘導性免疫機構では,OsRacGEF1によりOsRac1が活性化されていると考えられた.
3.OsRacGEF1はOsCERK1によりリン酸化され活性化する
PRONE型のGEFはリン酸化によりその活性が制御されていることが報告されていた8).そこで,まずOsRacGEF1とOsCERK1との相互作用を共免疫沈降法およびBiFC法により検証した.その結果,これらが細胞膜および小胞体において相互作用していることが示された.さらに,FRETセンサーを用いた解析から,OsRacGEF1の549番目のSerをAlaに置換した疑似リン酸化変異体は,野生型OsRacGEF1よりもOsRac1を強く活性化することが示された.また,この549番目のSerのリン酸化がイネいもち病菌に対する抵抗性に必要であるかどうか検証するため,この疑似リン酸化変異OsRacGEF1を過剰発現するイネを作出しイネいもち病菌を感染させたところ,野生型のイネよりも大きな病斑とイネいもち病菌の増殖が観察され,抵抗性の低下することが示された.この結果は,この疑似リン酸化変異OsRacGEF1が内在性のOsRacGEF1に対しドミナントに機能したためであると思われた.キチンに依存的にOsRacGEF1の549番目のSerがリン酸化されているかどうかを検証するため,キチンにより処理したイネの細胞からタンパク質を抽出し質量分析によりリン酸化の有無を調べた.その結果,OsRacGEF1の549番目のSerのリン酸化のみが検出された.つぎに,このキチンに依存的なリン酸化をひき起こすキナーゼを明らかにしようとした.イネにおいてキチンの受容体を構成する受容体型キナーゼOsCERK1は細胞内に機能的なキナーゼドメインをもつ2).大腸菌に発現させ精製したOsCERK1のキナーゼドメインとOsRacGEF1を用いてリン酸化解析を行った.その結果,OsCERK1の基質はOsRacGEF1であることが明らかになった.以上の結果から,OsRacGEF1はOsCERK1のもつ細胞内キナーゼドメインにより活性が制御されていると考えられた.
さらに,OsCERK1以外の受容体型キナーゼがOsRacGEF1を制御しているかどうかを検証するため,OsRacGEF1とイネのフラジェリン受容体OsFLS2および白葉枯れ病菌に由来するペプチドの受容体であるXA21との相互作用解析を行った.その結果,OsRacGEF1はOsFLS2と結合することが示された.
4.OsRacGEF1はOsCERK1とともに小胞体から細胞膜まで輸送される
さきに述べたOsRacGEF1とOsCERK1を用いたBiFC法による解析の結果,BiFCのシグナルは細胞膜および小胞体に局在することが示された.そのため,OsRacGEF1とOsCERK1とは小胞体において相互作用し,そののち,複合体として細胞膜まで輸送されていることが予想された.これまでの報告から,OsCERK1は小胞体においてHsp90およびHop/Stiと相互作用し,複合体として細胞膜まで輸送されることが示唆されている9).そこで,OsRacGEF1およびOsRac1も同様の複合体に含まれるかどうか検証した.シロイヌナズナAtSar1の恒常的活性化型変異体は小胞体からゴルジ体への小胞輸送を阻害することが知られている10).蛍光タンパク質によりそれぞれ標識したOsRacGEF1,OsCERK1,OsRac1をそれぞれ発現するイネOc細胞のプロトプラストに恒常的活性化型変異AtSar1を共発現させた.その結果,OsRacGEF1およびOsCERK1の細胞膜における局在は減少し小胞体において多く観察されるようになった.このことから,OsRacGEF1およびOsCERK1は小胞輸送により小胞体から細胞膜まで輸送されていることが示唆された.
おわりに
この研究はOsRac1の活性化タンパク質を探索するところからスタートし,OsRac1の上流における活性化経路を明らかにすることにより受容体型キナーゼのシグナル伝達機構を明らかにしようとした.その結果,つぎのような経路が明らかになった(図2).1)イネの細胞内では小胞体においてOsCERK1およびOsRacGEF1を含む複合体が形成され,細胞膜まで小胞輸送される.2)細胞膜においてOsRac1を含む複合体が形成される.3)OsCEBiPとOsCERK1からなる複合体がキチンを認識すると,OsCERK1のもつ細胞内キナーゼドメインがOsRacGEF1をリン酸化する.4)リン酸化により活性化されたOsRacGEF1はOsRac1をGTP結合型に変換し活性化する.5)活性化されたOsRac1はさまざまな下流のタンパク質と相互作用しあってシグナルを伝達し,イネの微生物関連分子パターン誘導性免疫機構が開始される.さらに,この研究から,スフィンゴ脂質によりOsRac1が活性化されることや,OsRacGEF1はフラジェリン受容体であるOsFLS2とも相互作用することが示された.そのため,この受容体型キナーゼとキチン結合タンパク質との複合体,GEF,低分子量Gタンパク質からなるモジュールは,構成タンパク質を変えることによりさまざまな微生物関連分子パターンに対応していると考えられた.
今回の研究において,OsRac1の活性化のようすを時空間的に明らかにするためFRETセンサーであるRaichuを用いた.Raichuは動物においては頻繁にRasタンパク質の活性化の挙動を明らかにしてきたが,植物での使用例はなかった.筆者らは,RaichuをOsRac1用に改変しイネでの使用を試みた.使用を開始した当初は安定したFRET値を得ることが困難であったが,たびかさなる条件検討の結果から安定した結果を得ることができるようになった.今後は,培養細胞だけではなく植物体における使用や,ほかの植物種での使用を目標にしたいと考えている.
最後に,最近,受容体様細胞質キナーゼであるOsRLCK185がOsCERK1により直接にリン酸化されるというたいへん興味深い報告がなされた11)(新着論文レビュー でも掲載).このOsRLCK185はMAPキナーゼカスケードにシグナルを伝達する.このことから,イネにおいてはOsCERK1の下流には少なくとも2つの経路が存在していると考えられる.これらの経路の相互作用の詳細を明らかにすることができれば,イネの微生物関連分子パターン誘導性免疫機構の解明がまた一歩進むと考えられる.
文 献
- Jones, J. D. & Dangl, J. L.: The plant immune system. Nature, 444, 323-329 (2006)[PubMed]
- Shimizu, T., Nakano, T., Takamizawa, D. et al.: Two LysM receptor molecules, CEBiP and OsCERK1, cooperatively regulate chitin elicitor signaling in rice. Plant J., 64, 204-214 (2010)[PubMed]
- Kaku, H., Nishizawa, Y., Ishii-Minami, N. et al.: Plant cells recognize chitin fragments for defense signaling through a plasma membrane receptor. Proc. Natl. Acad. Sci. USA, 103, 11086-11091 (2006)[PubMed]
- Ono, E., Wong, H. L., Kawasaki, T. et al.: Essential role of the small GTPase Rac in disease resistance of rice. Proc. Natl. Acad. Sci. USA, 98, 759-764 (2001)[PubMed]
- Wong, H. L., Pinontoan, R., Hayashi, K. et al.: Regulation of rice NADPH oxidase by binding of Rac GTPase to its N-terminal extension. Plant Cell, 19, 4022-4034 (2007)[PubMed]
- Kawasaki, T., Koita, H., Nakatsubo, T. et al.: Cinnamoyl-CoA reductase, a key enzyme in lignin biosynthesis, is an effector of small GTPase Rac in defense signaling in rice. Proc. Natl. Acad. Sci. USA, 103, 230-235 (2006)[PubMed]
- Kawano, Y., Akamatsu, A., Hayashi, K. et al.: Activation of a Rac GTPase by the NLR family disease resistance protein Pit plays a critical role in rice innate immunity. Cell Host Microbe, 7, 362-375 (2010)[PubMed]
- Zhang, Y. & McCormick, S.: A distinct mechanism regulating a pollen-specific guanine nucleotide exchange factor for the small GTPase Rop in Arabidopsis thaliana. Proc. Natl. Acad. Sci. USA, 104, 18830-18835 (2007)[PubMed]
- Chen, L., Hamada, S., Fujiwara, M. et al.: The Hop/Sti1-Hsp90 chaperone complex facilitates the maturation and transport of a PAMP receptor in rice innate immunity. Cell Host Microbe, 7, 185-196 (2010)[PubMed]
- Takeuchi, M., Ueda, T., Sato, K. et al.: A dominant negative mutant of sar1 GTPase inhibits protein transport from the endoplasmic reticulum to the Golgi apparatus in tobacco and Arabidopsis cultured cells. Plant J., 23, 517-525 (2000)[PubMed]
- Yamaguchi, K., Yamada, K., Ishikawa, K. et al.: A receptor-like cytoplasmic kinase targeted by a plant pathogen effector is directly phosphorylated by the chitin receptor and mediates rice immunity. Cell Host Microbe, 13, 347-357 (2013)[PubMed ] [新着論文レビュー]
著者プロフィール
略歴:2013年 奈良先端科学技術大学院大学バイオサイエンス研究科博士課程 修了,同年より同 博士研究員.
研究テーマ:植物における低分子量Gタンパク質の機能解析.
島本 功(Ko Shimamoto)
奈良先端科学技術大学院大学バイオサイエンス研究科 教授.
研究室URL:http://bsw3.naist.jp/simamoto/simamoto.html
© 2013 赤松 明・島本 功 Licensed under CC 表示 2.1 日本