ジスルフィド結合スキャン法によるβバレル型膜タンパク質のβストランドのアライメントおよびフォールディング中間体の解析
佐藤健大・Arthur E. Johnson
(米国Texas A&M Health Science Center,Department of Molecular and Cellular Medicine)
email:佐藤健大
DOI: 10.7875/first.author.2013.058
Disulfide-bond scanning reveals assembly state and β-strand tilt angle of the PFO β-barrel.
Takehiro K. Sato, Rodney K. Tweten, Arthur E. Johnson
Nature Chemical Biology, 9, 383-389 (2013)
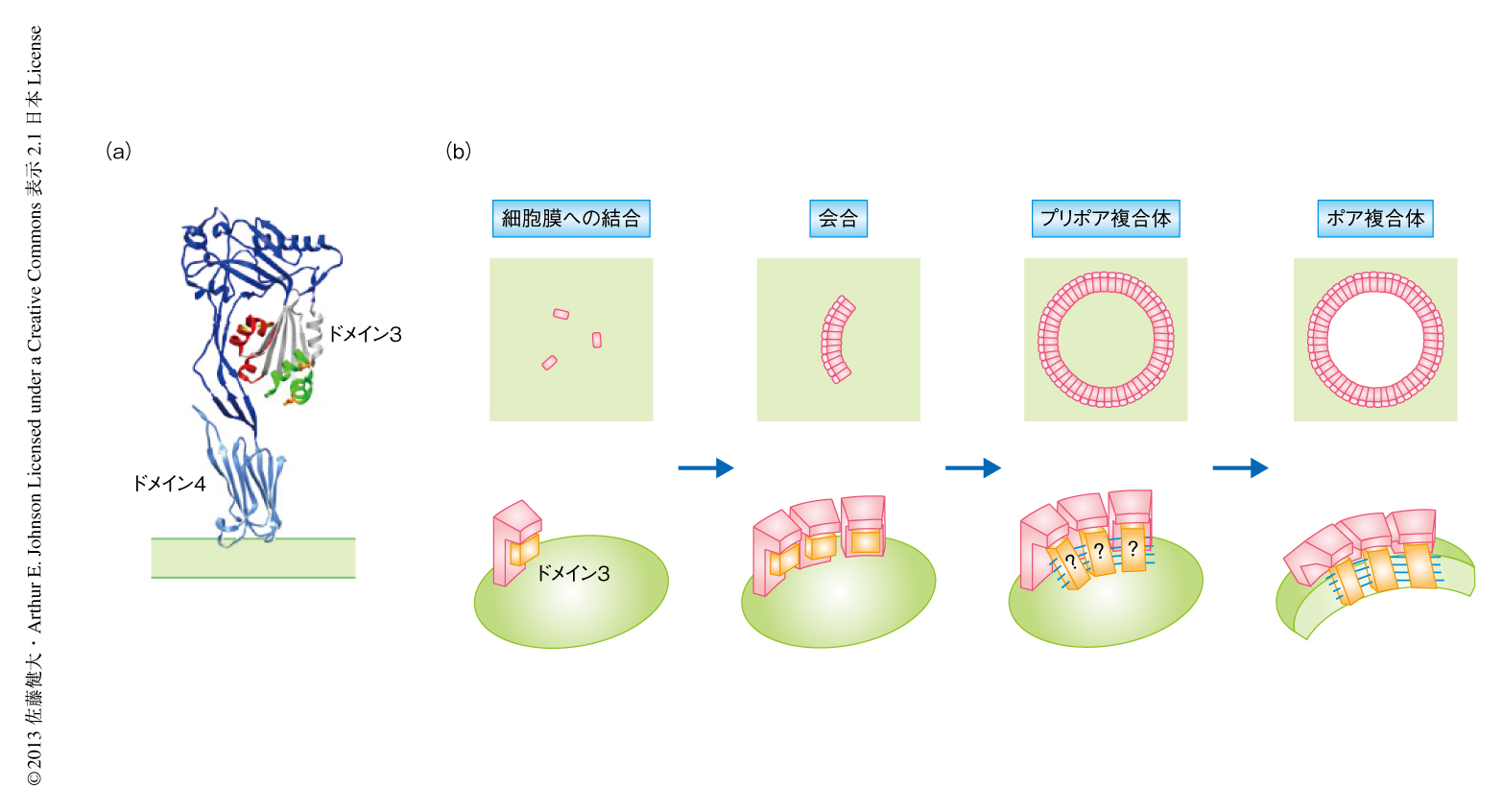
パーフリンゴライシンOはコレステロール依存性細胞溶解毒素ファミリーに属し,コレステロールを含む細胞膜に結合し約35量体からなるプリポア複合体を形成したのち,ポア複合体として直径約250Åのβバレル型の膜孔を細胞膜に形成する.パーフリンゴライシンOは可溶性の単量体においてドメイン3に3つの短いヘリックスからなるヘリックスバンドルを2つもつが,これらはβバレル型の膜孔の形成のとき2組のβヘアピン構造へと変換される.今回,筆者らは,βストランドのあいだに形成されるジスルフィド結合を利用したジスルフィド結合スキャン法により,βストランドは厳密に制御されて整列し20度の傾きをもってβバレル構造を形成していることを明らかにした.低温のもとで得られるプリポア複合体ではパーフリンゴライシンOのドメイン3のもつヘリックスバンドルはほどかれ,となりのパーフリンゴライシンOのほどけたヘリックスバンドルと遷移的に接触していた.これは,中間体においてβストランドはまだ整列せずβバレル構造を形成していないことを示していた.すなわち,パーフリンゴライシンOは細胞膜に結合したのち,プリポア複合体においてヘリックスバンドルから部分的にアンフォールドしたβバレルフォールディング中間体を形成し,膜内在性のβバレル構造へと変換されていた.
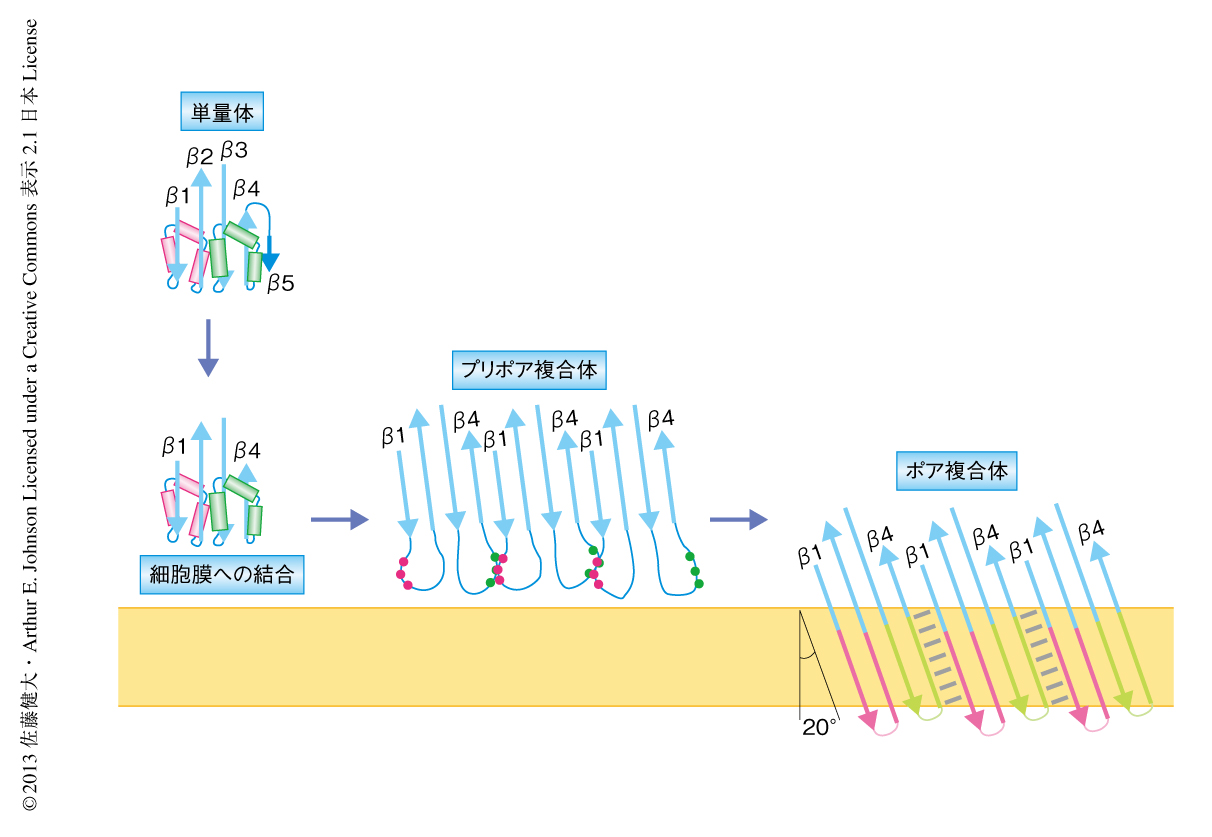
コレステロース依存性細胞溶解毒素はコレステロールを含む細胞膜(すなわち,哺乳類の細胞膜)へと結合し膜孔を形成する細菌毒素のファミリーである.このファミリーのタンパク質は,単量体として分泌されたのち,細胞膜に35量体~50量体からなる巨大な環状の複合体を形成し,直径250~300Åのβバレル型の膜孔を形成する1)(図1).この研究で使用したパーフリンゴライシンOはClostridium perfringensから分泌される毒素で,コレステロール依存性細胞溶解毒素ファミリーのなかでもっともよく研究されている1,2).パーフリンゴライシンOの単量体の結晶構造は4つのドメインからなる細長い構造で,ドメイン4の先端を介し細胞膜にほぼ直立した状態で結合する3,4).可溶性の単量体の状態においてドメイン3のコアβシートのもつ短いβストランド(βストランド5)は,細胞膜と結合したときにはβストランド5はアンフォールドし,露出したコアβシートにあるβストランド4がほかのパーフリンゴライシンOのコアβシートにあるβストランド1と主鎖のあいだの水素結合によりβシートを形成し,会合をくり返し巨大な環状複合体を形成する.環状のプリポア複合体を形成したのち,ポア複合体への変換のときドメイン3の2組のヘリックスバンドルは2組のβヘアピン(βストランド1とβストランド2,および,βストランド3とβストランド4からなる)へと構造変化し細胞膜に挿入される(図1).ポア複合体の構造はその巨大さゆえ結晶化が困難であり未解明である.コレステロール依存性細胞溶解毒素ファミリーのなかで唯一,ニューモライシンは低温電子顕微鏡によるポア複合体の構造が報告されている5).しかし,このニューモライシンのβバレル構造を形成するβストランドは膜孔の中心軸に対し平行(0度)であり,これまでに報告されているβバレル膜タンパク質の結晶構造のもつβストランドの角度(37度以上)から大きくはずれている6).
この研究では,ジスルフィド結合スキャン法によりパーフリンゴライシンOのポア複合体におけるβストランドのアライメントを同定し,巨大なβバレル構造の詳細を明らかにした.そして,低温のもとで形成されたプリポア複合体において,蛍光分光法と組み合わせることによりβバレルのフォールディングにおける中間体の構造を明らかにした.
βバレルのβストランドは主鎖のあいだの水素結合により互いにつながるため,となりあう残基からなるペアは固定され安定なβバレル構造を形成する.βストランドのあいだで主鎖間の水素結合を介しとなりあう残基のCα間の距離は5.5Åだが,水素結合でつながる残基から2残基分ずれた残基とのCα間の距離は7~9Åに広がる(1残基ずれた場合にはβシート平面の裏側に側鎖が出るため,ここでは考慮にいれない).ジスルフィド結合を形成したのちのCβ間の距離は4.5Å以下であるため,2つのシステイン残基がβストランドのあいだでとなりあった場合のみ,この2つの残基はジスルフィド結合を形成することができる.すなわち,βストランドへCys変異を導入しジスルフィド結合の形成の有無を確認することにより,どの残基どうしがβストランドのあいだでとなりあっているのかを調べ,その結果,βバレルにおいてβストランドどうしがどのように整列しているのかを知ることができる.そこで,もともとパーフリンゴライシンOのもつCysをAlaに置換してCysをもたないパーフリンゴライシンOを作製し,複合体においてとなりのパーフリンゴライシンOと相互作用するβストランド1を含むβヘアピン構造もしくはβストランド4のβヘアピン構造の細胞膜を貫通する領域において,膜孔の内側に側鎖のむいた7つの残基へCysを導入したパーフリンゴライシンO変異体を作製した.βストランド1へCysを導入した変異体とβストランド4へCysを導入した変異体とを系統的に混ぜ合わせ,どの残基のあいだでジスルフィド結合が形成されるか調べた.
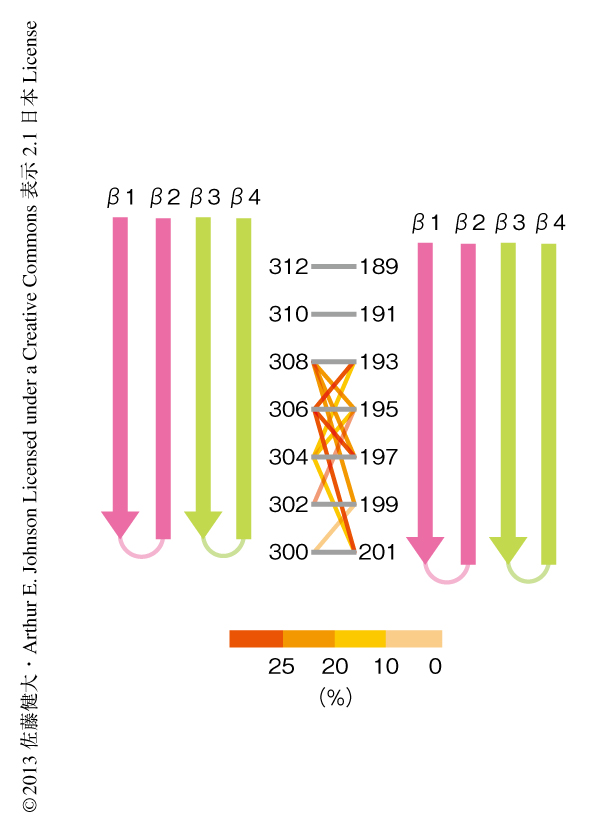
非特異的なジスルフィド結合をさけるため,βストランド1 Cys変異体とβストランド4のCys変異体とをジチオスレイトールの存在下で同量ずつ混ぜ,コレステロールを含むリポソームにおいてポア複合体を形成させた.つぎに,スクロース密度勾配遠心法によりポア複合体を含むリポソームを単離し,酸化剤によりジスルフィド結合反応を促進し,複合体を解離させてからSDS-アガロース電気泳動によりジスルフィド結合による二量体の形成効率を定量した.その結果,パーフリンゴライシンOのもつβバレル構造のβストランドのあいだでとなりあう7つの残基ペアを決定した(図2).これらのペアは,βストランドのあいだで水素結合によりつながったとなりあう残基とだけジスルフィド結合のペアを形成し,ほかのペアとはいっさい重複はなかった.すなわち,ひとつのβバレル型の膜孔を形成する約140本のβストランドがまったく整列を乱すことなく,厳密な制御をうけ安定なβバレル構造を形成していることが示された.また,形成効率は少し落ちたが,これらのペアは酸化剤なしでもジスルフィド結合を形成したことより,おのおのの残基はつねに近接し安定な状態を維持していることがわかった.
βバレル型の膜孔の内側からみたとき,右側のパーフリンゴライシンOのβヘアピン構造の先端は2残基ほど下へずれていた(図2).このずれはβバレルが右巻きにねじれた構造を示し,すなわち,パーフリンゴライシンOのβストランドはβバレルの軸に平行でなく傾いていた.βバレルの軸に対するβストランドの傾きは,同じストランドのCα-Cα間の距離とストランドのあいだのCα-Cα間の距離,βバレルを構成するストランドの数とずれの大きさから計算することができ,今回の結果からパーフリンゴライシンOのβストランドの傾きは20度であった7).これまでに報告されているβバレル構造のβストランドの角度(37度以上)とは大きく異なっていたが,分子モデリングの予測の結果とは一致していた6).一般的なβバレル型膜タンパク質は曲率が大きく(膜孔の直径は40Å以下),膜孔の内側をむいた側鎖のパッキングを緩和するためβストランドが大きく傾いている.しかし,膜孔の曲率が小さければ膜孔の内側の側鎖のパッキングは障害にならず,20度という急な角度が可能になる.このように,パーフリンゴライシンOのポア複合体にみられたβストランドの傾きは巨大なβバレル型膜タンパク質に特有の構造であると考えられた.
ジスルフィド結合や変異により膜孔の形成が停止したプリポア複合体ではパーフリンゴライシンOは細胞膜に対し直立しており,ドメイン3は細胞膜から60Åほど離れている4).これより,プリポア複合体にはβヘアピン構造が細胞膜へ挿入するまえにβバレル構造を形成できるスペースが存在している.もし,ジスルフィド結合のパターンと同じパターンがプリポア複合体でみられるならば,プリポア複合体においてβヘアピン構造が細胞膜へ挿入するよりまえにβバレル構造へと変換されたことを示す.低温下においてパーフリンゴライシンOは複合体を形成するが,膜孔の形成はほとんど検出されない.このことから,低温において形成されたプリポア複合体を解析すれば,細胞膜に挿入するまえのβヘアピン構造を調べることができる.さきに述べたポア複合体と同様の方法により,低温下において形成されたプリポア複合体に対しジスルフィド結合スキャン法を行った.その結果,おもにβストランド1とβストランド4の中央部の残基どうしでジスルフィド結合のペアを重複して形成し,コアβシートに近い残基はジスルフィド結合をまったく形成しなかった(図2).このように,プリポア複合体においてβヘアピンはβバレル構造を形成していないことが示された.βストランド1ととなりのパーフリンゴライシンOからのβストランド4とがさまざまな部位で相互作用しあっていたことから,βヘアピン構造はヘリックスバンドル構造から部分的にアンフォールドして流動的に構造を変えていると考えられた.実際,プリポア複合体においてみられたジスルフィド結合は酸化剤の存在下でなければみることはできなかった.よって,プリポア複合体において2組のβヘアピン構造のあいだの相互作用は遷移的であると思われた.くわえて,βストランド4のCys変異体だけでプリポア複合体を形成したとき,となりのパーフリンゴライシンOにあるβストランド4のCysともジスルフィド結合を形成したことから,βストランド1とβストランド2からなるβヘアピンに比べ,βストランド3とβストランド4からなるほうのβヘアピンはかなり柔軟な構造をもつといえた.
極性環境に敏感な蛍光分子NBDは,非極性環境においては極性環境に比べ蛍光強度が5~10倍に増加し,蛍光極大波長は15~20 nmの短波長側へのシフトを示す.この特徴を利用して,βヘアピン構造の4つの部位をCysに置換してNBDで修飾し,ヘリックスバンドルからβバレル構造へと変換する際の蛍光強度の変化からフォールディングの過程を考察した.ポア複合体の形成のときに膜孔の内側をむくβストランド1の193位とβストランド4の308位における蛍光変化をみたところ,ともにポア複合体では水性環境におかれるため非常に低い蛍光強度を示した.単量体の結晶構造において308位は分子の表面に位置しており,これにしたがい,308位を修飾した単量体の蛍光強度はポア複合体と同様に非常に低く,プリポア複合体でも蛍光強度に変化はなかった.一方,単量体の結晶構造においてコアβシートの裏側に位置し分子の内部に埋もれている193位を修飾した単量体は,若干高い蛍光強度を示したが,ポア複合体へ変換したのち長波長側にシフトして蛍光強度は減少した.興味深いことに,プリポア複合体では単量体の状態よりも1.5倍ほど高い蛍光強度が再現性よく得られた.すなわち,プリポア複合体において193位は疎水的な環境におかれており,単量体やポア複合体とは異なる環境にあることがわかった.
一方,βバレル構造において脂質の側に側鎖をむけるβストランド1の205位もしくはβ4の301位を修飾したところ,単量体においてはどちらも蛍光強度は非常に低く,ポア複合体を形成したときに10倍以上も蛍光強度が増加した.これは,単量体の結晶構造においてみられるとおり,単量体の状態では蛍光基は水性環境に存在し,ポア複合体では脂質にかこまれた非極性環境へと移動するためであると思われた8,9).一方,プリポア複合体ではともに蛍光強度は単量体とポア複合体との中間の値をとり,細胞膜への挿入のまえでありながらやや高い蛍光強度を示したことから,これらの残基は疎水性コアを形成しているようにみえた.このように,単量体からプリポア複合体をへてポア複合体へと変換される際,βヘアピン構造は特定の状態を経由するよう制御されβバレル構造へと変化していくようすが蛍光分光法からわかった.とくに,徐々に疎水性の高い環境へと移動するようすは,疎水性の度合いによりフォールディングが制御されている可能性を示唆した.
この研究では,ジスルフィド結合の形成を利用することにより,構造解析の困難であるパーフリンゴライシンOの膜内在性の巨大なβバレル構造の詳細を知ることができた(図3).この化学的なアプローチは,βバレル構造のβストランドのあいだのアライメントを決定し,βストランドの先端のずれを同定し,パーフリンゴライシンOのポア複合体が膜孔の軸に対し20度の傾きをもつβストランドからなる新規の右巻きβバレル構造であることを実験的に証明した.プリポア複合体におけるジスルフィド結合スキャン法および蛍光分光法は,βバレルのフォールディングにおける中間体構造の存在を明らかにした.βストランド1とβストランド4の複数の残基による重複したジスルフィド結合のペアは,中間体における残基のあいだの遷移的な相互作用と不安定なβヘアピン構造を示した.しかし,完全に伸長して自由に動きまわるわけではなく,膜貫通βストランドの中央部分となる残基どうしのみの相互作用であった.これは,βストランドの主鎖間の水素結合が,コアβシートからの延長ではなく膜貫通βストランドの中央部分から徐々にできていくことを示唆しているのだろうか.蛍光分光法によるデータは,βヘアピン構造がランダムではなく制御されてヘリックスバンドルからβバレル構造へと変換されていることを示した.プリポア複合体においてみられた疎水性コアはモルテングロビュール構造であると考えられ,βバレル構造の面の表と裏を決める重要なステップであるのかもしれない.今回,使用したプリポア複合体は低温により停止した中間体であり,室温に移すとすみやかにβバレル構造を形成した.すなわち,熱エネルギーによりパーフリンゴライシンOが屈曲するのか,中間体でみられた疎水性コアが崩壊するのか,なんらかのエネルギー障壁をこえることによりβバレル構造へと進行した.これよりさきの中間状態を観察することができれば,さらに多くの情報を得られるだろう.βバレル膜タンパク質の局在化やフォールディングの研究は,細菌,ミトコンドリア,葉緑体において発展してきた.今回,開発された筆者らの手法は,これらの研究においても多くの情報を提供するだろう.
略歴:2006年 名古屋大学大学院理学研究科 修了,同年 米国Texas A&M Health Science Centerポスドクリサーチアソシエイトを経て,2012年より同 シニアリサーチアソシエイト.
研究テーマ:細胞膜において起こるタンパク質の構造変化.
抱負:細菌毒素でβバレル業界をリードし,40度の夏が来ても自転車に乗ってエクササイズ.
Arthur E. Johnson
米国Texas A&M Health Science Center教授.
© 2013 佐藤健大・Arthur E. Johnson Licensed under CC 表示 2.1 日本
(米国Texas A&M Health Science Center,Department of Molecular and Cellular Medicine)
email:佐藤健大
DOI: 10.7875/first.author.2013.058
Disulfide-bond scanning reveals assembly state and β-strand tilt angle of the PFO β-barrel.
Takehiro K. Sato, Rodney K. Tweten, Arthur E. Johnson
Nature Chemical Biology, 9, 383-389 (2013)
要 約
パーフリンゴライシンOはコレステロール依存性細胞溶解毒素ファミリーに属し,コレステロールを含む細胞膜に結合し約35量体からなるプリポア複合体を形成したのち,ポア複合体として直径約250Åのβバレル型の膜孔を細胞膜に形成する.パーフリンゴライシンOは可溶性の単量体においてドメイン3に3つの短いヘリックスからなるヘリックスバンドルを2つもつが,これらはβバレル型の膜孔の形成のとき2組のβヘアピン構造へと変換される.今回,筆者らは,βストランドのあいだに形成されるジスルフィド結合を利用したジスルフィド結合スキャン法により,βストランドは厳密に制御されて整列し20度の傾きをもってβバレル構造を形成していることを明らかにした.低温のもとで得られるプリポア複合体ではパーフリンゴライシンOのドメイン3のもつヘリックスバンドルはほどかれ,となりのパーフリンゴライシンOのほどけたヘリックスバンドルと遷移的に接触していた.これは,中間体においてβストランドはまだ整列せずβバレル構造を形成していないことを示していた.すなわち,パーフリンゴライシンOは細胞膜に結合したのち,プリポア複合体においてヘリックスバンドルから部分的にアンフォールドしたβバレルフォールディング中間体を形成し,膜内在性のβバレル構造へと変換されていた.
はじめに
コレステロース依存性細胞溶解毒素はコレステロールを含む細胞膜(すなわち,哺乳類の細胞膜)へと結合し膜孔を形成する細菌毒素のファミリーである.このファミリーのタンパク質は,単量体として分泌されたのち,細胞膜に35量体~50量体からなる巨大な環状の複合体を形成し,直径250~300Åのβバレル型の膜孔を形成する1)(図1).この研究で使用したパーフリンゴライシンOはClostridium perfringensから分泌される毒素で,コレステロール依存性細胞溶解毒素ファミリーのなかでもっともよく研究されている1,2).パーフリンゴライシンOの単量体の結晶構造は4つのドメインからなる細長い構造で,ドメイン4の先端を介し細胞膜にほぼ直立した状態で結合する3,4).可溶性の単量体の状態においてドメイン3のコアβシートのもつ短いβストランド(βストランド5)は,細胞膜と結合したときにはβストランド5はアンフォールドし,露出したコアβシートにあるβストランド4がほかのパーフリンゴライシンOのコアβシートにあるβストランド1と主鎖のあいだの水素結合によりβシートを形成し,会合をくり返し巨大な環状複合体を形成する.環状のプリポア複合体を形成したのち,ポア複合体への変換のときドメイン3の2組のヘリックスバンドルは2組のβヘアピン(βストランド1とβストランド2,および,βストランド3とβストランド4からなる)へと構造変化し細胞膜に挿入される(図1).ポア複合体の構造はその巨大さゆえ結晶化が困難であり未解明である.コレステロール依存性細胞溶解毒素ファミリーのなかで唯一,ニューモライシンは低温電子顕微鏡によるポア複合体の構造が報告されている5).しかし,このニューモライシンのβバレル構造を形成するβストランドは膜孔の中心軸に対し平行(0度)であり,これまでに報告されているβバレル膜タンパク質の結晶構造のもつβストランドの角度(37度以上)から大きくはずれている6).
この研究では,ジスルフィド結合スキャン法によりパーフリンゴライシンOのポア複合体におけるβストランドのアライメントを同定し,巨大なβバレル構造の詳細を明らかにした.そして,低温のもとで形成されたプリポア複合体において,蛍光分光法と組み合わせることによりβバレルのフォールディングにおける中間体の構造を明らかにした.
1.ジスルフィド結合スキャン法によるβストランドのアライメントの解析
βバレルのβストランドは主鎖のあいだの水素結合により互いにつながるため,となりあう残基からなるペアは固定され安定なβバレル構造を形成する.βストランドのあいだで主鎖間の水素結合を介しとなりあう残基のCα間の距離は5.5Åだが,水素結合でつながる残基から2残基分ずれた残基とのCα間の距離は7~9Åに広がる(1残基ずれた場合にはβシート平面の裏側に側鎖が出るため,ここでは考慮にいれない).ジスルフィド結合を形成したのちのCβ間の距離は4.5Å以下であるため,2つのシステイン残基がβストランドのあいだでとなりあった場合のみ,この2つの残基はジスルフィド結合を形成することができる.すなわち,βストランドへCys変異を導入しジスルフィド結合の形成の有無を確認することにより,どの残基どうしがβストランドのあいだでとなりあっているのかを調べ,その結果,βバレルにおいてβストランドどうしがどのように整列しているのかを知ることができる.そこで,もともとパーフリンゴライシンOのもつCysをAlaに置換してCysをもたないパーフリンゴライシンOを作製し,複合体においてとなりのパーフリンゴライシンOと相互作用するβストランド1を含むβヘアピン構造もしくはβストランド4のβヘアピン構造の細胞膜を貫通する領域において,膜孔の内側に側鎖のむいた7つの残基へCysを導入したパーフリンゴライシンO変異体を作製した.βストランド1へCysを導入した変異体とβストランド4へCysを導入した変異体とを系統的に混ぜ合わせ,どの残基のあいだでジスルフィド結合が形成されるか調べた.
2.βバレル型膜タンパク質のβストランドのアライメント
非特異的なジスルフィド結合をさけるため,βストランド1 Cys変異体とβストランド4のCys変異体とをジチオスレイトールの存在下で同量ずつ混ぜ,コレステロールを含むリポソームにおいてポア複合体を形成させた.つぎに,スクロース密度勾配遠心法によりポア複合体を含むリポソームを単離し,酸化剤によりジスルフィド結合反応を促進し,複合体を解離させてからSDS-アガロース電気泳動によりジスルフィド結合による二量体の形成効率を定量した.その結果,パーフリンゴライシンOのもつβバレル構造のβストランドのあいだでとなりあう7つの残基ペアを決定した(図2).これらのペアは,βストランドのあいだで水素結合によりつながったとなりあう残基とだけジスルフィド結合のペアを形成し,ほかのペアとはいっさい重複はなかった.すなわち,ひとつのβバレル型の膜孔を形成する約140本のβストランドがまったく整列を乱すことなく,厳密な制御をうけ安定なβバレル構造を形成していることが示された.また,形成効率は少し落ちたが,これらのペアは酸化剤なしでもジスルフィド結合を形成したことより,おのおのの残基はつねに近接し安定な状態を維持していることがわかった.
3.βバレル型膜タンパク質のβストランドの傾き
βバレル型の膜孔の内側からみたとき,右側のパーフリンゴライシンOのβヘアピン構造の先端は2残基ほど下へずれていた(図2).このずれはβバレルが右巻きにねじれた構造を示し,すなわち,パーフリンゴライシンOのβストランドはβバレルの軸に平行でなく傾いていた.βバレルの軸に対するβストランドの傾きは,同じストランドのCα-Cα間の距離とストランドのあいだのCα-Cα間の距離,βバレルを構成するストランドの数とずれの大きさから計算することができ,今回の結果からパーフリンゴライシンOのβストランドの傾きは20度であった7).これまでに報告されているβバレル構造のβストランドの角度(37度以上)とは大きく異なっていたが,分子モデリングの予測の結果とは一致していた6).一般的なβバレル型膜タンパク質は曲率が大きく(膜孔の直径は40Å以下),膜孔の内側をむいた側鎖のパッキングを緩和するためβストランドが大きく傾いている.しかし,膜孔の曲率が小さければ膜孔の内側の側鎖のパッキングは障害にならず,20度という急な角度が可能になる.このように,パーフリンゴライシンOのポア複合体にみられたβストランドの傾きは巨大なβバレル型膜タンパク質に特有の構造であると考えられた.
4.βバレル型膜タンパク質のフォールディング中間体の解析
ジスルフィド結合や変異により膜孔の形成が停止したプリポア複合体ではパーフリンゴライシンOは細胞膜に対し直立しており,ドメイン3は細胞膜から60Åほど離れている4).これより,プリポア複合体にはβヘアピン構造が細胞膜へ挿入するまえにβバレル構造を形成できるスペースが存在している.もし,ジスルフィド結合のパターンと同じパターンがプリポア複合体でみられるならば,プリポア複合体においてβヘアピン構造が細胞膜へ挿入するよりまえにβバレル構造へと変換されたことを示す.低温下においてパーフリンゴライシンOは複合体を形成するが,膜孔の形成はほとんど検出されない.このことから,低温において形成されたプリポア複合体を解析すれば,細胞膜に挿入するまえのβヘアピン構造を調べることができる.さきに述べたポア複合体と同様の方法により,低温下において形成されたプリポア複合体に対しジスルフィド結合スキャン法を行った.その結果,おもにβストランド1とβストランド4の中央部の残基どうしでジスルフィド結合のペアを重複して形成し,コアβシートに近い残基はジスルフィド結合をまったく形成しなかった(図2).このように,プリポア複合体においてβヘアピンはβバレル構造を形成していないことが示された.βストランド1ととなりのパーフリンゴライシンOからのβストランド4とがさまざまな部位で相互作用しあっていたことから,βヘアピン構造はヘリックスバンドル構造から部分的にアンフォールドして流動的に構造を変えていると考えられた.実際,プリポア複合体においてみられたジスルフィド結合は酸化剤の存在下でなければみることはできなかった.よって,プリポア複合体において2組のβヘアピン構造のあいだの相互作用は遷移的であると思われた.くわえて,βストランド4のCys変異体だけでプリポア複合体を形成したとき,となりのパーフリンゴライシンOにあるβストランド4のCysともジスルフィド結合を形成したことから,βストランド1とβストランド2からなるβヘアピンに比べ,βストランド3とβストランド4からなるほうのβヘアピンはかなり柔軟な構造をもつといえた.
5.蛍光によるβバレル構造の形成過程の解析
極性環境に敏感な蛍光分子NBDは,非極性環境においては極性環境に比べ蛍光強度が5~10倍に増加し,蛍光極大波長は15~20 nmの短波長側へのシフトを示す.この特徴を利用して,βヘアピン構造の4つの部位をCysに置換してNBDで修飾し,ヘリックスバンドルからβバレル構造へと変換する際の蛍光強度の変化からフォールディングの過程を考察した.ポア複合体の形成のときに膜孔の内側をむくβストランド1の193位とβストランド4の308位における蛍光変化をみたところ,ともにポア複合体では水性環境におかれるため非常に低い蛍光強度を示した.単量体の結晶構造において308位は分子の表面に位置しており,これにしたがい,308位を修飾した単量体の蛍光強度はポア複合体と同様に非常に低く,プリポア複合体でも蛍光強度に変化はなかった.一方,単量体の結晶構造においてコアβシートの裏側に位置し分子の内部に埋もれている193位を修飾した単量体は,若干高い蛍光強度を示したが,ポア複合体へ変換したのち長波長側にシフトして蛍光強度は減少した.興味深いことに,プリポア複合体では単量体の状態よりも1.5倍ほど高い蛍光強度が再現性よく得られた.すなわち,プリポア複合体において193位は疎水的な環境におかれており,単量体やポア複合体とは異なる環境にあることがわかった.
一方,βバレル構造において脂質の側に側鎖をむけるβストランド1の205位もしくはβ4の301位を修飾したところ,単量体においてはどちらも蛍光強度は非常に低く,ポア複合体を形成したときに10倍以上も蛍光強度が増加した.これは,単量体の結晶構造においてみられるとおり,単量体の状態では蛍光基は水性環境に存在し,ポア複合体では脂質にかこまれた非極性環境へと移動するためであると思われた8,9).一方,プリポア複合体ではともに蛍光強度は単量体とポア複合体との中間の値をとり,細胞膜への挿入のまえでありながらやや高い蛍光強度を示したことから,これらの残基は疎水性コアを形成しているようにみえた.このように,単量体からプリポア複合体をへてポア複合体へと変換される際,βヘアピン構造は特定の状態を経由するよう制御されβバレル構造へと変化していくようすが蛍光分光法からわかった.とくに,徐々に疎水性の高い環境へと移動するようすは,疎水性の度合いによりフォールディングが制御されている可能性を示唆した.
おわりに
この研究では,ジスルフィド結合の形成を利用することにより,構造解析の困難であるパーフリンゴライシンOの膜内在性の巨大なβバレル構造の詳細を知ることができた(図3).この化学的なアプローチは,βバレル構造のβストランドのあいだのアライメントを決定し,βストランドの先端のずれを同定し,パーフリンゴライシンOのポア複合体が膜孔の軸に対し20度の傾きをもつβストランドからなる新規の右巻きβバレル構造であることを実験的に証明した.プリポア複合体におけるジスルフィド結合スキャン法および蛍光分光法は,βバレルのフォールディングにおける中間体構造の存在を明らかにした.βストランド1とβストランド4の複数の残基による重複したジスルフィド結合のペアは,中間体における残基のあいだの遷移的な相互作用と不安定なβヘアピン構造を示した.しかし,完全に伸長して自由に動きまわるわけではなく,膜貫通βストランドの中央部分となる残基どうしのみの相互作用であった.これは,βストランドの主鎖間の水素結合が,コアβシートからの延長ではなく膜貫通βストランドの中央部分から徐々にできていくことを示唆しているのだろうか.蛍光分光法によるデータは,βヘアピン構造がランダムではなく制御されてヘリックスバンドルからβバレル構造へと変換されていることを示した.プリポア複合体においてみられた疎水性コアはモルテングロビュール構造であると考えられ,βバレル構造の面の表と裏を決める重要なステップであるのかもしれない.今回,使用したプリポア複合体は低温により停止した中間体であり,室温に移すとすみやかにβバレル構造を形成した.すなわち,熱エネルギーによりパーフリンゴライシンOが屈曲するのか,中間体でみられた疎水性コアが崩壊するのか,なんらかのエネルギー障壁をこえることによりβバレル構造へと進行した.これよりさきの中間状態を観察することができれば,さらに多くの情報を得られるだろう.βバレル膜タンパク質の局在化やフォールディングの研究は,細菌,ミトコンドリア,葉緑体において発展してきた.今回,開発された筆者らの手法は,これらの研究においても多くの情報を提供するだろう.
文 献
- Tweten, R. K.: Cholesterol-dependent cytolysins, a family of versatile pore-forming toxins. Infect. Immun., 73, 6199-6209 (2005)[PubMed]
- Hotze, E. M. & Tweten, R. K.: Membrane assembly of the cholesterol-dependent cytolysin pore complex. Biochim. Biophys. Acta, 1818, 1028-1038 (2012)[PubMed]
- Rossjohn, J., Feil, S. C., McKinstry, W. J. et al.: Structure of a cholesterol-binding, thiol-activated cytolysin and a model of its membrane form. Cell, 89, 685-692 (1997)[PubMed]
- Ramachandran, R., Tweten, R. K. & Johnson, A. E.: The domains of a cholesterol-dependent cytolysin undergo a major FRET-detected rearrangement during pore formation. Proc. Natl. Acad. Sci. USA, 102, 7139-7144 (2005)[PubMed]
- Tilley, S. J., Orlova, E. V., Gilbert, R. J. C. et al.: Structural basis of pore formation by the bacterial toxin pneumolysin. Cell, 121, 247-256 (2005)[PubMed]
- Reboul, C. F., Mahmood, K., Whisstock, J. C. et al.: Predicting giant transmembrane β-barrel architecture. Bioinformatics, 28, 1299-1302 (2012)[PubMed]
- Sansom, M. S. & Kerr, I. D.: Transbilayer pores formed by β-barrels: molecular modeling of pore structures and properties. Biophys. J., 69, 1334-1343 (1995)[PubMed]
- Shepard, L. A., Heuck, A. P., Hamman, B. D. et al.: Identification of a membrane-spanning domain of the thiol-activated pore-forming toxin Clostridium perfringens perfringolysin O: an α-helical to β-sheet transition identified by fluorescence spectroscopy. Biochemistry, 37, 14563-14574 (1998)[PubMed]
- Shatursky, O., Heuck, A. P., Shepard, L. A. et al.: The mechanism of membrane insertion for a cholesterol-dependent cytolysin: a novel paradigm for pore-forming toxins. Cell, 99, 293-299 (1999)[PubMed]
著者プロフィール
略歴:2006年 名古屋大学大学院理学研究科 修了,同年 米国Texas A&M Health Science Centerポスドクリサーチアソシエイトを経て,2012年より同 シニアリサーチアソシエイト.
研究テーマ:細胞膜において起こるタンパク質の構造変化.
抱負:細菌毒素でβバレル業界をリードし,40度の夏が来ても自転車に乗ってエクササイズ.
Arthur E. Johnson
米国Texas A&M Health Science Center教授.
© 2013 佐藤健大・Arthur E. Johnson Licensed under CC 表示 2.1 日本