形質細胞様樹状細胞への卓越した分化能をもつ新しい樹状細胞前駆細胞の発見
小内伸幸・樗木俊聡
(東京医科歯科大学難治疾患研究所 生体防御学分野)
email:樗木俊聡
DOI: 10.7875/first.author.2013.053
A clonogenic progenitor with prominent plasmacytoid dendritic cell developmental potential.
Nobuyuki Onai, Kazutaka Kurabayashi, Mayuka Hosoi-Amaike, Noriko Toyama-Sorimachi, Kouji Matsushima, Kayo Inaba, Toshiaki Ohteki
Immunity, 38, 943-957 (2013)
1973年に発見された樹状細胞は,現在では免疫の司令塔として位置づけられ,ウイルスの感染など緊急時における免疫応答の誘導,および,定常状態における免疫寛容の維持に重要な役割を担っていることが明らかになっている.二次リンパ組織の樹状細胞は,従来型樹状細胞と形質細胞様樹状細胞とに大きく分類される.数年前,筆者らは,分化の方向性が樹状細胞に決定し,かつ,ほかの血液細胞には分化しない前駆細胞をはじめて同定し報告した.しかしながら,この樹状細胞前駆細胞から分化する大部分の樹状細胞は従来型樹状細胞であったことから,多くが形質細胞様樹状細胞へと分化する前駆細胞の存在が予測されていた.今回,筆者らは,この前駆細胞をつきとめた.新しい樹状細胞前駆細胞は,過去に報告した樹状細胞前駆細胞に比べ7~8倍もの形質細胞様樹状細胞を分化させる能力をもち,形質細胞様樹状細胞の分化および生存に必須の転写因子E2-2を高く発現していた.
樹状細胞は従来型樹状細胞と形質細胞様樹状細胞とに大別される.形質細胞様樹状細胞はTLR7およびTLR9(TLR:Toll-like receptor,Toll様受容体)を選択的に発現しており,病原微生物あるいは自己の核酸を認識して大量のI型インターフェロンを産生する.形質細胞様樹状細胞の活性化ならびにI型インターフェロンの産生は,ウイルスなどに対する感染防御免疫の誘導に重要であり,また,全身性エリテマトーデスや乾癬など自己免疫疾患の誘因となる.これらとは対照的に,定常状態では経口免疫寛容などの誘導における形質細胞様樹状細胞の重要性も報告されている.最近,DNA結合ドメインである塩基性ヘリックス-ループ-ヘリックスドメインをもつ転写因子E2-2が形質細胞様樹状細胞の分化および生存に重要であることが明らかにされている1,2).
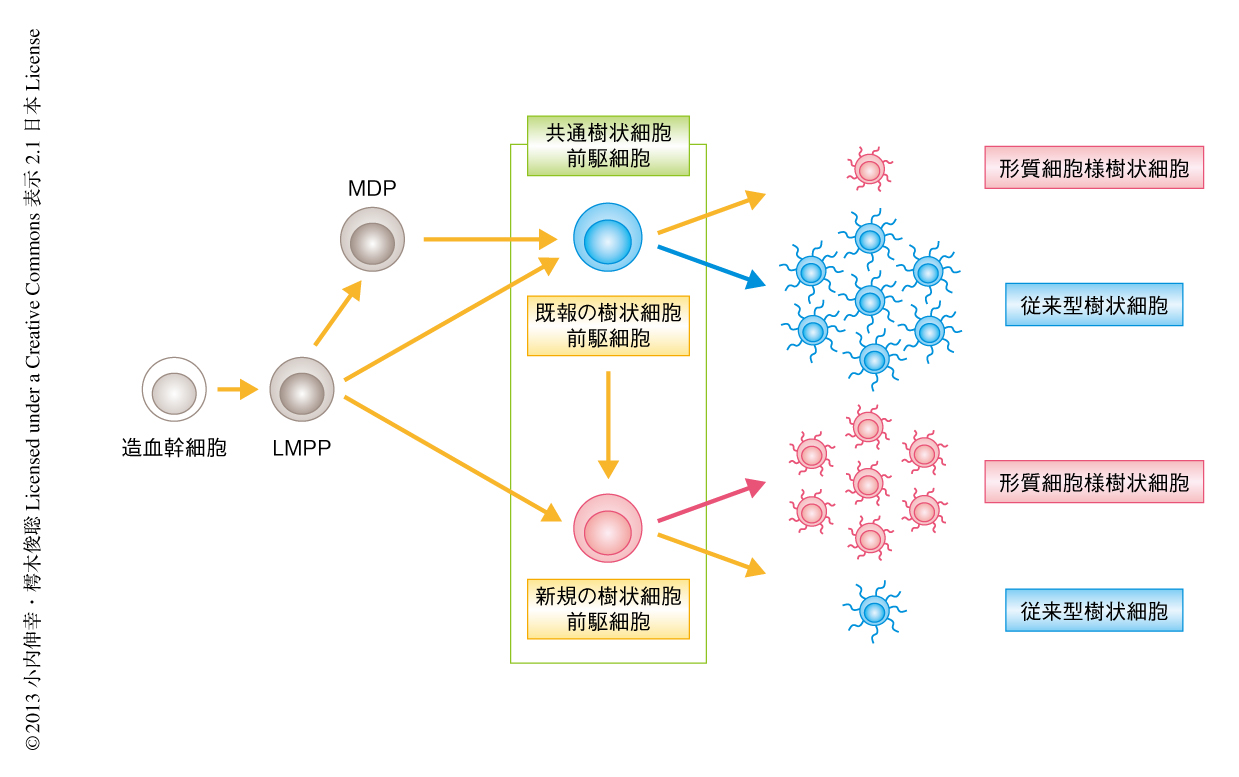
樹状細胞はほかの血液細胞と同様に造血幹細胞を起源とし,さまざまな分化段階の前駆細胞をへて最終的に樹状細胞に分化する.樹状細胞の分化には受容体型チロシンキナーゼのひとつFlt3およびそのリガンドFlt3Lが重要であり,それらを欠損したマウスでは樹状細胞の数が大幅に減少している3,4).また,マクロファージおよび樹状細胞への分化能を示す前駆細胞(macrophage and dendritic cell progenitor:MDP)や過去に筆者らが報告した樹状細胞前駆細胞もFlt3を発現しており5-7),MDPからマクロファージへの分化能が失われて樹状細胞前駆細胞になると考えられている(図1).しかしながら,それら前駆細胞から分化する大部分の樹状細胞は従来型樹状細胞であり,形質細胞様樹状細胞は少数であった5-7).これらの背景にもとづき,形質細胞様樹状細胞の供給能にすぐれた樹状細胞前駆細胞の存在を予測しその同定を試みた.
マクロファージおよび樹状細胞への分化能を示すMDPや既報の樹状細胞前駆細胞は,分化した細胞のマーカー(lineage maker:Lin)を発現せず,Flt3およびM-CSF受容体を発現している5-7).また,MDPはc-Kitに陽性であるが,既報の樹状細胞前駆細胞はc-Kitの発現は明らかに低い5-7).したがって,MDPはLin陰性c-Kit陽性Flt3陽性M-CSF受容体陽性,既報の樹状細胞前駆細胞はLin陰性c-Kit中間あるいは低発現Flt3陽性M-CSF受容体陽性ということになる.樹状細胞への分化能がM-CSF受容体陽性の画分に限局しているかどうかを検討するため,Lin陰性c-Kit中間あるいは低発現Flt3陽性M-CSF受容体陰性の画分を解析したところ,意外なことに,この画分にも樹状細胞への分化能が確認された.そこで,この画分からB細胞への分化能をもつインターロイキン7Rα受容体陽性細胞をさらに除いた画分,Lin陰性c-Kit中間あるいは低発現Flt3陽性M-CSF受容体陰性インターロイキン7Rα受容体陰性の画分に着目し詳細な解析を進めた.この画分の細胞をex vivoにおいてFlt3Lとともに培養したところ,分化してくる細胞のほとんどは樹状細胞であったこと,さらに,コロニーアッセイによりミエロイド系細胞やB細胞などへの分化能を示さなかったことから,新しい樹状細胞前駆細胞であることが示された.重要なことに,既報の樹状細胞前駆細胞と比べ,この新しい樹状細胞前駆細胞は形質細胞様樹状細胞が7~8倍も多く分化してくること,逆に,従来型樹状細胞への分化能は1/3~1/4程度に低下していることが判明した.新しい樹状細胞前駆細胞に由来する形質細胞様樹状細胞は機能的にも正常であり,特徴的なTLR7およびTLR9の発現と,代表的なTLR9のリガンドであるCpGの刺激により大量のインターフェロンαを産生することも確認された.さらに,限界希釈法により樹状細胞になるクローンの頻度を解析したところ,新しい樹状細胞前駆細胞と既報の樹状細胞前駆細胞はほぼ同等であったが,形質細胞様樹状細胞へと分化するクローンの頻度は新しい樹状細胞前駆細胞において明らかに高かった.これらの結果は,新しい樹状細胞前駆細胞が形質細胞様樹状細胞へのすぐれた分化能をもつことを支持するものであった.
新規の樹状細胞前駆細胞の表面抗原の発現パターンを解析した.新しい樹状細胞前駆細胞には形質細胞様樹状細胞に特徴的なPDCA-1の発現がわずかに認められたが,通常,従来型樹状細胞あるいは形質細胞様樹状細胞に発現しているMHCクラスII分子,CD11c,CD40,CD45RA,Ly49Q,CCR9,Siglec-Hなどの発現は認められなかった.したがって,新規の樹状細胞前駆細胞と過去に報告された樹状細胞前駆細胞との違いは,新規の樹状細胞前駆細胞がM-CSF受容体陰性PDCA-1低発現であるのに対して,既報の樹状細胞前駆細胞はM-CSF受容体陽性PDCA-1陰性であるということになった.また,新規の樹状細胞前駆細胞においては,既報の樹状細胞前駆細胞と同様に,樹状細胞の分化に重要な多くの遺伝子の発現が確認され,樹状細胞前駆細胞としてふさわしいものであった.特筆すべきは,新規の樹状細胞前駆細胞は形質細胞様樹状細胞の分化および生存に必須の転写因子E2-2を,既報の樹状細胞前駆細胞との比較において数倍も高く発現していたことである.この結果は,前駆細胞の段階でE2-2を高く発現することが 形質細胞様樹状細胞へのすぐれた分化能を保障していることを示唆した.
ex vivoだけでなくin vivoにおいて形質細胞様樹状細胞への分化能を確認することは重要である.そこで,新規の樹状細胞前駆細胞ならびに既報の樹状細胞前駆細胞を放射線照射した宿主マウスに移入したところ,既報の樹状細胞前駆細胞との比較において,新規の樹状細胞前駆細胞から分化する形質細胞様樹状細胞の数は数倍に達し,生体においても形質細胞様樹状細胞へのすぐれた分化能が確認された.このとき,樹状細胞以外の細胞への分化は認められなかった.また,樹状細胞の分化がピークに達したタイミングでTLR9のリガンドであるCpGを投与すると,既報の樹状細胞前駆細胞を移入したマウスに比べ,新規の樹状細胞前駆細胞を移入したマウスにおいてI型インターフェロンが有意に高く産生された.同様の結果は,放射線照射をしない宿主マウスに樹状細胞前駆細胞を移入した場合にも得られた.これらの結果は,新規の樹状細胞前駆細胞が生体においても機能的な形質細胞様樹状細胞を生み出す能力に長けていることを示した.
形質細胞様樹状細胞は均一な集団ではなく,Rag1の発現を指標にすると約30~40%はRag1が陽性であり,残りの60~70%はRag1を発現していない8).機能的にも,Rag1陽性の形質細胞様樹状細胞との比較において,Rag1陰性の形質細胞様樹状細胞はToll様受容体のリガンドの刺激などに対する炎症性サイトカインの産生が顕著であるという.新規の樹状細胞前駆細胞におけるRag1陽性およびRag1陰性の形質細胞様樹状細胞の供給能を検証するため,Rag1遺伝子のプロモーターの下流にEGFP遺伝子を挿入したレポーターマウスから新規の樹状細胞前駆細胞および既報の樹状細胞前駆細胞を精製し,放射線照射した宿主マウスに移入したところ,大部分のRag1陽性およびRag1陰性の形質細胞様樹状細胞は新規の樹状細胞前駆細胞から分化することが明らかになった.
樹状細胞の分化系譜における,新規の樹状細胞前駆細胞と既報の樹状細胞前駆細胞との関連性について解析した.過去,筆者らは,既報の樹状細胞前駆細胞をFlt3LにくわえM-CSFを添加して培養すると分化する形質細胞様樹状細胞の数が有意に増加することを報告している6).また,ヒトのCD34陽性細胞をFlt3Lとトロンボポエチンを添加して培養すると,Flt3L単独での培養に比べ形質細胞様樹状細胞の分化が促進されることも報告されている9).そこで,既報の樹状細胞前駆細胞を,Flt3L単独,Flt3L+M-CSF,Flt3L+トロンボポエチンを添加して培養したのち,形質細胞様樹状細胞の産生効率を比較したところ,Flt3L単独に比べ,Flt3L+M-CSF,および,Flt3L+トロンボポエチンの刺激により形質細胞様樹状細胞の分化は著しく促進され,同時に,転写因子E2-2の発現の上昇とM-CSF受容体の発現の低下が観察された.これらの結果は,少なくともこの培養条件においては既報の樹状細胞前駆細胞が新規の樹状細胞前駆細胞の形質を獲得したこと,すなわち,樹状細胞の分化系譜において既報の樹状細胞前駆細胞が新規の樹状細胞前駆細胞の上流に位置する可能性を示した(図1).
さらに,より上流のFlt3陽性前駆細胞から直接に新規の樹状細胞前駆細胞と既報の樹状細胞前駆細胞が分化する可能性を探求した.筆者らは,多能性前駆細胞のなかでも巨核球ならびに赤血球系への分化能を欠くLMPP(lymphoid-primed multipotential progenitor)に着目した10).なぜなら,巨核球および赤血球系前駆細胞は樹状細胞への分化能を示さないからである.CFSE色素でLMPPを標識したのち,野生型マウスの骨髄に移入した.LMPPが1回だけ分裂した直後に娘細胞の表面抗原パターンを解析したところ,興味深いことに,新規の樹状細胞前駆様細胞および既報の樹状細胞前駆細胞様細胞が出現しており,おのおのを精製してex vivoにおいて培養したところ,新規の樹状細胞前駆様細胞から多くの形質細胞様樹状細胞が誘導された.これらの結果は,既報の樹状細胞前駆細胞から新規の樹状細胞前駆様細胞が分化する経路にくわえ,LMPPから直接に既報の樹状細胞前駆細胞と新規の樹状細胞前駆様細胞が供給される経路が存在する可能性を示唆した(図1).
過去に報告された樹状細胞前駆細胞と,今回,新たに見い出された樹状細胞前駆細胞とをあわせて,共通樹状細胞前駆細胞と定義しなおした(図1).今回の成果は,樹状細胞の分化系譜を書き換える重要な発見ではあるが,同時に,今後,解明すべきいくつかの課題も提示した.形質細胞様樹状細胞へのすぐれた分化能をもつ樹状細胞前駆細胞のなかに完全に形質細胞様樹状細胞への分化に運命決定された前駆細胞が存在しており,さらなる絞り込みが必要である.樹状細胞前駆細胞の正常を維持するための“ニッチ”は存在するのであろうか? ヒトにおける樹状細胞前駆細胞の同定も残された課題である.ひとつの共通樹状細胞前駆細胞から500~1000個の新鮮な樹状細胞を分化させることが可能であり,将来的には,樹状細胞前駆細胞を用いたワクチンの開発やがんの免疫療法につながる可能性が期待される.
東京医科歯科大学難治疾患研究所 講師.
樗木 俊聡(Toshiaki Ohteki)
略歴:東京医科歯科大学難治疾患研究所 教授.
研究テーマ:樹状細胞の分化系譜と機能,組織幹細胞の恒常性の維持と破綻の機構.
研究室URL:http://www.tmd.ac.jp/mri/bre/index.html
© 2013 小内伸幸・樗木俊聡 Licensed under CC 表示 2.1 日本
(東京医科歯科大学難治疾患研究所 生体防御学分野)
email:樗木俊聡
DOI: 10.7875/first.author.2013.053
A clonogenic progenitor with prominent plasmacytoid dendritic cell developmental potential.
Nobuyuki Onai, Kazutaka Kurabayashi, Mayuka Hosoi-Amaike, Noriko Toyama-Sorimachi, Kouji Matsushima, Kayo Inaba, Toshiaki Ohteki
Immunity, 38, 943-957 (2013)
要 約
1973年に発見された樹状細胞は,現在では免疫の司令塔として位置づけられ,ウイルスの感染など緊急時における免疫応答の誘導,および,定常状態における免疫寛容の維持に重要な役割を担っていることが明らかになっている.二次リンパ組織の樹状細胞は,従来型樹状細胞と形質細胞様樹状細胞とに大きく分類される.数年前,筆者らは,分化の方向性が樹状細胞に決定し,かつ,ほかの血液細胞には分化しない前駆細胞をはじめて同定し報告した.しかしながら,この樹状細胞前駆細胞から分化する大部分の樹状細胞は従来型樹状細胞であったことから,多くが形質細胞様樹状細胞へと分化する前駆細胞の存在が予測されていた.今回,筆者らは,この前駆細胞をつきとめた.新しい樹状細胞前駆細胞は,過去に報告した樹状細胞前駆細胞に比べ7~8倍もの形質細胞様樹状細胞を分化させる能力をもち,形質細胞様樹状細胞の分化および生存に必須の転写因子E2-2を高く発現していた.
はじめに
樹状細胞は従来型樹状細胞と形質細胞様樹状細胞とに大別される.形質細胞様樹状細胞はTLR7およびTLR9(TLR:Toll-like receptor,Toll様受容体)を選択的に発現しており,病原微生物あるいは自己の核酸を認識して大量のI型インターフェロンを産生する.形質細胞様樹状細胞の活性化ならびにI型インターフェロンの産生は,ウイルスなどに対する感染防御免疫の誘導に重要であり,また,全身性エリテマトーデスや乾癬など自己免疫疾患の誘因となる.これらとは対照的に,定常状態では経口免疫寛容などの誘導における形質細胞様樹状細胞の重要性も報告されている.最近,DNA結合ドメインである塩基性ヘリックス-ループ-ヘリックスドメインをもつ転写因子E2-2が形質細胞様樹状細胞の分化および生存に重要であることが明らかにされている1,2).
樹状細胞はほかの血液細胞と同様に造血幹細胞を起源とし,さまざまな分化段階の前駆細胞をへて最終的に樹状細胞に分化する.樹状細胞の分化には受容体型チロシンキナーゼのひとつFlt3およびそのリガンドFlt3Lが重要であり,それらを欠損したマウスでは樹状細胞の数が大幅に減少している3,4).また,マクロファージおよび樹状細胞への分化能を示す前駆細胞(macrophage and dendritic cell progenitor:MDP)や過去に筆者らが報告した樹状細胞前駆細胞もFlt3を発現しており5-7),MDPからマクロファージへの分化能が失われて樹状細胞前駆細胞になると考えられている(図1).しかしながら,それら前駆細胞から分化する大部分の樹状細胞は従来型樹状細胞であり,形質細胞様樹状細胞は少数であった5-7).これらの背景にもとづき,形質細胞様樹状細胞の供給能にすぐれた樹状細胞前駆細胞の存在を予測しその同定を試みた.
1.新しい樹状細胞前駆細胞の発見
マクロファージおよび樹状細胞への分化能を示すMDPや既報の樹状細胞前駆細胞は,分化した細胞のマーカー(lineage maker:Lin)を発現せず,Flt3およびM-CSF受容体を発現している5-7).また,MDPはc-Kitに陽性であるが,既報の樹状細胞前駆細胞はc-Kitの発現は明らかに低い5-7).したがって,MDPはLin陰性c-Kit陽性Flt3陽性M-CSF受容体陽性,既報の樹状細胞前駆細胞はLin陰性c-Kit中間あるいは低発現Flt3陽性M-CSF受容体陽性ということになる.樹状細胞への分化能がM-CSF受容体陽性の画分に限局しているかどうかを検討するため,Lin陰性c-Kit中間あるいは低発現Flt3陽性M-CSF受容体陰性の画分を解析したところ,意外なことに,この画分にも樹状細胞への分化能が確認された.そこで,この画分からB細胞への分化能をもつインターロイキン7Rα受容体陽性細胞をさらに除いた画分,Lin陰性c-Kit中間あるいは低発現Flt3陽性M-CSF受容体陰性インターロイキン7Rα受容体陰性の画分に着目し詳細な解析を進めた.この画分の細胞をex vivoにおいてFlt3Lとともに培養したところ,分化してくる細胞のほとんどは樹状細胞であったこと,さらに,コロニーアッセイによりミエロイド系細胞やB細胞などへの分化能を示さなかったことから,新しい樹状細胞前駆細胞であることが示された.重要なことに,既報の樹状細胞前駆細胞と比べ,この新しい樹状細胞前駆細胞は形質細胞様樹状細胞が7~8倍も多く分化してくること,逆に,従来型樹状細胞への分化能は1/3~1/4程度に低下していることが判明した.新しい樹状細胞前駆細胞に由来する形質細胞様樹状細胞は機能的にも正常であり,特徴的なTLR7およびTLR9の発現と,代表的なTLR9のリガンドであるCpGの刺激により大量のインターフェロンαを産生することも確認された.さらに,限界希釈法により樹状細胞になるクローンの頻度を解析したところ,新しい樹状細胞前駆細胞と既報の樹状細胞前駆細胞はほぼ同等であったが,形質細胞様樹状細胞へと分化するクローンの頻度は新しい樹状細胞前駆細胞において明らかに高かった.これらの結果は,新しい樹状細胞前駆細胞が形質細胞様樹状細胞へのすぐれた分化能をもつことを支持するものであった.
2.新しい樹状細胞前駆細胞は転写因子E2-2を高く発現している
新規の樹状細胞前駆細胞の表面抗原の発現パターンを解析した.新しい樹状細胞前駆細胞には形質細胞様樹状細胞に特徴的なPDCA-1の発現がわずかに認められたが,通常,従来型樹状細胞あるいは形質細胞様樹状細胞に発現しているMHCクラスII分子,CD11c,CD40,CD45RA,Ly49Q,CCR9,Siglec-Hなどの発現は認められなかった.したがって,新規の樹状細胞前駆細胞と過去に報告された樹状細胞前駆細胞との違いは,新規の樹状細胞前駆細胞がM-CSF受容体陰性PDCA-1低発現であるのに対して,既報の樹状細胞前駆細胞はM-CSF受容体陽性PDCA-1陰性であるということになった.また,新規の樹状細胞前駆細胞においては,既報の樹状細胞前駆細胞と同様に,樹状細胞の分化に重要な多くの遺伝子の発現が確認され,樹状細胞前駆細胞としてふさわしいものであった.特筆すべきは,新規の樹状細胞前駆細胞は形質細胞様樹状細胞の分化および生存に必須の転写因子E2-2を,既報の樹状細胞前駆細胞との比較において数倍も高く発現していたことである.この結果は,前駆細胞の段階でE2-2を高く発現することが 形質細胞様樹状細胞へのすぐれた分化能を保障していることを示唆した.
3.新しい樹状細胞前駆細胞は生体においても形質細胞様樹状細胞へのすぐれた分化能を示す
ex vivoだけでなくin vivoにおいて形質細胞様樹状細胞への分化能を確認することは重要である.そこで,新規の樹状細胞前駆細胞ならびに既報の樹状細胞前駆細胞を放射線照射した宿主マウスに移入したところ,既報の樹状細胞前駆細胞との比較において,新規の樹状細胞前駆細胞から分化する形質細胞様樹状細胞の数は数倍に達し,生体においても形質細胞様樹状細胞へのすぐれた分化能が確認された.このとき,樹状細胞以外の細胞への分化は認められなかった.また,樹状細胞の分化がピークに達したタイミングでTLR9のリガンドであるCpGを投与すると,既報の樹状細胞前駆細胞を移入したマウスに比べ,新規の樹状細胞前駆細胞を移入したマウスにおいてI型インターフェロンが有意に高く産生された.同様の結果は,放射線照射をしない宿主マウスに樹状細胞前駆細胞を移入した場合にも得られた.これらの結果は,新規の樹状細胞前駆細胞が生体においても機能的な形質細胞様樹状細胞を生み出す能力に長けていることを示した.
4.新しい樹状細胞前駆細胞はRag1が陽性である形質細胞様樹状細胞の主要な起源である
形質細胞様樹状細胞は均一な集団ではなく,Rag1の発現を指標にすると約30~40%はRag1が陽性であり,残りの60~70%はRag1を発現していない8).機能的にも,Rag1陽性の形質細胞様樹状細胞との比較において,Rag1陰性の形質細胞様樹状細胞はToll様受容体のリガンドの刺激などに対する炎症性サイトカインの産生が顕著であるという.新規の樹状細胞前駆細胞におけるRag1陽性およびRag1陰性の形質細胞様樹状細胞の供給能を検証するため,Rag1遺伝子のプロモーターの下流にEGFP遺伝子を挿入したレポーターマウスから新規の樹状細胞前駆細胞および既報の樹状細胞前駆細胞を精製し,放射線照射した宿主マウスに移入したところ,大部分のRag1陽性およびRag1陰性の形質細胞様樹状細胞は新規の樹状細胞前駆細胞から分化することが明らかになった.
5.新規の樹状細胞前駆細胞と既報の樹状細胞前駆細胞との関係
樹状細胞の分化系譜における,新規の樹状細胞前駆細胞と既報の樹状細胞前駆細胞との関連性について解析した.過去,筆者らは,既報の樹状細胞前駆細胞をFlt3LにくわえM-CSFを添加して培養すると分化する形質細胞様樹状細胞の数が有意に増加することを報告している6).また,ヒトのCD34陽性細胞をFlt3Lとトロンボポエチンを添加して培養すると,Flt3L単独での培養に比べ形質細胞様樹状細胞の分化が促進されることも報告されている9).そこで,既報の樹状細胞前駆細胞を,Flt3L単独,Flt3L+M-CSF,Flt3L+トロンボポエチンを添加して培養したのち,形質細胞様樹状細胞の産生効率を比較したところ,Flt3L単独に比べ,Flt3L+M-CSF,および,Flt3L+トロンボポエチンの刺激により形質細胞様樹状細胞の分化は著しく促進され,同時に,転写因子E2-2の発現の上昇とM-CSF受容体の発現の低下が観察された.これらの結果は,少なくともこの培養条件においては既報の樹状細胞前駆細胞が新規の樹状細胞前駆細胞の形質を獲得したこと,すなわち,樹状細胞の分化系譜において既報の樹状細胞前駆細胞が新規の樹状細胞前駆細胞の上流に位置する可能性を示した(図1).
さらに,より上流のFlt3陽性前駆細胞から直接に新規の樹状細胞前駆細胞と既報の樹状細胞前駆細胞が分化する可能性を探求した.筆者らは,多能性前駆細胞のなかでも巨核球ならびに赤血球系への分化能を欠くLMPP(lymphoid-primed multipotential progenitor)に着目した10).なぜなら,巨核球および赤血球系前駆細胞は樹状細胞への分化能を示さないからである.CFSE色素でLMPPを標識したのち,野生型マウスの骨髄に移入した.LMPPが1回だけ分裂した直後に娘細胞の表面抗原パターンを解析したところ,興味深いことに,新規の樹状細胞前駆様細胞および既報の樹状細胞前駆細胞様細胞が出現しており,おのおのを精製してex vivoにおいて培養したところ,新規の樹状細胞前駆様細胞から多くの形質細胞様樹状細胞が誘導された.これらの結果は,既報の樹状細胞前駆細胞から新規の樹状細胞前駆様細胞が分化する経路にくわえ,LMPPから直接に既報の樹状細胞前駆細胞と新規の樹状細胞前駆様細胞が供給される経路が存在する可能性を示唆した(図1).
おわりに
過去に報告された樹状細胞前駆細胞と,今回,新たに見い出された樹状細胞前駆細胞とをあわせて,共通樹状細胞前駆細胞と定義しなおした(図1).今回の成果は,樹状細胞の分化系譜を書き換える重要な発見ではあるが,同時に,今後,解明すべきいくつかの課題も提示した.形質細胞様樹状細胞へのすぐれた分化能をもつ樹状細胞前駆細胞のなかに完全に形質細胞様樹状細胞への分化に運命決定された前駆細胞が存在しており,さらなる絞り込みが必要である.樹状細胞前駆細胞の正常を維持するための“ニッチ”は存在するのであろうか? ヒトにおける樹状細胞前駆細胞の同定も残された課題である.ひとつの共通樹状細胞前駆細胞から500~1000個の新鮮な樹状細胞を分化させることが可能であり,将来的には,樹状細胞前駆細胞を用いたワクチンの開発やがんの免疫療法につながる可能性が期待される.
文 献
- Nagasawa, M., Schmidlin, H., Hazekamp, M. G. et al.: Development of human plasmacytoid dendritic cells depends on the combined action of the basic helix-loop-helix factor E2-2 and the Ets factor Spi-B. Eur. J. Immunol., 38, 2389-2400 (2008)[PubMed]
- Cisse, B., Caton, M. L., Lehner, M. et al.: Transcription factor E2-2 is an essential and specific regulator of plasmacytoid dendritic cell development. Cell, 135, 37-48 (2008)[PubMed]
- McKenna, H. J., Stocking, K. L., Miller, R. E. et al.: Mice lacking flt3 ligand have deficient hematopoiesis affecting hematopoietic progenitor cells, dendritic cells, and natural killer cells. Blood, 95, 3489-3497 (2000)[PubMed]
- Waskow, C., Liu, K., Darrasse-Jeze, G. et al.: The receptor tyrosine kinase Flt3 is required for dendritic cell development in peripheral lymphoid tissues. Nat. Immunol., 9, 676-683 (2008)[PubMed]
- Fogg, D. K., Sibon, C., Miled, C. et al.: A clonogenic bone marrow progenitor specific for macrophages and dendritic cells. Science, 311, 83-87 (2006)[PubMed]
- Onai, N., Obata-Onai, A., Schmid, M. A. et al.: Identification of clonogenic common Flt3+M-CSFR+ plasmacytoid and conventional dendritic cell progenitors in mouse bone marrow. Nat. Immunol., 8, 1207-1216 (2007)[PubMed]
- Naik, S. H., Sathe, P., Park, H. Y. et al.: Development of plasmacytoid and conventional dendritic cell subtypes from single precursor cells derived in vitro and in vivo. Nat. Immunol., 8, 1217-1226 (2007)[PubMed]
- Pelayo, R., Hirose, J., Huang, J. et al.: Derivation of 2 categories of plasmacytoid dendritic cells in murine bone marrow. Blood, 105, 4407-4415 (2005)[PubMed]
- Chen, W., Antonenko, S., Sederstrom, J. M. et al.: Thrombopoietin cooperates with FLT3-ligand in the generation of plasmacytoid dendritic cell precursors from human hematopoietic progenitors. Blood, 103, 2547-2553 (2004)[PubMed]
- Adolfsson, J., Mansson, R., Buza-Vidas, N. et al.: Identification of Flt3+ lympho-myeloid stem cells lacking erythro-megakaryocytic potential a revised road map for adult blood lineage commitment. Cell, 121, 295-306 (2005)[PubMed]
著者プロフィール
東京医科歯科大学難治疾患研究所 講師.
樗木 俊聡(Toshiaki Ohteki)
略歴:東京医科歯科大学難治疾患研究所 教授.
研究テーマ:樹状細胞の分化系譜と機能,組織幹細胞の恒常性の維持と破綻の機構.
研究室URL:http://www.tmd.ac.jp/mri/bre/index.html
© 2013 小内伸幸・樗木俊聡 Licensed under CC 表示 2.1 日本