舌における角化上皮細胞の維持および再生を担う幹細胞の同定
田中敏宏・上野博夫
(関西医科大学 病理学第一講座)
email:田中敏宏
DOI: 10.7875/first.author.2013.048
Identification of stem cells that maintain and regenerate lingual keratinized epithelial cells.
Toshihiro Tanaka, Yoshihiro Komai, Yoko Tokuyama, Hirotsugu Yanai, Shuichi Ohe, Kazuichi Okazaki, Hiroo Ueno
Nature Cell Biology, 15, 511-518 (2013)
舌の糸状乳頭を構成する角化上皮細胞は,哺乳類の生体においてターンオーバーのもっとも速い細胞のひとつであり,舌扁平上皮がんの起源とも考えられているが,その細胞維持の機構はほとんどわかっていない.すべての細胞をランダムに3色に標識する多色細胞系譜追跡法により長期にわたり観察したところ,舌の上皮組織の一定の領域が単色となり,その領域は1個の幹細胞に由来すると考えられた.そこで,ほかの臓器の一部において共通な幹細胞マーカーであるBmi1に注目して解析した.マウスの舌幹細胞はBmi1陽性サイトケラチン14陽性サイトケラチン5陽性であり,糸状乳頭のあいだのくぼみの底から2段目から3段目の位置にもっとも高頻度に存在した.そのほとんどは遅い増殖を示し,多色細胞系譜追跡法での観察により,1年以上の長期にわたり生存するのは1つのくぼみにつき1個のBmi1陽性幹細胞であった.それらは角化上皮細胞を供給するが味蕾細胞は供給しない単能性の幹細胞であった.また,放射線による傷害においてこれら幹細胞は抵抗性を認め,すみやかに増殖して上皮組織を再生した.さらに,その再生時期にBmi1をノックアウトすることにより上皮組織の再生は抑制された.以上の結果から,Bmi1陽性幹細胞は舌の上皮組織の維持および再生にきわめて重要であると考えられた.
舌の糸状乳頭を構成する角化上皮細胞は,哺乳類の生体においてターンオーバーのもっとも速い細胞のひとつであり,舌扁平上皮がんの起源とも考えられているが,その細胞維持の機構についてはほとんどわかっていない.この研究において,筆者らは,マウスの舌幹細胞の同定と解析についてはじめて報告した.その結果は,これら幹細胞が舌の上皮組織の維持および再生に重要であることを証明するものであった.
舌の上皮組織における既知の幹細胞マーカーの発現を免疫染色により調べた.サイトケラチン14およびサイトケラチン5は糸状乳頭のあいだのくぼみに発現が多く上層に移動するにしたがい発現は低下したが,合計ではおよそ1/3がこれらマーカーを発現していた.この結果は,過去の報告と矛盾しないものであり1),糸状乳頭のあいだのくぼみに舌の上皮前駆細胞が存在していることを示唆した.しかし,細胞増殖のマーカーであるKi67染色にて,分裂している細胞は舌の上皮組織の最下層の基底細胞のみであり,サイトケラチン14陽性細胞のうち上皮組織を供給している分裂細胞はごく一部であることが示された.この結果より,サイトケラチン14およびサイトケラチン5は幹細胞のマーカーとしては特異性の低いことが示唆された.ただし,過去の報告より,ほかの臓器の幹細胞ではさかんに分裂し組織細胞を供給している短期前駆細胞と,増殖の遅い長期幹細胞とが併存して役割分担している例が知られており,必ずしも分裂している細胞が幹細胞とはかぎらないことが知られている.
そこで,舌の上皮組織の基底細胞のうち,どの細胞が真の長期幹細胞であるかを調べるため,筆者らの開発した多色細胞系譜追跡法2-4) を用いて,舌の上皮組織を長期間にわたり維持可能である幹細胞の解析を試みた5-7).多色細胞系譜追跡法では,従来の方法8) に比べ,ある細胞集団に存在する長期幹細胞のクローン数を予測すること,また,異なった幹細胞に由来するクローンを区別することが容易になっている2,3).Rosa26rbw/+マウスはCreリコンビナーゼによるDNA組換えが起こると,緑色(GFP)を発現していた細胞が青色(mCerulean),オレンジ色(mOrange),赤色(mCherry)にランダムに変化する.全身のすべての細胞においてタモキシフェンの投与によりCreリコンビナーゼを発現させることのできるマウスとRosa26rbw/+マウスとを掛け合わせ,タモキシフェンの投与により成体の舌の上皮組織すべての細胞をランダムな3色にて標識した.その結果,投与から7日目および14日目までは多数の細胞が基底層から上層の方向へと増殖しているようすが観察され,基底細胞が分裂し分化した上皮細胞を供給しているという過去の報告と合致する結果であった9).しかし,1カ月後には糸状乳頭のあいだのくぼみを中心とした区画ごとにそれぞれ単色となり,ほぼ1個の長期幹細胞がその区画のすべての上皮組織を維持していることが明らかになった.この結果から,舌の上皮組織の基底細胞のうち,ごく一部(事実上,1個)が長期幹細胞であることが示された.
舌の上皮組織を維持する真の長期幹細胞を同定するため,種々の幹細胞マーカー遺伝子にCreリコンビナーゼの遺伝子をノックインしたマウスによる上皮組織の標識を試みた.幹細胞マーカー遺伝子のうち,villin遺伝子,shh遺伝子,Lgr5遺伝子を用いた細胞系譜の追跡では成体の舌の上皮組織の標識はまったく認められなかった.しかし,Creリコンビナーゼの遺伝子をBmi1遺伝子にノックインしたマウス10) を用いたところ,舌の上皮組織の標識が認められた.
Creリコンビナーゼ遺伝子をBmi1遺伝子にノックインしたマウスとRosa26rbw/+マウスを掛け合わせたマウスにおいて,タモキシフェンの投与によりCreリコンビナーゼを発現させたのち2日目に単一の標識細胞が確認され,約2週間までに標識された幹細胞に由来する細胞集団が角化層にまで到達した.Bmi1陽性細胞から供給された範囲は4週間で単一色の細胞集団によりうめつくされた.そののち6カ月以上にわたり蛍光標識された細胞は維持され,上皮組織を供給しつづけていることが観察された.これらの結果から,Bmi1陽性細胞は舌の上皮組織を維持する長期幹細胞であることが証明された.また,基底細胞はKi67陽性細胞でありさかんに分裂していることと比較すると,標識されたBmi1陽性細胞は7日目ごろまで分裂せず,そののち,分裂をはじめたことは,この細胞が基本的に増殖の遅い幹細胞であることを示した.
in situハイブリダイゼーション法により,Bmi1陽性細胞は糸状乳頭のあいだのくぼみの底部に存在しており,1つのくぼみのなかに基本的に最大でも1個のBmi1陽性細胞が認められた.また,Creリコンビナーゼ遺伝子をBmi1遺伝子にノックインしたマウスとRosa26rbw/+マウスを掛け合わせたマウスにおいて,タモキシフェンの投与によりCreリコンビナーゼを発現させたのち2日目に認められたBmi1陽性細胞に由来する細胞の位置と,in situハイブリダイゼーション法により観察されたBmi1陽性細胞の位置は基本的に合致していた.舌における位置とBmi1陽性細胞の位置に相関はなかった.in situハイブリダイゼーション法により,ほとんどの糸状乳頭のあいだのくぼみにBmi1陽性細胞が認められたにもかかわらず,Creリコンビナーゼ遺伝子をBmi1遺伝子にノックインしたマウスとRosa26rbw/+マウスを掛け合わせたマウスにおいて標識された細胞は,一部ではBmi1遺伝子プロモーターによるCreリコンビナーゼ遺伝子の発現が多くないため,この系において閾値に達しない細胞が多く存在したと思われた.
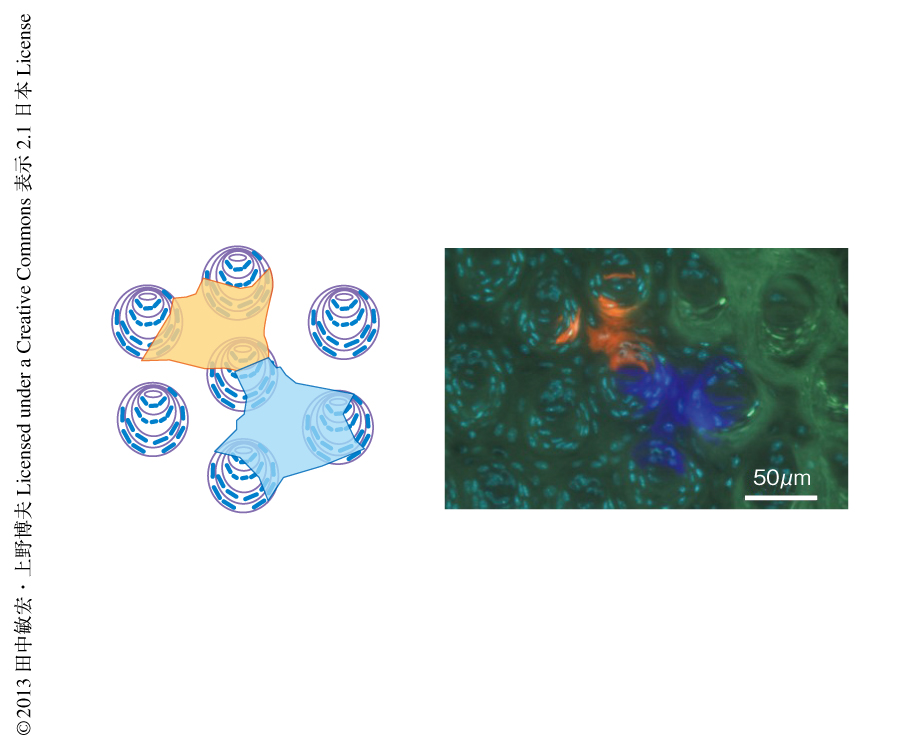
Bmi1陽性細胞は糸状乳頭のあいだのくぼみにおいて,もっとも下層ではなく,それよりやや上段に存在することが大部分であり,約50%が基底層から2~3個目の位置であった.水平断では,糸状乳頭は例外もあるが三角格子状にそって配置されていた.3つの糸状乳頭にかこまれた領域の中央にはくぼみがあり,そのなかにBmi1陽性幹細胞が存在した.タモキシフェンの投与ののち12週間の3次元画像において,1個のBmi1陽性幹細胞が維持する上皮組織の領域を解析した.1個のBmi1陽性細胞からの供給される細胞集団は糸状乳頭のあいだのくぼみ全体をしめ,それに由来する角化上皮細胞はくぼみの周囲に位置する3個(より少ない頻度では,4個)の糸状乳頭に及んでいた(図1).Creリコンビナーゼ遺伝子をBmi1遺伝子にノックインしたマウスとRosa26rbw/+マウスを掛け合わせたマウスを用いた場合,タモキシフェンを1回投与しただけでは一部の上皮細胞しか標識されなかったが,3回異なるタイミングで投与するとその頻度は非常に上昇した.興味深いことに,このように標識細胞の頻度を増加させた条件でもこのマウスにおいて味蕾細胞が標識されることはなかった.つまり,Bmi1陽性幹細胞は角化上皮細胞のみを維持しており,味蕾細胞を維持していないことがわかった.
EdUの投与後2時間でのEdU染色により,糸状乳頭のあいだのくぼみにおける増殖細胞の位置を確認した.EdU陽性細胞はKi67陽性の基底細胞と一致し,これらが非常にさかんに細胞分裂していることが確認できた.EdU陽性細胞はそののち分化しながら徐々に上層の方向へと移動し,最終的には角化上皮細胞となったのち,約7日で大半が脱落した.これらの結果は,舌の上皮組織における大部分の細胞のターンオーバー速度は約7日であることを示した.興味深いことに,Bmi1陽性幹細胞はEdUの投与後2時間のEdU陽性細胞およびKi67陽性細胞には含まれず,これらBmi1陽性幹細胞は細胞周期が遅いないし停止している細胞であることが確認できた.また,一部のBmi1陽性細胞はタモキシフェンの投与による標識ののち28日以上も分裂せず静止細胞のまま存在しつづけた.このことから,Bmi1陽性細胞は増殖の遅いことが確認できた.しかしながら,ごく一部のEdU陽性細胞は糸状乳頭のあいだのくぼみの下部に残り長期にわたり存在しつづけた.これらの細胞は,ほかの臓器で報告されているlabel retaining細胞と考えられた11).また,これらの細胞はBmi1陽性細胞とは重ならなかった.
サイトケラチン14陽性細胞が角化上皮細胞および味蕾細胞の幹細胞を含むとする報告があるため1),Bmi1陽性細胞との関係を解析した.サイトケラチン14は基底細胞および傍基底細胞に広く発現を認め,角化層にむかうにつれ発現量の減少を認めた.Bmi1陽性細胞は基底細胞から2列目ないし3列目に位置し,サイトケラチン14の発現が基底細胞より低い細胞のなかに含まれた.Bmi1陽性細胞におけるサイトケラチン5の発現もサイトケラチン14と同様であった.
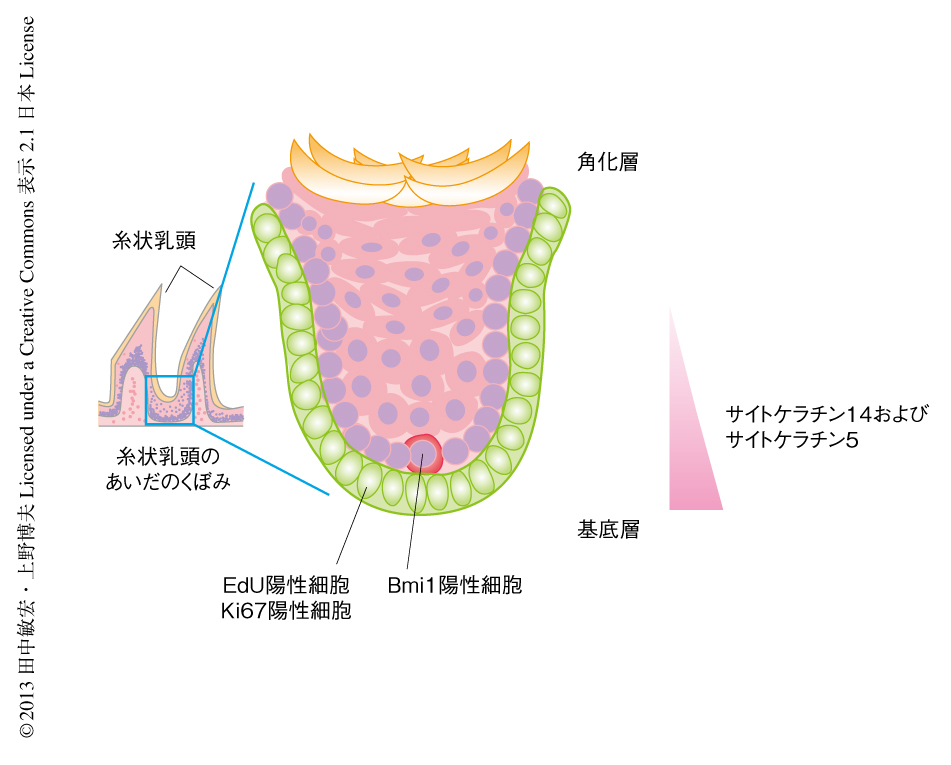
ここまでの結果をまとめると,Bmi1陽性細胞は糸状乳頭のあいだのくぼみに最大で1個が存在している(図2).サイトケラチン14陽性細胞は基底細胞から徐々に角化層にむかうにつれ発現が低下し,基底細胞においてKi67陽性細胞およびEdU陽性細胞などは増殖細胞に相当するが,その上部の2列目ないし3列目に存在しているBmi1陽性幹細胞はサイトケラチン14陽性サイトケラチン5陽性でありその増殖は遅かった.
放射線の照射による組織障害ののちの修復過程におけるBmi1陽性幹細胞の役割について解析した.以前に,15 Gyの放射線の照射にて5日目,20 Gyの放射線の照射にて6日目以降に細胞の増殖および再生を得たとの報告があったことから,10 Gyから20 Gyのあいだにおいて組織障害および障害ののちの修復を観察した.通常の状態ではBmi陽性細胞は7日目ころより増殖をはじめ標識された細胞が最上層の角化層に達するのに14日ほどかかった.10 Gyの放射線の照射では4日目にて舌の上皮組織において障害が認められたが,7日目にて照射のまえの状態にまで修復された.20 Gyの放射線の照射ではより高度の組織障害が認められ,一部は不可逆的であり,7日目に障害された組織において一部に再生された上皮組織が認められた.しかし,いずれの条件においても放射線の照射と同時にBmi1陽性細胞を標識すると,Bmi1陽性細胞に由来する細胞は4日目ごろより増殖をはじめ,7日目には基底層から角化層にまで達した.これは,通常の状態よりBmi1陽性細胞がはるかにすみやかに細胞分裂し上皮組織を修復したものであった.この結果より,Bmi1陽性細胞は通常でも放射線に抵抗性であり,正常のときにはその増殖は遅いが,障害のときにはただちに細胞周期移行し組織の修復および再生に機能することが明らかになった.
Bmi1を特異的にノックアウトすることを可能にしたマウスにおいて,放射線の照射ののちの再生過程においてBmi1を特異的にノックアウトすることで4日目以降の増殖を解析した.Ki67陽性細胞の数で比較したところ,放射線の照射ののちの状態と比較して,Bmi1をノックアウトしたマウスでは細胞の増殖が有意に抑制された.この結果からも,細胞の増殖および再生においてBmi1陽性細胞が重要であると考えられた.
今回,筆者らは,舌の上皮組織を維持し障害のとき修復を担当するBmi1陽性幹細胞を同定した.この結果から,これらの幹細胞は味蕾細胞を供給しておらず,舌において角化上皮細胞と味蕾細胞は別個の幹細胞により維持されていると考えられた.Bmi1陽性幹細胞は増殖が遅く,正常のときにも14日程度の経過ののちランダムに細胞周期に移行した.しかし,放射線による障害のときにはすみやかに細胞周期に移行し再生をはじめた.造血幹細胞,皮膚幹細胞,腸幹細胞などほかの臓器においても,増殖の遅い長期幹細胞と長期の寿命をもたずさかんに分裂する短期幹細胞とが併存しており,それらの役割分担が明らかになりつつある.舌の場合には短期幹細胞の特異的なマーカーが明らかになっていないので,現時点において,それらの併存および役割分担など明らかではないが,サイトケラチン14陽性細胞,Ki67陽性細胞,EdU陽性細胞は細胞分裂期にあり,これらの少なくとも一部はほかの臓器の短期幹細胞に相当する細胞であると予想された.
いずれにせよ,舌の上皮組織は外界からの化合物や感染源などさまざまな障害にさらされやすい組織であり,進化の過程において障害のときの再生機構を十分に発達させてきたと考えられ,今回の研究において,その分子機構の一端がはじめて明らかになったといえる.舌の上皮組織に由来すると考えられる舌がんについては多くのことが不明であり,今後,がん化の過程における正常なBmi1陽性幹細胞の関与などが重要な研究テーマになると考えられる.
関西医科大学医学研究科博士課程 在学中.
研究テーマ:組織幹細胞.
抱負:病態の解明や治療へ応用の可能な幹細胞研究をめざします.
上野 博夫(Hiroo Ueno)
関西医科大学 教授.
研究室URL:http://www3.kmu.ac.jp/pathol1/index.html
© 2013 田中敏宏・上野博夫 Licensed under CC 表示 2.1 日本
(関西医科大学 病理学第一講座)
email:田中敏宏
DOI: 10.7875/first.author.2013.048
Identification of stem cells that maintain and regenerate lingual keratinized epithelial cells.
Toshihiro Tanaka, Yoshihiro Komai, Yoko Tokuyama, Hirotsugu Yanai, Shuichi Ohe, Kazuichi Okazaki, Hiroo Ueno
Nature Cell Biology, 15, 511-518 (2013)
要 約
舌の糸状乳頭を構成する角化上皮細胞は,哺乳類の生体においてターンオーバーのもっとも速い細胞のひとつであり,舌扁平上皮がんの起源とも考えられているが,その細胞維持の機構はほとんどわかっていない.すべての細胞をランダムに3色に標識する多色細胞系譜追跡法により長期にわたり観察したところ,舌の上皮組織の一定の領域が単色となり,その領域は1個の幹細胞に由来すると考えられた.そこで,ほかの臓器の一部において共通な幹細胞マーカーであるBmi1に注目して解析した.マウスの舌幹細胞はBmi1陽性サイトケラチン14陽性サイトケラチン5陽性であり,糸状乳頭のあいだのくぼみの底から2段目から3段目の位置にもっとも高頻度に存在した.そのほとんどは遅い増殖を示し,多色細胞系譜追跡法での観察により,1年以上の長期にわたり生存するのは1つのくぼみにつき1個のBmi1陽性幹細胞であった.それらは角化上皮細胞を供給するが味蕾細胞は供給しない単能性の幹細胞であった.また,放射線による傷害においてこれら幹細胞は抵抗性を認め,すみやかに増殖して上皮組織を再生した.さらに,その再生時期にBmi1をノックアウトすることにより上皮組織の再生は抑制された.以上の結果から,Bmi1陽性幹細胞は舌の上皮組織の維持および再生にきわめて重要であると考えられた.
はじめに
舌の糸状乳頭を構成する角化上皮細胞は,哺乳類の生体においてターンオーバーのもっとも速い細胞のひとつであり,舌扁平上皮がんの起源とも考えられているが,その細胞維持の機構についてはほとんどわかっていない.この研究において,筆者らは,マウスの舌幹細胞の同定と解析についてはじめて報告した.その結果は,これら幹細胞が舌の上皮組織の維持および再生に重要であることを証明するものであった.
1.舌の上皮組織における既知の幹細胞マーカーの発現と細胞系譜の解析
舌の上皮組織における既知の幹細胞マーカーの発現を免疫染色により調べた.サイトケラチン14およびサイトケラチン5は糸状乳頭のあいだのくぼみに発現が多く上層に移動するにしたがい発現は低下したが,合計ではおよそ1/3がこれらマーカーを発現していた.この結果は,過去の報告と矛盾しないものであり1),糸状乳頭のあいだのくぼみに舌の上皮前駆細胞が存在していることを示唆した.しかし,細胞増殖のマーカーであるKi67染色にて,分裂している細胞は舌の上皮組織の最下層の基底細胞のみであり,サイトケラチン14陽性細胞のうち上皮組織を供給している分裂細胞はごく一部であることが示された.この結果より,サイトケラチン14およびサイトケラチン5は幹細胞のマーカーとしては特異性の低いことが示唆された.ただし,過去の報告より,ほかの臓器の幹細胞ではさかんに分裂し組織細胞を供給している短期前駆細胞と,増殖の遅い長期幹細胞とが併存して役割分担している例が知られており,必ずしも分裂している細胞が幹細胞とはかぎらないことが知られている.
そこで,舌の上皮組織の基底細胞のうち,どの細胞が真の長期幹細胞であるかを調べるため,筆者らの開発した多色細胞系譜追跡法2-4) を用いて,舌の上皮組織を長期間にわたり維持可能である幹細胞の解析を試みた5-7).多色細胞系譜追跡法では,従来の方法8) に比べ,ある細胞集団に存在する長期幹細胞のクローン数を予測すること,また,異なった幹細胞に由来するクローンを区別することが容易になっている2,3).Rosa26rbw/+マウスはCreリコンビナーゼによるDNA組換えが起こると,緑色(GFP)を発現していた細胞が青色(mCerulean),オレンジ色(mOrange),赤色(mCherry)にランダムに変化する.全身のすべての細胞においてタモキシフェンの投与によりCreリコンビナーゼを発現させることのできるマウスとRosa26rbw/+マウスとを掛け合わせ,タモキシフェンの投与により成体の舌の上皮組織すべての細胞をランダムな3色にて標識した.その結果,投与から7日目および14日目までは多数の細胞が基底層から上層の方向へと増殖しているようすが観察され,基底細胞が分裂し分化した上皮細胞を供給しているという過去の報告と合致する結果であった9).しかし,1カ月後には糸状乳頭のあいだのくぼみを中心とした区画ごとにそれぞれ単色となり,ほぼ1個の長期幹細胞がその区画のすべての上皮組織を維持していることが明らかになった.この結果から,舌の上皮組織の基底細胞のうち,ごく一部(事実上,1個)が長期幹細胞であることが示された.
舌の上皮組織を維持する真の長期幹細胞を同定するため,種々の幹細胞マーカー遺伝子にCreリコンビナーゼの遺伝子をノックインしたマウスによる上皮組織の標識を試みた.幹細胞マーカー遺伝子のうち,villin遺伝子,shh遺伝子,Lgr5遺伝子を用いた細胞系譜の追跡では成体の舌の上皮組織の標識はまったく認められなかった.しかし,Creリコンビナーゼの遺伝子をBmi1遺伝子にノックインしたマウス10) を用いたところ,舌の上皮組織の標識が認められた.
Creリコンビナーゼ遺伝子をBmi1遺伝子にノックインしたマウスとRosa26rbw/+マウスを掛け合わせたマウスにおいて,タモキシフェンの投与によりCreリコンビナーゼを発現させたのち2日目に単一の標識細胞が確認され,約2週間までに標識された幹細胞に由来する細胞集団が角化層にまで到達した.Bmi1陽性細胞から供給された範囲は4週間で単一色の細胞集団によりうめつくされた.そののち6カ月以上にわたり蛍光標識された細胞は維持され,上皮組織を供給しつづけていることが観察された.これらの結果から,Bmi1陽性細胞は舌の上皮組織を維持する長期幹細胞であることが証明された.また,基底細胞はKi67陽性細胞でありさかんに分裂していることと比較すると,標識されたBmi1陽性細胞は7日目ごろまで分裂せず,そののち,分裂をはじめたことは,この細胞が基本的に増殖の遅い幹細胞であることを示した.
2.Bmi1陽性細胞の存在する位置
in situハイブリダイゼーション法により,Bmi1陽性細胞は糸状乳頭のあいだのくぼみの底部に存在しており,1つのくぼみのなかに基本的に最大でも1個のBmi1陽性細胞が認められた.また,Creリコンビナーゼ遺伝子をBmi1遺伝子にノックインしたマウスとRosa26rbw/+マウスを掛け合わせたマウスにおいて,タモキシフェンの投与によりCreリコンビナーゼを発現させたのち2日目に認められたBmi1陽性細胞に由来する細胞の位置と,in situハイブリダイゼーション法により観察されたBmi1陽性細胞の位置は基本的に合致していた.舌における位置とBmi1陽性細胞の位置に相関はなかった.in situハイブリダイゼーション法により,ほとんどの糸状乳頭のあいだのくぼみにBmi1陽性細胞が認められたにもかかわらず,Creリコンビナーゼ遺伝子をBmi1遺伝子にノックインしたマウスとRosa26rbw/+マウスを掛け合わせたマウスにおいて標識された細胞は,一部ではBmi1遺伝子プロモーターによるCreリコンビナーゼ遺伝子の発現が多くないため,この系において閾値に達しない細胞が多く存在したと思われた.
Bmi1陽性細胞は糸状乳頭のあいだのくぼみにおいて,もっとも下層ではなく,それよりやや上段に存在することが大部分であり,約50%が基底層から2~3個目の位置であった.水平断では,糸状乳頭は例外もあるが三角格子状にそって配置されていた.3つの糸状乳頭にかこまれた領域の中央にはくぼみがあり,そのなかにBmi1陽性幹細胞が存在した.タモキシフェンの投与ののち12週間の3次元画像において,1個のBmi1陽性幹細胞が維持する上皮組織の領域を解析した.1個のBmi1陽性細胞からの供給される細胞集団は糸状乳頭のあいだのくぼみ全体をしめ,それに由来する角化上皮細胞はくぼみの周囲に位置する3個(より少ない頻度では,4個)の糸状乳頭に及んでいた(図1).Creリコンビナーゼ遺伝子をBmi1遺伝子にノックインしたマウスとRosa26rbw/+マウスを掛け合わせたマウスを用いた場合,タモキシフェンを1回投与しただけでは一部の上皮細胞しか標識されなかったが,3回異なるタイミングで投与するとその頻度は非常に上昇した.興味深いことに,このように標識細胞の頻度を増加させた条件でもこのマウスにおいて味蕾細胞が標識されることはなかった.つまり,Bmi1陽性幹細胞は角化上皮細胞のみを維持しており,味蕾細胞を維持していないことがわかった.
3.Bmi1陽性細胞における組織維持の周期
EdUの投与後2時間でのEdU染色により,糸状乳頭のあいだのくぼみにおける増殖細胞の位置を確認した.EdU陽性細胞はKi67陽性の基底細胞と一致し,これらが非常にさかんに細胞分裂していることが確認できた.EdU陽性細胞はそののち分化しながら徐々に上層の方向へと移動し,最終的には角化上皮細胞となったのち,約7日で大半が脱落した.これらの結果は,舌の上皮組織における大部分の細胞のターンオーバー速度は約7日であることを示した.興味深いことに,Bmi1陽性幹細胞はEdUの投与後2時間のEdU陽性細胞およびKi67陽性細胞には含まれず,これらBmi1陽性幹細胞は細胞周期が遅いないし停止している細胞であることが確認できた.また,一部のBmi1陽性細胞はタモキシフェンの投与による標識ののち28日以上も分裂せず静止細胞のまま存在しつづけた.このことから,Bmi1陽性細胞は増殖の遅いことが確認できた.しかしながら,ごく一部のEdU陽性細胞は糸状乳頭のあいだのくぼみの下部に残り長期にわたり存在しつづけた.これらの細胞は,ほかの臓器で報告されているlabel retaining細胞と考えられた11).また,これらの細胞はBmi1陽性細胞とは重ならなかった.
4.Bmi1陽性細胞と既知の幹細胞マーカーとの関係
サイトケラチン14陽性細胞が角化上皮細胞および味蕾細胞の幹細胞を含むとする報告があるため1),Bmi1陽性細胞との関係を解析した.サイトケラチン14は基底細胞および傍基底細胞に広く発現を認め,角化層にむかうにつれ発現量の減少を認めた.Bmi1陽性細胞は基底細胞から2列目ないし3列目に位置し,サイトケラチン14の発現が基底細胞より低い細胞のなかに含まれた.Bmi1陽性細胞におけるサイトケラチン5の発現もサイトケラチン14と同様であった.
ここまでの結果をまとめると,Bmi1陽性細胞は糸状乳頭のあいだのくぼみに最大で1個が存在している(図2).サイトケラチン14陽性細胞は基底細胞から徐々に角化層にむかうにつれ発現が低下し,基底細胞においてKi67陽性細胞およびEdU陽性細胞などは増殖細胞に相当するが,その上部の2列目ないし3列目に存在しているBmi1陽性幹細胞はサイトケラチン14陽性サイトケラチン5陽性でありその増殖は遅かった.
5.Bmi1陽性の舌幹細胞は組織障害ののちの再生のとき機能する
放射線の照射による組織障害ののちの修復過程におけるBmi1陽性幹細胞の役割について解析した.以前に,15 Gyの放射線の照射にて5日目,20 Gyの放射線の照射にて6日目以降に細胞の増殖および再生を得たとの報告があったことから,10 Gyから20 Gyのあいだにおいて組織障害および障害ののちの修復を観察した.通常の状態ではBmi陽性細胞は7日目ころより増殖をはじめ標識された細胞が最上層の角化層に達するのに14日ほどかかった.10 Gyの放射線の照射では4日目にて舌の上皮組織において障害が認められたが,7日目にて照射のまえの状態にまで修復された.20 Gyの放射線の照射ではより高度の組織障害が認められ,一部は不可逆的であり,7日目に障害された組織において一部に再生された上皮組織が認められた.しかし,いずれの条件においても放射線の照射と同時にBmi1陽性細胞を標識すると,Bmi1陽性細胞に由来する細胞は4日目ごろより増殖をはじめ,7日目には基底層から角化層にまで達した.これは,通常の状態よりBmi1陽性細胞がはるかにすみやかに細胞分裂し上皮組織を修復したものであった.この結果より,Bmi1陽性細胞は通常でも放射線に抵抗性であり,正常のときにはその増殖は遅いが,障害のときにはただちに細胞周期移行し組織の修復および再生に機能することが明らかになった.
Bmi1を特異的にノックアウトすることを可能にしたマウスにおいて,放射線の照射ののちの再生過程においてBmi1を特異的にノックアウトすることで4日目以降の増殖を解析した.Ki67陽性細胞の数で比較したところ,放射線の照射ののちの状態と比較して,Bmi1をノックアウトしたマウスでは細胞の増殖が有意に抑制された.この結果からも,細胞の増殖および再生においてBmi1陽性細胞が重要であると考えられた.
おわりに
今回,筆者らは,舌の上皮組織を維持し障害のとき修復を担当するBmi1陽性幹細胞を同定した.この結果から,これらの幹細胞は味蕾細胞を供給しておらず,舌において角化上皮細胞と味蕾細胞は別個の幹細胞により維持されていると考えられた.Bmi1陽性幹細胞は増殖が遅く,正常のときにも14日程度の経過ののちランダムに細胞周期に移行した.しかし,放射線による障害のときにはすみやかに細胞周期に移行し再生をはじめた.造血幹細胞,皮膚幹細胞,腸幹細胞などほかの臓器においても,増殖の遅い長期幹細胞と長期の寿命をもたずさかんに分裂する短期幹細胞とが併存しており,それらの役割分担が明らかになりつつある.舌の場合には短期幹細胞の特異的なマーカーが明らかになっていないので,現時点において,それらの併存および役割分担など明らかではないが,サイトケラチン14陽性細胞,Ki67陽性細胞,EdU陽性細胞は細胞分裂期にあり,これらの少なくとも一部はほかの臓器の短期幹細胞に相当する細胞であると予想された.
いずれにせよ,舌の上皮組織は外界からの化合物や感染源などさまざまな障害にさらされやすい組織であり,進化の過程において障害のときの再生機構を十分に発達させてきたと考えられ,今回の研究において,その分子機構の一端がはじめて明らかになったといえる.舌の上皮組織に由来すると考えられる舌がんについては多くのことが不明であり,今後,がん化の過程における正常なBmi1陽性幹細胞の関与などが重要な研究テーマになると考えられる.
文 献
- Okubo, T., Clark, C. & Hogan, B. L.: Cell lineage mapping of taste bud cells and keratinocytes in the mouse tongue and soft palate. Stem Cells, 27, 442-450 (2009)[PubMed]
- Ueno, H., Turnbull, B. B. & Weissman, I. L.: Two-step oligoclonal development of male germ cells. Proc. Natl. Acad. Sci. USA, 106, 175-180 (2009)[PubMed]
- Ueno, H. & Weissman, I. L.: Clonal analysis of mouse development reveals a polyclonal origin for yolk sac blood islands. Dev. Cell, 11, 519-533 (2006)[PubMed]
- Ueno, H. & Weissman, I. L.: The origin and fate of yolk sac hematopoiesis: application of chimera analyses to developmental studies. Int. J. Dev. Biol., 54, 1019-1031 (2010)[PubMed]
- Zhang, H., Zheng, W., Shen, Y. et al.: Experimental evidence showing that no mitotically active female germline progenitors exist in postnatal mouse ovaries. Proc. Natl. Acad. Sci. USA, 109, 12580-12585 (2012)[PubMed]
- Rinkevich, Y., Lindau, P., Ueno, H. et al.: Germ-layer and lineage-restricted stem/progenitors regenerate the mouse digit tip. Nature, 476, 409-413 (2011)[PubMed]
- Red-Horse, K., Ueno, H., Weissman, I. L. et al.: Coronary arteries form by developmental reprogramming of venous cells. Nature, 464, 549-553 (2010)[PubMed]
- Soriano, P.: Generalized lacZ expression with the ROSA26 Cre reporter strain. Nat. Genet., 21, 70-71 (1999)[PubMed]
- Hume, W. J. & Potten, C. S.: The ordered columnar structure of mouse filiform papillae. J. Cell Sci., 22, 149-160 (1976)[PubMed]
- Sangiorgi, E. & Capecchi, M. R.: Bmi1 is expressed in vivo in intestinal stem cells. Nat Genet, 40, 915-920 (2008)[PubMed]
- Potten, C. S., Hume, W. J., Reid, P. et al.: The segregation of DNA in epithelial stem cells. Cell, 15, 899-906 (1978)[PubMed]
著者プロフィール
関西医科大学医学研究科博士課程 在学中.
研究テーマ:組織幹細胞.
抱負:病態の解明や治療へ応用の可能な幹細胞研究をめざします.
上野 博夫(Hiroo Ueno)
関西医科大学 教授.
研究室URL:http://www3.kmu.ac.jp/pathol1/index.html
© 2013 田中敏宏・上野博夫 Licensed under CC 表示 2.1 日本