複製因子様複合体であるElg1複合体はDNA複製においてDNA鎖からPCNAを取り除く機能をもつ
久保田隆史・Anne D. Donaldson
(英国Aberdeen大学Institute of Medical Sciences)
email:久保田隆史
DOI: 10.7875/first.author.2013.046
The Elg1 replication factor C-like complex functions in PCNA unloading during DNA replication.
Takashi Kubota, Kohei Nishimura, Masato T. Kanemaki, Anne D. Donaldson
Molecular Cell, 50, 273-280 (2013)
PCNAはDNA複製において中心的なはたらきをもつ.PCNAは環状のホモ三量体であり,DNA鎖をとりかこむよう結合し.DNAポリメラーゼや複製にかかわるタンパク質をDNA鎖にとどめるクランプとしてはたらく.これまで,複製因子RFCがPCNAをDNA鎖にロードすることはわかっていたが,PCNAをDNA鎖から取り除く機構は不明であった.この研究により,複製因子様複合体であるElg1複合体がPCNAをDNA鎖から取り除く機能をもつことが明らかになった.筆者らは,まずElg1を欠損した出芽酵母において,PCNAがS期にDNA鎖に異常に蓄積することを見い出した.そのDNA鎖に蓄積したPCNAはin vivoにおいてElg1を発現させることにより,また,in vitroにおいて精製したElg1複合体で処理することにより,取り除かれることが示された.
正確なDNA複製はすべての生物にとり重要である.PCNA(proliferating cell nuclear antigen,増殖細胞核抗原)はDNA複製において中心的なはたらきをもつ.PCNAはDNA鎖をとりかこむよう結合し,DNAポリメラーゼや複製にかかわるタンパク質をDNAにとどめるクランプ(留め金)としてはたらく1).DNA複製においてラギング鎖は不連続なOkazaki断片として合成されていく.Okazaki断片は約200塩基からなり,PCNAは約200塩基ごとにDNA鎖にロードされると考えられている.これまで,PCNAは複製因子RFCによりDNA鎖にロードされることがわかっていたが2),PCNAをDNA鎖から取り除く機構は不明であった.
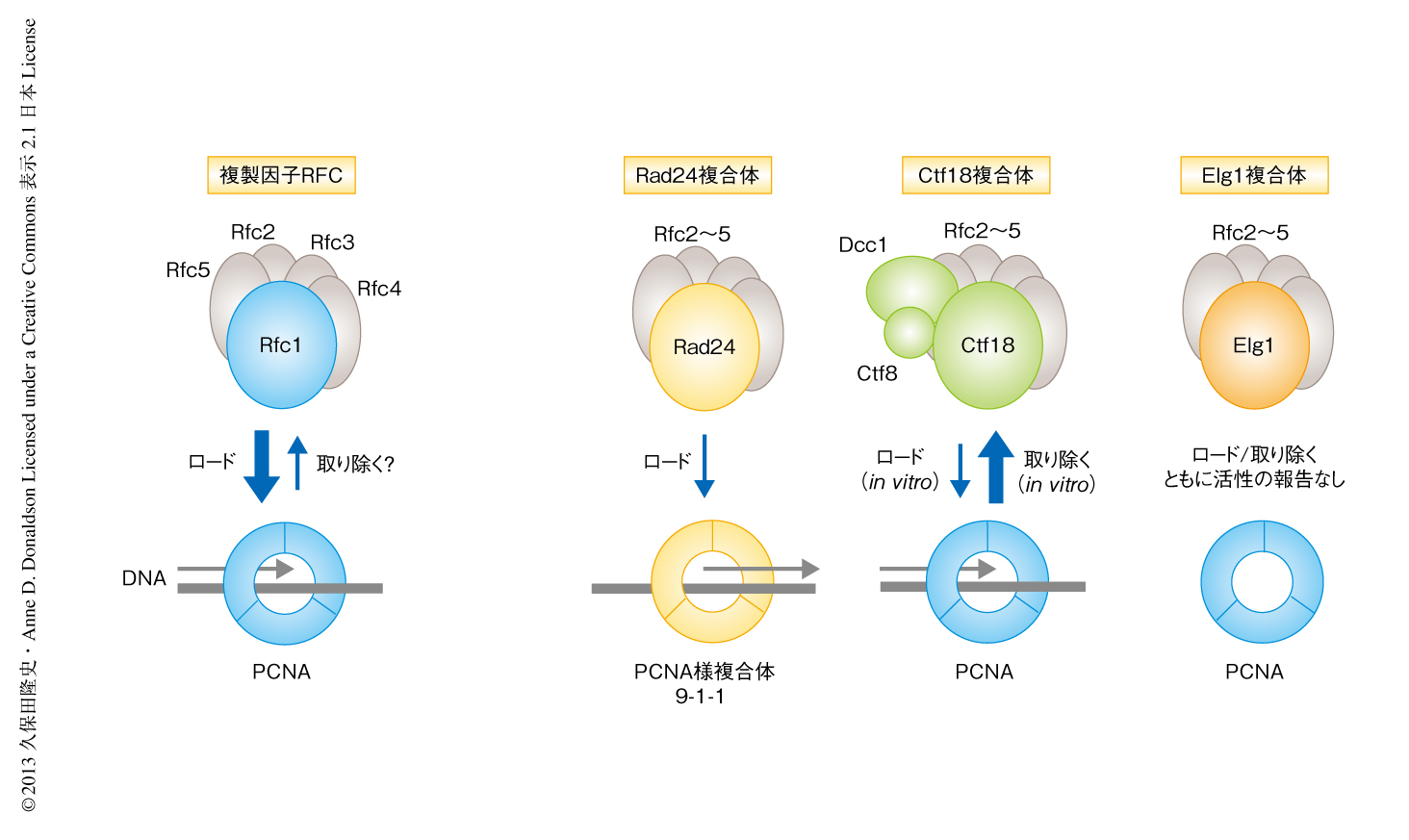
真核生物はRad24複合体,Ctf18複合体,Elg1複合体の3つの複製因子様複合体をもつ3).複製因子RFCは五量体からなり,いちばん大きいサブユニットRfc1と小さいサブユニットRfc2~Rfc5から構成されている.3つの複製因子様複合体も小さいサブユニットRfc2~Rfc5を共通にもち,Rfc1の代わりとしてRad24,Ctf18,あるいは,Elg1をもつ(図1).Elg1複合体はPCNAと結合するが,PCNAをDNA鎖にロードする活性やDNA鎖から取り除く活性については報告されていない4).Ctf18複合体はin vitroにおいてPCNAをDNA鎖にロードする活性および取り除く活性を示すが,in vivoにおける機能は明らかになっていない5).筆者らの以前の研究から,in vivoにおいてDNA鎖にPCNAをロードする機能あるいは取り除く機能は,Ctf18複合体のおもな機能ではないことが示唆されている6).Rad24複合体はPCNA様複合体9-1-1をDNA損傷部位にロードする活性をもつとされる.この研究において,筆者らは,機能の明らかになっていないElg1複合体の機能解析を行った.
Elg1複合体の機能を調べるため,Elg1を欠損した出芽酵母においてクロマチンにどのような異常が現われるか調べた.方法としては,質量分析法によりタンパク質を定量できるSILAC法を用いた6,7).その結果,Elg1欠損株においてPCNAがクロマチンに異常に蓄積することが見い出された.また,SUMO化されたPCNAもElg1欠損株においてクロマチンに蓄積した.これまで,DNAに結合したPCNAはDNA損傷の有無によらずSUMO化されることが報告されている.
Elg1の非存在下において,いつPCNAがクロマチンに蓄積するか調べた.方法としては,タンパク質の分解を誘導できるAID(Auxin-inducible degron)系を用いた8).出芽酵母をG1期に同調したのち,Elg1の分解を誘導したうえで,S期に進行させ,クロマチンに結合したPCNAをウェスタンブロット法により定量した.その結果,Elg1の非存在下においてPCNAは最初のS期にクロマチンに蓄積しはじめることが見い出された.また,PCNAはG2期になってもクロマチンに残存していた.
なぜPCNAはElg1の非存在下においてクロマチンに蓄積するのか,可能性として,Elg1複合体のもつPCNAを取り除く活性が失われたため,あるいは,それとは異なる機能の欠損によりひき起こされた2次的な要因が考えられた.以前の論文において,Elg1の欠損によりOkazaki断片のプロセシングの遅れがひき起こされたり,DNAの損傷が増加したりする可能性が示唆されていた4,9).どちらも,クロマチンにおけるPCNAの蓄積をひき起こす要因となりうるものである.そこで,Elg1の非存在下においてOkazaki断片のプロセシングに遅れが生じるかどうか検証した.その結果,DNAリガーゼの非存在下では予想どおりOkazaki断片の蓄積がみられたが,Elg1の非存在下ではOkazaki断片の蓄積はみられず,Elg1の非存在下におけるPCNAの蓄積はOkazaki断片のプロセシングの遅れによるものではないことが示された.また,Elg1の非存在においてDNAの傷害が増加することも観察されず,PCNAの蓄積がDNA傷害の増加によるものである可能性も否定された.
Elg1複合体がPCNAを取り除く活性をもつかどうか検証した.まず,細胞においてElg1の発現をオフの状態からオンの状態にしたとき,PCNAがクロマチンから取り除かれるかどうかを調べた.Elg1の発現を制御するためELG1遺伝子をGALプロモーターの制御下においた.GALプロモーターはグルコースの存在下でオフになり,ガラクトースの存在下でオンになる.Elg1の発現がオフの状態の出芽酵母をG1期に同調し,そののち,S期に進行させた.ガラクトースをS期またはG2期において添加することでElg1の発現を誘導させ,このとき,クロマチンに蓄積したPCNAが減少するかどうかを検証した.その結果,S期あるいはG2期によらず,Elg1の発現を誘導することによりPCNAの蓄積が減少することが見い出された.また,複製因子RFCの大サブユニットRfc1や,ほかの複製因子様複合体の大サブユニットCtf18あるいはRad24を過剰に発現させても,クロマチンに蓄積したPCNAの減少はみられなかった.
Elg1複合体がin vitroの系においてPCNAをクロマチンから取り除くことができるかどうか検証した.以前の論文において,Elg1複合体にはin vitroにおいてPCNAを取り除く活性はないことが示されていた5).しかし,その論文では,精製したタンパク質と合成したDNAを用いていたため,in vivoの状態を反映していない可能性が高いと考えた.そこで,よりin vivoの状態に近い基質であるクロマチンを用いた.Elg1を欠損した出芽酵母から調製したクロマチンを,出芽酵母から精製したElg1複合体により処理し,クロマチンに蓄積したPCNAが減少するかどうか検証した.その結果,Elg1複合体はクロマチンに蓄積したPCNAを取り除く活性をもつことが示された.
Elg1複合体はSUMO化されたPCNAに好んで結合することが示されていたことから10),SUMO化されたPCNAのみを取り除いている可能性が考えられた.そこで,Elg1複合体が未修飾のPCNAを取り除く活性をもつのかどうか検証した.SUMO化修飾部位に変異をもつPCNA変異体を用いたところ,このPCNA変異体もElg1を欠損した出芽酵母においてクロマチンに異常に蓄積した.このことから,Elg1複合体は未修飾のPCNA,および,SUMO化されたPCNAの両方をクロマチンから取り除く活性をもつものと考えられた.
この研究より考えられたモデルを示す(図2).複製因子RFCによりDNA鎖にロードされたPCNAは,Okazaki断片のプロセシングが終了したのち,Elg1複合体により取り除かれる.このとき,Elg1複合体は未修飾のPCNAおよびSUMO化されたPCNAの両方を取り除く.Elg1を欠損した出芽酵母では,PCNAは取り除かれずにDNA鎖に残る.その場合,DNA鎖にロードされたPCNAはSUMO化の標的となるため,結果として,PCNAは過剰にSUMO化されることが考えられる.Elg1の非存在下でもPCNAは最終的にDNA鎖から取り除かれるため,代替としてDNA鎖からPCNAを取り除く機構があるものと考えられる.それらの機構は複製因子RFCや複製因子様複合体Ctf18複合体によるのかもしれない.
今後は,Elg1複合体によりPCNAが取り除かれる機構の解明をめざしていきたい.この機構においては,Elg1複合体と協同するほかのタンパク質が必要なことや,DNAの構造が重要であることが予想される.
略歴:2008年 東京理科大学大学院理工学研究科博士課程 修了,同年より英国Aberdeen大学 ポスドク研究員.
研究テーマ:DNAにおけるすべてのイベント.
関心事:自分の遺伝子を後世に残すべきか.
Anne D. Donaldson
英国Aberdeen大学 教授.
© 2013 久保田隆史・Anne D. Donaldson Licensed under CC 表示 2.1 日本
(英国Aberdeen大学Institute of Medical Sciences)
email:久保田隆史
DOI: 10.7875/first.author.2013.046
The Elg1 replication factor C-like complex functions in PCNA unloading during DNA replication.
Takashi Kubota, Kohei Nishimura, Masato T. Kanemaki, Anne D. Donaldson
Molecular Cell, 50, 273-280 (2013)
要 約
PCNAはDNA複製において中心的なはたらきをもつ.PCNAは環状のホモ三量体であり,DNA鎖をとりかこむよう結合し.DNAポリメラーゼや複製にかかわるタンパク質をDNA鎖にとどめるクランプとしてはたらく.これまで,複製因子RFCがPCNAをDNA鎖にロードすることはわかっていたが,PCNAをDNA鎖から取り除く機構は不明であった.この研究により,複製因子様複合体であるElg1複合体がPCNAをDNA鎖から取り除く機能をもつことが明らかになった.筆者らは,まずElg1を欠損した出芽酵母において,PCNAがS期にDNA鎖に異常に蓄積することを見い出した.そのDNA鎖に蓄積したPCNAはin vivoにおいてElg1を発現させることにより,また,in vitroにおいて精製したElg1複合体で処理することにより,取り除かれることが示された.
はじめに
正確なDNA複製はすべての生物にとり重要である.PCNA(proliferating cell nuclear antigen,増殖細胞核抗原)はDNA複製において中心的なはたらきをもつ.PCNAはDNA鎖をとりかこむよう結合し,DNAポリメラーゼや複製にかかわるタンパク質をDNAにとどめるクランプ(留め金)としてはたらく1).DNA複製においてラギング鎖は不連続なOkazaki断片として合成されていく.Okazaki断片は約200塩基からなり,PCNAは約200塩基ごとにDNA鎖にロードされると考えられている.これまで,PCNAは複製因子RFCによりDNA鎖にロードされることがわかっていたが2),PCNAをDNA鎖から取り除く機構は不明であった.
真核生物はRad24複合体,Ctf18複合体,Elg1複合体の3つの複製因子様複合体をもつ3).複製因子RFCは五量体からなり,いちばん大きいサブユニットRfc1と小さいサブユニットRfc2~Rfc5から構成されている.3つの複製因子様複合体も小さいサブユニットRfc2~Rfc5を共通にもち,Rfc1の代わりとしてRad24,Ctf18,あるいは,Elg1をもつ(図1).Elg1複合体はPCNAと結合するが,PCNAをDNA鎖にロードする活性やDNA鎖から取り除く活性については報告されていない4).Ctf18複合体はin vitroにおいてPCNAをDNA鎖にロードする活性および取り除く活性を示すが,in vivoにおける機能は明らかになっていない5).筆者らの以前の研究から,in vivoにおいてDNA鎖にPCNAをロードする機能あるいは取り除く機能は,Ctf18複合体のおもな機能ではないことが示唆されている6).Rad24複合体はPCNA様複合体9-1-1をDNA損傷部位にロードする活性をもつとされる.この研究において,筆者らは,機能の明らかになっていないElg1複合体の機能解析を行った.
1.PCNAはElg1を欠損した出芽酵母においてクロマチンに蓄積する
Elg1複合体の機能を調べるため,Elg1を欠損した出芽酵母においてクロマチンにどのような異常が現われるか調べた.方法としては,質量分析法によりタンパク質を定量できるSILAC法を用いた6,7).その結果,Elg1欠損株においてPCNAがクロマチンに異常に蓄積することが見い出された.また,SUMO化されたPCNAもElg1欠損株においてクロマチンに蓄積した.これまで,DNAに結合したPCNAはDNA損傷の有無によらずSUMO化されることが報告されている.
2.PCNAはElg1の非存在下においてS期にクロマチンに蓄積する
Elg1の非存在下において,いつPCNAがクロマチンに蓄積するか調べた.方法としては,タンパク質の分解を誘導できるAID(Auxin-inducible degron)系を用いた8).出芽酵母をG1期に同調したのち,Elg1の分解を誘導したうえで,S期に進行させ,クロマチンに結合したPCNAをウェスタンブロット法により定量した.その結果,Elg1の非存在下においてPCNAは最初のS期にクロマチンに蓄積しはじめることが見い出された.また,PCNAはG2期になってもクロマチンに残存していた.
3.Elg1の非存在下におけるPCNAの蓄積はOkazaki断片のプロセシングの遅れやDNAの傷害によるものではない
なぜPCNAはElg1の非存在下においてクロマチンに蓄積するのか,可能性として,Elg1複合体のもつPCNAを取り除く活性が失われたため,あるいは,それとは異なる機能の欠損によりひき起こされた2次的な要因が考えられた.以前の論文において,Elg1の欠損によりOkazaki断片のプロセシングの遅れがひき起こされたり,DNAの損傷が増加したりする可能性が示唆されていた4,9).どちらも,クロマチンにおけるPCNAの蓄積をひき起こす要因となりうるものである.そこで,Elg1の非存在下においてOkazaki断片のプロセシングに遅れが生じるかどうか検証した.その結果,DNAリガーゼの非存在下では予想どおりOkazaki断片の蓄積がみられたが,Elg1の非存在下ではOkazaki断片の蓄積はみられず,Elg1の非存在下におけるPCNAの蓄積はOkazaki断片のプロセシングの遅れによるものではないことが示された.また,Elg1の非存在においてDNAの傷害が増加することも観察されず,PCNAの蓄積がDNA傷害の増加によるものである可能性も否定された.
4.蓄積したPCNAはElg1の発現を誘導することにより減少する
Elg1複合体がPCNAを取り除く活性をもつかどうか検証した.まず,細胞においてElg1の発現をオフの状態からオンの状態にしたとき,PCNAがクロマチンから取り除かれるかどうかを調べた.Elg1の発現を制御するためELG1遺伝子をGALプロモーターの制御下においた.GALプロモーターはグルコースの存在下でオフになり,ガラクトースの存在下でオンになる.Elg1の発現がオフの状態の出芽酵母をG1期に同調し,そののち,S期に進行させた.ガラクトースをS期またはG2期において添加することでElg1の発現を誘導させ,このとき,クロマチンに蓄積したPCNAが減少するかどうかを検証した.その結果,S期あるいはG2期によらず,Elg1の発現を誘導することによりPCNAの蓄積が減少することが見い出された.また,複製因子RFCの大サブユニットRfc1や,ほかの複製因子様複合体の大サブユニットCtf18あるいはRad24を過剰に発現させても,クロマチンに蓄積したPCNAの減少はみられなかった.
5.蓄積したPCNAはElg1複合体によりクロマチンから取り除かれる
Elg1複合体がin vitroの系においてPCNAをクロマチンから取り除くことができるかどうか検証した.以前の論文において,Elg1複合体にはin vitroにおいてPCNAを取り除く活性はないことが示されていた5).しかし,その論文では,精製したタンパク質と合成したDNAを用いていたため,in vivoの状態を反映していない可能性が高いと考えた.そこで,よりin vivoの状態に近い基質であるクロマチンを用いた.Elg1を欠損した出芽酵母から調製したクロマチンを,出芽酵母から精製したElg1複合体により処理し,クロマチンに蓄積したPCNAが減少するかどうか検証した.その結果,Elg1複合体はクロマチンに蓄積したPCNAを取り除く活性をもつことが示された.
6.Elg1複合体は未修飾およびSUMO化されたPCNAをクロマチンから取り除く
Elg1複合体はSUMO化されたPCNAに好んで結合することが示されていたことから10),SUMO化されたPCNAのみを取り除いている可能性が考えられた.そこで,Elg1複合体が未修飾のPCNAを取り除く活性をもつのかどうか検証した.SUMO化修飾部位に変異をもつPCNA変異体を用いたところ,このPCNA変異体もElg1を欠損した出芽酵母においてクロマチンに異常に蓄積した.このことから,Elg1複合体は未修飾のPCNA,および,SUMO化されたPCNAの両方をクロマチンから取り除く活性をもつものと考えられた.
おわりに
この研究より考えられたモデルを示す(図2).複製因子RFCによりDNA鎖にロードされたPCNAは,Okazaki断片のプロセシングが終了したのち,Elg1複合体により取り除かれる.このとき,Elg1複合体は未修飾のPCNAおよびSUMO化されたPCNAの両方を取り除く.Elg1を欠損した出芽酵母では,PCNAは取り除かれずにDNA鎖に残る.その場合,DNA鎖にロードされたPCNAはSUMO化の標的となるため,結果として,PCNAは過剰にSUMO化されることが考えられる.Elg1の非存在下でもPCNAは最終的にDNA鎖から取り除かれるため,代替としてDNA鎖からPCNAを取り除く機構があるものと考えられる.それらの機構は複製因子RFCや複製因子様複合体Ctf18複合体によるのかもしれない.
今後は,Elg1複合体によりPCNAが取り除かれる機構の解明をめざしていきたい.この機構においては,Elg1複合体と協同するほかのタンパク質が必要なことや,DNAの構造が重要であることが予想される.
文 献
- Moldovan, G. L., Pfander, B. & Jentsch, S.: PCNA, the maestro of the replication fork. Cell, 129, 665-679 (2007)[PubMed]
- Gomes, X. V. & Burgers, P. M.: ATP utilization by yeast replication factor C. I. ATP-mediated interaction with DNA and with proliferating cell nuclear antigen. J. Biol. Chem., 276, 34768-34775 (2001)[PubMed]
- Kim, J. & MacNeill, S. A.: Genome stability: a new member of the RFC family. Curr. Biol., 13, R873-R875 (2003)[PubMed]
- Kanellis, P., Agyei, R. & Durocher, D.: Elg1 forms an alternative PCNA-interacting RFC complex required to maintain genome stability. Curr. Biol., 13, 1583-1595 (2003)[PubMed]
- Bylund, G. O. & Burgers, P. M.: Replication protein A-directed unloading of PCNA by the Ctf18 cohesion establishment complex. Mol. Cell. Biol., 25, 5445-5455 (2005)[PubMed]
- Kubota, T., Hiraga, S., Yamada, K. et al.: Quantitative proteomic analysis of chromatin reveals that Ctf18 acts in the DNA replication checkpoint. Mol. Cell. Proteomics, 10, M110.005561 (2011)[PubMed]
- Kubota, T., Stead, D. A., Hiraga, S. -i. et al.: Quantitative proteomic analysis of yeast DNA replication proteins. Methods, 57, 196-202 (2012)[PubMed]
- Nishimura, K., Fukagawa, T., Takisawa, H. et al.: An auxin-based degron system for the rapid depletion of proteins in nonplant cells. Nat. Methods, 6, 917-922 (2009)[PubMed]
- Davidson, M. B. & Brown, G. W.: The N- and C-termini of Elg1 contribute to the maintenance of genome stability. DNA Repair, 7, 1221-1232 (2008)[PubMed]
- Parnas, O., Zipin-Roitman, A., Pfander, B. et al.: Elg1, an alternative subunit of the RFC clamp loader, preferentially interacts with SUMOylated PCNA. EMBO J., 29, 2611-2622 (2010)[PubMed]
著者プロフィール
略歴:2008年 東京理科大学大学院理工学研究科博士課程 修了,同年より英国Aberdeen大学 ポスドク研究員.
研究テーマ:DNAにおけるすべてのイベント.
関心事:自分の遺伝子を後世に残すべきか.
Anne D. Donaldson
英国Aberdeen大学 教授.
© 2013 久保田隆史・Anne D. Donaldson Licensed under CC 表示 2.1 日本