ユビキチンリガーゼFbxw7の阻害は白血病幹細胞を静止期から追い出しこれを根絶する
武石昭一郎・中山敬一
(九州大学生体防御医学研究所 分子医科学分野)
email:武石昭一郎
DOI: 10.7875/first.author.2013.042
Ablation of Fbxw7 eliminates leukemia-initiating cells by preventing quiescence.
Shoichiro Takeishi, Akinobu Matsumoto, Ichiro Onoyama, Kazuhito Naka, Atsushi Hirao, Keiichi I. Nakayama
Cancer Cell, 23, 347-361 (2013)
近年,少なくとも一部のがんにおいて,がん組織は“がん幹細胞”により維持されていることが明らかになった.これまでの研究により,がん幹細胞は細胞周期を脱出し静止期にとどまっていることが判明しているが,この知見はがん治療の戦略を考えるうえで非常に重要である.なぜなら,従来のがん治療法は増殖能が亢進したがん細胞の細胞周期の進行をさまたげることを目的として開発されてきたため,この治療法では静止期に維持されているがん幹細胞を標的とすることができないからである.このため,がん幹細胞は治療ののちも残存し再発や転移をひき起こす.したがって,がん幹細胞の治療抵抗性の一因となっている静止期への維持機構を解明することは,がんの根治にむけた新たな治療法の開発につながることが期待される.今回,筆者らは,ユビキチンリガーゼFbxw7は細胞周期のアクセルとしてはたらくc-Mycを分解することにより白血病幹細胞を静止期に維持していることをつきとめた.さらに,Fbxw7を欠損させた白血病幹細胞は抗がん剤に感受性になっていることを明らかにし,Fbxw7阻害と抗がん剤を併用することにより白血病マウスモデルにおいて白血病幹細胞を根絶させ,治療ののちの再発を著明に減少させることに成功した.
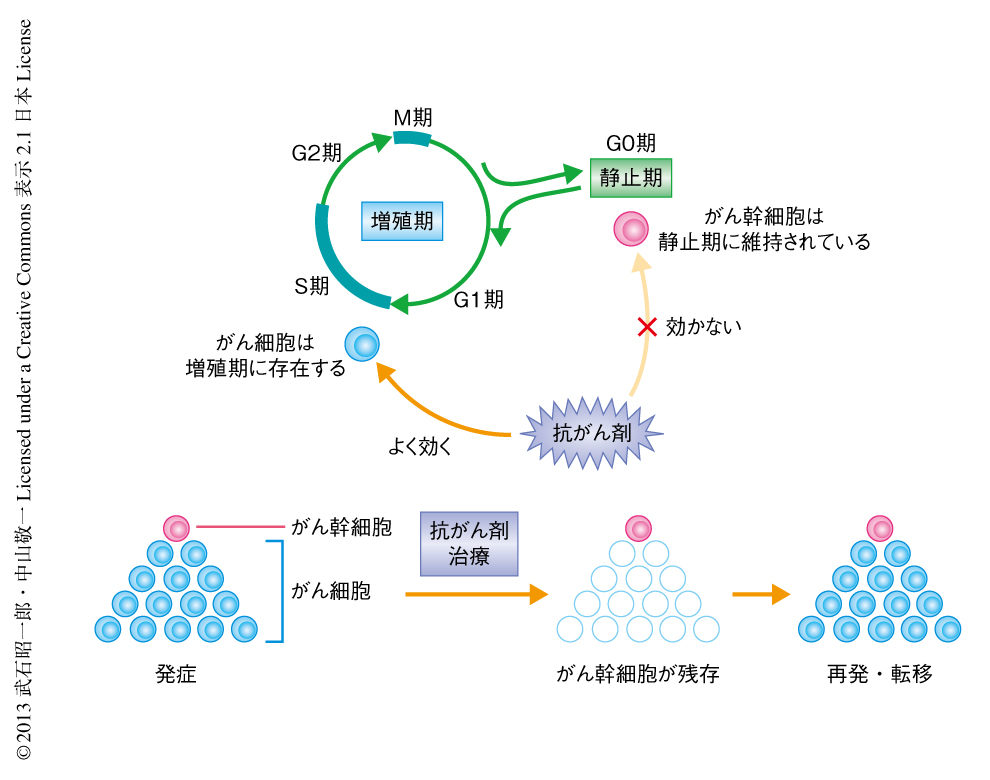
近年,少なくとも一部のがんにおいて,がん組織を構成する細胞にヒエラルキーが存在し,多くのがん細胞はこのヒエラルキーの頂点にあるがん幹細胞から生じると考えられるようになった1).これまでの研究により,がん細胞が増殖期にあってさかんに細胞増殖を行っているのとは対照的に,がん幹細胞は細胞周期を脱出して静止期にとどまっており細胞増殖をほとんど行っていないことが明らかになったが,この知見は,がん治療法にパラダイムシフトを起こした.がん治療法のひとつに抗がん剤治療があげられるが,がん幹細胞が同定される以前の抗がん剤は,増殖期にあるがん細胞の細胞周期の進行をさまたげることを目的として開発されてきた.例をあげれば,抗がん剤のうち5-FUやAra-Cなどの代謝拮抗剤はDNA合成やDNAポリメラーゼを阻害し,また,エトポシドなどトポイソメラーゼ阻害薬はトポイソメラーゼの活性を阻害することにより細胞周期のS期に作用,また,ビンクリスチンやパクリタキセルなどアルカロイド系抗がん剤は微小管重合の阻害により細胞周期のM期に作用して,それぞれ細胞周期の進行をさまたげる.これらはその作用機序から明らかなように増殖期にあるがん細胞を標的にしている.ところが,がん幹細胞は静止期にとどまっているためこれらの薬剤は効果がなく,がん幹細胞の静止期への維持機構は抗がん剤耐性の一因となっている.したがって,従来のがん治療法では,増殖期にあるがん細胞を死滅させがんが治癒したと思われる場合でも,その多くにおいてがん幹細胞が残存している.原発巣においてこの残存したがん幹細胞から再びがん細胞が生じるのが“再発”であり,がん幹細胞がほかの部位へと移動しがん細胞を生じるのが“転移”である(図1).これらの事実は,がんを根治するためにはがん幹細胞の根絶が必要であることを示している.がん幹細胞の静止期への維持機構を解明することは,がん幹細胞の治療抵抗性の打破,ひいては,がん根治療法の開発に直結すると期待されるが,その詳細な分子機構はこれまで明らかにされていなかった.
がん幹細胞が静止期に維持されている原因は,この細胞において細胞周期のアクセルとしてはたらくタンパク質の発現が抑制されているためではないかと考えた.細胞周期のアクセルタンパク質として有名なもののひとつにc-Mycがあるが,このc-Mycはユビキチン-プロテアソーム系により分解されることが知られている.筆者らは以前に,c-Mycの分解において機能するユビキチンリガーゼがFbxw7(F-box and WD40 repeat domain-containing 7)であることを発見している2).そこで今回,Fbxw7はc-Mycを分解することによりがん幹細胞を静止期に維持しているのではないかと仮説をたてた.
この仮説を慢性骨髄性白血病(chronic myeloid leukemia:CML)におけるがん幹細胞(白血病幹細胞)において検証した.慢性骨髄性白血病は第22染色体のBCR遺伝子が染色体転座により第9染色体のABL遺伝子と結合しBCR-ABL融合遺伝子が形成されることにより発症する.さらに,これまでの研究により,この染色体転座は正常な造血幹細胞において起こり,その結果として,慢性骨髄性白血病の白血病幹細胞が出現することがわかっている3).そこでまず,正常な造血幹細胞にBCR-ABL融合遺伝子を導入したのち,この細胞をレシピエントマウスに移植することにより慢性骨髄性白血病マウスモデルを作製した.そして,リアルタイムPCR法により白血病細胞のそれぞれの分化段階においてFbxw7の発現量を調べたところ,Fbxw7は白血病幹細胞においてもっとも高く発現していることがわかった.このことは,Fbxw7が白血病幹細胞を静止期に維持しているという仮説に適合していた.
白血病幹細胞の静止期への維持におけるFbxw7の役割を明らかにするため,慢性骨髄性白血病マウスモデルの白血病細胞においてFbxw7を遺伝学的に欠損させた.そして,白血病幹細胞の細胞周期の解析を行ったところ,Fbxw7を欠損させることにより静止期にとどまっている白血病幹細胞の割合が減少したことをつきとめた.この結果は,Fbxw7が白血病幹細胞を静止期に維持する役割をもつことを示したが,つぎに,この分子機構にc-Mycがかかわっているかどうかを調べた.まず,白血病幹細胞におけるc-Mycのタンパク質量を調べ,Fbxw7を欠損させることにより白血病幹細胞においてc-Mycのタンパク質量が増加していることを確認した.つぎに,Fbxw7を欠損した白血病幹細胞における静止期の破綻がc-Mycの蓄積によるものであるかどうかを調べるため,この細胞においてさらにc-myc遺伝子の片方の対立遺伝子を欠損させたところ,Fbxw7の欠損による表現型は回復した.以上の結果から,Fbxw7はc-Mycを分解することにより白血病幹細胞において静止期維持タンパク質として機能していることが明らかになった.がん幹細胞の静止期への維持機構の解明はがん根治療法の開発に直結すると考えられることからこの問題の解決にむけた研究は世界中で行われているが4,5),今回の結果は,細胞周期を直接に制御することによりがん幹細胞を静止期に維持しているタンパク質をはじめて同定したものであった.
がん幹細胞の静止期への維持機構は抗がん剤への抵抗性の一因となっている.慢性骨髄性白血病に対する抗がん剤に関しては,これまでに数種類のBCR-ABL阻害剤(チロシンキナーゼ阻害剤)が開発されている.はじめに開発されたBCR-ABL阻害剤はイマチニブであるが,このイマチニブの登場は慢性骨髄性白血病患者の予後を劇的に改善させた6).しかしそののち,イマチニブは増殖している白血病細胞には著効するものの,静止期の白血病幹細胞には効かないことが報告された7).これまでに,ニロチニブやダサチニブといった第2世代のBCR-ABL阻害剤も開発され,すでに実際の慢性骨髄性白血病の治療に用いられているが,これらの薬剤もまた静止期の白血病幹細胞に対する治療効果の乏しいことが指摘されている8).これらの知見から,慢性骨髄性白血病の白血病幹細胞においても,やはり静止期への維持機構が抗がん剤抵抗性の原因となっていることがわかる.Fbxw7を欠損した白血病幹細胞は静止期を維持できなくなっていたことから,この細胞はBCR-ABL阻害剤に感受性になっているのではないかと思われた.そこでこの可能性を検証するため,慢性骨髄性白血病マウスモデルにイマチニブを投与し,白血病幹細胞の画分におけるアポトーシス細胞の割合を調べた.すると,Fbxw7を欠損させたのちイマチニブを投与すると,アポトーシスを起こす白血病幹細胞の割合が著明に亢進することが判明した.このことは,Fbxw7を欠損させることにより白血病幹細胞は抗がん剤に感受性になることを示していた.
イマチニブの開発は慢性骨髄性白血病の患者の予後を劇的に改善したが,最近の臨床研究において,イマチニブの投与により2年以上の寛解(白血病細胞が検出限界以下となること)を維持している患者において,イマチニブ投与を中止すると約60%の患者が6か月以内に再発することが報告されている9).この事実は,イマチニブ治療を長期にわたりうけている慢性骨髄性白血病の患者の過半数において,白血病幹細胞が残存していることを示唆する.Fbxw7を欠損した白血病幹細胞がイマチニブに感受性になっていたことから,Fbxw7の阻害とイマチニブの投与を併用することにより,イマチニブ投与を中止したのちの再発を抑えることができるのではないかと考えた.そこで,慢性骨髄性白血病マウスモデルの生存率を調べたところ,イマチニブの単独投与群では無治療群と比較して生存期間は延長したものの,イマチニブの投与を中止するとほとんどのマウスにおいて再発を認めた.この結果は,慢性骨髄性白血病マウスモデルにおいても慢性骨髄性白血病の患者と同様に,イマチニブは増殖している白血病細胞には著効するものの静止期の白血病幹細胞には効かず,この細胞集団が残存していることを示した.これとは対照的に,Fbxw7を欠損させたのちにイマチニブを投与した慢性骨髄性白血病マウスモデルでは,イマチニブの投与を中止しても再発はほとんどみられず,Fbxw7欠損+イマチニブの併用により白血病幹細胞は根絶されていた.
最後に,この併用療法の効果がヒト白血病幹細胞においてもみられるかどうかを検証するため,慢性骨髄性白血病の患者に由来する白血病幹細胞においてFbxw7をノックダウンしたのちイマチニブ処理を行い,コロニー形成能を調べた.すると,Fbxw7ノックダウン+イマチニブ処理を行った際のコロニー形成能は,イマチニブ処理のみを行った場合と比較して著明に抑制されていた.この結果は,Fbxw7阻害+イマチニブの併用がヒトの白血病幹細胞に対しても有効であることを示しており,白血病の治療においてFbxw7は有望な標的であると結論づけた.
この研究により,Fbxw7を阻害することで白血病幹細胞を静止期から追い出し,抗がん剤を併用することにより白血病幹細胞を根絶できることが明らかになった(図2).筆者らは,この新たながん治療戦略を“静止期追い出し療法”と命名し,実際のがん治療への応用へむけさらに検討を重ねている.1つ目の検討課題は,Fbxw7の機能を阻害する手段である.今回の研究では,白血病細胞において遺伝学的な手法によりFbxw7を欠損させているが,臨床応用のためにはFbxw7の阻害剤が必要となるため,現在,そのスクリーニングを行っている.2つ目の検討課題は,ほかのがんへの応用である.がん幹細胞は白血病をはじめとして,乳がん,脳腫瘍,大腸がんなど,さまざまながんにおいて同定されているが,これらのがんにおけるがん幹細胞は共通の細胞生物学的な特性を数多くもつことが知られている.したがって,Fbxw7は白血病のみならず,ほかのがんの幹細胞においても治療抵抗性の原因になっている可能性が考えられる.Fbxw7阻害剤の開発により,白血病のみならず多くのがんにおいて,がん根治療法を実現できるのではないかと期待している.
この研究の結果は,基礎医学の手法を用いた実験動物の解析にもとづいたものであるが,実際のがん治療への応用にあたっては,このような基礎医学の見地からの検討だけでなく,臨床の現場から得られる知見も非常に重要である.基礎研究者と臨床家とで濃厚な議論を重ねることが,真に有力な抗がん治療法の確立につながると確信している.
略歴:2013年 九州大学大学院医学研究院 修了.
研究テーマ:がん幹細胞の静止期への維持機構.
抱負:幹細胞の生物学的な特性の包括的な理解をとおし,生命の設計図のしくみという生物学におけるもっとも大きな命題に取り組むとともに,がん治療や再生医療など臨床医学へ真に貢献できる研究の礎を築きたい.
中山 敬一(Keiichi I. Nakayama)
九州大学生体防御医学研究所 教授.
研究室URL:http://www.bioreg.kyushu-u.ac.jp/saibou/index.html
© 2013 武石昭一郎・中山敬一 Licensed under CC 表示 2.1 日本
(九州大学生体防御医学研究所 分子医科学分野)
email:武石昭一郎
DOI: 10.7875/first.author.2013.042
Ablation of Fbxw7 eliminates leukemia-initiating cells by preventing quiescence.
Shoichiro Takeishi, Akinobu Matsumoto, Ichiro Onoyama, Kazuhito Naka, Atsushi Hirao, Keiichi I. Nakayama
Cancer Cell, 23, 347-361 (2013)
要 約
近年,少なくとも一部のがんにおいて,がん組織は“がん幹細胞”により維持されていることが明らかになった.これまでの研究により,がん幹細胞は細胞周期を脱出し静止期にとどまっていることが判明しているが,この知見はがん治療の戦略を考えるうえで非常に重要である.なぜなら,従来のがん治療法は増殖能が亢進したがん細胞の細胞周期の進行をさまたげることを目的として開発されてきたため,この治療法では静止期に維持されているがん幹細胞を標的とすることができないからである.このため,がん幹細胞は治療ののちも残存し再発や転移をひき起こす.したがって,がん幹細胞の治療抵抗性の一因となっている静止期への維持機構を解明することは,がんの根治にむけた新たな治療法の開発につながることが期待される.今回,筆者らは,ユビキチンリガーゼFbxw7は細胞周期のアクセルとしてはたらくc-Mycを分解することにより白血病幹細胞を静止期に維持していることをつきとめた.さらに,Fbxw7を欠損させた白血病幹細胞は抗がん剤に感受性になっていることを明らかにし,Fbxw7阻害と抗がん剤を併用することにより白血病マウスモデルにおいて白血病幹細胞を根絶させ,治療ののちの再発を著明に減少させることに成功した.
はじめに
近年,少なくとも一部のがんにおいて,がん組織を構成する細胞にヒエラルキーが存在し,多くのがん細胞はこのヒエラルキーの頂点にあるがん幹細胞から生じると考えられるようになった1).これまでの研究により,がん細胞が増殖期にあってさかんに細胞増殖を行っているのとは対照的に,がん幹細胞は細胞周期を脱出して静止期にとどまっており細胞増殖をほとんど行っていないことが明らかになったが,この知見は,がん治療法にパラダイムシフトを起こした.がん治療法のひとつに抗がん剤治療があげられるが,がん幹細胞が同定される以前の抗がん剤は,増殖期にあるがん細胞の細胞周期の進行をさまたげることを目的として開発されてきた.例をあげれば,抗がん剤のうち5-FUやAra-Cなどの代謝拮抗剤はDNA合成やDNAポリメラーゼを阻害し,また,エトポシドなどトポイソメラーゼ阻害薬はトポイソメラーゼの活性を阻害することにより細胞周期のS期に作用,また,ビンクリスチンやパクリタキセルなどアルカロイド系抗がん剤は微小管重合の阻害により細胞周期のM期に作用して,それぞれ細胞周期の進行をさまたげる.これらはその作用機序から明らかなように増殖期にあるがん細胞を標的にしている.ところが,がん幹細胞は静止期にとどまっているためこれらの薬剤は効果がなく,がん幹細胞の静止期への維持機構は抗がん剤耐性の一因となっている.したがって,従来のがん治療法では,増殖期にあるがん細胞を死滅させがんが治癒したと思われる場合でも,その多くにおいてがん幹細胞が残存している.原発巣においてこの残存したがん幹細胞から再びがん細胞が生じるのが“再発”であり,がん幹細胞がほかの部位へと移動しがん細胞を生じるのが“転移”である(図1).これらの事実は,がんを根治するためにはがん幹細胞の根絶が必要であることを示している.がん幹細胞の静止期への維持機構を解明することは,がん幹細胞の治療抵抗性の打破,ひいては,がん根治療法の開発に直結すると期待されるが,その詳細な分子機構はこれまで明らかにされていなかった.
1.ユビキチンリガーゼFbxw7は白血病幹細胞において高発現している
がん幹細胞が静止期に維持されている原因は,この細胞において細胞周期のアクセルとしてはたらくタンパク質の発現が抑制されているためではないかと考えた.細胞周期のアクセルタンパク質として有名なもののひとつにc-Mycがあるが,このc-Mycはユビキチン-プロテアソーム系により分解されることが知られている.筆者らは以前に,c-Mycの分解において機能するユビキチンリガーゼがFbxw7(F-box and WD40 repeat domain-containing 7)であることを発見している2).そこで今回,Fbxw7はc-Mycを分解することによりがん幹細胞を静止期に維持しているのではないかと仮説をたてた.
この仮説を慢性骨髄性白血病(chronic myeloid leukemia:CML)におけるがん幹細胞(白血病幹細胞)において検証した.慢性骨髄性白血病は第22染色体のBCR遺伝子が染色体転座により第9染色体のABL遺伝子と結合しBCR-ABL融合遺伝子が形成されることにより発症する.さらに,これまでの研究により,この染色体転座は正常な造血幹細胞において起こり,その結果として,慢性骨髄性白血病の白血病幹細胞が出現することがわかっている3).そこでまず,正常な造血幹細胞にBCR-ABL融合遺伝子を導入したのち,この細胞をレシピエントマウスに移植することにより慢性骨髄性白血病マウスモデルを作製した.そして,リアルタイムPCR法により白血病細胞のそれぞれの分化段階においてFbxw7の発現量を調べたところ,Fbxw7は白血病幹細胞においてもっとも高く発現していることがわかった.このことは,Fbxw7が白血病幹細胞を静止期に維持しているという仮説に適合していた.
2.ユビキチンリガーゼFbxw7は白血病幹細胞を静止期に維持している
白血病幹細胞の静止期への維持におけるFbxw7の役割を明らかにするため,慢性骨髄性白血病マウスモデルの白血病細胞においてFbxw7を遺伝学的に欠損させた.そして,白血病幹細胞の細胞周期の解析を行ったところ,Fbxw7を欠損させることにより静止期にとどまっている白血病幹細胞の割合が減少したことをつきとめた.この結果は,Fbxw7が白血病幹細胞を静止期に維持する役割をもつことを示したが,つぎに,この分子機構にc-Mycがかかわっているかどうかを調べた.まず,白血病幹細胞におけるc-Mycのタンパク質量を調べ,Fbxw7を欠損させることにより白血病幹細胞においてc-Mycのタンパク質量が増加していることを確認した.つぎに,Fbxw7を欠損した白血病幹細胞における静止期の破綻がc-Mycの蓄積によるものであるかどうかを調べるため,この細胞においてさらにc-myc遺伝子の片方の対立遺伝子を欠損させたところ,Fbxw7の欠損による表現型は回復した.以上の結果から,Fbxw7はc-Mycを分解することにより白血病幹細胞において静止期維持タンパク質として機能していることが明らかになった.がん幹細胞の静止期への維持機構の解明はがん根治療法の開発に直結すると考えられることからこの問題の解決にむけた研究は世界中で行われているが4,5),今回の結果は,細胞周期を直接に制御することによりがん幹細胞を静止期に維持しているタンパク質をはじめて同定したものであった.
3.ユビキチンリガーゼFbxw7を欠損させると白血病幹細胞は抗がん剤に感受性になる
がん幹細胞の静止期への維持機構は抗がん剤への抵抗性の一因となっている.慢性骨髄性白血病に対する抗がん剤に関しては,これまでに数種類のBCR-ABL阻害剤(チロシンキナーゼ阻害剤)が開発されている.はじめに開発されたBCR-ABL阻害剤はイマチニブであるが,このイマチニブの登場は慢性骨髄性白血病患者の予後を劇的に改善させた6).しかしそののち,イマチニブは増殖している白血病細胞には著効するものの,静止期の白血病幹細胞には効かないことが報告された7).これまでに,ニロチニブやダサチニブといった第2世代のBCR-ABL阻害剤も開発され,すでに実際の慢性骨髄性白血病の治療に用いられているが,これらの薬剤もまた静止期の白血病幹細胞に対する治療効果の乏しいことが指摘されている8).これらの知見から,慢性骨髄性白血病の白血病幹細胞においても,やはり静止期への維持機構が抗がん剤抵抗性の原因となっていることがわかる.Fbxw7を欠損した白血病幹細胞は静止期を維持できなくなっていたことから,この細胞はBCR-ABL阻害剤に感受性になっているのではないかと思われた.そこでこの可能性を検証するため,慢性骨髄性白血病マウスモデルにイマチニブを投与し,白血病幹細胞の画分におけるアポトーシス細胞の割合を調べた.すると,Fbxw7を欠損させたのちイマチニブを投与すると,アポトーシスを起こす白血病幹細胞の割合が著明に亢進することが判明した.このことは,Fbxw7を欠損させることにより白血病幹細胞は抗がん剤に感受性になることを示していた.
4.Fbxw7阻害と抗がん剤の併用療法は白血病の再発を減少させる
イマチニブの開発は慢性骨髄性白血病の患者の予後を劇的に改善したが,最近の臨床研究において,イマチニブの投与により2年以上の寛解(白血病細胞が検出限界以下となること)を維持している患者において,イマチニブ投与を中止すると約60%の患者が6か月以内に再発することが報告されている9).この事実は,イマチニブ治療を長期にわたりうけている慢性骨髄性白血病の患者の過半数において,白血病幹細胞が残存していることを示唆する.Fbxw7を欠損した白血病幹細胞がイマチニブに感受性になっていたことから,Fbxw7の阻害とイマチニブの投与を併用することにより,イマチニブ投与を中止したのちの再発を抑えることができるのではないかと考えた.そこで,慢性骨髄性白血病マウスモデルの生存率を調べたところ,イマチニブの単独投与群では無治療群と比較して生存期間は延長したものの,イマチニブの投与を中止するとほとんどのマウスにおいて再発を認めた.この結果は,慢性骨髄性白血病マウスモデルにおいても慢性骨髄性白血病の患者と同様に,イマチニブは増殖している白血病細胞には著効するものの静止期の白血病幹細胞には効かず,この細胞集団が残存していることを示した.これとは対照的に,Fbxw7を欠損させたのちにイマチニブを投与した慢性骨髄性白血病マウスモデルでは,イマチニブの投与を中止しても再発はほとんどみられず,Fbxw7欠損+イマチニブの併用により白血病幹細胞は根絶されていた.
最後に,この併用療法の効果がヒト白血病幹細胞においてもみられるかどうかを検証するため,慢性骨髄性白血病の患者に由来する白血病幹細胞においてFbxw7をノックダウンしたのちイマチニブ処理を行い,コロニー形成能を調べた.すると,Fbxw7ノックダウン+イマチニブ処理を行った際のコロニー形成能は,イマチニブ処理のみを行った場合と比較して著明に抑制されていた.この結果は,Fbxw7阻害+イマチニブの併用がヒトの白血病幹細胞に対しても有効であることを示しており,白血病の治療においてFbxw7は有望な標的であると結論づけた.
おわりに
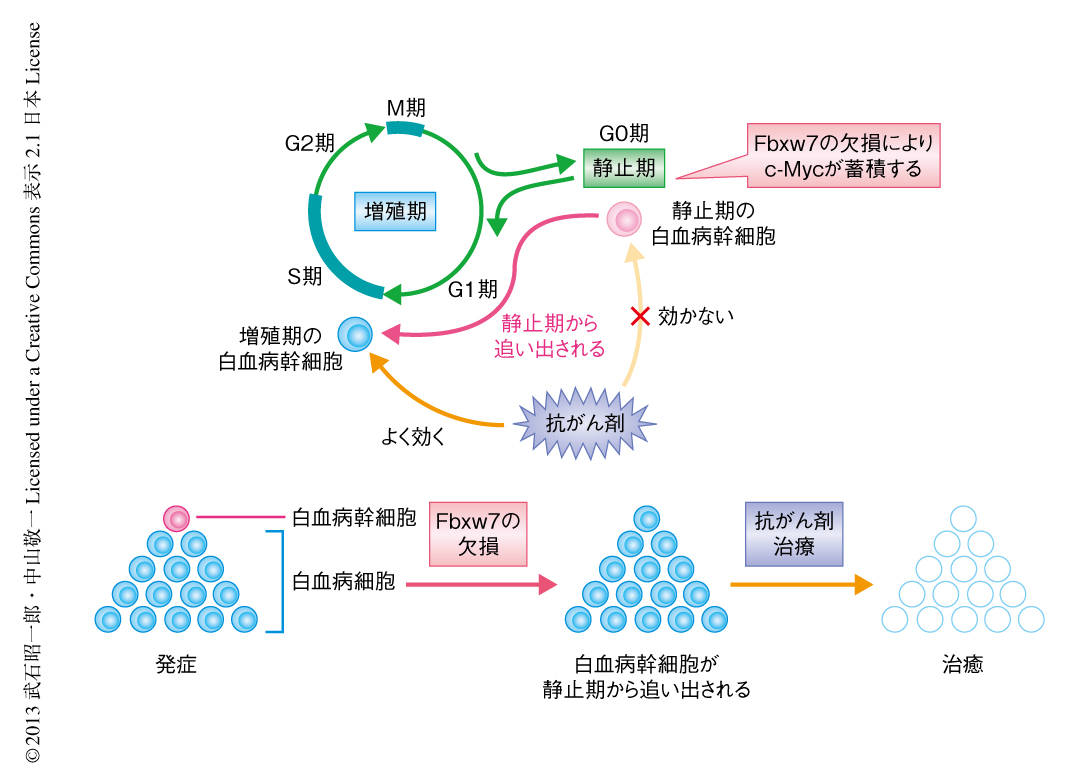
この研究により,Fbxw7を阻害することで白血病幹細胞を静止期から追い出し,抗がん剤を併用することにより白血病幹細胞を根絶できることが明らかになった(図2).筆者らは,この新たながん治療戦略を“静止期追い出し療法”と命名し,実際のがん治療への応用へむけさらに検討を重ねている.1つ目の検討課題は,Fbxw7の機能を阻害する手段である.今回の研究では,白血病細胞において遺伝学的な手法によりFbxw7を欠損させているが,臨床応用のためにはFbxw7の阻害剤が必要となるため,現在,そのスクリーニングを行っている.2つ目の検討課題は,ほかのがんへの応用である.がん幹細胞は白血病をはじめとして,乳がん,脳腫瘍,大腸がんなど,さまざまながんにおいて同定されているが,これらのがんにおけるがん幹細胞は共通の細胞生物学的な特性を数多くもつことが知られている.したがって,Fbxw7は白血病のみならず,ほかのがんの幹細胞においても治療抵抗性の原因になっている可能性が考えられる.Fbxw7阻害剤の開発により,白血病のみならず多くのがんにおいて,がん根治療法を実現できるのではないかと期待している.
この研究の結果は,基礎医学の手法を用いた実験動物の解析にもとづいたものであるが,実際のがん治療への応用にあたっては,このような基礎医学の見地からの検討だけでなく,臨床の現場から得られる知見も非常に重要である.基礎研究者と臨床家とで濃厚な議論を重ねることが,真に有力な抗がん治療法の確立につながると確信している.
文 献
- Clevers, H.: The cancer stem cell: premises, promises and challenges. Nat. Med., 17, 313-319 (2011)[PubMed]
- Yada, M., Hatakeyama, S., Kamura, T. et al.: Phosphorylation-dependent degradation of c-Myc is mediated by the F-box protein Fbw7. EMBO J., 23, 2116-2125 (2004)[PubMed]
- Pear, W. S., Miller, J. P., Xu, L. et al.: Efficient and rapid induction of a chronic myelogenous leukemia-like myeloproliferative disease in mice receiving P210 bcr/abl-transduced bone marrow. Blood, 92, 3780-3792 (1998)[PubMed]
- Ito, K., Bernardi, R., Morotti, A. et al.: PML targeting eradicates quiescent leukemia-initiating cells. Nature, 453, 1072-1078 (2008)[PubMed]
- Saito, Y., Uchida, N., Tanaka, S. et al.: Induction of cell cycle entry eliminates human leukemia stem cells in a mouse model of AML. Nat. Biotechnol., 28, 275-280 (2010)[PubMed]
- Kantarjian, H., Sawyers, C., Hochhaus, A. et al.: Hematologic and cytogenetic responses to imatinib mesylate in chronic myelogenous leukemia. N. Engl. J. Med., 346, 645-652 (2002)[PubMed]
- Graham, S. M., Jorgensen, H. G., Allan, E.: Primitive, quiescent, Philadelphia-positive stem cells from patients with chronic myeloid leukemia are insensitive to STI571 in vitro. Blood, 99, 319-325 (2002)[PubMed]
- Copland, M., Hamilton, A., Elrick, L. J. et al.: Dasatinib (BMS-354825) targets an earlier progenitor population than imatinib in primary CML but does not eliminate the quiescent fraction. Blood, 107, 4532-4539 (2006)[PubMed]
- Mahon, F. X., Rea, D., Guilhot, J. et al.: Discontinuation of imatinib in patients with chronic myeloid leukaemia who have maintained complete molecular remission for at least 2 years: the prospective, multicentre Stop Imatinib (STIM) trial. Lancet Oncol., 11, 1029-1035 (2010)[PubMed]
著者プロフィール
略歴:2013年 九州大学大学院医学研究院 修了.
研究テーマ:がん幹細胞の静止期への維持機構.
抱負:幹細胞の生物学的な特性の包括的な理解をとおし,生命の設計図のしくみという生物学におけるもっとも大きな命題に取り組むとともに,がん治療や再生医療など臨床医学へ真に貢献できる研究の礎を築きたい.
中山 敬一(Keiichi I. Nakayama)
九州大学生体防御医学研究所 教授.
研究室URL:http://www.bioreg.kyushu-u.ac.jp/saibou/index.html
© 2013 武石昭一郎・中山敬一 Licensed under CC 表示 2.1 日本