RNAキナーゼCLP1のtRNAプロセシングにおける役割とその破綻による運動神経病
花田俊勝・Josef M. Penninger
(オーストリアInstitute of Molecular Biotechnology:IMBA)
email:花田俊勝
DOI: 10.7875/first.author.2013.031
CLP1 links tRNA metabolism to progressive motor-neuron loss.
Toshikatsu Hanada, Stefan Weitzer, Barbara Mair, Christian Bernreuther, Brian J. Wainger, Justin Ichida, Reiko Hanada, Michael Orthofer, Shane J. Cronin, Vukoslav Komnenovic, Adi Minis, Fuminori Sato, Hiromitsu Mimata, Akihiko Yoshimura, Ido Tamir, Johannes Rainer, Reinhard Kofler, Avraham Yaron, Kevin C. Eggan, Clifford J. Woolf, Markus Glatzel, Ruth Herbst, Javier Martinez, Josef M. Penninger
Nature, 495, 474-480 (2013)
CLP1は哺乳類においてはじめて報告されたRNAキナーゼであるが,その詳細な分子機構については不明であった.今回,筆者らは,生体におけるCLP1の機能について解析するため,キナーゼドメインの1アミノ酸残基のみを置換したCLP1キナーゼ活性欠損マウスを作製した.このマウスは運動ニューロンにおいて軸索の変性および神経筋接合部の変性をともなう運動神経病を発症した.分子機構の解析から,CLP1はtRNA前駆体におけるイントロンのスプライシング機構に関与すること,また,そのキナーゼ活性の欠失によりtRNA前駆体から生じるRNA断片が細胞に蓄積してp53を過剰に活性化し,もともと酸化ストレスに脆弱な運動ニューロンの細胞死が惹起されることが示唆された.この研究において,筆者らは,tRNAプロセシングとその過程から生じる細胞ストレス誘導性の新規のRNA,そして,そのRNAと進行性の運動ニューロン細胞死を結ぶ新たな病態機構の可能性を示した.
生体において機能するRNAは転写されたのちさまざまな修飾をうけて機能的なRNAへと成熟する.2007年,RNAキナーゼCLP1はRNAの5’末端をリン酸化する酵素として哺乳類においてはじめて報告された1).CLP1はmRNAの3’末端を切断しポリアデニル化に関与する酵素複合体の構成タンパク質として2),また,tRNAスプライシングエンドヌクレアーゼ酵素複合体の構成タンパク質として3),報告されていた.tRNAスプライシングエンドヌクレアーゼ酵素複合体は多くのtRNA前駆体がアンチコドンループにもつイントロンを取り外し,5’側エキソンおよび3’側エキソンを形成する.CLP1はこのtRNA前駆体のスプライシング機構に関与していると考えられていたが,そのin vivoにおける機能に関し,これまで不明な点が多く残されていた.この研究では,CLP1のもつキナーゼ活性に焦点をあて,その活性部位に変異を導入することによりキナーゼ活性を欠失させたCLP1キナーゼ活性欠損マウスを作製し,その機能的な解析を試みた.
まずClp1遺伝子のノックアウトマウスを作製したが,非常に早い胎生期(胎生6.5日以内)に死亡したため詳細な解析が不可能であった.そこで,CLP1タンパク質の発現はそのままキナーゼ活性のみを欠失させるため,その127番目のリジン残基をアラニン残基に置換したノックインマウスを作製した.この部位はWalker AモチーフのATP結合部位にあり,この変異によりCLP1のキナーゼ活性は欠失することが期待された.実際に,このCLP1キナーゼ活性欠損マウスより得た胎仔線維芽細胞を用いた実験により,変異CLP1は野生型CLP1と同じ程度に発現するが,キナーゼ活性はほぼ完全に欠失していることが確認された.
野生型C57BL/6マウスの遺伝子背景において,CLP1キナーゼ活性欠損マウスはメンデルの法則に従い正常の比率で生まれてくるものの,生後まもなく死亡してしまった.肺の解剖所見より呼吸不全が強く示唆され,その原因として,肺の発達異常を考慮して胎生期の肺におけるカベオリンおよびサーファクタント分子の発現レベルを確認したが,とくに異常を認めなかった.つぎに,呼吸筋の運動障害の可能性を考え神経科学的な解析を行ったところ,横隔膜の動きをつかさどる横隔神経において神経束の乱れや神経の走行の異常,神経筋接合部における脱神経などが認められた.これらの所見から,CLP1キナーゼ活性欠損マウスは横隔膜における神経発達の異常により呼吸不全を生じ死亡したものと考えられた.
さらに詳細に横隔膜における運動ニューロンの経時的な発達を検討するため,胎生14.5日,胎生16.5日,胎生18.5日の横隔膜について観察したところ,胎生14.5日では明らかな脱神経の所見を認めず,胎生16.5日で部分的な脱神経が出現し,胎生18.5日においては重度の脱神経を認めるようになった.それと対応して,脊髄における運動ニューロンの数は胎生18.5日において顕著に減少していることが明らかになった.生体におけるCLP1のキナーゼ活性の欠失は異常な神経終末の発達と神経筋接合部の形成不全をともなう進行性の運動ニューロン細胞死を導くことが明らかになった.
C57BL/6マウスおよびBALB/cマウスの遺伝子背景に戻し交配をしたところCLP1キナーゼ活性欠損マウスは100%が死亡したが,CBA/Jマウスの遺伝子背景では長期にわたる生存の可能なCLP1キナーゼ活性欠損マウスを得ることができた.しかしながら,やはり加齢とともに運動失調が進行し,歩行の障害,筋力の低下,バランスの障害などを示した.最終的に12カ月齢の前後で多くのCLP1キナーゼ活性欠損マウスは四肢麻痺を発症し死にいたった.一方,温痛覚などの感覚神経の障害はほとんど認められず,おもに運動神経において障害の生じていることが明らかになった.また,脊髄におけるコリンアセチルトランスフェラーゼ陽性の運動ニューロンの数は,生後は野生型マウスと差はないが,4カ月をすぎると明らかに減少が認められ,それにともない末梢の座骨神経も顕著に細小化した.電子顕微鏡を用いて詳細に検討したところ,運動ニューロンの線維と考えられる大径の線維の数は著名に減少していたのに対し,感覚ニューロンの線維である小径の線維の数はほぼ保存されていた.感覚ニューロンの細胞体の存在する後根神経節の形態や,後根神経節の培養による軸索の進展などにも差はなく,少なくとも,末梢の感覚神経は保存されているものと考えられた.また,C57BL6/Jマウスの遺伝子背景において横隔膜で認めた脱神経をともなう神経筋接合部の形成不全も,CBA/Jマウスの遺伝子背景をもつCLP1キナーゼ活性欠損マウスにおいて加齢にともない明らかになり,とくに速筋である長指伸筋や腓腹筋において顕著であった.この傾向は,筋萎縮性側索硬化症のモデルマウスであるSOD1トランスジェニックマウスでも同様であり4),CLP1キナーゼ活性欠損マウスは進行性の運動神経病を発症する新たなマウスモデルであることが示唆された.
CLP1キナーゼ活性欠損マウスから調製した胎仔線維芽細胞を用いて,RNA代謝機構におけるCLP1の分子機能を調べた.CLP1はmRNA前駆体の転写終結の際に作用するRNAの3’末端にある切断酵素複合体に含まれることから2),mRNAの成熟機構への関与を検討したがとくに異常はなく,また,mRNA前駆体のスプライシングに関しても野生型マウスと比べ有意な差は認めなかった.またさらに,マイクロRNA(miRNA)の成熟機構に関しても異常はなく,少なくとも,CLP1のキナーゼ活性はmRNAおよびmiRNAの成熟機構には影響をあたえないことがわかった.
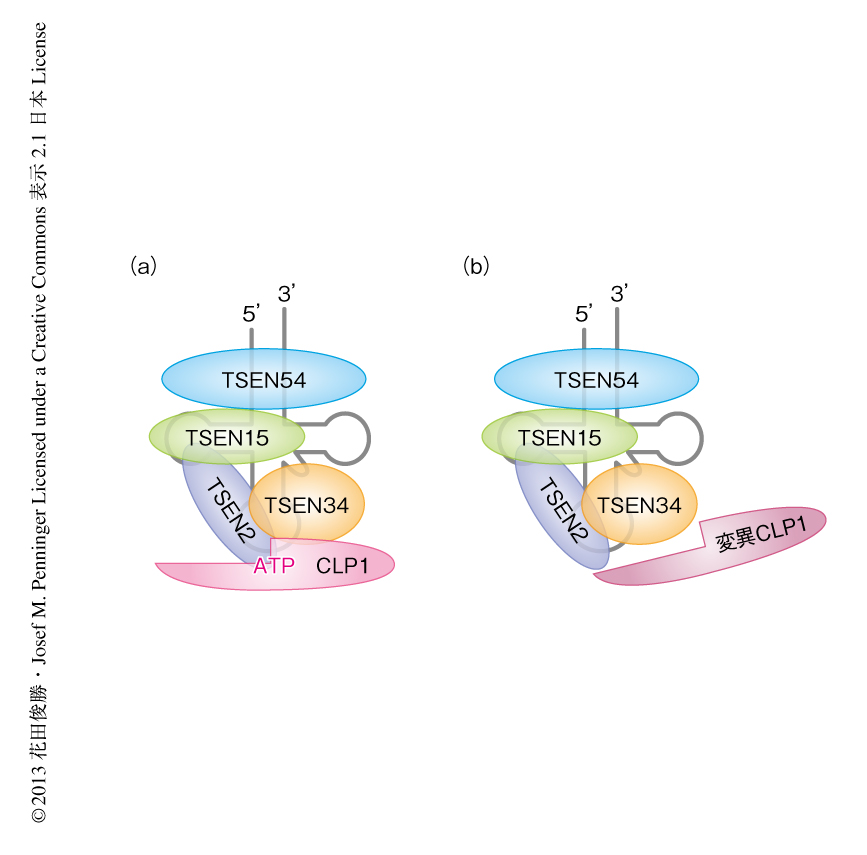
CLP1はtRNAの成熟機構に重要なtRNAスプライシングエンドヌクレアーゼ酵素複合体の構成タンパク質であることから3),tRNAの成熟化について検討した.in vitroのアッセイ系においてtRNA前駆体のスプライシングを調べたところ,その効率は減弱し成熟したtRNAエキソンの量が減少していた.つまり,tRNAスプライシングエンドヌクレアーゼ酵素複合体によるtRNAスプライシング機能の低下していることが判明した.そこで,tRNAスプライシングエンドヌクレアーゼ酵素複合体を構成するタンパク質のあいだの結合を免疫沈降法により調べたところ,CLP1キナーゼ活性欠損マウスのもつ変異CLP1ではTSEN2,TSEN34,TSEN54との親和性が減少して複合体の形成が不安定になっており,そのためスプライシングの効率が低下したものと考えられた(図1).同様に,生体においてもtRNA前駆体の成熟化の効率が低下するために機能的な成熟tRNAの量的な低下の起こっているものと予想されたが,野生型マウスとCLP1キナーゼ活性欠損マウスとのあいだにそのような差異はなく,CLP1キナーゼ活性欠損マウスの表現型は成熟tRNAの量的な変化以外の分子機構によることが示唆された.
tRNAをコードする遺伝子の多くはイントロンを含まないが,興味深いことに,チロシンtRNAをコードするすべての遺伝子はイントロンを含むことが知られている.tRNAのノーザンブロット解析において,チロシンtRNA遺伝子の転写産物から生じるRNA断片がCLP1キナーゼ活性欠損マウスに由来する胎仔線維芽細胞において顕著に蓄積していることが見い出された.RNA塩基配列の決定により,その断片は5’側リーダー配列を含む5’側エキソンで,5’末端が三リン酸化修飾されており,チロシンtRNA前駆体から直接に生じたものと思われた.また,少量ではあるがチロシンtRNA以外のtRNA遺伝子の産物からのRNA断片も蓄積が認められた.また,このRNA断片はCLP1キナーゼ活性欠損マウスにおいて全身の組織に蓄積していた.近年,ストレスにより誘導される小分子RNAとしてtiRNAが報告されている5).これは,成熟tRNAよりangiogeninのもつリボヌクレアーゼ活性により産生され細胞質に存在する.CLP1キナーゼ活性欠損マウスに認められたチロシンtRNA断片も同様に酸化ストレス刺激により強く誘導されたが,その機序にangiogeninはかかわっておらず,また,tRNA前駆体から切り出され核に存在することからtiRNAとは異なるものと考えられた.また,H2O2の添加による酸化ストレス刺激に対し,CLP1キナーゼ活性欠損マウスに由来する胎仔線維芽細胞は野生型の胎仔線維芽細胞より感受性が高く,細胞死におちいりやすいことが判明した.さらに,胎仔線維芽細胞のみでなく,CLP1キナーゼ活性欠損マウスに由来する培養運動ニューロンにおいても同様に,酸化ストレスにより誘導される細胞死に対し感受性の高いことも明らかになった.これらの結果から,CLP1のもつキナーゼ活性はtRNAの成熟機構に重要であり,その機能欠失により生じるチロシンtRNA断片は酸化ストレスによる運動ニューロン細胞死における感受性に影響をあたえることが示唆された.
酸化ストレスによる細胞死はp53の活性化,とくに18番目のセリン残基(ヒトにおいては,15番目のセリン残基)のリン酸化を介することが知られている6-8).そこで,CLP1キナーゼ活性欠損マウスに由来する胎仔線維芽細胞においてH2O2刺激によるp53の18番目のセリン残基のリン酸化を解析したところ,野生型の胎仔線維芽細胞に比べp53は過剰に活性化されていることが判明した.H2O2と同様に酸化ストレスを誘導するグルコースオキシダーゼ刺激でも同様に過剰なp53のリン酸化が認められた.一方で,p53ノックアウトマウスとCLP1キナーゼ活性欠損マウスとを交配して得たマウスに由来する胎仔線維芽細胞においては,p53について野生型のCLP1キナーゼ活性欠損マウスに由来する胎仔線維芽細胞において認められた酸化ストレスに対する過剰な細胞死を回避することができた.また,CLP1キナーゼ活性欠損マウスに認められたチロシンtRNA断片をマウスの運動ニューロン細胞株NSC-34に過剰発現するとp53の活性化がより強力に惹起された.これらの結果より,CLP1キナーゼ活性を欠損した細胞における酸化ストレスに対する脆弱性は,チロシンtRNA断片の蓄積により生じるp53の過剰な活性化が関与している可能性が示唆された.マウスの生体においても,C57BL/6マウスの遺伝子背景をもつCLP1キナーゼ活性欠損マウスは生後すぐに100%が死亡したが,p53を欠損したCLP1キナーゼ活性欠損マウスは正常に生まれ神経科学的な所見もほぼ正常であった.さらに,酸化ストレスを予防する目的で妊娠した母親マウスに受精ののちN-アセチルシステインを含む飲水を投与したところ,生まれたCLP1キナーゼ活性欠損マウスは神経科学的な所見が部分的に回復し,数日の生存が可能となった.つまり,CLP1キナーゼ活性欠損マウスの運動ニューロン細胞死による新生仔の死亡においては酸化ストレスとp53が重要な因子であることが明らかになった.
今回,筆者らは,RNAキナーゼCLP1の生体における分子機能について報告した.CLP1キナーゼ活性欠損マウスは脊髄における進行性の運動ニューロン細胞死により末梢での脱神経および運動麻痺を呈した.また,CLP1のキナーゼ活性の欠失はtRNA前駆体におけるスプライシング効率の低下と同時に,5’側リーダー配列を含む新規のチロシンtRNA断片の蓄積を生じることが明らかになった(図2).これまでも,さまざまなtRNA断片が報告されており,たとえば,細胞質に存在しtRNA前駆体に由来するtRF-1001はがん細胞の生存維持に重要な役割をはたしており9),また,細胞質に存在し成熟tRNAに由来するtiRNAはストレスに応じてタンパク質の翻訳を制御することが報告されている5).この研究において発見された新規のチロシンtRNA断片は,酸化ストレスによるp53の活性化における感受性に影響をあたえる役割を担っていることが示唆された.今後,さらに詳細な分子機構の解明が期待される.今回の研究により,tRNAプロセシング,新規のRNA,そして,これらがp53を介した運動ニューロン細胞死に関与するという新たな病態機構の可能性が提示された.以上の知見をもとに,運動神経病である筋萎縮性側索硬化症や脊髄性筋萎縮症における新たな病因の解明や治療の開発につながる可能性が期待できる.
略歴:2000年 大分医科大学大学院医学研究科 修了,2003年 九州大学生体防御医学研究所 助手,2005年 オーストリアInstitute of Molecular Biotechnology(IMBA)研究員を経て,2012年より京都大学大学院医学研究科 特定准教授.
研究テーマ:マウス遺伝学を用いた疾患の分子機構の解明.
抱負:治療や創薬につながる研究をめざしています.
Josef M Penninger
オーストリアInstitute of Molecular Biotechnology(IMBA)所長.
研究室URL:http://www.imba.oeaw.ac.at/research/josef-penninger/
© 2013 花田俊勝・Josef M. Penninger Licensed under CC 表示 2.1 日本
(オーストリアInstitute of Molecular Biotechnology:IMBA)
email:花田俊勝
DOI: 10.7875/first.author.2013.031
CLP1 links tRNA metabolism to progressive motor-neuron loss.
Toshikatsu Hanada, Stefan Weitzer, Barbara Mair, Christian Bernreuther, Brian J. Wainger, Justin Ichida, Reiko Hanada, Michael Orthofer, Shane J. Cronin, Vukoslav Komnenovic, Adi Minis, Fuminori Sato, Hiromitsu Mimata, Akihiko Yoshimura, Ido Tamir, Johannes Rainer, Reinhard Kofler, Avraham Yaron, Kevin C. Eggan, Clifford J. Woolf, Markus Glatzel, Ruth Herbst, Javier Martinez, Josef M. Penninger
Nature, 495, 474-480 (2013)
要 約
CLP1は哺乳類においてはじめて報告されたRNAキナーゼであるが,その詳細な分子機構については不明であった.今回,筆者らは,生体におけるCLP1の機能について解析するため,キナーゼドメインの1アミノ酸残基のみを置換したCLP1キナーゼ活性欠損マウスを作製した.このマウスは運動ニューロンにおいて軸索の変性および神経筋接合部の変性をともなう運動神経病を発症した.分子機構の解析から,CLP1はtRNA前駆体におけるイントロンのスプライシング機構に関与すること,また,そのキナーゼ活性の欠失によりtRNA前駆体から生じるRNA断片が細胞に蓄積してp53を過剰に活性化し,もともと酸化ストレスに脆弱な運動ニューロンの細胞死が惹起されることが示唆された.この研究において,筆者らは,tRNAプロセシングとその過程から生じる細胞ストレス誘導性の新規のRNA,そして,そのRNAと進行性の運動ニューロン細胞死を結ぶ新たな病態機構の可能性を示した.
はじめに
生体において機能するRNAは転写されたのちさまざまな修飾をうけて機能的なRNAへと成熟する.2007年,RNAキナーゼCLP1はRNAの5’末端をリン酸化する酵素として哺乳類においてはじめて報告された1).CLP1はmRNAの3’末端を切断しポリアデニル化に関与する酵素複合体の構成タンパク質として2),また,tRNAスプライシングエンドヌクレアーゼ酵素複合体の構成タンパク質として3),報告されていた.tRNAスプライシングエンドヌクレアーゼ酵素複合体は多くのtRNA前駆体がアンチコドンループにもつイントロンを取り外し,5’側エキソンおよび3’側エキソンを形成する.CLP1はこのtRNA前駆体のスプライシング機構に関与していると考えられていたが,そのin vivoにおける機能に関し,これまで不明な点が多く残されていた.この研究では,CLP1のもつキナーゼ活性に焦点をあて,その活性部位に変異を導入することによりキナーゼ活性を欠失させたCLP1キナーゼ活性欠損マウスを作製し,その機能的な解析を試みた.
1.CLP1キナーゼ活性欠損マウスは生後まもなく呼吸不全を呈し死亡する
まずClp1遺伝子のノックアウトマウスを作製したが,非常に早い胎生期(胎生6.5日以内)に死亡したため詳細な解析が不可能であった.そこで,CLP1タンパク質の発現はそのままキナーゼ活性のみを欠失させるため,その127番目のリジン残基をアラニン残基に置換したノックインマウスを作製した.この部位はWalker AモチーフのATP結合部位にあり,この変異によりCLP1のキナーゼ活性は欠失することが期待された.実際に,このCLP1キナーゼ活性欠損マウスより得た胎仔線維芽細胞を用いた実験により,変異CLP1は野生型CLP1と同じ程度に発現するが,キナーゼ活性はほぼ完全に欠失していることが確認された.
野生型C57BL/6マウスの遺伝子背景において,CLP1キナーゼ活性欠損マウスはメンデルの法則に従い正常の比率で生まれてくるものの,生後まもなく死亡してしまった.肺の解剖所見より呼吸不全が強く示唆され,その原因として,肺の発達異常を考慮して胎生期の肺におけるカベオリンおよびサーファクタント分子の発現レベルを確認したが,とくに異常を認めなかった.つぎに,呼吸筋の運動障害の可能性を考え神経科学的な解析を行ったところ,横隔膜の動きをつかさどる横隔神経において神経束の乱れや神経の走行の異常,神経筋接合部における脱神経などが認められた.これらの所見から,CLP1キナーゼ活性欠損マウスは横隔膜における神経発達の異常により呼吸不全を生じ死亡したものと考えられた.
2.CLP1キナーゼ活性欠損マウスは進行性の運動ニューロン細胞死を呈する
さらに詳細に横隔膜における運動ニューロンの経時的な発達を検討するため,胎生14.5日,胎生16.5日,胎生18.5日の横隔膜について観察したところ,胎生14.5日では明らかな脱神経の所見を認めず,胎生16.5日で部分的な脱神経が出現し,胎生18.5日においては重度の脱神経を認めるようになった.それと対応して,脊髄における運動ニューロンの数は胎生18.5日において顕著に減少していることが明らかになった.生体におけるCLP1のキナーゼ活性の欠失は異常な神経終末の発達と神経筋接合部の形成不全をともなう進行性の運動ニューロン細胞死を導くことが明らかになった.
C57BL/6マウスおよびBALB/cマウスの遺伝子背景に戻し交配をしたところCLP1キナーゼ活性欠損マウスは100%が死亡したが,CBA/Jマウスの遺伝子背景では長期にわたる生存の可能なCLP1キナーゼ活性欠損マウスを得ることができた.しかしながら,やはり加齢とともに運動失調が進行し,歩行の障害,筋力の低下,バランスの障害などを示した.最終的に12カ月齢の前後で多くのCLP1キナーゼ活性欠損マウスは四肢麻痺を発症し死にいたった.一方,温痛覚などの感覚神経の障害はほとんど認められず,おもに運動神経において障害の生じていることが明らかになった.また,脊髄におけるコリンアセチルトランスフェラーゼ陽性の運動ニューロンの数は,生後は野生型マウスと差はないが,4カ月をすぎると明らかに減少が認められ,それにともない末梢の座骨神経も顕著に細小化した.電子顕微鏡を用いて詳細に検討したところ,運動ニューロンの線維と考えられる大径の線維の数は著名に減少していたのに対し,感覚ニューロンの線維である小径の線維の数はほぼ保存されていた.感覚ニューロンの細胞体の存在する後根神経節の形態や,後根神経節の培養による軸索の進展などにも差はなく,少なくとも,末梢の感覚神経は保存されているものと考えられた.また,C57BL6/Jマウスの遺伝子背景において横隔膜で認めた脱神経をともなう神経筋接合部の形成不全も,CBA/Jマウスの遺伝子背景をもつCLP1キナーゼ活性欠損マウスにおいて加齢にともない明らかになり,とくに速筋である長指伸筋や腓腹筋において顕著であった.この傾向は,筋萎縮性側索硬化症のモデルマウスであるSOD1トランスジェニックマウスでも同様であり4),CLP1キナーゼ活性欠損マウスは進行性の運動神経病を発症する新たなマウスモデルであることが示唆された.
3.CLP1はtRNA前駆体の効率的なプロセシングを促進する
CLP1キナーゼ活性欠損マウスから調製した胎仔線維芽細胞を用いて,RNA代謝機構におけるCLP1の分子機能を調べた.CLP1はmRNA前駆体の転写終結の際に作用するRNAの3’末端にある切断酵素複合体に含まれることから2),mRNAの成熟機構への関与を検討したがとくに異常はなく,また,mRNA前駆体のスプライシングに関しても野生型マウスと比べ有意な差は認めなかった.またさらに,マイクロRNA(miRNA)の成熟機構に関しても異常はなく,少なくとも,CLP1のキナーゼ活性はmRNAおよびmiRNAの成熟機構には影響をあたえないことがわかった.
CLP1はtRNAの成熟機構に重要なtRNAスプライシングエンドヌクレアーゼ酵素複合体の構成タンパク質であることから3),tRNAの成熟化について検討した.in vitroのアッセイ系においてtRNA前駆体のスプライシングを調べたところ,その効率は減弱し成熟したtRNAエキソンの量が減少していた.つまり,tRNAスプライシングエンドヌクレアーゼ酵素複合体によるtRNAスプライシング機能の低下していることが判明した.そこで,tRNAスプライシングエンドヌクレアーゼ酵素複合体を構成するタンパク質のあいだの結合を免疫沈降法により調べたところ,CLP1キナーゼ活性欠損マウスのもつ変異CLP1ではTSEN2,TSEN34,TSEN54との親和性が減少して複合体の形成が不安定になっており,そのためスプライシングの効率が低下したものと考えられた(図1).同様に,生体においてもtRNA前駆体の成熟化の効率が低下するために機能的な成熟tRNAの量的な低下の起こっているものと予想されたが,野生型マウスとCLP1キナーゼ活性欠損マウスとのあいだにそのような差異はなく,CLP1キナーゼ活性欠損マウスの表現型は成熟tRNAの量的な変化以外の分子機構によることが示唆された.
4.チロシンtRNA前駆体から生じる新規のRNA断片の細胞における蓄積
tRNAをコードする遺伝子の多くはイントロンを含まないが,興味深いことに,チロシンtRNAをコードするすべての遺伝子はイントロンを含むことが知られている.tRNAのノーザンブロット解析において,チロシンtRNA遺伝子の転写産物から生じるRNA断片がCLP1キナーゼ活性欠損マウスに由来する胎仔線維芽細胞において顕著に蓄積していることが見い出された.RNA塩基配列の決定により,その断片は5’側リーダー配列を含む5’側エキソンで,5’末端が三リン酸化修飾されており,チロシンtRNA前駆体から直接に生じたものと思われた.また,少量ではあるがチロシンtRNA以外のtRNA遺伝子の産物からのRNA断片も蓄積が認められた.また,このRNA断片はCLP1キナーゼ活性欠損マウスにおいて全身の組織に蓄積していた.近年,ストレスにより誘導される小分子RNAとしてtiRNAが報告されている5).これは,成熟tRNAよりangiogeninのもつリボヌクレアーゼ活性により産生され細胞質に存在する.CLP1キナーゼ活性欠損マウスに認められたチロシンtRNA断片も同様に酸化ストレス刺激により強く誘導されたが,その機序にangiogeninはかかわっておらず,また,tRNA前駆体から切り出され核に存在することからtiRNAとは異なるものと考えられた.また,H2O2の添加による酸化ストレス刺激に対し,CLP1キナーゼ活性欠損マウスに由来する胎仔線維芽細胞は野生型の胎仔線維芽細胞より感受性が高く,細胞死におちいりやすいことが判明した.さらに,胎仔線維芽細胞のみでなく,CLP1キナーゼ活性欠損マウスに由来する培養運動ニューロンにおいても同様に,酸化ストレスにより誘導される細胞死に対し感受性の高いことも明らかになった.これらの結果から,CLP1のもつキナーゼ活性はtRNAの成熟機構に重要であり,その機能欠失により生じるチロシンtRNA断片は酸化ストレスによる運動ニューロン細胞死における感受性に影響をあたえることが示唆された.
5.CLP1キナーゼ活性欠損マウスにおける運動ニューロン細胞死にはp53が関与する
酸化ストレスによる細胞死はp53の活性化,とくに18番目のセリン残基(ヒトにおいては,15番目のセリン残基)のリン酸化を介することが知られている6-8).そこで,CLP1キナーゼ活性欠損マウスに由来する胎仔線維芽細胞においてH2O2刺激によるp53の18番目のセリン残基のリン酸化を解析したところ,野生型の胎仔線維芽細胞に比べp53は過剰に活性化されていることが判明した.H2O2と同様に酸化ストレスを誘導するグルコースオキシダーゼ刺激でも同様に過剰なp53のリン酸化が認められた.一方で,p53ノックアウトマウスとCLP1キナーゼ活性欠損マウスとを交配して得たマウスに由来する胎仔線維芽細胞においては,p53について野生型のCLP1キナーゼ活性欠損マウスに由来する胎仔線維芽細胞において認められた酸化ストレスに対する過剰な細胞死を回避することができた.また,CLP1キナーゼ活性欠損マウスに認められたチロシンtRNA断片をマウスの運動ニューロン細胞株NSC-34に過剰発現するとp53の活性化がより強力に惹起された.これらの結果より,CLP1キナーゼ活性を欠損した細胞における酸化ストレスに対する脆弱性は,チロシンtRNA断片の蓄積により生じるp53の過剰な活性化が関与している可能性が示唆された.マウスの生体においても,C57BL/6マウスの遺伝子背景をもつCLP1キナーゼ活性欠損マウスは生後すぐに100%が死亡したが,p53を欠損したCLP1キナーゼ活性欠損マウスは正常に生まれ神経科学的な所見もほぼ正常であった.さらに,酸化ストレスを予防する目的で妊娠した母親マウスに受精ののちN-アセチルシステインを含む飲水を投与したところ,生まれたCLP1キナーゼ活性欠損マウスは神経科学的な所見が部分的に回復し,数日の生存が可能となった.つまり,CLP1キナーゼ活性欠損マウスの運動ニューロン細胞死による新生仔の死亡においては酸化ストレスとp53が重要な因子であることが明らかになった.
おわりに
今回,筆者らは,RNAキナーゼCLP1の生体における分子機能について報告した.CLP1キナーゼ活性欠損マウスは脊髄における進行性の運動ニューロン細胞死により末梢での脱神経および運動麻痺を呈した.また,CLP1のキナーゼ活性の欠失はtRNA前駆体におけるスプライシング効率の低下と同時に,5’側リーダー配列を含む新規のチロシンtRNA断片の蓄積を生じることが明らかになった(図2).これまでも,さまざまなtRNA断片が報告されており,たとえば,細胞質に存在しtRNA前駆体に由来するtRF-1001はがん細胞の生存維持に重要な役割をはたしており9),また,細胞質に存在し成熟tRNAに由来するtiRNAはストレスに応じてタンパク質の翻訳を制御することが報告されている5).この研究において発見された新規のチロシンtRNA断片は,酸化ストレスによるp53の活性化における感受性に影響をあたえる役割を担っていることが示唆された.今後,さらに詳細な分子機構の解明が期待される.今回の研究により,tRNAプロセシング,新規のRNA,そして,これらがp53を介した運動ニューロン細胞死に関与するという新たな病態機構の可能性が提示された.以上の知見をもとに,運動神経病である筋萎縮性側索硬化症や脊髄性筋萎縮症における新たな病因の解明や治療の開発につながる可能性が期待できる.
文 献
- Weitzer, S. & Martinez, J.: The human RNA kinase hClp1 is active on 3’ transfer RNA exons and short interfering RNAs. Nature, 447, 222-226 (2007)[PubMed]
- de Vries, H, Ruegsegger, U., Hubner, W. et al.: Human pre-mRNA cleavage factor IIm contains homologs of yeast proteins and bridges two other cleavage factors. EMBO J., 19, 5895-5904 (2000)[PubMed]
- Paushkin, S. V., Patel, M., Furia, B. S. et al.: Identification of a human endonuclease complex reveals a link between tRNA splicing and pre-mRNA 3’ end formation. Cell, 117, 311-321 (2004)[PubMed]
- Atkin, J. D., Scott, R. L., West, J. M. et al.: Properties of slow- and fast-twitchmuscle fibres in amousemodel of amyotrophic lateral sclerosis. Neuromuscul. Disord., 15, 377-388 (2005)[PubMed]
- Yamasaki, S., Ivanov, P., Hu, G. F. et al.: Angiogenin cleaves tRNA and promotes stress-induced translational repression. J. Cell Biol., 185, 35-42 (2009)[PubMed]
- Lambert, P. F., Kashanchi, F., Radonovich, M. F. et al.: Phosphorylation of p53 serine 15 increases interaction with CBP. J. Biol. Chem., 273, 33048-33053 (1998)[PubMed]
- Dumaz, N. & Meek, D. W.: Serine 15 phosphorylation stimulates p53 transactivation but does not directly influence interaction withHDM2. EMBO J., 18, 7002-7010 (1999)[PubMed]
- Chao, C., Hergenhahn, M., Kaeser, M. D. et al.: Cell type- and promoter-specific roles of Ser18 phosphorylation in regulating p53 responses. J. Biol. Chem., 278, 41028-41033 (2003)[PubMed]
- Lee, Y. S., Shibata, Y., Malhotra, A. et al.: A novel class of small RNAs: tRNA derived RNA fragments (tRFs). Genes Dev., 23, 2639-2649 (2009)[PubMed]
著者プロフィール
略歴:2000年 大分医科大学大学院医学研究科 修了,2003年 九州大学生体防御医学研究所 助手,2005年 オーストリアInstitute of Molecular Biotechnology(IMBA)研究員を経て,2012年より京都大学大学院医学研究科 特定准教授.
研究テーマ:マウス遺伝学を用いた疾患の分子機構の解明.
抱負:治療や創薬につながる研究をめざしています.
Josef M Penninger
オーストリアInstitute of Molecular Biotechnology(IMBA)所長.
研究室URL:http://www.imba.oeaw.ac.at/research/josef-penninger/
© 2013 花田俊勝・Josef M. Penninger Licensed under CC 表示 2.1 日本