アルツハイマー病の患者に由来するiPS細胞を用いた細胞内へのアミロイドβタンパク質の蓄積に関連するストレスと薬剤応答性の解明
近藤孝之・井上治久
(京都大学iPS細胞研究所 臨床応用研究部門神経変性研究チーム)
email:井上治久
DOI: 10.7875/first.author.2013.030
Modeling Alzheimer's disease with iPSCs reveals stress phenotypes associated with intracellular Aβ and differential drug responsiveness.
Takayuki Kondo, Masashi Asai, Kayoko Tsukita, Yumiko Kutoku, Yutaka Ohsawa, Yoshihide Sunada, Keiko Imamura, Naohiro Egawa, Naoki Yahata, Keisuke Okita, Kazutoshi Takahashi, Isao Asaka, Takashi Aoi, Akira Watanabe, Kaori Watanabe, Chie Kadoya, Rie Nakano, Dai Watanabe, Kei Maruyama, Osamu Hori, Satoshi Hibino, Tominari Choshi, Tatsutoshi Nakahata, Hiroyuki Hioki, Takeshi Kaneko, Motoko Naitoh, Katsuhiro Yoshikawa, Satoko Yamawaki, Shigehiko Suzuki, Ryuji Hata, Shu-ichi Ueno, Tsuneyoshi Seki, Kazuhiro Kobayashi, Tatsushi Toda, Kazuma Murakami, Kazuhiro Irie, William L. Klein, Hiroshi Mori, Takashi Asada, Ryosuke Takahashi, Nobuhisa Iwata, Shinya Yamanaka, Haruhisa Inoue
Cell Stem Cell, 12, 487-496 (2013)
進行性の認知機能の低下を生じるアルツハイマー病の病理学的な特徴のひとつは,脳におけるアミロイドβタンパク質の細胞外への蓄積である.しかし,ヒトではワクチンによるアミロイドβタンパク質の除去ののちにも,認知機能の低下の進行したことが報告されている.筆者らは,複数のアルツハイマー病の患者のiPS細胞から大脳皮質ニューロンを作製した.アミロイド前駆体タンパク質のGlu693を欠失した変異をもつ家族性アルツハイマー病の患者のニューロンでは,細胞内にアミロイドβオリゴマーとよばれるアミロイドβタンパク質の可溶性の重合体が蓄積し,小胞体ストレスおよび酸化ストレスが生じて脆弱になっていた.また,低濃度のドコサヘキサエン酸はこの細胞ストレスを緩和した.さらに,一部の孤発性アルツハイマー病の患者に由来するニューロンにおいては,アミロイド前駆体タンパク質のGlu693を欠失した変異はもたないにもかかわらず,細胞内におけるアミロイドβオリゴマーの蓄積と細胞ストレスが生じていた.これらの結果は,iPS細胞技術によりアルツハイマー病という高齢で発症する疾患の再現が可能であること,iPS細胞技術がアルツハイマー病に対し病態のタイプにもとづく先制的な医療介入に寄与する可能性を示した.
神経変性疾患は多岐におよび,これまで,電気生理学的あるいは神経放射線学的な検査など臨床的な手法を用いて疾患の概念が確立され,診断法および治療法の開発が進歩してきた.一方で,疾患の首座である中枢神経系は再生がむずかしいため,かぎられた場合を除いて生検材料を得ることはできない.そのため,病態の直接的な解明には限界があった.これまで,病態の解明のための研究は,遺伝性疾患の遺伝学的な解析,および,死後の病理組織,遺伝子改変動物,細胞モデルなどに対する生化学的および組織学的な解析を中心として進められており,間接的にしか患者の病態を解析することができなかった.2006年,iPS細胞(induced pluripotent stem cell,人工多能性幹細胞)が誕生し1),医学と生物学の世界に衝撃をあたえた.神経疾患の領域においては,iPS細胞技術により患者自身の体細胞から,これまで生検材料を得ることが困難であった中枢神経系の組織にある標的となる細胞を入手することが可能となり,これまでにないまったく新たな医療開発の扉が開かれた.
アルツハイマー病(Alzheimer’s disease)は進行性の記銘力の低下,見当識の障害を中心とする,もっとも頻度の高い神経変性疾患である.アルツハイマー病では加齢が大きな発症リスクであり,その予防法あるいは治療法の開発は高度高齢化社会をむかえつつあるわが国において喫緊の課題である.アルツハイマー病の病理学的な特徴は,脳に老人斑といわれるタンパク質の沈着がみられることで,この老人斑の主成分はアミロイド前駆体タンパク質(amyloid precursor protein:APP)から酵素による2段階の切断により切り出されるアミロイドβタンパク質である2).老人斑に蓄積するアミロイドβタンパク質は不溶性の線維状の重合構造をとっている.さらに,脳における老人斑の分布の解析や,線維状アミロイドβタンパク質を蓄積する遺伝子改変マウスや培養細胞での実験結果にもとづき,細胞外のアミロイドβタンパク質(とくに,線維状のアミロイドβタンパク質である老人斑)を起点として神経細胞死が導かれるとする“アミロイドカスケード仮説”が広く受け入れられてきた.この仮説にもとづきアミロイドβタンパク質のワクチン療法の治験が実施され,そこでは老人斑を取り去ることには成功したものの,認知症状の進行を抑制することはできなかった3).一方で,不溶性の線維状の重合構造をとったアミロイドβタンパク質ではなく,2分子から12分子のアミロイドβタンパク質が重合したオリゴマー体であるアミロイドβオリゴマーを重要視する仮説が提唱されるようになった.アミロイドβオリゴマーは可溶性であり,細胞外に存在するとシナプスの機能異常をひき起こし,より強い神経細胞毒性をもつことが細胞株やモデル動物を用いて示されてきた4,5).さらに,アルツハイマー病の患者の神経におけるアミロイドβオリゴマーの蓄積量は認知機能の低下と相関することが示されている6,7).そのような状況のなか,アミロイド前駆体タンパク質のGlu693を欠失するという新規の変異をもつ家族性アルツハイマー病の家系が同定された.この家系の患者は典型的な臨床症状を呈する一方で,老人斑を検出できるPIB-PETでは脳において線維状のアミロイドβタンパク質が検出されなかった.培養細胞を用いた実験により,この変異が存在すると線維状のアミロイドβタンパク質ではなく,細胞内に可溶性のアミロイドβオリゴマーが蓄積することがわかった8).
これまで,アルツハイマー病の患者から得たiPS細胞を用いた研究は9,10),細胞外のアミロイドβタンパク質に着目していた.そこで筆者らは,細胞内のアミロイドβタンパク質に着目し,家族性アルツハイマー病のなかでも,細胞内にアミロイドβタンパク質が蓄積するタイプであるアミロイド前駆体タンパク質のGlu693を欠失した変異をもつ家族性アルツハイマー病の患者からiPS細胞を樹立し,細胞内のアミロイドβタンパク質とそれに関連するストレスについて解析を行った.
健常人,および,家族性アルツハイマー病の患者(アミロイド前駆体タンパク質のGlu693を欠失した変異型,あるいは,アミロイド前駆体タンパク質のVal717がLeuに置換した変異型),孤発性アルツハイマー病の患者の線維芽細胞を,染色体ベクターを用いた遺伝子導入によりiPS細胞へと初期化した.樹立されたiPS細胞は,自己複製能と多分化能をもつES細胞と同等の性質を呈した.
つぎに,ES細胞からのニューロンの分化誘導であるSFEBq法(serum-free floating culture of embryoid body-like aggregates quick法[要文献])を改変した方法により,樹立したiPS細胞を大脳皮質ニューロンへと分化誘導した.まず,胚様体の形成のときにドルソモルフィンとSB431542を添加することにより,神経幹細胞のマーカーであるネスチンの陽性率が99%以上という高効率で神経系の細胞へと誘導した.さらに,2次元の接着培養をつづけ,合計72日間の培養期間をへて,ニューロンのマーカーであるTUJ1と,大脳皮質神経のマーカーであるTBR1およびSATB2を高効率に発現する大脳皮質ニューロンへと成熟させた.
まず,細胞外に分泌されたアミロイドβタンパク質の量を測定すると,健常人に由来するニューロンと比較して,アミロイド前駆体タンパク質のGlu693を欠失した変異をもつニューロンでは1/10~1/20程度ときわめて低いことがわかった.一方で,アミロイドβタンパク質のなかでも線維状の構造をとりやすく毒性の高いサブタイプであるAβ42の存在比は健常人と変わらなかった.アミロイド前駆体タンパク質のVal717がLeuに置換した変異をもつニューロンにおいては細胞外に分泌されるAβ42は約1.5倍に増加しており,細胞株を用いたこれまでの報告と一致する結果であった.さらに,ヒトiPS細胞から200日以上かけてアストロサイトを分化誘導した.そして,このアストロサイトにおいて細胞外に分泌されたアミロイドβタンパク質の量を測定すると,ニューロンと同様に,アミロイド前駆体タンパク質のGlu693を欠失した変異をもつアストロサイトにおける細胞外への分泌は健常人と比べ少ないことがわかった.
アミロイドβオリゴマーを特異的に認識する抗体を用いると,アミロイド前駆体タンパク質のGlu693を欠失した変異をもつニューロンの細胞内にアミロイドβオリゴマーの蓄積していることがわかった.そして,この細胞内のアミロイドβオリゴマーは,アミロイド前駆体タンパク質からアミロイドβタンパク質の産生する際にはたらくβセクレターゼを阻害する薬剤を用いることで減少した.アストロサイトにおいても細胞内にアミロイドβオリゴマーの蓄積を認めた一方で,線維芽細胞では蓄積を認めなかった.さらに,健常人のiPS細胞に由来するニューロンにGlu693を欠失した変異をもつアミロイド前駆体タンパク質を過剰発現させると,細胞内にアミロイドβオリゴマーの蓄積がみられた.以上より,アミロイド前駆体タンパク質のGlu693を欠失した変異が存在することで,ニューロンおよびアストロサイトの細胞内にアミロイドβオリゴマーの蓄積することが示された.
細胞内にアミロイドβオリゴマーを蓄積するニューロンおよびアストロサイトでは,小胞体ストレスのマーカータンパク質であるBiPの発現の上昇がみられた.さらに,マイクロアレイを用いて網羅的な遺伝子発現解析を行ったところ,アミロイド前駆体タンパク質のGlu693を欠失した変異をもつニューロンおよびアストロサイトでは,酸化ストレスに関連する遺伝子の発現が上昇していた.ウェスタンブロット法によるタンパク質レベルでの解析でも,酸化ストレスマーカーのひとつであるペルオキシレドキシン4の量が増加していた.酸化ストレスを惹起する活性酸素種についても,細胞内の活性酸素種を検出する化合物により,アミロイド前駆体タンパク質のGlu693を欠失した変異をもつニューロンおよびアストロサイトではその増加を認めた.最終的に,これらの小胞体ストレスおよび酸化ストレスが神経栄養因子を添加しない培養条件において,アミロイド前駆体タンパク質のGlu693を欠失した変異をもつニューロンの細胞死を誘導することを見い出した.
アミロイド前駆体タンパク質のGlu693を欠失した変異をもつニューロンおよびアストロサイトを用い,小胞体ストレスを指標として複数種の化合物の効果を評価したところ,ドコサヘキサエン酸5μMを培地に添加すると小胞体ストレスが緩和され細胞死が抑制された.このドコサヘキサエン酸の添加濃度を20μM以上に上げると逆に小胞体ストレスは増加し,至適濃度の存在が示唆された.
複数の孤発性アルツハイマー病の患者からもiPS細胞を樹立し,同様に大脳皮質ニューロンへと分化誘導し解析した結果,1人の孤発性アルツハイマー病の患者に由来するニューロンにおいて,アミロイド前駆体タンパク質のGlu693を欠失した変異はないにもかかわらず,細胞内にアミロイドβオリゴマーの蓄積と細胞ストレスの生じていることを見い出した.一方で,もう1人の孤発性アルツハイマー病の患者に由来するニューロンでは細胞内にアミロイドβオリゴマーを認めなかった.
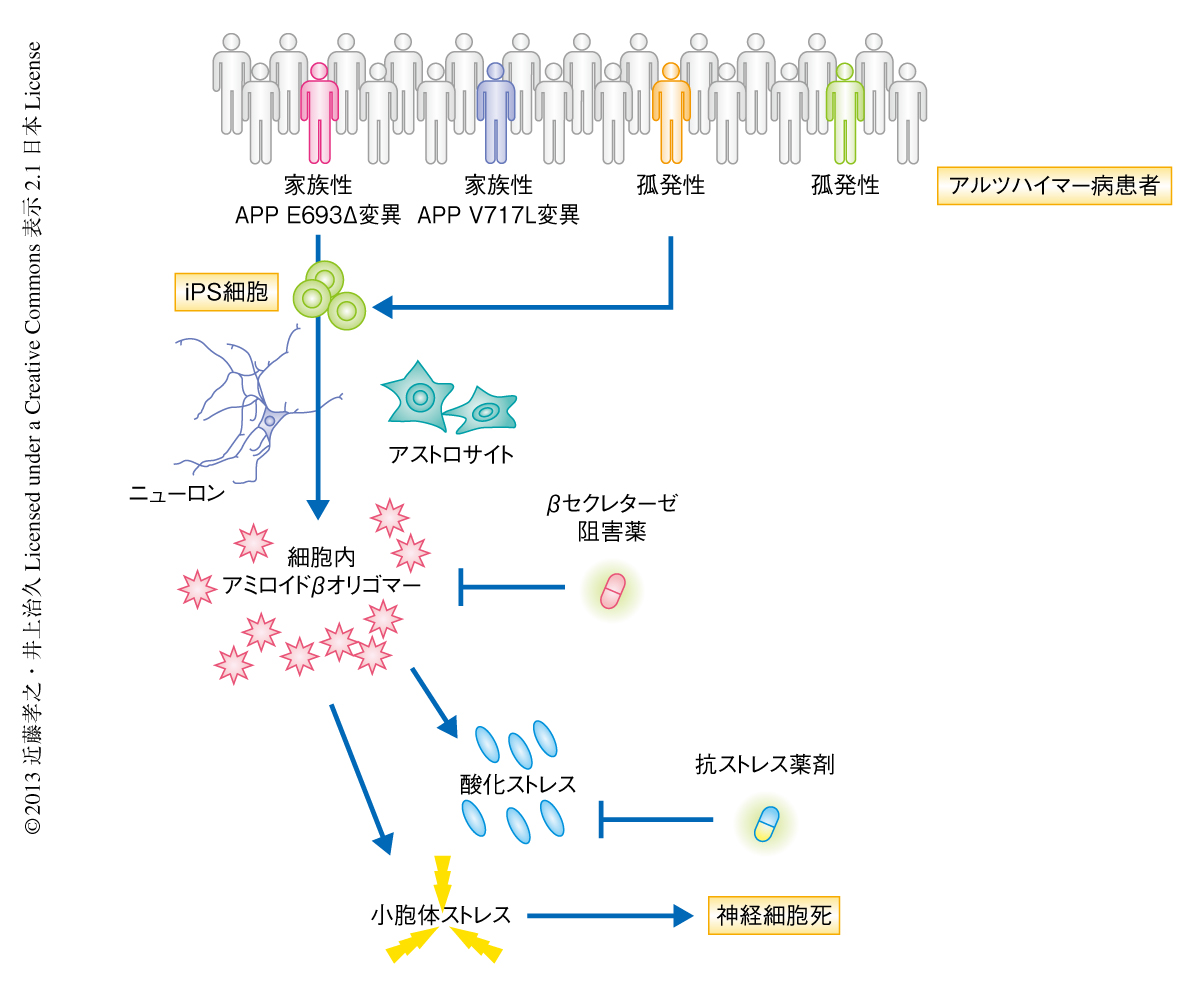
孤発性アルツハイマー病の患者に由来するニューロンの解析結果は,臨床症状から孤発性アルツハイマー病として診断される患者において,その背景にひそむ病態は一元的ではなく,個々の患者の病態に特性の潜在する可能性を意味した.そして,その治療の選択において個々の病態の背景を念頭におくことの必要性を示唆した.iPS細胞技術は,疾患の病態の解明あるいは治療法の開発のみならず,疾患の原因や進行に関する研究知見をもとに,体内の異常を早期に診断し,疾患を発症するまえから治療を開始することにより発症を遅らせる,もしくは,防ぐことをめざす,“先制医療”に役立つ可能性が考えられた(図1).
iPS細胞の樹立法の開発からわずか7年で,神経疾患の領域を含めた疾患研究への応用は広がりをみせている.iPS細胞を用いた疾患研究は,原因遺伝子の過剰発現やノックアウトでは検討のむずかしかった孤発例の検討や,生理的な遺伝子発現量における病態の解明および治療薬の開発につながる可能性が高く,今後の発展が期待される.
略歴:京都大学大学院医学研究科博士課程 在学中.
井上 治久(Haruhisa Inoue)
京都大学iPS細胞研究所 准教授.
研究室URL:http://www.cira.kyoto-u.ac.jp/inoue/
© 2013 近藤孝之・井上治久 Licensed under CC 表示 2.1 日本
(京都大学iPS細胞研究所 臨床応用研究部門神経変性研究チーム)
email:井上治久
DOI: 10.7875/first.author.2013.030
Modeling Alzheimer's disease with iPSCs reveals stress phenotypes associated with intracellular Aβ and differential drug responsiveness.
Takayuki Kondo, Masashi Asai, Kayoko Tsukita, Yumiko Kutoku, Yutaka Ohsawa, Yoshihide Sunada, Keiko Imamura, Naohiro Egawa, Naoki Yahata, Keisuke Okita, Kazutoshi Takahashi, Isao Asaka, Takashi Aoi, Akira Watanabe, Kaori Watanabe, Chie Kadoya, Rie Nakano, Dai Watanabe, Kei Maruyama, Osamu Hori, Satoshi Hibino, Tominari Choshi, Tatsutoshi Nakahata, Hiroyuki Hioki, Takeshi Kaneko, Motoko Naitoh, Katsuhiro Yoshikawa, Satoko Yamawaki, Shigehiko Suzuki, Ryuji Hata, Shu-ichi Ueno, Tsuneyoshi Seki, Kazuhiro Kobayashi, Tatsushi Toda, Kazuma Murakami, Kazuhiro Irie, William L. Klein, Hiroshi Mori, Takashi Asada, Ryosuke Takahashi, Nobuhisa Iwata, Shinya Yamanaka, Haruhisa Inoue
Cell Stem Cell, 12, 487-496 (2013)
要 約
進行性の認知機能の低下を生じるアルツハイマー病の病理学的な特徴のひとつは,脳におけるアミロイドβタンパク質の細胞外への蓄積である.しかし,ヒトではワクチンによるアミロイドβタンパク質の除去ののちにも,認知機能の低下の進行したことが報告されている.筆者らは,複数のアルツハイマー病の患者のiPS細胞から大脳皮質ニューロンを作製した.アミロイド前駆体タンパク質のGlu693を欠失した変異をもつ家族性アルツハイマー病の患者のニューロンでは,細胞内にアミロイドβオリゴマーとよばれるアミロイドβタンパク質の可溶性の重合体が蓄積し,小胞体ストレスおよび酸化ストレスが生じて脆弱になっていた.また,低濃度のドコサヘキサエン酸はこの細胞ストレスを緩和した.さらに,一部の孤発性アルツハイマー病の患者に由来するニューロンにおいては,アミロイド前駆体タンパク質のGlu693を欠失した変異はもたないにもかかわらず,細胞内におけるアミロイドβオリゴマーの蓄積と細胞ストレスが生じていた.これらの結果は,iPS細胞技術によりアルツハイマー病という高齢で発症する疾患の再現が可能であること,iPS細胞技術がアルツハイマー病に対し病態のタイプにもとづく先制的な医療介入に寄与する可能性を示した.
はじめに
神経変性疾患は多岐におよび,これまで,電気生理学的あるいは神経放射線学的な検査など臨床的な手法を用いて疾患の概念が確立され,診断法および治療法の開発が進歩してきた.一方で,疾患の首座である中枢神経系は再生がむずかしいため,かぎられた場合を除いて生検材料を得ることはできない.そのため,病態の直接的な解明には限界があった.これまで,病態の解明のための研究は,遺伝性疾患の遺伝学的な解析,および,死後の病理組織,遺伝子改変動物,細胞モデルなどに対する生化学的および組織学的な解析を中心として進められており,間接的にしか患者の病態を解析することができなかった.2006年,iPS細胞(induced pluripotent stem cell,人工多能性幹細胞)が誕生し1),医学と生物学の世界に衝撃をあたえた.神経疾患の領域においては,iPS細胞技術により患者自身の体細胞から,これまで生検材料を得ることが困難であった中枢神経系の組織にある標的となる細胞を入手することが可能となり,これまでにないまったく新たな医療開発の扉が開かれた.
アルツハイマー病(Alzheimer’s disease)は進行性の記銘力の低下,見当識の障害を中心とする,もっとも頻度の高い神経変性疾患である.アルツハイマー病では加齢が大きな発症リスクであり,その予防法あるいは治療法の開発は高度高齢化社会をむかえつつあるわが国において喫緊の課題である.アルツハイマー病の病理学的な特徴は,脳に老人斑といわれるタンパク質の沈着がみられることで,この老人斑の主成分はアミロイド前駆体タンパク質(amyloid precursor protein:APP)から酵素による2段階の切断により切り出されるアミロイドβタンパク質である2).老人斑に蓄積するアミロイドβタンパク質は不溶性の線維状の重合構造をとっている.さらに,脳における老人斑の分布の解析や,線維状アミロイドβタンパク質を蓄積する遺伝子改変マウスや培養細胞での実験結果にもとづき,細胞外のアミロイドβタンパク質(とくに,線維状のアミロイドβタンパク質である老人斑)を起点として神経細胞死が導かれるとする“アミロイドカスケード仮説”が広く受け入れられてきた.この仮説にもとづきアミロイドβタンパク質のワクチン療法の治験が実施され,そこでは老人斑を取り去ることには成功したものの,認知症状の進行を抑制することはできなかった3).一方で,不溶性の線維状の重合構造をとったアミロイドβタンパク質ではなく,2分子から12分子のアミロイドβタンパク質が重合したオリゴマー体であるアミロイドβオリゴマーを重要視する仮説が提唱されるようになった.アミロイドβオリゴマーは可溶性であり,細胞外に存在するとシナプスの機能異常をひき起こし,より強い神経細胞毒性をもつことが細胞株やモデル動物を用いて示されてきた4,5).さらに,アルツハイマー病の患者の神経におけるアミロイドβオリゴマーの蓄積量は認知機能の低下と相関することが示されている6,7).そのような状況のなか,アミロイド前駆体タンパク質のGlu693を欠失するという新規の変異をもつ家族性アルツハイマー病の家系が同定された.この家系の患者は典型的な臨床症状を呈する一方で,老人斑を検出できるPIB-PETでは脳において線維状のアミロイドβタンパク質が検出されなかった.培養細胞を用いた実験により,この変異が存在すると線維状のアミロイドβタンパク質ではなく,細胞内に可溶性のアミロイドβオリゴマーが蓄積することがわかった8).
これまで,アルツハイマー病の患者から得たiPS細胞を用いた研究は9,10),細胞外のアミロイドβタンパク質に着目していた.そこで筆者らは,細胞内のアミロイドβタンパク質に着目し,家族性アルツハイマー病のなかでも,細胞内にアミロイドβタンパク質が蓄積するタイプであるアミロイド前駆体タンパク質のGlu693を欠失した変異をもつ家族性アルツハイマー病の患者からiPS細胞を樹立し,細胞内のアミロイドβタンパク質とそれに関連するストレスについて解析を行った.
1.ヒトのiPS細胞からの大脳皮質ニューロンの分化誘導法の開発
健常人,および,家族性アルツハイマー病の患者(アミロイド前駆体タンパク質のGlu693を欠失した変異型,あるいは,アミロイド前駆体タンパク質のVal717がLeuに置換した変異型),孤発性アルツハイマー病の患者の線維芽細胞を,染色体ベクターを用いた遺伝子導入によりiPS細胞へと初期化した.樹立されたiPS細胞は,自己複製能と多分化能をもつES細胞と同等の性質を呈した.
つぎに,ES細胞からのニューロンの分化誘導であるSFEBq法(serum-free floating culture of embryoid body-like aggregates quick法[要文献])を改変した方法により,樹立したiPS細胞を大脳皮質ニューロンへと分化誘導した.まず,胚様体の形成のときにドルソモルフィンとSB431542を添加することにより,神経幹細胞のマーカーであるネスチンの陽性率が99%以上という高効率で神経系の細胞へと誘導した.さらに,2次元の接着培養をつづけ,合計72日間の培養期間をへて,ニューロンのマーカーであるTUJ1と,大脳皮質神経のマーカーであるTBR1およびSATB2を高効率に発現する大脳皮質ニューロンへと成熟させた.
2.アミロイド前駆体タンパク質のGlu693を欠失した変異ではアミロイドβタンパク質の細胞外への分泌が低下する
まず,細胞外に分泌されたアミロイドβタンパク質の量を測定すると,健常人に由来するニューロンと比較して,アミロイド前駆体タンパク質のGlu693を欠失した変異をもつニューロンでは1/10~1/20程度ときわめて低いことがわかった.一方で,アミロイドβタンパク質のなかでも線維状の構造をとりやすく毒性の高いサブタイプであるAβ42の存在比は健常人と変わらなかった.アミロイド前駆体タンパク質のVal717がLeuに置換した変異をもつニューロンにおいては細胞外に分泌されるAβ42は約1.5倍に増加しており,細胞株を用いたこれまでの報告と一致する結果であった.さらに,ヒトiPS細胞から200日以上かけてアストロサイトを分化誘導した.そして,このアストロサイトにおいて細胞外に分泌されたアミロイドβタンパク質の量を測定すると,ニューロンと同様に,アミロイド前駆体タンパク質のGlu693を欠失した変異をもつアストロサイトにおける細胞外への分泌は健常人と比べ少ないことがわかった.
3.アミロイド前駆体タンパク質のGlu693を欠失した変異をもつニューロンでは細胞内にアミロイドβオリゴマーが蓄積する
アミロイドβオリゴマーを特異的に認識する抗体を用いると,アミロイド前駆体タンパク質のGlu693を欠失した変異をもつニューロンの細胞内にアミロイドβオリゴマーの蓄積していることがわかった.そして,この細胞内のアミロイドβオリゴマーは,アミロイド前駆体タンパク質からアミロイドβタンパク質の産生する際にはたらくβセクレターゼを阻害する薬剤を用いることで減少した.アストロサイトにおいても細胞内にアミロイドβオリゴマーの蓄積を認めた一方で,線維芽細胞では蓄積を認めなかった.さらに,健常人のiPS細胞に由来するニューロンにGlu693を欠失した変異をもつアミロイド前駆体タンパク質を過剰発現させると,細胞内にアミロイドβオリゴマーの蓄積がみられた.以上より,アミロイド前駆体タンパク質のGlu693を欠失した変異が存在することで,ニューロンおよびアストロサイトの細胞内にアミロイドβオリゴマーの蓄積することが示された.
4.細胞内のアミロイドβオリゴマーの蓄積は小胞体ストレスおよび酸化ストレスを惹起する
細胞内にアミロイドβオリゴマーを蓄積するニューロンおよびアストロサイトでは,小胞体ストレスのマーカータンパク質であるBiPの発現の上昇がみられた.さらに,マイクロアレイを用いて網羅的な遺伝子発現解析を行ったところ,アミロイド前駆体タンパク質のGlu693を欠失した変異をもつニューロンおよびアストロサイトでは,酸化ストレスに関連する遺伝子の発現が上昇していた.ウェスタンブロット法によるタンパク質レベルでの解析でも,酸化ストレスマーカーのひとつであるペルオキシレドキシン4の量が増加していた.酸化ストレスを惹起する活性酸素種についても,細胞内の活性酸素種を検出する化合物により,アミロイド前駆体タンパク質のGlu693を欠失した変異をもつニューロンおよびアストロサイトではその増加を認めた.最終的に,これらの小胞体ストレスおよび酸化ストレスが神経栄養因子を添加しない培養条件において,アミロイド前駆体タンパク質のGlu693を欠失した変異をもつニューロンの細胞死を誘導することを見い出した.
5.iPS細胞に由来するニューロンを用いた薬剤の評価
アミロイド前駆体タンパク質のGlu693を欠失した変異をもつニューロンおよびアストロサイトを用い,小胞体ストレスを指標として複数種の化合物の効果を評価したところ,ドコサヘキサエン酸5μMを培地に添加すると小胞体ストレスが緩和され細胞死が抑制された.このドコサヘキサエン酸の添加濃度を20μM以上に上げると逆に小胞体ストレスは増加し,至適濃度の存在が示唆された.
6.一部の孤発性アルツハイマー病の患者に由来するニューロンにもアミロイドβオリゴマーは蓄積する
複数の孤発性アルツハイマー病の患者からもiPS細胞を樹立し,同様に大脳皮質ニューロンへと分化誘導し解析した結果,1人の孤発性アルツハイマー病の患者に由来するニューロンにおいて,アミロイド前駆体タンパク質のGlu693を欠失した変異はないにもかかわらず,細胞内にアミロイドβオリゴマーの蓄積と細胞ストレスの生じていることを見い出した.一方で,もう1人の孤発性アルツハイマー病の患者に由来するニューロンでは細胞内にアミロイドβオリゴマーを認めなかった.
7.iPS細胞を用いたアルツハイマー病の先制医療の開発への道
孤発性アルツハイマー病の患者に由来するニューロンの解析結果は,臨床症状から孤発性アルツハイマー病として診断される患者において,その背景にひそむ病態は一元的ではなく,個々の患者の病態に特性の潜在する可能性を意味した.そして,その治療の選択において個々の病態の背景を念頭におくことの必要性を示唆した.iPS細胞技術は,疾患の病態の解明あるいは治療法の開発のみならず,疾患の原因や進行に関する研究知見をもとに,体内の異常を早期に診断し,疾患を発症するまえから治療を開始することにより発症を遅らせる,もしくは,防ぐことをめざす,“先制医療”に役立つ可能性が考えられた(図1).
おわりに
iPS細胞の樹立法の開発からわずか7年で,神経疾患の領域を含めた疾患研究への応用は広がりをみせている.iPS細胞を用いた疾患研究は,原因遺伝子の過剰発現やノックアウトでは検討のむずかしかった孤発例の検討や,生理的な遺伝子発現量における病態の解明および治療薬の開発につながる可能性が高く,今後の発展が期待される.
文 献
- Takahashi, K. & Yamanaka, S.: Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126, 663-676 (2006)[PubMed]
- Goedert, M. & Spillantini, M. G.: A century of Alzheimer's disease. Science, 314, 777-781 (2006)[PubMed]
- Holmes, C., Boche, D., Wilkinson, D. et al.: Long-term effects of Aβ42 immunisation in Alzheimer's disease: follow-up of a randomised, placebo-controlled phase I trial. Lancet, 372, 216-223 (2008)[PubMed]
- Gong, Y., Chang, L., Viola, K. L. et al.: Alzheimer's disease-affected brain: presence of oligomeric Aβ ligands (ADDLs) suggests a molecular basis for reversible memory loss. Proc. Natl. Acad. Sci. USA, 100, 10417-10422 (2003)[PubMed]
- Walsh, D. M., Klyubin, I., Fadeeva, J. V. et al.: Naturally secreted oligomers of amyloid β protein potently inhibit hippocampal long-term potentiation in vivo. Nature, 416, 535-539 (2002)[PubMed]
- Krafft, G. A. & Klein, W. L.: ADDLs and the signaling web that leads to Alzheimer's disease. Neuropharmacology, 59, 230-242 (2010)[PubMed]
- Haass, C. & Selkoe, D. J.: Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer's amyloid β-peptide. Nat. Rev. Mol. Cell Biol., 8, 101-112 (2007)[PubMed]
- Tomiyama, T., Nagata, T., Shimada, H. et al.: A new amyloid β variant favoring oligomerization in Alzheimer's-type dementia. Ann. Neurol., 63, 377-387 (2008)[PubMed]
- Yagi, T., Ito, D., Okada, Y. et al.: Modeling familial Alzheimer's disease with induced pluripotent stem cells. Hum. Mol. Genet., 20, 4530-4539 (2011)[PubMed]
- Israel, M. A., Yuan, S. H., Bardy, C. et al.: Probing sporadic and familial Alzheimer's disease using induced pluripotent stem cells. Nature, 482, 216-220 (2012)[PubMed]
著者プロフィール
略歴:京都大学大学院医学研究科博士課程 在学中.
井上 治久(Haruhisa Inoue)
京都大学iPS細胞研究所 准教授.
研究室URL:http://www.cira.kyoto-u.ac.jp/inoue/
© 2013 近藤孝之・井上治久 Licensed under CC 表示 2.1 日本