細胞膜の過剰な生産により誘導される原始的な細胞分裂
川合 良和
(英国Newcastle大学Medical School,The Centre for Bacterial Cell Biology)
email:川合良和
DOI: 10.7875/first.author.2013.028
Excess membrane synthesis drives a primitive mode of cell proliferation.
Romain Mercier, Yoshikazu Kawai, Jeff Errington
Cell, 152, 997-1007 (2013)
細胞壁は細菌の特色を示す構造であり,細胞の形態そして細胞分裂および増殖を維持するため必要不可欠な役割を担う.しかしながら,多くの細菌は細胞壁を失ってもL型とよばれる状態へと変化することにより分裂し増殖しつづけることができる.L型では細菌の細胞分裂において必須であるFtsZシステムを必要とせず,細胞がチューブ状に変形,あるいは,細胞の表面に複数の突起を形成し突出と退縮をくり返すなど,形態の変化に依存して分裂する.しかしながら,これまでその分子機構は不明であった.筆者らは,枯草菌においてL型の形態変化および細胞分裂を誘導するために,細胞膜の過剰な生産をもたらす遺伝的な変異が必要かつ十分であることを見い出した.さらには,変異をもたない野生株のプロトプラストでも,人為的に細胞膜の表面積を増大させるだけでL型と同様な形態変化と細胞分裂が誘導されることを示した.これらの結果は,細菌が細胞壁を獲得する以前の細胞,すなわち,高度な制御系をもたない原始的な生命体においても,同様な方法を用いて効率的に増殖することが可能であったことを示唆した.
細菌のもつペプチドグリカンをおもな成分とする細胞壁は,細菌の特色を示す構造である.細胞壁がほぼすべての細菌に存在していることは,30億年以上まえに誕生した細菌の共通祖先にもすでに細胞壁が備わっていた可能性を示す1).細胞壁の前躯体の合成およびその構築には多数の遺伝子を必要とするが,それらのほとんどは細胞の増殖に必須である.そのため,細胞壁合成系は抗生物質にとり有効な標的となっている.しかしながら驚くべきことに,多くの細菌は細胞壁を失ってもL型(L-form)へと変化することにより再び増殖が可能になる2).L型をとる細菌はさまざまな感染症の患者などから単離されており,その抗生物質耐性および継続的な感染能が認められてきた3).研究室環境でのL型の分離は,通常,スクロースなど浸透圧保護剤を含む培地を用いて行われ,適切な抗生物質による長期間にわたる細胞壁の合成阻害を必要とする.また,安定なL型の形成および増殖にはなんらかの遺伝的変異が必要であり2),いくつかの細菌に由来するL型においてゲノム塩基配列の解析が行われてきた4).しかしながら,そうした遺伝的変異がどのようにL型の形成と増殖に関与しているのかは明らかにされていない.
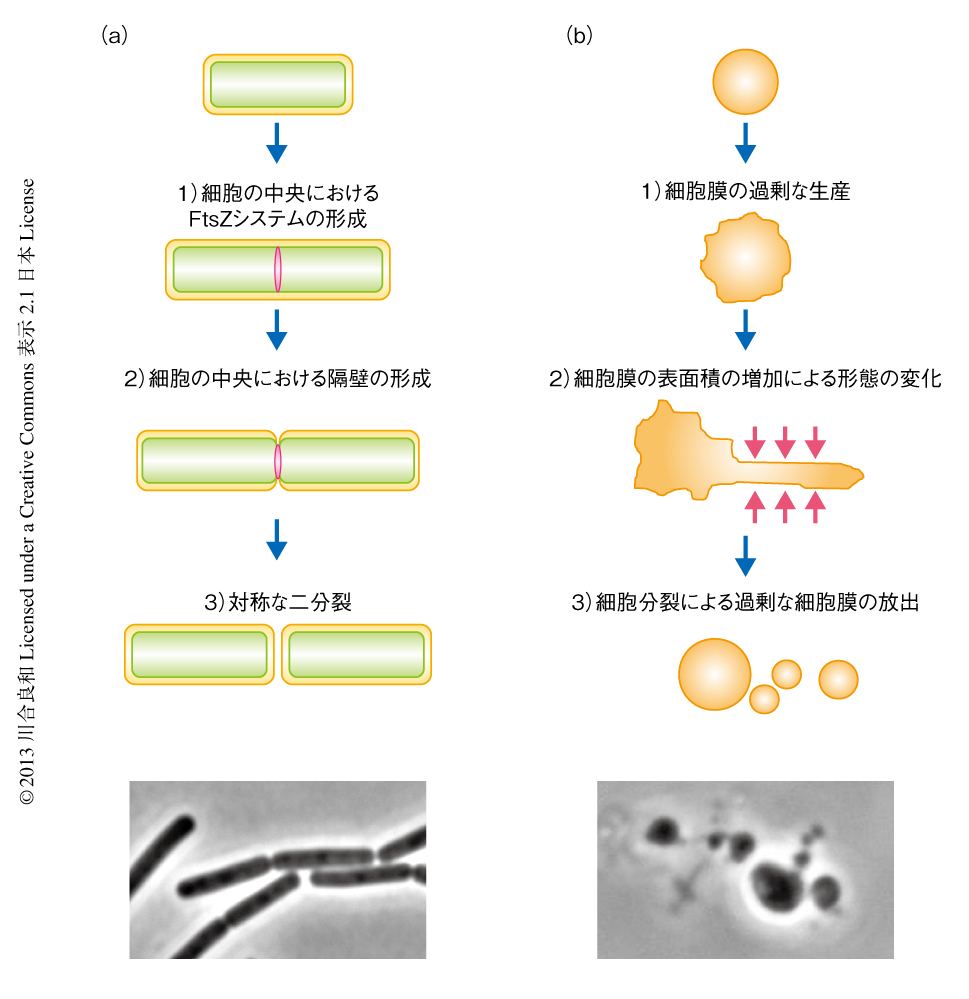
最近,代表的なモデル生物のひとつである枯草菌のL型において遺伝学そして細胞生物学的な手法を用いた解析がはじめられ,その増殖機構に関して重要な発見がなされた4-6).通常,細菌の細胞分裂はFtsZを中心とした10種類以上の構成タンパク質からなる分子装置により厳密に制御されており,細胞の中央において規則正しい二分裂が起こる7)(図1a).一方,L型では,細胞がチューブ状に変形(membrane tubulation),あるいは,細胞の表面に複数の突起を形成し突出と退縮をくり返す(membrane blebbing)など,不規則な細胞形態の変化に依存したランダムな分裂が起こり,これらはFtsZを必要としない4)(図1b).
今回の報告において,筆者らは,枯草菌がL型として増殖するため必要な遺伝的変異の詳細な解析を行うことにより,FtsZシステムに依存しないL型での分裂が細胞膜の表面積の増大のみで起こることを示した.
L型の安定な増殖にはいくつかの遺伝的変異を必要とすることが知られている2).これまでに分離された枯草菌のL型株では,ペプチドグリカン前躯体の合成に必須な遺伝子群であるmurEオペロンおよびイソプレノイド合成遺伝子であるispA遺伝子の機能抑制をもたらす遺伝子変異がその増殖に必要であると考えられている4).そこで,これらの遺伝子変異が及ぼす細胞増殖への影響をリゾチーム処理により細胞壁を取り除きプロトプラスト化した細胞において調べた.野生株のプロトプラストでは浸透圧保護剤であるスクロースを含む培地においてその増殖はみられなかった.また,murEオペロンあるいはispA遺伝子それぞれ一方の発現抑制株でもその増殖はみられなかった.しかしながら,murEオペロンおよびispA遺伝子の転写を同時に抑制したプロトプラストでは増殖が観察された.このように,これまでに報告されていた結果と一致して,murEオペロンおよびispA遺伝子の機能抑制は細胞壁を失った細胞の増殖を誘導することが確認された.
L型での分裂は細胞形態の変化に依存して起こることが知られている4,6).そこで,murEオペロンおよびispA遺伝子に対する遺伝子変異がプロトプラストの細胞形態に及ぼす影響を顕微鏡タイムラプス解析により調べた.野生株は均一で安定な球状の形態をとり細胞分裂はみられなかったが,murEオペロンおよびispA遺伝子を同時に抑制するとL型で観察される形態変化に依存した細胞分裂が誘導されることがわかった.つづいて,ispA遺伝子のみを発現抑制したプロトプラストでも同様な解析を行ったが,細胞分裂はみられなかった.一方,murEオペロンを発現抑制した場合にはL型と同様の形態変化と細胞分裂の誘導がみられたが,多くの細胞は細胞分裂の際に溶菌した.これらの結果から,L型での増殖にはmurEオペロンの機能抑制による形態変化および細胞分裂の誘導,そして,ispA遺伝子の機能抑制による細胞分裂の際の溶菌の抑制が必要であると考えられた.
分裂能および増殖能をもたない野生株のプロトプラストを細胞壁の再形成を抑制するような適切な抗生物質を含む培地で培養しつづけることにより,自然突然変異を利用したL型の分離を行った.ゲノム塩基配列の解析の結果,18遺伝子を含む18 kbpの欠失が同定され,そこにはmurEオペロンと同じくペプチドグリカン前躯体の合成に必須なmurC遺伝子が含まれていた.さらなる解析の結果,この18 kbp欠失変異体におけるL型での増殖にはmurC遺伝子にくわえ,ほかに1つ以上の遺伝子の欠失が必要であることがわかった.また,murC遺伝子をispA遺伝子と同時に発現抑制した場合においてもL型での増殖は誘導された.さらに,異なるペプチドグリカン前躯体合成遺伝子においても同様であることが確認された.これらの結果は,L型での増殖には形態変化と細胞分裂を誘導するための変異(ペプチドグリカン前躯体合成系の抑制)と,細胞分裂の過程の細胞を安定化させる変異(ispA遺伝子の機能抑制など)の,少なくとも2種類の異なる役割をもつ遺伝的変異が必要であることを示した.
細胞はペプチドグリカンの合成に異常が生じた際に,通常とは異なるなんらかの分裂機構を誘導していると考えられた.そこで,ispA発現抑制株のプロトプラストを用いて自然突然変異を利用したL型の分離を行うことにより,L型での細胞分裂を誘導するために必要な遺伝的変異のスクリーニングを行った.ペプチドグリカン合成遺伝子への変異をさけるため,細胞壁の再合成が可能な変異体のみを選択した.ゲノム塩基配列の解析の結果,accDA遺伝子の上流に1塩基の置換変異が同定され,この変異によりAccDAの過剰な発現が誘導されていることがわかった.AccDAはアセチルCoAからマロニルCoAを合成する酵素であるアセチルCoAカルボキシラーゼ複合体の主要な構成タンパク質である.顕微鏡タイムラプス解析によりAccDAの過剰な発現がプロトプラストに及ぼす影響を観察した結果,murEオペロンの発現抑制と同様に,形態変化と細胞分裂を誘導していることが確認された.
アセチルCoAカルボキシラーゼにより合成されるマロニルCoAは,細胞膜の主要な構成成分である脂肪酸およびリン脂質の合成における基質である.また,マロニルCoAの細胞内における濃度の上昇は細胞膜合成遺伝子(脂肪酸合成遺伝子およびリン脂質合成遺伝子)の高発現を誘導する8).そこで,AccDAの過剰な発現の及ぼすマロニルCoAの濃度および細胞膜合成遺伝子の転写への影響を解析した結果,ともに上昇が認められた.したがって,AccDAの過剰な発現は細胞膜合成系の活性を上昇させると考えた.そこで,細胞膜合成遺伝子の発現制御株を用い,細胞膜合成の活性の上昇が及ぼすL型での増殖への影響を解析した.その結果,細胞膜合成遺伝子の高発現を抑えるとAccDAの過剰な発現に依存したL型での増殖は阻害された.さらに,顕微鏡タイムラプス解析により,このL型での増殖の阻害は形態変化と細胞分裂が抑制されたためであることがわかった.これらの結果は,AccDAの過剰な発現による細胞膜合成系の活性の上昇がL型での形態変化と細胞分裂を誘導していることを強く示唆した.
細胞膜合成系の活性の上昇が細胞膜の形成に及ぼす影響を調べるため,AccDAを過剰に発現した細胞を超解像度顕微鏡および透過型電子顕微鏡を用いて解析した.その結果,細胞壁をもつ通常の細胞において,細胞膜の過剰生産のためと考えられる多数の細胞内膜小胞の形成が観察された.この膜小胞の形成は,L型での形態変化および細胞分裂と同様に,細胞膜合成遺伝子の高発現に依存していた.このことから,細胞膜の過剰な生産がL型の形態変化と細胞分裂を誘導していると考えられた.
そこで,murEオペロン発現抑制株においても細胞膜の過剰生産の可能性を検討した.細胞膜の形成への影響を顕微鏡を用いて解析した結果,やはり,murEオペロンの発現を抑制すると細胞膜の過剰生産のためと考えられる細胞内膜小胞の形成が誘導された.さらに,この膜小胞の形成およびL型の形態変化と細胞分裂は細胞膜合成遺伝子の発現を抑えることにより阻害された.これらの結果は,細胞膜の過剰な生産がL型での形態変化と細胞分裂を誘導していることを支持した.
近年,高度な制御装置を必要としない原始的な細胞分裂を再現しようという試みから,試験管内で単純な合成膜(ベシクル)を分裂させる研究が活発に行われている.こうしたモデル細胞膜では,膜分子を取り込みその膜表面積を増大させるだけで,膜の物理的性質に依存した自発的な分裂が起こる9-11).細菌のL型においても,細胞膜の過剰な生産による細胞膜の表面積の増大が細胞分裂を誘導していると考え,通常は分裂能をもたない野生株のプロトプラストにおいて,人為的な細胞膜の表面積の増大が及ぼす分裂への影響を解析した.
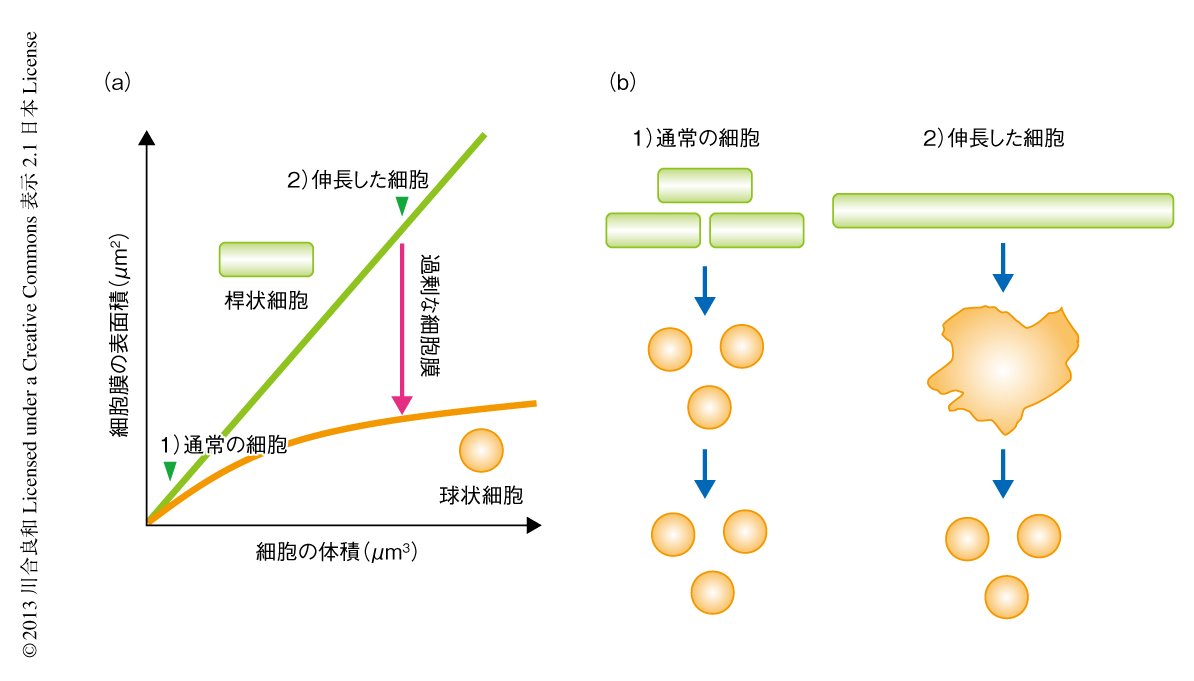
桿状の形態をとる細胞では細胞の体積の増加に比例して細胞膜の表面積も増加するため,体積と表面積の比はほぼ一定に保たれる(図2a).一方,球状の形態をとる細胞では,細胞体積の増加にともない必要とされる細胞膜の表面積は,桿状の細胞に比べ減少する(図2a).したがって,より体積の大きい(伸長した)桿状細胞を球状細胞に変化させると,過剰な細胞膜の表面積をもつ細胞となる(図2a).そこで,細胞壁をもつ野生株の枯草菌(長さ4μm)の分裂をFtsZ阻害剤により抑制することにより伸長した細胞(長さ8~24μm)を得た.つぎに,リゾチーム処理により細胞壁を取り除いてプロトプラスト化したのち,細胞膜の表面積の増大が及ぼす細胞の形態および細胞分裂への影響を顕微鏡タイムラプス解析により調べた.その結果,通常の細胞から得られたプロトプラストは均一な球状細胞であったのに対し,伸長した細胞から得られた多くのプロトプラストはL型に類似した異常な細胞形態を示した(図2b).さらに,それらの細胞はL型と類似した方法で2つあるいは複数の細胞へと細胞分裂することが確認された(図2b).細胞分裂の結果,通常のプロトプラストと同様な球状細胞となり,そののち,さらなる細胞分裂は観察されなかった.これは,細胞分裂により過剰な細胞膜を使いはたしたためと考えられた.
筆者らは,今回の報告において,細胞は高度な制御系がなくても細胞膜の表面積の増大という単純な方法により分裂する能力を備えていることを示した.L型での分裂は細胞壁の合成およびFtsZシステムを必要としないが,細胞膜の過剰な生産をもたらす遺伝的変異を必須としていた.これにより,細胞膜の表面積の増大に依存した細胞分裂のサイクルをくり返し,L型での継続的な分裂および増殖を可能にしていた(図1b).これは原始的な細胞分裂を再現した,単純な合成膜の自発的な分裂の機構と一致していた9-11).マイコプラズマなど進化の過程で細胞壁を失ったと考えられる細菌を除くと,細胞壁はすべての細菌に存在している.したがって,30億年以上まえに誕生したと考えられる細菌の共通祖先にも細胞壁は存在していたと思われる1).原始の生命体が現在の細菌へと進化した過程をみることはできないが,もしかすると,細胞壁を獲得する以前の原始的な生命体はL型と同様な方法で分裂および増殖していたのかもしれない.原始生命の謎にせまりうる新しいモデル生物として,L型の今後の研究に期待している.
略歴:2003年 奈良先端科学技術大学院大学バイオサイエンス研究科 修了,同年 同 ポスドク研究員を経て,2006年より英国Newcastle大学Medical Schoolポスドク研究員.
研究テーマ:細菌の細胞分裂および増殖を担う制御系の理解.
関心事:2歳の息子の成長.
© 2013 川合 良和 Licensed under CC 表示 2.1 日本
(英国Newcastle大学Medical School,The Centre for Bacterial Cell Biology)
email:川合良和
DOI: 10.7875/first.author.2013.028
Excess membrane synthesis drives a primitive mode of cell proliferation.
Romain Mercier, Yoshikazu Kawai, Jeff Errington
Cell, 152, 997-1007 (2013)
要 約
細胞壁は細菌の特色を示す構造であり,細胞の形態そして細胞分裂および増殖を維持するため必要不可欠な役割を担う.しかしながら,多くの細菌は細胞壁を失ってもL型とよばれる状態へと変化することにより分裂し増殖しつづけることができる.L型では細菌の細胞分裂において必須であるFtsZシステムを必要とせず,細胞がチューブ状に変形,あるいは,細胞の表面に複数の突起を形成し突出と退縮をくり返すなど,形態の変化に依存して分裂する.しかしながら,これまでその分子機構は不明であった.筆者らは,枯草菌においてL型の形態変化および細胞分裂を誘導するために,細胞膜の過剰な生産をもたらす遺伝的な変異が必要かつ十分であることを見い出した.さらには,変異をもたない野生株のプロトプラストでも,人為的に細胞膜の表面積を増大させるだけでL型と同様な形態変化と細胞分裂が誘導されることを示した.これらの結果は,細菌が細胞壁を獲得する以前の細胞,すなわち,高度な制御系をもたない原始的な生命体においても,同様な方法を用いて効率的に増殖することが可能であったことを示唆した.
はじめに
細菌のもつペプチドグリカンをおもな成分とする細胞壁は,細菌の特色を示す構造である.細胞壁がほぼすべての細菌に存在していることは,30億年以上まえに誕生した細菌の共通祖先にもすでに細胞壁が備わっていた可能性を示す1).細胞壁の前躯体の合成およびその構築には多数の遺伝子を必要とするが,それらのほとんどは細胞の増殖に必須である.そのため,細胞壁合成系は抗生物質にとり有効な標的となっている.しかしながら驚くべきことに,多くの細菌は細胞壁を失ってもL型(L-form)へと変化することにより再び増殖が可能になる2).L型をとる細菌はさまざまな感染症の患者などから単離されており,その抗生物質耐性および継続的な感染能が認められてきた3).研究室環境でのL型の分離は,通常,スクロースなど浸透圧保護剤を含む培地を用いて行われ,適切な抗生物質による長期間にわたる細胞壁の合成阻害を必要とする.また,安定なL型の形成および増殖にはなんらかの遺伝的変異が必要であり2),いくつかの細菌に由来するL型においてゲノム塩基配列の解析が行われてきた4).しかしながら,そうした遺伝的変異がどのようにL型の形成と増殖に関与しているのかは明らかにされていない.
最近,代表的なモデル生物のひとつである枯草菌のL型において遺伝学そして細胞生物学的な手法を用いた解析がはじめられ,その増殖機構に関して重要な発見がなされた4-6).通常,細菌の細胞分裂はFtsZを中心とした10種類以上の構成タンパク質からなる分子装置により厳密に制御されており,細胞の中央において規則正しい二分裂が起こる7)(図1a).一方,L型では,細胞がチューブ状に変形(membrane tubulation),あるいは,細胞の表面に複数の突起を形成し突出と退縮をくり返す(membrane blebbing)など,不規則な細胞形態の変化に依存したランダムな分裂が起こり,これらはFtsZを必要としない4)(図1b).
今回の報告において,筆者らは,枯草菌がL型として増殖するため必要な遺伝的変異の詳細な解析を行うことにより,FtsZシステムに依存しないL型での分裂が細胞膜の表面積の増大のみで起こることを示した.
1.L型での増殖に必要な変異とその役割
L型の安定な増殖にはいくつかの遺伝的変異を必要とすることが知られている2).これまでに分離された枯草菌のL型株では,ペプチドグリカン前躯体の合成に必須な遺伝子群であるmurEオペロンおよびイソプレノイド合成遺伝子であるispA遺伝子の機能抑制をもたらす遺伝子変異がその増殖に必要であると考えられている4).そこで,これらの遺伝子変異が及ぼす細胞増殖への影響をリゾチーム処理により細胞壁を取り除きプロトプラスト化した細胞において調べた.野生株のプロトプラストでは浸透圧保護剤であるスクロースを含む培地においてその増殖はみられなかった.また,murEオペロンあるいはispA遺伝子それぞれ一方の発現抑制株でもその増殖はみられなかった.しかしながら,murEオペロンおよびispA遺伝子の転写を同時に抑制したプロトプラストでは増殖が観察された.このように,これまでに報告されていた結果と一致して,murEオペロンおよびispA遺伝子の機能抑制は細胞壁を失った細胞の増殖を誘導することが確認された.
L型での分裂は細胞形態の変化に依存して起こることが知られている4,6).そこで,murEオペロンおよびispA遺伝子に対する遺伝子変異がプロトプラストの細胞形態に及ぼす影響を顕微鏡タイムラプス解析により調べた.野生株は均一で安定な球状の形態をとり細胞分裂はみられなかったが,murEオペロンおよびispA遺伝子を同時に抑制するとL型で観察される形態変化に依存した細胞分裂が誘導されることがわかった.つづいて,ispA遺伝子のみを発現抑制したプロトプラストでも同様な解析を行ったが,細胞分裂はみられなかった.一方,murEオペロンを発現抑制した場合にはL型と同様の形態変化と細胞分裂の誘導がみられたが,多くの細胞は細胞分裂の際に溶菌した.これらの結果から,L型での増殖にはmurEオペロンの機能抑制による形態変化および細胞分裂の誘導,そして,ispA遺伝子の機能抑制による細胞分裂の際の溶菌の抑制が必要であると考えられた.
2.ペプチドグリカン前躯体の合成の抑制はL型での増殖を誘導する
分裂能および増殖能をもたない野生株のプロトプラストを細胞壁の再形成を抑制するような適切な抗生物質を含む培地で培養しつづけることにより,自然突然変異を利用したL型の分離を行った.ゲノム塩基配列の解析の結果,18遺伝子を含む18 kbpの欠失が同定され,そこにはmurEオペロンと同じくペプチドグリカン前躯体の合成に必須なmurC遺伝子が含まれていた.さらなる解析の結果,この18 kbp欠失変異体におけるL型での増殖にはmurC遺伝子にくわえ,ほかに1つ以上の遺伝子の欠失が必要であることがわかった.また,murC遺伝子をispA遺伝子と同時に発現抑制した場合においてもL型での増殖は誘導された.さらに,異なるペプチドグリカン前躯体合成遺伝子においても同様であることが確認された.これらの結果は,L型での増殖には形態変化と細胞分裂を誘導するための変異(ペプチドグリカン前躯体合成系の抑制)と,細胞分裂の過程の細胞を安定化させる変異(ispA遺伝子の機能抑制など)の,少なくとも2種類の異なる役割をもつ遺伝的変異が必要であることを示した.
3.アセチルCoAカルボキシラーゼの過剰な発現はL型での分裂を誘導する
細胞はペプチドグリカンの合成に異常が生じた際に,通常とは異なるなんらかの分裂機構を誘導していると考えられた.そこで,ispA発現抑制株のプロトプラストを用いて自然突然変異を利用したL型の分離を行うことにより,L型での細胞分裂を誘導するために必要な遺伝的変異のスクリーニングを行った.ペプチドグリカン合成遺伝子への変異をさけるため,細胞壁の再合成が可能な変異体のみを選択した.ゲノム塩基配列の解析の結果,accDA遺伝子の上流に1塩基の置換変異が同定され,この変異によりAccDAの過剰な発現が誘導されていることがわかった.AccDAはアセチルCoAからマロニルCoAを合成する酵素であるアセチルCoAカルボキシラーゼ複合体の主要な構成タンパク質である.顕微鏡タイムラプス解析によりAccDAの過剰な発現がプロトプラストに及ぼす影響を観察した結果,murEオペロンの発現抑制と同様に,形態変化と細胞分裂を誘導していることが確認された.
4.L型での分裂は細胞膜合成系の活性の上昇に依存する
アセチルCoAカルボキシラーゼにより合成されるマロニルCoAは,細胞膜の主要な構成成分である脂肪酸およびリン脂質の合成における基質である.また,マロニルCoAの細胞内における濃度の上昇は細胞膜合成遺伝子(脂肪酸合成遺伝子およびリン脂質合成遺伝子)の高発現を誘導する8).そこで,AccDAの過剰な発現の及ぼすマロニルCoAの濃度および細胞膜合成遺伝子の転写への影響を解析した結果,ともに上昇が認められた.したがって,AccDAの過剰な発現は細胞膜合成系の活性を上昇させると考えた.そこで,細胞膜合成遺伝子の発現制御株を用い,細胞膜合成の活性の上昇が及ぼすL型での増殖への影響を解析した.その結果,細胞膜合成遺伝子の高発現を抑えるとAccDAの過剰な発現に依存したL型での増殖は阻害された.さらに,顕微鏡タイムラプス解析により,このL型での増殖の阻害は形態変化と細胞分裂が抑制されたためであることがわかった.これらの結果は,AccDAの過剰な発現による細胞膜合成系の活性の上昇がL型での形態変化と細胞分裂を誘導していることを強く示唆した.
5.AccDAの過剰な発現による細胞膜の過剰な生産
細胞膜合成系の活性の上昇が細胞膜の形成に及ぼす影響を調べるため,AccDAを過剰に発現した細胞を超解像度顕微鏡および透過型電子顕微鏡を用いて解析した.その結果,細胞壁をもつ通常の細胞において,細胞膜の過剰生産のためと考えられる多数の細胞内膜小胞の形成が観察された.この膜小胞の形成は,L型での形態変化および細胞分裂と同様に,細胞膜合成遺伝子の高発現に依存していた.このことから,細胞膜の過剰な生産がL型の形態変化と細胞分裂を誘導していると考えられた.
そこで,murEオペロン発現抑制株においても細胞膜の過剰生産の可能性を検討した.細胞膜の形成への影響を顕微鏡を用いて解析した結果,やはり,murEオペロンの発現を抑制すると細胞膜の過剰生産のためと考えられる細胞内膜小胞の形成が誘導された.さらに,この膜小胞の形成およびL型の形態変化と細胞分裂は細胞膜合成遺伝子の発現を抑えることにより阻害された.これらの結果は,細胞膜の過剰な生産がL型での形態変化と細胞分裂を誘導していることを支持した.
6.細胞膜の表面積の増大による野生株のプロトプラストの分裂
近年,高度な制御装置を必要としない原始的な細胞分裂を再現しようという試みから,試験管内で単純な合成膜(ベシクル)を分裂させる研究が活発に行われている.こうしたモデル細胞膜では,膜分子を取り込みその膜表面積を増大させるだけで,膜の物理的性質に依存した自発的な分裂が起こる9-11).細菌のL型においても,細胞膜の過剰な生産による細胞膜の表面積の増大が細胞分裂を誘導していると考え,通常は分裂能をもたない野生株のプロトプラストにおいて,人為的な細胞膜の表面積の増大が及ぼす分裂への影響を解析した.
桿状の形態をとる細胞では細胞の体積の増加に比例して細胞膜の表面積も増加するため,体積と表面積の比はほぼ一定に保たれる(図2a).一方,球状の形態をとる細胞では,細胞体積の増加にともない必要とされる細胞膜の表面積は,桿状の細胞に比べ減少する(図2a).したがって,より体積の大きい(伸長した)桿状細胞を球状細胞に変化させると,過剰な細胞膜の表面積をもつ細胞となる(図2a).そこで,細胞壁をもつ野生株の枯草菌(長さ4μm)の分裂をFtsZ阻害剤により抑制することにより伸長した細胞(長さ8~24μm)を得た.つぎに,リゾチーム処理により細胞壁を取り除いてプロトプラスト化したのち,細胞膜の表面積の増大が及ぼす細胞の形態および細胞分裂への影響を顕微鏡タイムラプス解析により調べた.その結果,通常の細胞から得られたプロトプラストは均一な球状細胞であったのに対し,伸長した細胞から得られた多くのプロトプラストはL型に類似した異常な細胞形態を示した(図2b).さらに,それらの細胞はL型と類似した方法で2つあるいは複数の細胞へと細胞分裂することが確認された(図2b).細胞分裂の結果,通常のプロトプラストと同様な球状細胞となり,そののち,さらなる細胞分裂は観察されなかった.これは,細胞分裂により過剰な細胞膜を使いはたしたためと考えられた.
おわりに
筆者らは,今回の報告において,細胞は高度な制御系がなくても細胞膜の表面積の増大という単純な方法により分裂する能力を備えていることを示した.L型での分裂は細胞壁の合成およびFtsZシステムを必要としないが,細胞膜の過剰な生産をもたらす遺伝的変異を必須としていた.これにより,細胞膜の表面積の増大に依存した細胞分裂のサイクルをくり返し,L型での継続的な分裂および増殖を可能にしていた(図1b).これは原始的な細胞分裂を再現した,単純な合成膜の自発的な分裂の機構と一致していた9-11).マイコプラズマなど進化の過程で細胞壁を失ったと考えられる細菌を除くと,細胞壁はすべての細菌に存在している.したがって,30億年以上まえに誕生したと考えられる細菌の共通祖先にも細胞壁は存在していたと思われる1).原始の生命体が現在の細菌へと進化した過程をみることはできないが,もしかすると,細胞壁を獲得する以前の原始的な生命体はL型と同様な方法で分裂および増殖していたのかもしれない.原始生命の謎にせまりうる新しいモデル生物として,L型の今後の研究に期待している.
文 献
- Errington, J.: L-form bacteria, cell walls and the origins of life. Open Biol., 3, 120143 (2013)[PubMed]
- Allan, E. J., Hoischen, C. & Gumpert, J.: Bacterial L-forms. Adv. Appl. Microbiol., 68, 1-39 (2009)[PubMed]
- Domingue, G. J. Sr. & Woody, H. B.: Bacterial persistence and expression of disease. Clin. Microbiol. Rev., 10, 320-344 (1997)[PubMed]
- Leaver, M., Dominguez-Cuevas, P., Coxhead, J. M. et al.: Life without a wall or division machine in Bacillus subtilis. Nature, 457, 849-853 (2009)[PubMed]
- Dominguez-Cuevas, P., Mercier, R., Leaver, M. et al.: The rod to L-form transition of Bacillus subtilis is limited by a requirement for the protoplast to escape from the cell wall sacculus. Mol. Microbiol., 83, 52-66 (2012)[PubMed]
- Mercier, R., Dominguez-Cuevas, P. & Errington, J.: Crucial role for membrane fluidity in proliferation of primitive cells. Cell Rep., 1, 417-423 (2012)[PubMed]
- Adams, D. W. & Errington, J.: Bacterial cell division: assembly, maintenance and disassembly of the Z ring. Nat. Rev. Microbiol., 7, 642-653 (2009)[PubMed]
- Schujman, G. E., Guerin, M., Buschiazzo, A. et al.: Structural basis of lipid biosynthesis regulation in Gram-positive bacteria. EMBO J., 25, 4074-4083 (2006)[PubMed]
- Peterlin, P., Arrigler, V., Kogej, K. et al.: Growth and shape transformations of giant phospholipid vesicles upon interaction with an aqueous oleic acid suspension. Chem. Phys. Lipids, 159, 67-76 (2009)[PubMed]
- Zhu, T. F. & Szostak, J. W.: Coupled growth and division of model protocell membranes. J. Am. Chem. Soc., 131, 5705-5713 (2009)[PubMed]
- Svetina, S.: Vesicle budding and the origin of cellular life. Chemphyschem, 10, 2769-2776 (2009)[PubMed]
著者プロフィール
略歴:2003年 奈良先端科学技術大学院大学バイオサイエンス研究科 修了,同年 同 ポスドク研究員を経て,2006年より英国Newcastle大学Medical Schoolポスドク研究員.
研究テーマ:細菌の細胞分裂および増殖を担う制御系の理解.
関心事:2歳の息子の成長.
© 2013 川合 良和 Licensed under CC 表示 2.1 日本